Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.18 n.3-4 Lima jul./dic. 2001
TRABAJOS ORIGINALES
Producción de Bacillus thuringiensis H-14 var. Israelensis utilizando espárrago (Asparagus officinalis) y su uso potencial para el control de la Malaria en la Libertad- Perú*
Franklin Vargas V 1; Judith Roldán R 1; Gina Zavaleta E 1; Miriam Gil F 1; Cynthia Ampuero R 1; Ana Burga 2; Bertha Moreno 2; Carlos Vergara D 3; Palmira Ventosilla L 4.
1 Universidad Nacional Trujillo.
2 Dirección Regional de Salud La Libertad.
3 Sanidad Policial III, Región La Libertad.
4 Universidad Peruana Cayetano Heredia.
RESUMEN
Objetivo: Estandarizar un medio, de cultivo utilizando la infusión de espárrago (Asparagus officinalis) para la producción masiva de Bacillus thuringiensis (Bti) H-14 var. israelensis y determinar el efecto biolarvicida del Bti sobre Anopheles sp en criaderos naturales del distrito Laredo durante los meses de Enero a Diciembre del 2000. Materiales y métodos: Se ensayaron 3 medios a base de infusión de espárrago blanco: M1: 100 mL de la infusión, pH 9; M2: 50 mL de la infusión con 50 mL de buffer fosfato, pH 7; y M3: 25 mL de la infusión con 75 mL de agua destilada, pH 9. Como control se utilizó el medio estándar TPH. La producción de Bti en los medios de cultivo fueron evaluadas para determinar la efectividad biolarvicida a través del LC50 y LC90. El medio de cultivo óptimo (menor LC50 y LC90) sirvió para la producción masiva del Bti, el cual se sometió a bioensayos de laboratorio y aplicaciones en criaderos naturales. La efectividad fue determinada mediante la densidad larvaria pre y post aplicación del Bti. Resultados: El medio de cultivo óptimo para la producción de Bti fue M1 mostrando alta efectividad, con 100% de mortalidad en condiciones de laboratorio y 71-97% de mortalidad en el campo a las 24 horas de exposición con 3 aplicaciones realizadas semanalmente. Conclusiones: M1 es el medio optimo para cultivar Bti, con alta efectividad para controlar larvas de Anopheles en el laboratorio y en el campo.
Palabras claves: Bacillus thuringiensis; Asparagus officinalis; Malaria/provención & control; Control vectorial (fuente: BIREME).
ABSTRACT
Objective: To standardize a culture medium using asparagus infusion (Asparagus officinalis) for the massive production of Bacillus thurigiensis (Bti) H-14 var. israelensis and to determine Bti bio-larvicide effect upon Anopheles sp. in natural breeding sites in Laredo district from January to December, 2000. Materials and methods: Three media based on white asparagus infusion were tested: M1: 100-mL infusion, pH: 9; M 2: 50-mL infusion plus 50-mL buffer phosphate, pH: 7, and M 3: 25-mL infusion plus 75-mL distilled water, pH: 9. The standard TPH medium was used as a control. Bti production in the different culture media was assessed in order to determine the bio-larvicide effectiveness using LC50 and LC90 The optimum culture medium (lower values for LC 50 and LC90) served for Bti production, and it was evaluated in laboratory and natural breeding sites. Effectiveness was determined measuring larval density prior and after Bti application. Results: The optimum medium for Bti production was M,. It showed high effectiveness, with 100% mortality under laboratory conditions, and 71-97% mortality in the field after 24 hours of exposition with three weekly applications. Conclusions: M1 is the optimum medium for culturing Bti, with high effectiveness for controlling Anopheles larvae both under laboratory and field conditions.
Key words: Bacillus thuringiensis; Asparagus officinalis; Malaria/prevention & control; Vector control (source: BIREME).
INTRODUCCIÓN
Según la Organización Mundial de la Salud (OMS), de 85 especies de Anopheles que transmiten malaria, 56 presentan resistencia a los insecticidas: 54 al DDT, 28 a los organofosforados, y 19 a carbamatos y piretroides. El uso irracional y excesivo de estos insecticidas químicos responsables de la resistencia generada por los vectores maláricos, ha traído como resultado alta toxicidad para los humanos y su persistencia en el ambiente, con acumulación en grasas de animales y humanos 1,2.
Cada año la malaria causa enfermedad en más de 100 millones de personas y ocasiona la muerte a mis de 1 millón. En el Perú constituye uno de los más graves problemas de salud pública: los casos notificados en 1998 sobrepasaron los 200 000 casos; además, ocasiona un gran impacto sobre la economía de las poblaciones afectadas 3. La malaria es ocasionada por hemoparásitos del género, Plasmodium y transmitida por la picadura de mosquitos hembra del género Anopheles. Debido a la variedad geográfica del país; esto determina la presencia de numerosas especies anophelinas, de las cuáles siete han sido señaladas como responsables de la transmisión 4. Estos insectos pasan por cuatro fases bien definidas en su ciclo vital: huevo, larva, pupa y adulto, las tres primeras fases son acuáticas y el adulto aéreo; la larva es muy voraz y obtiene su alimento del agua, adaptándose a cualquier superficie de agua estancada dulce o salubre 5,6.
El control de los vectores es el componente más importante de los programas de las enfermedades metaxénicas. La notable eficacia de los insecticidas hizo posible combatir durante muchos años a los vectores de malaria. Inicialmente, el insecticida más usado fue el DDT 7,8. Es conocido que apareció resistencia a este compuesto químico, y además se limitó su uso por producir alto grado de contaminación y desequilibrio ecológico, al no ser biodegradable y acumularse en la naturaleza. Actualmente, en nuestro medio se están usando los carbamatos y cipermetrinas, los cuáles también afectan el ecosistema debido a su falta de selectividad, causando daño a otras formas de vida 9,10. El uso del larvicida Temephos (abate) ha tenido buenos resultados, sin embargo, en otros países de América Latina ya se han informado casos de resistencia.
Una de las acciones dirigidas a disminuir el riesgo de infección y el número de casos, es a través de la disminución de la población de vectores, sean en su estadío adulto o larvario. El control vectorial ha mejorado mucho por el uso de plaguicidas químicos y la manipulación del medio ambiente; no obstante, la OMS ha continuado buscando nuevos métodos de control, destacando el control biológico que utiliza directamente enemigos naturales. También existen otros métodos, como el control genético y el manejo del medio ambiente, que requieren utilización de tecnologías sofisticadas y de mayor costo 11.
El control biológico puede definirse como el control de plagas por el uso directo o indirecto de enemigos naturales, depredadores y patógenos; es el uso de poblaciones de un organismo para controlar a otro. Se ha demostrado que el uso de bacterias esporógenas es muy importante en el control de mosquitos vectores debido al alto grado de actividad letal que presentan; una de ellas es el Bacillus thuringiensis. Esta bacteria gram positiva produce toxinas altamente específicas contra insectos 12,13. Al esporular produce cristales paraesporales formados por la glicoproteína delta-endotoxina y que causa parálisis del epitelio intestinal, ruptura de las microvellosidades, cambios en los organelos citoplasmáticos y, finalmente, la muerte de la larva 14,15. Los productos que contienen B. thuringiensis (Bti) son notablemente seguros, hasta ahora no se han registrado efectos dañinos en ensayos de seguridad con abejas, vertebrados y humanos; Bti es un larvicida eficaz y muy seguro para los trabajadores de salud, así como para los moradores y animales domésticos 10,16,17. A fin de disminuir los costos en la producción masiva del Bti H-14 se han realizado trabajos con buenos resultados en el desarrollo de esporas y actividad tóxica usando como medios de cultivo agua de coco y extracto de endospermo, coco entero y yuca con resultados semejantes a los medios de cultivo comerciales 17,19.
La ejecución del proyecto de irrigación Chavimochic en el departamento de La Libertad, ha propiciado un cambio regional en las condiciones ambientales y socioeconómicas. El incremento de las actividades agroindustriales ha permitido la migración y permanencia del hombre a estas zonas. Asimismo, la mayor disponibilidad de agua para el riego ha generado cuerpos de agua estancada, tanto en acequias como en pequeñas lagunas, que se han constituido en criaderos de larvas de zancudos, permitiendo un comportamiento endémico-epidémico de la malaria. Según el reporte de nuestro programa de control, Anopheles pseudopunctipennis y An. calderoni son los principales vectores de malaria registrados en este departamento, notificándose que hasta la semana epidemiológica 51, el número de casos de malaria se incrementó en algunos distritos, considerándose a Laredo como un distrito de mediano riesgo 20.
Decidimos producir Bti en un medio de cultivo óptimo, con la utilización de productos naturales como el espárrago (Asparagus officinalis), debido a que en la zona norte del Perú este vegetal constituye uno de los cultivos más importantes y de bajo costo. Su exportación es muy elevada, dado que a nivel mundial es considerado un gran alimento nutritivo, con aporte calórico muy bajo pero rico en carbohidratos y fibra, conteniendo cantidades significativas de vitamina A, riboflavina y vitamina C, necesarios para el crecimiento bacteriano.
El presente trabajo tuvo como objetivo estandarizar un medio de cultivo utilizando infusión de Asparagus officinalis para la producción de B. thuringiensis H-14 variedad israelensis y determinar el efecto sobre formas larvarias de Anopheles sp. en criaderos naturales del distrito de Laredo de enero a diciembre del 2000.
MATERIALES Y MÉTODOS
Se utilizó la cepa Bacillus thuringiensis, serotipo H-14, variedad israelensis, lote 91509. Las hembras de Anopheles sp. fueron colectadas en el campo y trasladadas al laboratorio, donde se aislaron individualmente, a temperatura ambiental (24°C-28°C) y humedad entre 78-82%, para la oviposición 21. Se colocaron los huevos obtenidos en pequeños recipientes de plástico con agua destilada para la eclosión. Las larvas fueron incubadas hasta que alcanzaron el III estadío de desarrollo para ser usadas en los bioensayos.
MEDIOS DE CULTIVO
Se seleccionaron plantas de espárrago blanco procedentes del sector El Rosario, Chao, departamento de La Libertad. En un litro de agua destilada se colocó 400 g de espárrago, poniendo en ebullición por 5 minutos, posteriormente se filtró y distribuyó 100 mL del filtrado, en frascos de 250 mL para ser autoclavados. Los medios de cultivo utilizados fueron los siguientes:
- Medio 1 (M1) : 100 mL del infuso, pH 9
- Medio 2 (M2) : 50 mL del infuso suplementado con 50 mL cle buffer fosfato, pH 7.
- Medio 3 (M3) : 25 mL del infuso suplementado con 75 mL de agua destilada, pH 9.
- Medio control (TPH): 100 mL de medio comercial, pH 7
Se sembró y reaisló 10 mg del liófilo del B. thuringiensis H-14 var. israelensis, según las recomendaciones estándares para su producción 22. Se utilizaron 4 botellas de vidrio estériles con capacidad de 1 L; a 3 de ellas se les colocó 100 mL de infusión de espárrago del M1, M2 y M3, respectivamente, y a la cuarta botella, 100 mL del medio TPH. Los cuatro medios fueron esterilizados nuevamente y sembrados con una colonia típica de B. thuringiensis del reaislamiento anterior. Los medios fueron homogenizados por 3 minutos e incubados en un agitador mecánico (shaker), a 6 rpm por 96 horas 18. Para la estandarización del medio de cultivo, se realizaron 3 repeticiones. Se realizó el control microbiológico cada 24 horas (coloración Gram y verde de Malaquita modificado).
A las 96 horas de incubación se realizó la cosecha, colocando el contenido de cada botella en tubos de centrífuga estériles, donde se realizaron los lavados con solución salina estéril y agua destilada por tres veces. Los productos de los lavados se inactivaron a 75°C por 15 minutos y se almacenaron a 4°C hasta su uso.
Se colocaron 10 larvas del III estadío de Anopheles sp. en vasos de plástico de 5 cm de diámetro, conteniendo 5 mL de agua destilada. Se escogió aleatoriamente un control y a los vasos restantes se añadió 100 mL de los lavados del Bti, evaluándolos cada 15 minutos hasta observar mortalidad al 100%.
Los lavados obtenidos de las cosechas en los medios M1, M2, M3 y control (TPH) se sometieron a 70°C por 10 minutos, se homogenizaron y se diluyeron decimalmente de 100 mL hasta 10-8. Se tomó 100 mL de las últimas diluciones para ser sembradas e incubadas en agar por duplicado. Se leyó el número de colonias en cada placa y se calculó el número de esporas viables por mL23.
BIOENSAYOS EN LABORATORIO
Para los bioensayos se utilizaron 7 grupos: 6 experimentales y 1 control. Cada grupo estuvo formado por 3 vasos conteniendo 20 larvas de Anopheles sp. del III estadío, y 100 mL de agua destilada, adicionándole volúmenes correspondientes a las concentraciones de 6700 esp/mL, 16829 esp/mL, 42274 esp/mL, 106187 esp/mL, 266731 esp/mL y 670000 esp/mL, respectivamente. Las concentraciones fueron tomadas de tablas estandarizadas DDT17. Al grupo control se le agregó 1 mL de agua destilada estéril. Los 7 grupos se mantuvieron a las mismas condiciones ambientales y las lecturas del número de larvas muertas fueron realizadas después de 2, 4, 8, 12, 24, 48 y 72 horas de aplicación del Bti.
Se determinó la concentración necesaria para matar el 50 y 90% de la población expuesta (infectividad o LC50-90) y el tiempo necesario para matar el 50 y 90% de la población de cada producción en los medios; (virulencia o LT50-90). Este cálculo se realizó con la ayuda del programa Probit versión 1,4 24, con un nivel de confianza del 95%. Una vez conocido el medio óptimo para la producción del Bti, se procedió a reactivar, aislar y reaislar la cepa de Bti, como se indicó anteriormente.
Reaislada la cepa de Bti, se realizaron las siembras en el medio estandarizado (M1) para su producción masiva. Se utilizaron 6 botellas de vidrio estériles con capacidad de 1 L. Se agregó 100 mL de infusión de espárrago y se esterilizaron y sembraron con una colonia típica de Bfi del reaislamiento previo. Las cosechas y el control microbiológico se realizaron siguiendo los pasos indicados anteriormente.
TRABAJO DE CAMPO EN CRIADEROS NATURALES
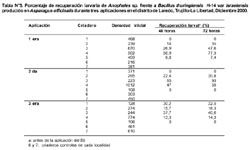
Se seleccionaron 7 criaderos naturales de las localidades de Menocucho y Santa Victoria (distrito de Laredo, Trujillo, La Libertad) (Tabla N° 1), 5 fueron tratados con Bti y 2 controles. Durante un mes se determinó la producción larvaria del criadero natural con la ayuda de cucharones de plástico, determinándose algunas características físicas y químicas del criadero, depredadores y densidad larvaria por estadíos. Para la determinación de la densidad larvaria se marcaron áreas de muestreo de 1m2 cada uno; el número total de áreas evaluadas por criadero varió de acuerdo al tamaño de éste (16, 18 y 28 áreas), siguiendo la secuencia sugerida por Montalván 25.
La flora presente dentro de los criaderos estuvo conformada por algas del género Genphosfaeria sp., Pediastrum sp., Cladophora sp., Lyngbya sp., Gomphonomo sp., Cosmarium sp. y Ormotocercus sp., así como flora acuática de la especie Portulaca oleracea. En tanto que la flora alrededor de los criaderos fue: Convolvulus avuensis, Verbena littoralis, Conmelina fasciculata, Tessaria integrifolia, Arundo donax y Cyperus cotymbosus. La fauna asociada en los criaderos y testigos estuvo dado por invertebrados acuáticos corno molúscos, malacostráceos, copépodos (Eucyclos sp.), Belastoma sp., Hidrometra sp., Notonecta sp., Gerris sp., Libelula sp., Brachionus sp., Euchlanis sp. y peces del los géneros Lebiasina sp. y Poecifia sp.
Se aplicó una dosis de 1 mL/m2 del Bti producido en el M1, a una concentración de 1,0 x 107-108 esp/mL. (concentración determinada en los bioensayos realizados en el laboratorio). Se realizó la aplicación de Bti en los criaderos centinelas cada 7 días durante tres semanas consecutivas. Las aplicaciones se realizaron a las primeras horas del día, considerando las especificaciones técnicas de los factores que influyen en la actividad biológica del Bti, tales como rayos solares (ultravioleta), calidad, temperatura y agua, vientos y el desplazamiento del aplicador en el criadero, el cual fue mantenido con la boquilla en posición horizontal a la superficie acuática.
Después de la aplicación de Bti, los criaderos tratados y controles fueron evaluados para determinar la densidad larvaria después de 2, 4, 8, 24, 48 y 72 horas de exposición. Asimismo, se determinó la recuperación de la densidad, según la siguiente fórmula:
% de recuperación larvaria = TL post aplic. /TL pre aplic. x 100
TL post-aplic.: Nº total de larvas vivas después de la aplicación.
TL pre-aplic.: Nº total de larvas vivas antes de la aplicación.
ANÁLISIS DE DATOS
Se utilizó el test chi cuadrado o el test exacto de Fischer, según correspondiera, para la comparación de los porcentajes, y el análisis de varianza para la comparación de los promedios. Se consideró estadísticamente significativo un p<0,05. Se utilizó el programa estadístico SPSS 9,0 para la elaboración de la base y el procesamiento de los datos.
RESULTADOS
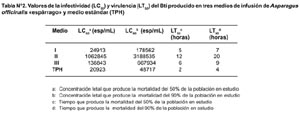
Se encontró que el medio de cultivo M1 presentó en promedio la menor LC50 y LC90 (Tabla N° 2). El M1 empleó menos tiempo que M2 y M3 para ejercer efecto larvicida. No se encontraron diferencias significativas entre el M1 y el TPH (medio estándar) en cuanto a LC50, LC90, LT50 y LT90. (Tabla N° 3).
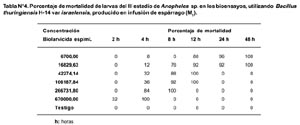
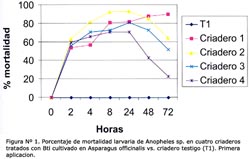
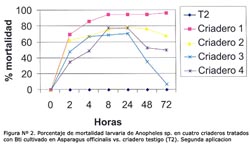
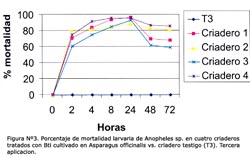
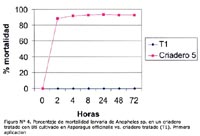
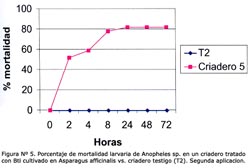
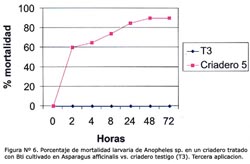
La concentración óptima en los bioensayos del larvicida Bti fue 6,7 x 105 esp/mL, producido en el M1 a las 2, 4, 8, 12, 24 y 48 horas (Tabla N° 4). Se observó que después de la primera aplicación, el porcentaje de mortalidad fue mayor al 55% a las 2 horas post-aplicación en los criaderos 1-4, pero el efecto disminuyó considerablemente después de las 24 h en los criaderos; 2, 3 y 4, siendo entre 20% y 60% a las 72 horas y manteniéndose durante 72 horas en el criadero 1 mayor al 80% (Figura N° 1). Luego de la segunda aplicación, la mortalidad fue mayor al 50% en los criaderos 1-4 a las 4 horas, y el efecto disminuyó luego de las 24 horas en los criaderos 3 y 4 hasta menos del 50% a las 72 horas, manteniéndose constante en los criaderos 1 y 2 durante las 72 horas, con un valor mayor al 65% (Figura Nº 2). Después de la tercera aplicación, la mortalidad fue mayor al 55% a las 2 horas, superando el 90% a las 24 horas y disminuyendo a menos del 70% en los criaderos 3 y 4, y persistiendo en los criaderos; 1 y 2 con un valor mayor al 80% a las 72 horas (Figura N° 3). El criadero 5 luego de 8 horas de la primera, segunda y tercera aplicación presentó una mortalidad mayor al 80% (Figuras N° 4-6). En los criaderos donde disminuyó la mortalidad antes de las 72 horas (criaderos 2, 3 y 4), el efecto del Bti disminuyó luego de las 24 horas de la aplicación (Figuras N° 1-3). Es en estos criaderos que la recuperación larvaria se manifestó después de las 48 horas de aplicación (Tabla N° 5).
DISCUSIÓN
Los resultados muestran que el medio de cultivo M1 es óptimo para el desarrollo y producción masiva de Bacillus thuringiensis H-14 var israelensis (Tabla N° 1). Su acción tóxica sobre las larvas de Anopheles sp. y su efecto larvicida es muy similar al medio comercial TPH, demostrado por la similitud de los valores de LC50 y LT50, indicando que el medio con espárrago presenta los requerimientos nutricionales y sales minerales necesarios para el desarrollo de esta bacteria.
Estudios previos demostraron buenos resultados en el cultivo y acción tóxica del Bti, utilizando como medios de cultivo agua de coco y extracto de endospermo 18. Igualmente, utilizando coco entero e infusión de yuca para la producción de la bacteria, se obtuvieron resultados similares a los de Barjac, considerado un medio estándar19,21.
La aplicación de Bti H-14 var israelensis puede reducir la población de larvas de Anopheles sp en criaderos naturales. El medio de cultivo utilizado en nuestro estudio puede abaratar los costos para su producción y, por lo tanto, desempeñar un papel significativo en los programas de control de malaria en distintas regiones productoras de espárragos. La efectividad del Bti sobre la mortalidad de larvas de III estadío de Anopheles sp ejercida a concentración de 6,7 x 105 fue 100% a las cuatro horas de exposición (en las tres repeticiones realizadas). Este hallazgo demuestra que la concentración del Bti obtenido en el M1 es óptima para la producción del Bti en condiciones de laboratorio.
Concordando con los resultados obtenidos por otros investigadores 26 , quienes demostraron un alto efecto larvicida de Bacillus thuringiensis H-14 var israelensis en criaderos de Anopheles albimanus, con efectividad del 100% a las 48 horas de exposición al Bti, nuestros resultados demuestran un alto porcentaje de mortalidad de larvas de Anopheles sp a las 24 horas de exposición a aplicaciones del Bti en los criaderos naturales.
La variación del porcentaje de mortalidad de larvas de Anopheles sp entre la primera, segunda y tercera aplicación, podría deberse a la existencia de factores que influyen sobre la actividad del Bti y la fisiología de las larvas tales como la temperatura (a mayor temperatura, mayor actividad metabólica). Esto nos podría sugerir que las larvas se alimentaron con el cristal y esporas del Bti antes de ser afectado por los rayos solares. Estudios realizados con esta bacteria demuestran que se desactivan después de 24 horas de exposición solar, mostrando que las radiaciones ultravioleta podrían tener un efecto perjudicial 14 . Debido a que las larvas de Anopheles sp. se alimentan exclusivamente de partículas que se encuentran en la superficie de los criaderos 27, es posible que la sedimentación haya jugado un papel importante en la variación del efecto larvicida, ya que puede impedir que el compuesto activo se encuentre disponible. Según estudios realizados en cuatro formulaciones del Bti, se encontró que el ingrediente activo sedimenta rápidamente en un periodo de 48 horas 14.
Al evaluar la efectividad de la producción de Bti cultivado en espárrago sobre las larvas de Anopheles sp. en condiciones de campo, se pudo observar que en las primeras horas de evaluación se presentó una elevada mortalidad y que esta empezó dentro, de las dos horas de la aplicación del biolarvicida, en relación directa con el tiempo de exposición del Bti. Esto implica una mayor probabilidad que las larvas se alimenten con el cristal y esporas del Bti antes de ser afectado por los rayos solares o sedimentado. Otros factores que podrían intervenir en la disponibilidad de los cristales del Bti en condiciones de campo, son la presencia de animales menores dentro de los criaderos y el factor climático (lluvias).
Luego de las aplicaciones se observó una mayor mortalidad de los primeros estadíos larvales, debido a una mayor susceptibilidad a la acción tóxica del Bti. Por el contrario, las larvas del IV estadío, que disminuyen su alimentación por estar próximas a empupar, necesitan mayor tiempo para ingerir la cantidad suficiente que les ocasione la muerte.
La recuperación de la densidad larvaria se observó a las 48 horas después de la aplicación en los criaderos 2, 3 y 4, no así en los criaderos 1 y 5. En estos dos últimos, se pudo observar que el Bti permanece hasta las 72 horas, es decir, en estos criaderos el efecto residual es mayor que en los anteriores. Este hallazgo es probablemente debido al tipo de flora existente. El criadero 1 presentó una abundante cantidad de algas que cubría la mayor parte del área del criadero y que pudieron servir como soporte para la permanencia del Bti. De manera similar, el criadero 5 presentó abundante vegetación flotante, representada por verdolaga 14. Por otro lado, la recuperación larvaria ocurrida a las 48 horas en los criaderos 2, 3 y 4, podría deberse a la abundante materia orgánica existente en ellos, que pudo haber inactivado la acción tóxica del Bti 14. Asimismo, la presencia de depredadores y competencia biológica de los organismos en estos criaderos, pudieron haber afectado la disponibilidad del biolarvicida.
Durante muchos años, el temephos (organofosforado) demostró ser un excelente larvicida, de bajo costo y con acción rápida para controlar la malaria. La aparición de casos de resistencia 28, la contaminación del ambiente, la muerte de algunos insectos benéficos para la agricultura y la potencial toxicidad en seres humanos, obligó a buscar otros productos. Referente a la seguridad del ecosistema, nuestro estudio sugiere que el Bti cultivado en medio espárrago constituye una alternativa segura, efectiva y de bajo costo para el control de la malaria, que puede reemplazar el uso de organofosforados o disminuir su uso, al combinar ambos métodos. Al realizar las tres aplicaciones semanales de Bti en los criaderos centinelas, caracterizados por ser charcos grandes con agua permanente tipo laguna, típicos para la aplicación de Bti en las localidades de Menocuho y Santa Victoria, se observó que no existió efecto dañino sobre peces, anfibios, flora y demás fauna.
En conclusión, el Bacillus thuringiensis H-14 var israelensis, cultivado en medio infusión de espárrago, produce una alta concentración de esporas y cristales con actividad larvicida frente a Anopheles sp., tanto en condiciones de laboratorio como en criaderos naturales de Laredo, La Libertad-Perú, reduciendo significativamente la población de Anopheles, por lo que se constituye en una alternativa razonable para el control de vectores de malaria en áreas donde se cultiva espárrago. Sin embargo, hay que considerar el efecto de las variables físico-químicas y ambientales en el trabajo de campo, debido a que influyen sobre su actividad larvicida.
REFERENCIAS
1. Priest FG. Biological control of mosquitoes and other biting files by Bacillus sphaericus and Bacillus thuringiensis. J Appl Bacteriol 1992; 72: 357-69. [ Links ]
2. Organización Mundial de la Salud. Resistencia de los vectores de enfermedades a los plaguicidas. 15 vo Informe del Comité de Expertos de la OMS en biología de vectores y lucha antivectorial. Ginebra: OMS; 1992. 784 (Serie Informes Técnicos N° 818). [ Links ]
3. Ministerio de Salud. Bases para el análisis de la situación del salud, Perú-1999. Boletín de la Oficina General de Epidemiología. Lima: MINSA; 1999. [ Links ]
4. Calderón G. Densidad y distribución de los anofelinos del Perú. (Tesis doctoral). Trujillo: Universidad Nacional de Trujillo; 1976. [ Links ]
5. Botero D. Parasitosis humana. 2a ed. Bogotá: Edit. Bogotá. Corporación para investigaciones biológicas; 1992. [ Links ]
6. Fleming G. Biología y ecología de los vectores de malaria de las Américas. Washington D.C.: Organización Panamericana de la Salud; 1986. [ Links ]
7. Jian L, Wal Y, Thirumaran T, Porter A. Efficient synthesis of mosquitocidal toxins in asticcacaulis excentricus demonstrates potential of gram negative bacteria in mosquito control. Nature Biotechnology 1996; 14: 343-7. [ Links ]
8. Koldenkova L, García L, Garcés J, Gonzáles R. Capacidad depredadora del pez larvívoro Poecilia reticulata (Peters, 1985). Cyprinodontiformis: Poecilidae en un criadero natural de Culex quinquefasciatus say, 1923. Rev Cub Med Trop 1988; 40(1): 21-6. [ Links ]
9. Davinson E. A review of the pathology of bacilli infecting mosquitoes including an ultraestructual study of larvae for Bacillus sphaericus, 1593. Dev Ind Microbiol 1981; 22: 69-81. [ Links ]
10. Mulla M, Feclerice A, Darwazen A. Larvicidal efficacy of Bacillus thuringiensis serotype H-14 against stagnant water mosquitoes and its effects on nortarget, organisms. Envirom Entomol 1982; 11: 788-95. [ Links ]
11. Ministerio de Salud. Informe ejecutivo proyectado al 31-12-98. Trujillo: MINSA, 1998. [ Links ]
12. Ortiz A, Braso A, Quintero R. Aislamiento y caracterización de cepas de Bacillus thuringiensis nativas del estado de Morelos. Revista de la Universidad Ciencia y Tecnología 1992; 3: 45-9. [ Links ]
13. Robles E. Optimización de la producción de bioinsecticida por Bacillus thuringiensis (Tesis para optar el Grado de Maestro). Trujillo: Universidad Nacional de Trujillo; 1996. [ Links ]
14. Centro Panamericano de Ecología Humana y Salud. Información técnica sobre el agente de control biológico Bacillus thuringiensis SH-14 de Barjac. México; 1984. [ Links ]
15. Restrepo N, Gutiérrez D, Patirio M, Thery I, Delechuse A, Orduz S. Cloning expression and toxicity of a mosquitocidal toxin gene of Bacillus thuringiensis sub sp. Medellin. Instituto Oswaldo Cruz 1997; 92(2): 125-8. [ Links ]
16. Federici A. Site of action of the delta-endotoxin of Bacillus thuringiensis in mosquito and blackfly larvae. In: Basic biology of microbial larvicides of vector of human diseases. Special program for research and training in tropical diseases. Geneva, Switzerland: UNDP/WORLD BANK BANK/WHO; 1982. p. 37-47. [ Links ]
17. Ventosilla P, Ruiz C, Guerra H, Marin D, Columbus I. Producción piloto usando cocos de Bacillus thuringiensis var. israelensis para el control biológico de Anopheles en áreas endémicas de malaria en el Perú. Rev Med Exp (2da época) 1997; XIV(2): 61. [ Links ]
18. Chilcott C, Pillai BS. The use of coconut wastes for the production of Bacillus thuringiensis var. israelensis. Departament of Microbiology, University of Otago; 1985. [ Links ]
19. Merello J, Ventosilla P, Chauca J, Guerra H, Infante B, Pérez E. Coconut and yuca agars to produce Bacilus thuringiensis var. israelensis. 65 Annual Meeting of the AMCA and the 87 Annual Meeting of the New Yersey Mosquito Control Association, Inc. March 12-16. Atlantic City NJ; 2000. [ Links ]
20. Oficina General de Epidemiología. Vigilancia Epidemiológica. Boletín informativo semana epidemiológica 51. (Fecha de acceso: noviembre 2000). URL disponible en: www.oge.sld.pe/bol/boletines/index.htm;2000 [ Links ]
21. Zerpa N, Moreno J, González J, Novoa O. Colonization and laboratory maintenance of Anopheles albimanus. Wiedemann in Venezuela. Rev Inst Med Trop Sao Paulo 1998; 40(3):173-6. [ Links ]
22. Vandekar M, Dulmage H. Guidelines for production of Bacillus thuringiensis H-14. Edit. UNDP/WORLD BANK/WHO. Special programme for research and training in tropical diseases 1982. Geneva: WHO. p. 51-9. [ Links ]
23. Roberts EA, Coote GG. Estimation of concentration from dilution counts. Biometrics 1965; 21: 600-15. [ Links ]
24. Hadad M. Andlise de probites. En: Controle microbiano de insetos. Edit. Manole; 1986. [ Links ]
25. Montalván-Santillán E. Bacillus thuringiensis para controlar mosquitos culícidos en Sullana, Piura-1987. Rev Per Entomol 1990; 32:103-9. [ Links ]
26. Montero G, Espino R, Garcia I, Díaz M. Efectividad del Bacillus thuringiensis variedad israelensis SH-14 en criaderos de Anopheles albimanus en las condiciones naturales de Cuba. Rev Cub Hig Epidemiol 1986b; 24(2):165-71. [ Links ]
27. Klowden M, Held G, Bulla L. Toxicity of Bacillus thuringiensis sub sp. israelensis to adult Aedes aegypti mosquitoes. Applied and Environmental Microbiol 1983; 46 (2): 312-5. [ Links ]
28. Moquillaza J. Tratamiento focal con larvicidas en los criaderos de Aedes aegypti. En: Curso macro-regional entomología básica: uso de plaguicidas en salud pública control vectorial integrado en malaria y OEM. Convenio MINSA-Comunidad Europea. Lima: MINSA; 1998. [ Links ]
* Este estudio contó con el apoyo técnico-financiero del Proyecto Vigía "Enfrentando las Amenazas de las Enfermedades Infecciosas Emergentes y Reemergentes" MINSA-USAID.
Correspondencia: Franklin Vargas Vásquez.
Universidad Nacional de Trujillo.
Calle Las Esmeraldas 403-Urb. Santa Inés, Trujillo.
Telf: (044) 222201.
E-mail: frvv@usa.net