Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.19 n.1 Lima ene./mar 2002
TRABAJOS ORIGINALES
Hiperendemicidad de leptospirosis y factores de riesgo asociados en localidades arroceras del departamento de San Martín - Perú1
Rollin Cruz M1; Freddy Fernández V1; Heriberto Arévalo R1.
1 Dirección Regional de Salud San Martín - Perú.
RESUMEN
Objetivos: Determinar la prevalencia de infección por leptospiras y los factores asociados a dicha infección en localidades dedicadas al cultivo de arroz del departamento de San Martín. Materiales y métodos: en este estudio transversal analítico se seleccionó una muestra de 457 pobladores de 73 localidades con la mayor producción de arroz de 4 provincias del departamento de San Martín de julio a diciembre del 2000, en quienes se evaluó la presencia de anticuerpos IgG anti-lesptospiras en suero por el método de ELISA, con identificación de los serovares (en muestras positivas) a través de la prueba de microaglutinación (MAT). La presencia de factores de riesgo asociados a la infección por leptospiras fue evaluada por una encuesta epidemiológica. Resultados: 115 (25,2%) pobladores tuvieron anticuerpos antileptospiras. Los factores asociados a la infección por leptospiras en los pobladores incluidos en la muestra fueron: edad mayor de 30 años (OR=1,69, p=0,018), no ser natural de San Martín (OR=1,59, p=0,032), ser agricultor (OR=1,71, p=0,013), habitar una vivienda con piso de tierra (OR=2,17, p=0,018), eliminación de excretas a campo abierto (OR=2,11, p=0,023) y no guardar lo comida tapada (OR=3,63, p=0,023). Conclusiones: existe una alta prevalencia de leptospirosis en áreas dedicadas al cultivo de arroz del departamento de San Martín. En estas zonas debe realizarse actividades educativas preventivas tomando en cuenta los factores de riesgo identificados.
Palabras clave: Leptospirosis; Prevalencia; Anticuerpos; Factores de riesgo; Perú (fuente: BIREME).
ABSTRACT
Objectives: To determine the prevalence of Leptospira infection and associated factors in rice growing places in San Martin Department, Peru. Materials and methods: In this analytical and cross-sectional study, we chose a sample of 457 settlers at 73 major rice growing places in 4 provinces of San Martin Department, between July and December 2000. They were assessed for the presence of serum IgG anti-Leptospira antibodies using an ELISA method, identifying serovars (in positive samples) through a microagglutination test (MAT). The presence of risk factors associated to Leptospira infection was assessed with an epidemiological survey. Results: 115 (25,2%) settlers had anti-Leptospira antibodies. Factors associated to Leptospira infection in settlers were: age over 30 (OR=1,69 , p=0,018), not being born in San Martin (OR=1,59, p=0,032 ), being a farmer (OR=1,71, p=0,13), to live in a house without an appropriate floor (OR= 2,17, p= 0,018), absence of a sewage system, eliminating stools to the field (OR=2,11, p=0,023) and not keeping food adequately protected (OR=3,63, p=0,023). Conclusions: There is a high prevalence of leptospirosis in areas dedicated to rice cultivation in San Martin Department. Preventive educational activities should be performed in these areas, taking into account the risk factors identified.
Key wods: Leptospirosis; Prevalence; Antibodies; Risk factor; Peru (source: BIREME).
INTRODUCCIÓN
La leptospirosis es una enfermedad zoonótica causada por espiroquetas, que tiene una amplia distribución en el mundo, sobre todo en lugares con inadecuadas condiciones de saneamiento y malos hábitos higiénicos1-3. El cuadro clínico producido por la especie patógena de leptospira (Leptospira interrogans) es variable, pudiéndose presentar desde infecciones asintomáticas o formas anictéricas de la enfermedad con sintomatología general e inespecífica, hasta formas graves ictéricas y hemorrágicas con diversos grados de insuficiencia renal y hepática (Enfermedad de Weil)4-6.
La leptospirosis afecta tanto a humanos como animales, siendo el hombre un hospedero accidental que adquiere la infección, ya sea en forma directa al contacto con la piel y membranas mucosas, con orina, sangre o tejidos de animales contaminados, o indirectamente, a través del contacto con agua o suelo húmedo contaminado por animales infectados. Estos mecanismos de transmisión explican el alto riesgo ocupacional que presentan ciertos grupos de trabajadores relacionados a la exposición a desagües, estancos y suelos húmedos (campos de caña de azúcar, de cultivo de arroz, etc)7-9.
En nuestro país, esta enfermedad no es de notificación inmediata, no existiendo reportes serológicos continuos, ni información confiable de la prevalencia nacional. A pesar de esto, se ha observado en los últimos años un incremento en el número de muestras de pacientes sospechosos de leptospirosis que llegaron al Instituto Nacional de Salud para su confirmación: 41 muestras (21 positivas) en 1997, 443 (98 positivas) en 1998 y 855 (93 positivas) en 1999 3 . Debemos mencionar, además, que los estudios de seroprevalencia son escasos, siendo la mayoría realizados en población con sintomatología sospechosa y muy pocos en población asintomática; dentro de estos últimos tenemos las investigaciones hechas en Koribeni (La Convención-Cusco) en 199810 y en Oyotún y Picsi (Lambayeque) en 1999, con 25% y 22% de prevalencia de anticuerpos anti-leptospira, respectivamente11.
Tampoco en el Perú se cuenta con estudios publicados de los factores de riesgo para leptospirosis, sumiéndose que dichos factores son similares a los encontrados en otros países. Así, dentro de los factores de riesgo asociados a la infección y enfermedad por leptospiras encontrados tenemos: las características de los suelos, la presencia de aguas contaminadas, las características de las viviendas, la disponibilidad de sistemas de eliminación de excretas y la existencia de reservorios vertebrados (roedores)12,13. Además, debemos señalar que se ha catalogado a la leptospirosis como una enfermedad de tipo ocupacional, de mayor frecuencia en agricultores, limpiadores de desagües, cortadores de caña de azúcar, arroceros, militares, mineros y veterinarios7,8.
Las localidades rurales del departamento de San Martín son áreas tropicales dedicadas casi exclusivamente a actividades agrícolas (cultivos de arroz y azúcar, esencialmente). En dichas áreas, el reporte de pacientes con síndromes ictéricos es frecuente, llegándose a reportar 4 casos de leptospirosis entre éstos durante un brote de Fiebre Amarilla en 1999 en la región San Martín14.
Debido al reporte reciente de casos confirmados de leptospirosis en San Martín y a las condiciones propicias en sus localidades para la transmisión de esta enfermedad; se diseñó el presente estudio con el objetivo de determinar la prevalencia de infección por leptospiras y los factores que condicionan esta infección en localidades productoras de arroz del departamento de San Martín.
MATERIALES Y MÉTODOS
En el presente estudio transversal analítico se evaluó la presencia de anticuerpos anti-Leptospira en residentes de diferentes localidades de cuatro provincias del departamento de San Martín (Perú), en el periodo comprendido entre los meses de julio y diciembre del 2000.
Considerando que las localidades dedicadas al cultivo de arroz (por las características propias de esta actividad y ámbito geográfico en que se desarrolla) poseían condiciones favorables para la transmisión de la leptospirosis, se incluyeron 73 localidades con la mayor producción arrocera, distribuidas en 24 distritos de las provincias de Bellavista, Moyobamba, Picota y Rioja. Dicha selección fue realizada tomando en cuenta información publicada por el Ministerio de Agricultura (producción promedio por campaña mayor a 150 hectáreas), empleándose, además, criterios de accesibilidad y tipo de regadío (bajo riego) para la inclusión de localidades.
Tomando en cuenta los datos del censo local de 1993, se consideró una población total en riesgo (de las 73 localidades) de 50 330 habitantes, los cuales residían en 11 711 viviendas. Con esta información, usando el programa Statcalc del EPI-INFO 2000 para Windows, se calculó un tamaño muestral mínimo de 452 pobladores, considerando una prevalencia esperada de infección por leptospiras del 5%, un nivel de confianza del 95% y un error absoluto del 2%. Se realizó un muestreo estratificado proporcional al número de habitantes por localidad, sexo y edad, seleccionándose la muestra luego de elegir al azar las viviendas a visitar por localidad, a partir de un croquis previamente elaborado. Se excluyó del estudio a los niños menores de 5 años y a aquellos pobladores con un tiempo de residencia en la zona menor de 6 meses.
A todos los pobladores incluidos en el estudio se les realizó una entrevista, a través de la cual se registraba en una ficha previamente diseñada y validada: datos generales, datos epidemiológicos de riesgo para leptospirosis y antecedentes patológicos. Luego, previo consentimiento informado, se obtuvo de cada poblador 7 cc de sangre venosa en tubos al vacío. Dichas muestras fueron centrifugadas, siendo los sueros separados en viales y transportados bajo cadena de frío al Laboratorio de Referencia Regional. Posteriormente, se remitieron al Laboratorio de Bacterias de Transmisión Sexual y Leptospiras del Instituto Nacional de Salud para la detección de anticuerpos IgG anti-leptospiras mediante la técnica de ELISA y la confirmación de las muestras reactivas y tipificación de los serovares a través de la prueba de aglutinación microscópica (MAT)15.
La información fue ingresada a una base de datos previamente diseñada. Los resultados fueron expresados en frecuencias absolutas y relativas. Mediante análisis bivariado a través de pruebas no paramétricas (Chi- cuadrado, Kruskal-Wallis) se evaluó la existencia de asociación entre la presencia de anticuerpos anti- leptospiras y las variables registradas en la ficha (datos generales, datos epidemiológicos y antecedentes patológicos), considerándose un p<0,05 como significativo. Se calcularon además los odds ratio (OR) e intervalos de confianza respectivos. En el procesamiento y análisis de los datos se utilizó el paquete estadístico SPSS 9,0 para Windows.
RESULTADOS
Desde julio a diciembre del 2000 se incluyó una muestra de 457 de un total de 50 330 pobladores de 73 localidades con la mayor producción arrocera en cuatro provincias del departamento de San Martín. Dicha muestra conservó las proporciones según localidad, grupos etáreos y sexos reportadas en el censo de 1993 para la región San Martín. Estas características demográficas se muestran en la Tabla N°1.
En la Tabla Nº 2 se observa la prevalencia de infección por leptospiras en la muestra estudiada; además, señala las diferencias existentes según las características generales de la muestra: 115 (25,2%) pobladores tuvieron presencia de anticuerpos IgG anti-leptospiras (antecedente de infección). Los pobladores naturales de otros departamentos diferentes a San Martín (migrantes de la sierra norte de Cajamarca, Piura y Amazonas) (OR=1,59, I.C.95%:1,02- 2,48)(p=0,032), aquellos mayores de 30 años (OR=1,69, I.C.:1,06-2,67) (p=0,018) y aquellos dedicados a la agricultura (OR=1,71, I.C.: 1,09-2,68) (p=0,013) tuvieron mayor proporción de casos con serología positiva. Además, se encontró una tendencia no significativa de que los varones tengan mayor presencia de anticuerpos anti-leptospiras que las mujeres (p=0,056). No se encontró diferencias en la presencia de este marcador serológico para leptospirosis según la provincia de procedencia, ni nivel de instrucción.
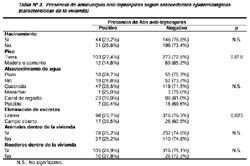
La Tabla Nº 3 nos muestra que dentro de las características de las viviendas, sólo el piso de tierra (OR=2,17, I.C.:1,09- 4,41)(p=0,018) y la eliminación de excretas en campo abierto (OR=2,11, I.C.: 1,04-4,23)(p=0,023) estuvieron asociados a una mayor infección por leptospiras. No se encontró diferencias en relación al hacinamiento, presencia de roedores, presencia de animales al interior de la vivienda, ni el tipo de abastecimiento de agua.
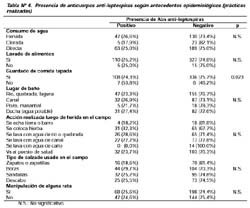
Respecto a los antecedentes epidemiológicos (prácticas realizadas); sólo el no guardar la comida tapada estuvo asociado a una mayor presencia de anticuerpos anti-leptospiras en los pobladores (OR=3,63, I.C.: 1,07- 12,49)(p=0,023). No se encontró asociación en relación a las siguientes prácticas: consumo de agua directa (no hervida o clorada), lavado de alimentos, lugar en donde se toma el baño (río, quebrada, laguna, canal ducha, etc.), práctica realizada luego de herida en piel en el campo, tipo de calzado usado en el campo y manipulación de una rata en alguna oportunidad (Tabla Nº 4).
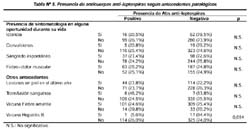
Ninguno de los antecedentes patológicos y clínicos registrado a través de la encuesta mostró asociación con la infección por leptospiras (Tabla Nº 5).
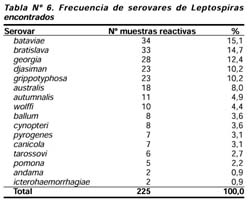
La Tabla Nº 6 nos muestra la distribución de serovares de las leptospiras encontradas. Los serovares más frecuentemente identificados fueron: bataviae (15,1%), bratislava (14,7%) y georgia (12,7%), así los distritos con mayor prevalencia de infección por leptospiras presentaron similares serovares que los de menor prevalencia.
DISCUSIÓN
En el presente estudio encontramos elevada prevalencia de infección por leptospiras en los pobladores de las localidades incluidas en el estudio, con presencia de acticuerpos IgG anti-leptospiras en 25,2% de sus pobladores. Aunque era esperable que estas localidades de San Martín sean endémicas, por ser una región tropical dedicada a la actividad agrícola y en particular al cultivo de arroz y azúcar, la prevalencia hallada supera a las encontradas en la mayoría de estudios internacionales realizados en poblaciones similares.
Así, estudios realizados en Brasil en localidades cuya actividad principal es el cultivo de arroz y azúcar han mostrado prevalencias de infección por leptospiras que no sobrepasan el 8,9%, siendo esta prevalencia mayor en el grupo de agricultores16. Similares cifras fueron encontradas en Yucatán (México)17 y en Abangares (Costa Rica)18 , con prevalencias que van del 14,1% a 16,0%, también mayor en los trabajadores dedicados a la agricultura que en los trabajadores del área urbana (30,0% vs. 13,3%).
En nuestro país, los estudios de seroprevalencia realizados son escasos, no existiendo alguno realizado en localidades cuya actividad económica principal sea el cultivo de arroz. La mayoría fueron realizados en población con sintomatología sospechosa o en población sin sintomatología, pero luego de haberse reportado casos confirmados de leptospirosis en el lugar. En 1997, se identificó presencia de anticuerpos contra Leptospiras a través de pruebas rápidas (dipstick) en 46,0% de la población de 3 comunidades ubicadas a lo largo del río Nanay19. En 1998, el Ministerio de Salud en el distrito de Lagunas (Sullana-Piura), encontró que 6 de 29 (20,0%) muestras de pacientes con fiebre y mialgias tenían anticuerpos anti-leptospiras20. También, en 1998 ante la evidencia de una epidemia, se realizó un estudio de seroprevalencia de infección en humanos y animales domésticos en la localidad de Koribeni del distrito de Echarate, provincia de La Convención-Cusco, en donde se obtuvo 164 sueros de pobladores asintomáticos, de los cuáles 41 mostraron anticuerpos contra Leptospiras (25,0%)10. El último estudio de seroprevalencia en nuestro país fue realizado en Lambayeque en 1999, en los distritos de Oyotún y Picsi encontrándose en el 22,0% de los pobladores presencia de anticuerpos anti-leptospiras11.
Respecto al estudio de factores asociados a la infección por leptospiras, encontramos que los pobladores no naturales del departamento de San Martín tuvieron mayor probabilidad de tener anticuerpos anti-leptospiras, siendo éstos en su mayoría naturales de departamentos contiguos (sierra norte de Cajamarca, Piura y Amazonas) en donde también se han reportado casos de leptospirosis3,20 ; esto nos sugeriría que parte de estos pobladores podrían haberse infectado antes (tiempo mayor de 6 meses) de su llegada a San Martín en lugares con endemecidad igual o inclusive mayor que la encontrada en nuestro estudio.
La prevalencia de infección por leptospiras tuvo una tendencia creciente conforme aumentaba la edad, observándose mayor prevalencia en el grupo etáreo mayor de 30 años, hallazgo que podría atribuirse a un mayor periodo de exposición. Encontramos además que los pobladores dedicados a la agricultura tuvieron mayor prevalencia de infección que aquellos dedicados a otro tipo de actividad laboral, lo que demostraría la categoría de enfermedad ocupacional que tiene la leptospirosis7,8. En relación a este hallazgo, debemos mencionar los estudios realizados en Costa Rica y Cuba, en donde también se identificó que la actividad agrícola (cultivo de arroz y azúcar, especialmente) realizada por sus pobladores, constituye un verdadero factor de riesgo para la adquisición de la infección y enfermedad18,21.
También se evidenció que los varones tuvieron una tendencia no significativa de presentar mayor positividad a anticuerpos anti-leptospiras que las mujeres, hallazgo que se explicaría por diferencias en exposición a factores de riesgo reconocidos para la infección por leptospiras, como por ejemplo: el hecho de que la mayoría de pobladores dedicados a la agricultura en nuestra muestra fueron del sexo masculino. No se halló diferencias en la prevalencia de infección por leptospiras en relación a la provincia de procedencia de los pobladores, tampoco según el grado de instrucción; esto nos sugeriría que las localidades incluidas en el estudio (localidades con alta producción de arroz) poseen similares factores de riesgo para la infección y que el nivel de instrucción no constituye un verdadero factor asociado a la infección por leptospiras en estas localidades.
En relación a las características de la vivienda, aquellos pobladores que tenían en su vivienda piso de tierra y que no contaban con servicios higiénicos (eliminando sus excretas a campo abierto) tuvieron mayor probabilidad de presentar anticuerpos anti-leptospiras. Dicho hallazgo coincide con lo reportado por Almeida y col. quienes en un muestra de trabajadores del servicio de saneamiento ambiental, identificaron como factor de riesgo asociado a la infección por Leptospirosis el no poseer servicios higiénicos dentro de la casa22.
Un hallazgo que llamó la atención fue encontrar que aquellos pobladores que preparaban sus alimentos y no los guardaban adecuadamente (tapados) para consumirlos después, tuvieron mayor proporción de serología positiva, respecto a quienes sí lo hacían.
Estos alimentos dejados a la intemperie podían así, estar expuestos a roedores, reservorios importantes en la transmisión de la leptospirosis. A diferencia de este hallazgo, el tipo de abastecimiento de agua, la forma de su consumo (hervida, clorada o directa), el no lavado de alimentos antes de comerlos y el lugar donde los pobladores toman el baño corporal, no estuvieron asociados a la presencia de anticuerpos anti-leptospiras. Tampoco la presencia de roedores en la vivienda ni la manipulación de éstos (haberlos tocado alguna vez) mostraron asociación, esto podría sugerir que la elevada prevalencia de infección por leptospiras se deba más a la exposición a roedores silvestres en áreas rurales, que a la de roedores domésticos.
Ningún signo, ni síntoma presentado por los pobladores en alguna oportunidad mostró asociación con la infección por leptospiras, debido a que la mayoría de cuadros clínicos de Leptospirosis pasan inadvertidos por su condición de infecciones asintomáticas o formas anictéricas caracterizadas por signos y síntomas generales e inespecíficos4,5.
Mediante la técnica de aglutinación microscópica (MAT) identificamos 16 de 23 serovares de Leptospiras reportados en la literatura nacional3. Todos los serovares estuvieron distribuidos en forma homogénea en las cuatro provincias estudiadas, siendo los más frecuentes: bataviae, bratislava, georgia, djasiman y grippotyphosa. Dicha distribución es diferente a la encontrada en Koribeni (La Convención-Cusco)10, demostrando la variación de serotipos entre las regiones debido principalmente a diferencias ecológicas. Debemos señalar además que la infección concomitante fue frecuente, habiendo 8 pobladores hasta con 4 tipos diferentes de serovares. Otro hallazgo importante fue la baja frecuencia (sólo 2 casos) del serovar icterohaemorrhagiae, principalmente relacionado a casos graves de Leptospirosis y formas de Enfermedad de Weil5,6 .
Nuestro trabajo permitió identificar a las localidades arroceras de las provincias de Bellavista, Picota, Moyobamba y Rioja del departamento de San Martín como zonas de alta endemecidad de infección por leptospiras. En estos lugares se justifican medidas educativas de prevención, las cuáles deben incidir en explicar y hacer entender a la población y sus autoridades las formas de transmisión de esta infección y los animales posiblemente infectados (reservorios), resaltando las prácticas y actividades de riesgo identificadas en nuestro estudio (eliminación de excretas en campo, guardado de comida no tapada y actividad agrícola).
REFERENCIAS
1. De Aguirre L. Leptospirosis ocupacional en humanos. 1a ed. FONAIAP–Centro Nacional de Investigación Agropecuaria. Instituto de Investigación Veterinaria. Maracay: FONIAP; 1995. [ Links ]
2. Oficina General de Epidemiología. Boletín: Leptospirosis en el Perú. Lima: OGE; 1999. [ Links ]
3. Oficina General de Epidemiología - Instituto Nacional de Salud. Leptospirosis. Lima: OGE-INS; 2000. Módulo Técnico N.º 2. [ Links ]
4. Correa M, Veronesi R, De Brito T. Leptospiroses. En: Veronesi R. Doenças y parasitárias. 7ª edición. Edit. Guanabara; 1987. p. 573-92. [ Links ]
5. Sandford JP. Leptospirosis. En: Braunwald E, Isselbacher K, Petersdorf , Wilson J, Martin J, Fauci A. Harrison´s Principles of Internal Medicine. 11 th ed. New YorK: McGraw-Hill Book Company; 1987. p. 652-5. [ Links ]
6. Farrar W. Especies de Leptospira (Leptospirosis). En: Mandell G, Gordon R, Bennett J. Enfermedades infecciosas, principios y práctica. 4ª ed. New York : Churchill Livingstone Inc.; 1995. p. 2396-400. [ Links ]
7. Martone WJ, Kaufmann A. Leptospirosis in humans in the United States, 1974-1978. From the Center for Disease Control. News. J infect Dis 1979; 140(6): 1020-2. [ Links ]
8. Farr RW. Leptospirosis. Clin Infect Dis 1995; 21(1): 1-6. [ Links ]
9. Coutinho de Oima S, Sakata E, Rocha-Santo C. Surto de leptospirose humana por atividade recreacional no municipio de São Paulo, estudo seroepidemiológico. Rev Inst Med Trop São Paulo 1990; 32(6): 474-9. [ Links ]
10. Oficina General de Epidemiología. Reporte epidemiológico semanal: Semana epidemiológica #23. Lima: OGE; 1998. [ Links ]
11. CTAR Lambayeque. Oficio Nº 09560-99 CTAR Lambayeque - DRSAL/Epi; 1999. [ Links ]
12. Perolat P. Epidemiology of leptospirosis, in New Caledonia (South Pacific): a one – year survey. Eur J Epidemiol 1997;13(2): 161-7. [ Links ]
13. Everard C, Bennett S, Edwards CN, Nicholson GD, Hassell TA, Carrington DG, et al. An investigation of some risk factors for severe leptospirosis on Barbados. J Trop Med Hyg 1992; 95: 13-22. [ Links ]
14. Romero K, Cruz R. Estudio de leptospirosis en la Provincia de Moyobamba. San Martín: DISA San Martín; 1999. [ Links ]
15. Instituto Nacional de Salud. Manual de procedimientos de laboratorio para el diagnóstico de leptospirosis. Lima: INS;2002. Serie de Normas Técnicas Nº 34. [ Links ]
16. Brito M, Moreira E, Modena C. Aglutininas anti-leptospiras em arrozeiros e roedores silvestres de manga, Minas serais. Rev Med Minas Gerais 1994; 4(2): 94-7. [ Links ]
17. Zavala J, Pinzón J, Flores M, Damián A. La leptospirosis en Yucatán: estudio serológico en humanos y animales. Salud Pública Mex 1984; 26(3): 254-9. [ Links ]
18. Rojas A, Valverde M, Peña I. Estudio serológico de leptospira en una población de Abangares. Rev Med Costa Rica Centroam 1999; 66(548): 105-9. [ Links ]
19. Paxton H. Integrate diagnostics, INC. Baltimore; 1998. Unpublished data. [ Links ]
20. Oficina General de Epidemiología. Alerta OGE Nº 1 y Nº 4. Lima: OGE; 1998. [ Links ]
21. Chamizo H, Cruz de la Paz R, Borroto R. Estudio geoepidemiológico de la leptospirosis humana en Cuba. Rev Cub Hig Epidemiol 1996; 34(1): 15-22. [ Links ]
22. Almeida LP, Martins LF, Brod CS. Fatores de risco associados a presenca de anticorpos anileptospira em trabalhadores do servico de saneamento ambiental. Cienc Rural 1999; 29(3): 511-6. [ Links ]
Correspondencia: Rollin Cruz Malpartida.
Av. Miguel Grau 216 - Huánuco.
Telf.: (064) 513750
E-mail: rollincm@yahoo.es
1 Este estudio contó con el apoyo técnico - financiero del Proyecto Vigía Enfrentando las amenazas de las enfermedades infecciosas emergentes y reemergentes. MINSA – USAID.