Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.19 no.1 Lima Jan./mar 2002
TRABAJOS ORIGINALES
Prueba de Elisa indirecta para la detección de anticuerpos IgM para el diagnóstico de Leptospirosis humana.
Manuel Céspedes Z1; Martha Glenny A1; Vidal Felices A1; Lourdes Balda J1; Víctor Suárez M2.
1 Laboratorio de Leptospiras, División de Bacteriología, Centro Nacional en Salud Pública. Instituto Nacional de Salud. Lima – Perú.
2 Centro Nacional de Laboratorios en Salud Pública. Instituto Nacional de Salud. Lima – Perú.
RESUMEN
Para el diagnóstico temprano de enfermedades con cuadro clínico inespecífico como la leptospirosis, es necesario la confirmación laboratorial mediante pruebas específicas, con la finalidad de que el diagnóstico sea más acertado y rápido. Objetivo: se realizó un estudio comparativo entre la prueba de microaglutinacion (MAT) y la prueba de ELISA indirecta estandarizada con un pool de antígenos de Leptospira interrogans, para la detección de anticuerpos IgM, en muestras de suero de fase aguda de leptospirosis humana. Materiales y métodos: 40 muestras de pacientes con sospecha clínica y con títulos de 1:100-1:12800 por la prueba de MAT, 80 muestras negativas de pacientes aparentemente sanos con enfermedades como Brucelosis, Sífilis, Tifus murino, Hepatitis B, Fiebre Amarilla, Dengue y Enfermedad de Carrión fueron evaluados por ELISA IgM. Resultados: se obtuvo una sensibilidad de 97,5% y especificidad de 98,75%, no observándose reacción cruzada con otras enfermedades. Conclusión: ELISA IgM validado en el laboratorio es suficiente sensible, específico y de fácil aplicación para el uso como prueba de tamizaje en una infección por Leptospiras con la subsecuente confirmación por MAT.
Palabras clave: Test de ELISA; Test de aglutinación; Leptospirosis; Leptospira interrogans (fuente: BIREME).
ABSTRACT
In order to have an early diagnosis for diseases with a non-specific clinical presentation, it is necessary to have laboratory confirmation using special tests, so that the diagnosis is more accurate and timely. Objective: A comparative study using microagglutination MAT test and an Indirect ELISA, standardized using an antigen pool from Lepsotspira interrogans, aiming at detecting IgM antibodies, in acute phase serum samples from cases of human leptospirosis. Materials and methods: 40 samples from patients with clinical suspicion and 1:100-1:12800 titers using the MAT test, and 80 negative samples from apparently healthy subjects free from Brucelosis, Syphilis, murine typhus, hepatitis B, yellow fever, dengue, and Carrions disease were assessed using ELISA for IgM. Results: A 97.5% sensitivity and a 98.75% specificity were found, and there was no cross-reaction with other diseases. Conclusion: The laboratory validated ELISA-IgM test is sensitive, specific, and easy to use as a screening test when Leptospira infection is suspected, using the MAT test for confirming the diagnosis.
Key words: Enzyme-linked inmunosorbent assay; Agglutination; Leptospirosis; Leptospira interrogans (source: BIREME).
INTRODUCCIÓN
La leptospirosis es una enfermedad zoonótica de distribución mundial que afecta tanto a humanos y animales. Es considerada también como una enfermedad ocupacional, dado que su transmisión está asociada con la actividad de las personas, sobre todo cuando el hombre está en contacto directo o indirecto con orina de animales infectados1-6.
Esta enfermedad es causada por Leptospira interrogans que agrupa más de 240 serovares que son patógenos para los humanos y animales. En el ambiente también se encuentra otra especie que no causa enfermedad en los humanos es Leptospira biflexa que agrupa más de 60 serovariedades1-3.
Dentro de las manifestaciones clínicas de la leptospirosis, se encuentran el síndrome de Weil, el cual muchas veces es fatal para el paciente si es que no se llega a dar un tratamiento adecuado, sobre todo porque en esta etapa se confunde con patologías virales3.
La leptospirosis humana se puede diagnosticar mediante aislamiento de la bacteria o demostrando anticuerpos contra leptospiras. El cultivo tiene la desventaja de que el periodo que tarda la bacteria en crecer y su bajo porcentaje de aislamiento hacen que no sea útil para un diagnóstico oportuno3.
Para la detección de anticuerpos como prueba de referencia (gold estándar) se usa la prueba de micro- aglutinación (MAT); sin embargo, esta prueba necesita de personal entrenado y de antígenos vivos, además de que el mantenimiento de cepas es costoso, siendo difícil su realización como método de rutina en los laboratorios1-3.
El objetivo de este trabajo fue validar una prueba de ELISA para detectar anticuerpos IgM contra las cepas de leptospiras comunes en nuestro país.
MATERIALES Y MÉTODOS
SELECCIÓN DE LA MUESTRA
Se emplearon 40 muestras positivas de personas provenientes de zonas endémicas de leptospirosis, con sospecha clínica y epidemiológica, que presentaron serología positiva a la prueba de MAT. Además, se emplearon 80 muestras negativas, de las cuales 45 fueron de personas aparentemente sanas con serología negativa a la prueba de MAT y sin antecedentes clínico-epidemiológicos para leptospirosis. Los restantes 35 sueros fueron de personas con otras patologías confirmadas por diferentes métodos serológicos, como Brucelosis (6), Sífilis (7), Tifus murino (7), Hepatitis B (6), Fiebre amarilla (2), Dengue (3) y Enfermedad de Carrión (4).
PROCEDIMIENTO DE LABORATORIO
Preparación del antígeno
Se siguió la metodología de Adler con algunas modificaciones. Se utilizó la especie patógena Leptospira interrogans y las siguientes cepas: Icterohaemorrhagiae cepa Icterohaemorrhagiae, Australis cepa Jez Bratislava, Ballum cepa MUS 127, Canicola cepa Hond Utrecht IV, Cynopteri cepa 3522 C, Grippotyphosa cepa Moskova V. Para la producción de la masa celular, cada cepa fue cultivada en frascos con medio Ellinghausen Mc Culloug Johnson and Harris (EMJH), incubados a 28°C por 7 días, realizando un recuento de células en cámara de Neubauer cada dos días, hasta llegar a una población celular de 5x109 células por mL. Los cultivos fueron conservados a –20°C.
Lisis celular
Se siguió la metodología de Silva y col 4 con algunas modificaciones. Los cultivos fueron centrifugados a 10 000 g por 30 minutos a 4°C, el sedimento se resuspendió en tampón fosfato salino 0,02 M, pH 7,2 y se centrifugó como en el paso anterior por tres veces; el sedimento final se resuspendió en 5 mL de PBS 0,02 M, pH 7,2, y luego se realizó la lisis celular con sonicador a 0,8 mA y una frecuencia de 20 KHz durante tres minutos por tres ciclos en hielo. Se repartió alícuotas del antígeno sonicado en crioviales de 0,5 mL y se conservó a -70ºC. La concentración de cada antígeno se determinó con el KIT B. C. A. Protein (PIERCE) la cual se basa en la reducción del Cu +2 a Cu +1 por la proteína en un medio alcalino con alta sensibilidad y selectividad en la detección colorimétrica del catión cuproso (Cu +1 ) mediante el ácido bicinconínico.
Ensayo inmunoenzimáticos
Soluciones y tampones
Tampón fosfato salino pH 7,2 (PBS), solución de lavado (PBS conteniendo 0,05% de Tween 20), solución de bloqueo (solución de lavado conteniendo 5% de leche descremada), tampón de incubación (Tris a 0,05 M, NaCl a 0,15 M, pH 7,3, conteniendo 2% de suero albúmina bovina) solución cromógena OPD y solución de parada ácido sulfúrico 2N.
Ejecución del ensayo
A cada pocillo de la microtira de poliestireno fondo plano (Nunc) se agregó 100 µL de antígeno diluido en PBS, pH 7,2, se incubó a 4°C por 24 horas, se lavó la placa seis veces con solución de lavado, se agregó 200 µL de la solución de bloqueo, se volvió a incubar por una hora a 37ºC y se lavó 6 veces. Los sueros fueron diluidos 1:100 en tampón de incubación, se agregó 100 µL de cada dilución a los pocillos, se incubó por 30 minutos a 37°C y luego cada pocillo fue lavado seis veces. Posteriormente, se agregó 100 mL de conjugado antihumano IgM-peroxidasa diluido adecuadamente en tampón de incubación, se incubó por 30 minutos a 37°C, se realizó seis lavados, se agregó 100 µL de OPD y nuevamente se incubó por 30 minutos a 37°C; para detener la reacción enzimática se agregó 100 µL de H2SO4 2N. La lectura de realizó en un lector de microplacas a 490 nm. El punto de corte se determinó con la media aritmética de las muestras negativas más dos desviaciones estándar.
Prueba de microaglutinación (MAT)
La prueba de MAT se realizó de acuerdo a las normas de la Organización Mundial de la Salud, utilizando los siguientes serogrupos: Andamana, Australis, Autumnalis, Ballum, Bataviae, Canicola, Celledoni, Pomona, Hebdomadis, Cynopteri, Djasiman, Mini, Grippotyphosa, Icterohaemorrhagiae, Javanica, Pyrogenes, Sejroe y Tarassovi1-3.
Para el análisis estadístico se usó el programa EPIDAT 2,0. Se calculó la concordancia de la prueba y los índices de sensibilidad y especificidad.
RESULTADOS
ANTÍGENO
La concentración proteica que se obtuvo de cada antígeno de leptospiras fue: Australis (2,10 mg/mL), Ballum (0,87 mg/mL), Canicola (1,24mg/mL), Cynopteri (0,56 mg/mL), Icterohaemorrhagiae (0,66 mg/mL) y Grippotyphosa (0,5 mg/mL). A partir de la concentración original de cada antígeno se llevó a una concentración de 8 µg/mL, formándose una muestra homogénea (pool) de antígenos; luego, al probar en diferentes concentraciones, se encontró la concentración de proteína más adecuada para realizar la prueba de ELISA entre 0,5-1,0 µg/mL permitiéndonos observar una buena discriminación entre positivos y negativos.
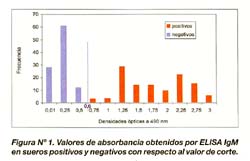
La prueba de ELISA indirecta usando el pool de antígenos fue aplicada a las 80 muestras negativas. La media A490nm del grupo control negativo fue 0,35±0,12. El punto de corte estimado como la media de los negativos más 2 desviaciones estándar fue 0,6, lo que permitió establecer el límite de reactividad (Figura Nº 1).
Los sueros de pacientes positivos con leptospirosis mostraron un rango entre 0,88 a 2,08 con un valor de la media de 1,63±0,54 (Figura N° 1). El rango A490nm de los sueros de otras etiologías fue 0,10 a 0,57, con una media de 0,31±0,11. Todas las muestras negativas tuvieron absorbancias menores al punto de corte (Figura Nº 2).
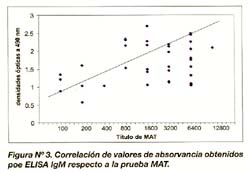
Los resultados de la prueba serológica MAT de los pacientes positivos con leptospirosis presentaron títulos entre 1/100 a 1/12800. Se encontró una correlación positiva entre los títulos de MAT mayores a 1600 y los valores de absorbancia entre 1,0-2,5 (Figura N°3).
No se observó reacción cruzada con sueros de pacientes con Brucelosis, Hepatitis B, Tifus, Fiebre amarilla, Sífilis, Dengue y Enfermedad de Carrión ( Figura N° 2).
Para determinar la sensibilidad y especificidad, se evaluó el total de muestras, observándose un índice de concordancia de 98,33%. De ellos, el resultado de la prueba ELISA IgM indirecta fueron coincidentes con la prueba MAT en 39 muestras positivas y 79 negativas. Una muestra positiva no fue detectada por el ELISA IgM y una muestra fue considerada como falso positivo (Tabla Nº 1).

La sensibilidad de la prueba ELISA IgM impregnado con el pool de antígenos fue 97,5% (IC 95%: 85,3–99,8), en tanto que la especificidad de la prueba fue 98,75% (IC 95%: 92,3–99,9).
DISCUSIÓN
Un método rápido e inicial en el diagnóstico de leptospirosis humana es importante para poder auxiliar al médico, el cual puede disponer de recursos laboratoriales para una confirmación diagnóstica oportuna.
Existen diferentes metodologías de diagnóstico para leptospirosis, como por ejemplo fijación de complemento, test de látex y reacción de hemaglutinación, pero cuya desventaja es que no son muy sensibles ni específicas12,13. Otros métodos como son la inmunofluorescencia, contra-inmunoelectroforesis y radioinmunoensayo, requieren de equipos sofisticados14,15. A diferencia de los métodos antes señalados, la técnica de ELISA tiene una gran ventaja por su simplicidad, sensibilidad y especificidad.
La estandarización y validación de la prueba ELISA IgM para diagnóstico serológico de leptospirosis humana fue realizada con la tentativa de obtener una prueba altamente sensible y específica de aplicación práctica para muchos laboratorios.
Utilizando concentraciones de antígeno entre 0,5-5,0 µg/mL se detectó la reacción en los sueros, demostrando una mayor sensibilidad de la prueba, por lo que será capaz de detectar bajos niveles de anticuerpos. El antígeno utilizado para la prueba ELISA IgM con un pool de antígenos fue de fácil ejecución y de buen rendimiento (100 µL del stock de antígeno sirve para más de 450 pruebas), en tanto que los procedimientos de preparación de antígenos tratados por sonicación presentaron resultados satisfactorios, como se reportó en trabajos anteriores10,11,17,18.
A través de investigaciones anteriores en nuestro país fueron establecidos los serogrupos más frecuentes que presentaban resultados positivos por la prueba MAT y éstos son Australis, Ballum, Bataviae, Canicola, Grippotyphosa, Icterohaemorrhagiae, Mini, Pomona, Hebdomadis, Djasiman y Cynopteri4-8. En la prueba de ELISA IgM con el pool de antígenos, reaccionaron sueros de pacientes infectados por leptospirosis de diferentes serogrupos, coincidiendo con reportes anteriores10-23, dado que está bien demostrado que el antígeno leptospiral somático es género-específico y el antígeno de envoltura serovar-específico. Los resultados evidencian la existencia de reacciones cruzadas entre los diferentes serogrupos de Leptospira interrogans (Datos por publicar).
Los resultados obtenidos en la prueba ELISA IgM de una mezcla antigénica (pool) presentó una buena sensibilidad (97,5%) y alta especificidad (98,75%) en el diagnóstico de una infección leptospiral aguda coincidiendo con Cumberland17. En cuanto a la concordancia entre ELISA IgM y MAT para los sueros de pacientes positivos fue buena permitiendo inferir que el ELISA IgM es sensible y se puede aplicar en el diagnóstico temprano de la leptospirosis, coincidiendo con Silva y Winslow10,11,21.
En relación a los sueros de personas infectados con otras patologías no leptospirales, no se observó reacción cruzada en la prueba ELISA IgM con el pool de antígenos, similar a lo reportado por Silva10,11.
En este estudio la prueba ELISA IgM detectó todos los casos producidos por Leptospira interrogans serogrupos Australis, Autumnalis, Ballum, Bataviae, Canicola, Pomona, Cynopteri, Djasiman, Mini, ebdomadis, Grippotyphosa, Icterohaemorrhagiae y otros.
Consecuentemente, el ELISA descrito en este trabajo podría particularmente servir como prueba para seguimiento de rutina en el diagnóstico de leptospirosis en el laboratorio. En aquellos laboratorios que no puedan contar con la prueba MAT, es recomendable el uso de esta prueba ELISA IgM, aunque es necesario la confirmación del diagnóstico por MAT como una prueba de referencia.
Por su rapidez, la prueba ELISA permite una confirmación diagnóstica rápida y segura, útil también en situaciones epidémicas o brotes, posibilitando dirigir medidas de vigilancia y control epidemiológico.
AGRADECIMIENTOS
Al Ph.D. Álvaro Marcelo de la Universidad Federico Villarreal por el apoyo en la revisión del protocolo; al Técnico Benjamín Cárdenas por el apoyo incondicional en el laboratorio y a los Dres. Fernando Llanos-Zavalaga, Susana Zurita M. y Leonid Lecca G. por la revisión y consejos en la elaboración del manuscrito.
REFERENCIAS
1. Faine S. Guidelines for the control of leptospirosis. Geneva, World Health Organization; 1982. Publication Nº 67.
2. Faine S, Adler B, Bolin C, Perolat P. Leptospira and leptospirosis. 2nd. ed. Melbourne: Medi Sci; 2000.
3. Hartskeerl R, Smits H, Korver H, Terpstra W. International course on laboratory methods for diagnosis of leptospirosis. The Netherlands: Royal Tropical Institute Department of Biomedical Research; 2001.
4. Liceras J. Leptospirosis humana en las provincias de Lima y Callao. Rev Med Per 1973; 34: 27-34.
5. Liceras J. Leptospirosis en Tingo María, departamento de Huánuco, Perú. II. Estudio en animales silvestres. Bol Of Sanit Panam 1981; 68: 297-306.
6. Herrer A, Liceras J. Leptospirosis en el Perú. II. Encuesta serológica en el mercado central de Lima. Rev Med Exp 1960; 13 : 109–13.
7. Liceras J. Leptospirosis en San Martín, Perú. Bol Of Sanit Panam 1975; 74: 410-21.
8. Macedo S, Cornide R, Cáceres I. Cepas endémicas de Leptospiras patógenas en America Latina y en el Caribe. Rev Cub Med Trop 1983; 35: 186-92.
9. Adler B, Murphi A, Locarni S, Faine S. Detection of spe cific anti-leptospiral immunoglobulin M and G in human serum by solid-phase-enzime-linked immunosorbent assay. J Clin Microbiol 1980; 11: 452-7.
10. Silva V, Camargo D, Vaz J, Souza C, Veda M, Sakata E. Teste inmunoenzimatico (ELISA) para deteccao de anticorpos circulantes da clase Ig M na la leptospirose humana. Rev Inst Med Trop Sao Paulo 1988; 30: 95-100.
11. Silva V, Camargo E, Vaz J, Souza A, Chieeff P, Sakata E. Imunodiagnostico da leptospirose humana atraves do teste ELISA IgM, empregnandose diferentes preparacoes antigenicas a partir do sorotipos prevalentes do Leptospira interrogans. Rev Inst Med Trop Sao Paulo 1990; 32: 233-9.
12. Arimitsu Y, Matunasi T. Serodiagnosis of leptospirosis in China by the one point MCA method. Epidem infect 1987; 99: 393-8.
13. Brandao P, Camargo E, da Silva E, Silva M, Abrao R. Macroscopic agglutination test for rapid diagnosis of human leptospirosis. J Clin Microbiol 1998; 36(11): 3138-42.
14. Myers D. Serodiagnosis of human leptospirosis by counterimmunoelectrophoresis. J Clin Microbiol 1987; 25: 897-9.
15. Ribeiro A, Kawarabayashi M, Yamada K, Takeda K, Correa M. Immnunodiagnostico da leptospirose humana. 2. Estudo comparativo das reacoes de soroaglutinacao microscopica, hemaglutinacao passiva e imunofluoresencia. Rev Inst Adolfo Lutz 1981; 41: 135-43.
16. Cho H, Gale P, Malkin K. Diagnostic specifity sensitivity and cross-reactivity of an enzime-linked immunosorbent assay for the detection of antibody against Leptospira interrogans serovar pomona, sejroe and hardjo in cattle. Can J Vet Res 1989; 53: 285-9.
17. Cumberland P, Everard C, Levett P. Assessment of the efficacy of an IgM ELISA and microscopic agluttination test (MAT) in the diagnosis of acute leptospirosis. Am Trop Med Hyg 1999; 61(5): 731-4.
18. Mailloux M, Mazonelli G, Dufresne Y. Application of an immune-enzyme technique to titration of antibodies in leptospirosis: ELISA (Enzime-linked immunosorbent assay). Zbl Bakt Hyg I Abt Orig 1984; 257: 511-3.
19. Milner A, Jackson B, Woodruff K, Smart J. Enzyme linked immunosorbent assay for determining specific immunoglobulin M in infection caused by Leptospira interrogans serovar hardjo. J Clin Microbiol 1985; 22: 539-42.
20. Terpstra W, Ligthart S, Schoone G. Serodiagnosis of human leptospirosis by enzime-linked immunosorbent assay (ELISA) Zbl Bakt Hyg I Abt Orig 1980; 247: 400-5.
21. Winslow W, Merry D, Pir M, Devine P. Evaluation of a commercial enzime-linked immununosorbent assay for detection of an immunoglobulin M antibody in diagnosis of human leptospiral infection. J Clin Microbiol 1997; 35:1938-42.
22. Smits H, Ananiyina Y, Cherensky A, Dancel L, Lai-A-Fat R, Chee H, et al. International multicenter evaluation of the clinical utility of a dipstick assay for detection of leptospira-specific immunoglobulin M antibodies in human serum specimens. J Clin Microbiol 1999; 37(9): 2904-9.
23. Watt G, Alquiza L, Padre P, Tuazon L, Laughlin L. The rapid diagnosis of leptospirosis a prospective of the dot enzime-linked immunosorbent assay and the genus specific microscopic agglutination test at different stages of illness. J Infect Dis 1988; 157: 840-2.
Correspondencia: Manuel Céspedes Zambrano. División de Bacteriología, Centro Nacional de Salud Pública. Instituto Nacional de Salud. Calle Cápac Yupanqui 1400, Lima 11, Perú. Apartado postal 471. Telf.: (0511)4719920.
Fax: (0511)4710179.
E-mail: mcespedes@ins.gob.pe