Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.19 no.2 Lima Apr.-jun 2002
COMUNICACIÓN CORTA
Evaluación de la transmisión vertical de Bartonella bacilliformis en Lutzomyia verrucarum (Diptera: Psychodidae)1
Carlos Ponce G1; Nelson Solórzano E1.
1 Hospital de Apoyo de Caraz – Dirección de Salud Ancash. Ancash – Perú.
RESUMEN
Objetivos: Identificar la existencia de transmisión vertical de Bartonella bacilliformis en Lutzomyia verrucarum. Materiales y métodos: en este estudio experimental, se realizó la crianza individual y masiva (Tº 22°C±2ºC, humedad relativa: 80%±5%) de Lutzomyia verrucarum en el Laboratorio de Entomología del Centro de Investigaciones del Hospital de Caraz (Ancash– Perú). Con la finalidad de lograr la infección de las hembras se procedió a alimentarlas con sangre infectada obtenida por éstas directamente al picar la piel de pacientes con bartonelosis aguda frotis positivo. Las hembras, luego de poner sus huevos, fueron evaluadas a través de la prueba de PCR para Bartonella baciliformis. Resultados: 13 de 18 (72,2%) hembras alimentadas con sangre infectada con bacteremia al 3% lograron poner huevos y de éstas ninguna resultó ser positiva al PCR. 12 de 54 (22,2%) hembras alimentadas con sangre infectada con bacteremia al 80% ovipusieron y de éstas sólo una (8,3%) resultó ser positiva al PCR. Ninguno de los descendientes adultos de esta hembra resultó positivo al PCR. Conclusiones: el bajo porcentaje de infección por Bartonella baciliformis encontrado en hembras oviponedoras no permitió determinar la existencia de transmisión vertical de Bartonella bacilliformis en Lutzomyia verrucarum.
Palabras clave: Bartonella; Psychodidae; Infecciones por Bartonella/transmisión; Transmisión vertical de enfermedad; Reacción en cadena por polimerasa (fuente: BIREME).
ABSTRACT
Objectives: To determine vertical transmission of Bartonella bacilliformis in Lutzomyia verrucarum. Materials And methods: In this experimental study, we performed individual and massive breeding (Tº: 22 ± 2º C, relative humidity: 80 ± 5%) of Lutzomyia verrucarum at the entomology laboratory in Caraz Hospital (Ancash – Peru). In order to infect female mosquitoes, we fed them with blood from patients with positive-smear acute bartonellosis. Female mosquitoes were assessed after they laid their eggs, using a PCR test for Bartonella baciliformis. Results: Thirteen of 18 (72.2%) females fed with infected blood with 3% bacteremia laid their eggs, and none of them was PCR positive. Twelve of 54 (22.2%) females fed with infected blood, with 80% bacteremia laid their eggs, and only one (8.3%) was PCR positive. No adult offspring of this female was PCR positive. Conclusions: The low rate of Bartonella baciliformis infection in female mosquitoes laying their eggs did not show the existence of vertical transmission of Bartonella bacilliformis in Lutzomyia verrucarum.
Key words: Bartonella; Psychodidae; Bartonella infections/transmisión; Disease transmission, vertical; Polymerase chain reaction (source: BIREME).
INTRODUCCIÓN
La Bartonelosis o enfermedad de Carrión es una enfermedad endémica producida por la bacteria Bartonella baciliformis, y se presenta principalmente en valles interandinos ubicados entre 500 y 3200 m.s.n.m de algunas regiones del Perú. Estos valles tienen las condiciones ecológicas propicias para que el vector Lutzomyia verrucarum viva y transmita la enfermedad1,2. Las áreas de riesgo identificadas para la transmisión de esta enfermedad, abarcan los departamentos de Cajamarca, Amazonas, Piura, La Libertad, Ancash, Lima, Huancavelica y Cusco3.
A diferencia de otras Bartonellas, ningún reservorio animal ha sido identificado para Bartonella baciliformis, siendo pertinente buscar las posibles formas por las cuáles este agente patógeno está circulando. La mayoría de investigadores señalan como principales reservorios para esta enfermedad a las personas con enfermedad crónica o personas infectadas, que permanecen asintomáticas por meses antes de presentar el cuadro clínico. Sin embargo, no se ha descartado el posible rol del vector de mantener la bacteria en la naturaleza, mediante la transmisión vertical de una generación a otra. Las bacterias como las Bartonellas del nuevo mundo pueden haber evolucionado de organismos simbiontes de insectos4 y haber desarrollado una relación tal que sea posible la permanencia de la bacteria en el insecto, sin la presencia del huésped animal o humano.
Se ha encontrado Bartonella baciliformis en el intestino y las partes bucales de Lutzomyia (Phlebotomus)5 , sin embargo se desconoce su ciclo de desarrollo en este vector, no existiendo reportes sobre la transmisión vertical de bacterias en los flebotominos; situación diferente a la que ocurre con algunos virus. Por ejemplo, algunos flebótomos pueden cargar virus que se transmiten transováricamente6, reportándose la transmisión vertical del virus de Toscana en Phlebotomus perniciosus7 y del flebovirus Virus de Río Grande en Lutzomyia anthophora en el laboratorio8. También se ha reportado el hallazgo del Virus del Oeste del Nilo en mosquitos machos del Phlebotomus perniciosus, lo que sugiere que ocurre la transmisión vertical de estos virus9 .
Con la finalidad de determinar si existe transmisión vertical de Bartonella bacilliformis en Lutzomyia verrucarum se diseñó la presente investigación orientada a conocer otros probables factores que permitan la perpetuación de la endemia de la enfermedad de Carrión en algunas regiones del país.
MATERIALES Y MÉTODOS
El presente estudio experimental fue realizado de diciembre de 2000 a junio de 2001 en el laboratorio de crianza que se encuentra ubicado dentro de las instalaciones del Hospital San Juan de Dios del distrito de Caraz, provincia de Huaylas, departamento de Ancash - Perú.
Los flebótomos usados para el establecimiento de colonias fueron de las localidades de Colcas (distrito de Santa Cruz) y Choquechaca (distrito de Caraz) de la provincia de Huaylas, lugares con gran densidad de Lutzomyia verrucarum y alta prevalencia de la enfermedad. Se capturaron hembras alimentadas con sangre o grávidas de los lugares de reposo dentro de los domicilios con aspiradores manuales, los cuales fueron depositados en vasos de colecta para su transporte al laboratorio.
CRIANZA INDIVIDUAL
Para iniciar la colonia se realizó la crianza individual en frascos de vidrio transparente de 30 cc con ±1 cm. de espesor de yeso de París como sustrato para que los insectos depositen sus huevos. Luego de humedecer el sustrato, se colocó una hembra alimentada o grávida en cada frasco y se tapó la abertura con un pedazo pequeño de organza atada a una liga. Los procedimientos para el mantenimiento de las colonias se basaron en los métodos de Endris et al.8,10 con algunas modificaciones hechas por P. Lawyer11. Se diseñó una incubadora de madera, con paredes de corcho sintético y un aparato de baño maría dentro, con temperatura de agua constante de 30ºC, a fin de que provea dentro de la incubadora una temperatura de 22ºC± 2°C y una humedad relativa de 80%±5%, condiciones muy favorables para la crianza de L. verrucarum en el laboratorio. Para asegurar que la colonia esté formada por la misma especie de flebotominos se realizó, luego de colocar los huevos, la identificación taxonómica de las hembras.
CRIANZA MASIVA
Para el mantenimiento, cópula y liberación de los frascos de crianza de larvas se emplearon cajas de crianza 12, las cuales consistían en cajas de mica cuadrada de ±12 L de capacidad, con la superficies inferior y posterior cubiertas con yeso de París preparado con agua destilada (proporción 1:1). Las colonias fueron expuestas a fotoperiodos naturales 12:12 (luz: oscuridad) durante todo el periodo de crianza13.
ALIMENTACIÓN DE ADULTOS Y LARVAS
Para proveer el recurso azucarado de los adultos, en el caso de la crianza individual, se colocó pequeños trozos de manzana en la superficie de la organza, los que se cambiaban diariamente para evitar la proliferación de hongos14. De forma similar, en la caja de crianza masiva se colocó en una placa petri pequeños trozos de manzana o pasas hervidas. Debido a la dificultad de las hembras de Lutzomia verrucarum para alimentarse con sangre de animales (cuyes o pollos), se decidió alimentarlas con sangre humana, mediante la introducción de un brazo en la caja de crianza. En el caso de nuestra colonia no hubo problemas para alimentarlos en el día, a pesar de conocer que los flebotominos tienen hábitos crepusculares o nocturnos 15.
En el caso de las larvas, la preparación estuvo basada en el método mejorado de Lawyer et al.16. Este preparado tiene como ingredientes: heces secas de conejo y alimento para conejo (Purina Cia ® ). Teniendo en cuenta que luego que los adultos ponen sus huevos éstos mueren, se revisó diariamente los frascos de crianza para observar la oviposición. Al evidenciar las primeras eclosiones, se suministró una pequeña cantidad de alimento, para evitar el sofocamiento y el crecimiento de hongos. Se revisó cada frasco, diariamente, para evitar el crecimiento de hongos o infestación de ácaros y registrar los datos del ciclo biológico. Conforme crecían las larvas, éstas necesitaban más alimento, hasta llegar al final del cuarto estadio larvario y el periodo de pupa, etapas en donde dejan de alimentarse.
INFECCIÓN EXPERIMENTAL
A diferencia de otras especies de flebotominos, no se logró la alimentación de las hembras de Lutzomyia verrucarum con sangre suministrada mediante un alimentador artificial a través de una membrana de parafilm16. Por ello, se tuvo que recurrir a la infección directa con pacientes con diagnóstico confirmado de bartonellosis aguda frotis positivo a quienes, previo consentimiento informado, se les solicitó que introduzcan su brazo dentro de la cámara de crianza por 10 a 15 minutos, tiempo suficiente para que un buen número de insectos hembras, se alimenten de sangre infectada con B. bacilliformis. Estas hembras después de alimentarse fueron dejadas dentro de la caja de crianza por un mínimo de 24 horas para asegurar la copulación10,13, y luego fueron colocadas en los frascos de crianza individual hasta conseguir la siguiente generación de adultos.
PROCESAMIENTO POR PCR EN EL LABORATORIO
Las hembras infectadas, fallecidas luego de la oviposición, fueron colocadas en viales con alcohol al 80% para su conservación y procesamiento posterior mediante la técnica de reacción en cadena por polimerasa (PCR). Los insectos descendientes de progenitores infectados, luego de su muerte, también fueron conservados y procesados mediante la técnica de PCR. Esta técnica se realizó en el Laboratorio de Biología Molecular del NAMRID (Instituto Naval de Investigación Médica), utilizando el kit de extracción de tejido DNA DNeasy Tissue Kit, el kit de PCR Boeringer Manhelheim y los primers (porción del gen que codifica la enzima citrato sintetasa de la Bartonella) desarrollados en el Centro de Control de Enfermedades de Atlanta (CDC). Esta técnica identifica a la Bartonella hasta el nivel de género17.
La información fue ingresada a una hoja de cálculo de Microsoft Excel, siendo los resultados expresados en frecuencias absolutas y relativas. Para determinar si existe asociación entre variables no parámétricas, se usó la prueba de chi-cuadrado, considerando un p<0,05 como significativo.
RESULTADOS
Los procedimientos realizados para la crianza de Lutzomyia verrucarum fueron exitosos en nuestra investigación, obteniéndose durante la crianza de colonias alimentadas con sangre infectada con Bartonella baciliformis (crianza de colonias sanas) una tasa de oviposición de 67% y un promedio de 23,4 huevos por hembra.
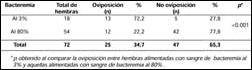
En total, 72 flebotominos hembras fueron alimentadas con sangre de pacientes con Bartonelosis aguda frotis positivo: 18 con sangre con bacteremia al 3% (primer grupo) y 54 con sangre con bacteremia al 80% (segundo grupo)(Tabla N° 1).
13 (72,2%) hembras alimentadas con sangre infectada con bacteremia al 3% (primer grupo) lograron poner huevos, y de estas hembras ninguna resultó ser positiva al PCR para Bartonella baciliformis. En cambio del total de hembras alimentadas con sangre infectada con bacteremia al 80% (segundo grupo) sólo 12 (22,2%) ovipusieron, y de éstas sólo una hembra (8,3%) resultó positiva al PCR para Bartonella baciliformis (Tablas N° 1 y N° 2). La única hembra de Lutzomyia infectada llegó a oviponer 19 huevos, de los cuales 15 eclosionaron: 6 larvas evaluadas en estadio II-III resultaron PCR negativas, 7 evaluadas en el estadio adulto también fueron PCR negativas y 2 murieron antes de la eclosión.
Las hembras que no ovipusieron tuvieron un menor tiempo de vida luego de la alimentación con sangre infectada (2 a 5 días) que aquellas que ovipusieron (7-10 días).
También se hizo la prueba de PCR a aquellas hembras que fallecieron sin oviponer a manera de control, encontrándose positividad en 83,3% de las hembras.
Tabla Nº 1. Porcentaje de Lutzomyias hembras alimentadas con sangre infectada por Bartonella baciliformis que lograron poner huevos. *p obtenido al comparar la oviposición entre hembras alimentadas con sangre de bacteremia al 3% y aquellas alimentadas con sangre de bacteremia al 80%.
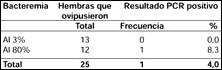
Tabla Nº 2. Porcentaje de Lutzomyias hembras fallecidas luego de la oviposición con resultado de PCR positivo para Bartonella baciliformis.
DISCUSIÓN
En nuestra investigación logramos con éxito realizar la crianza de Lutzomyia verrucarum usando técnicas y procedimientos que aún no están estandarizados para este especie de flebotomino10-13 , por lo que se encuentran en continuo mejoramiento. Es así que a diferencia de otros flebotominos16, la alimentación con sangre en hembras de Lutzomyia verrucarum mediante un alimentador artificial a través de un membrana de parafilm no resultó, por lo que se usó para la alimentación de estos insectos sangre obtenida directamente por éstos al picar la piel del brazo de un ser humano. Debido a esta dificultad, tuvimos que utilizar pacientes con diagnóstico de Bartonelosis aguda frotis positivo con la finalidad de lograr la infección de flebotominos hembras. Esto trajo limitaciones al tratar de obtener un buen número de insectos alimentados con sangre infectada por Bartonella baciliformis.
Encontramos diferencias en oviposición y mortalidad de las hembras, según el porcentaje de bacteremia de la sangre infectada usada para su alimentación (p<0,001), lo cual indirectamente indica que una mayor bacteremia usada en la alimentación de esta especie resultaría en una disminución de su capacidad de procreación debido a una mortalidad más precoz luego de ser alimentadas por la sangre infectada.
Sólo se logró demostrar la infección por Bartonella baciliformis mediante PCR en una hembra fallecida (alimentada con sangre infectada con bacteremia al 80%) luego de oviponer, representando sólo 4% de todas las hembras que lograron poner huevos. Este hallazgo fue muy diferente al encontrado en el grupo de hembras fallecidas que no lograron poner huevos (compuesto en su mayoría por aquellas alimentadas con sangre infectada con bacteremia al 80%), en donde la positividad al PCR superó el 80%, resultado que, junto a un menor tiempo de vida de este grupo de hembras luego de su alimentación con sangre infectada (2 a 5 días) y la observación bajo estereoscopía de la ruptura de la membrana peritrófica e intestinal de éstas8, apoyan la hipótesis de una mayor mortalidad de Lutzomyia verrucarum debido a una mayor bacteremia.
La transmisión vertical (transovárica) de algunos flavivirus tropicales, como el dengue y la fiebre amarilla, que ocurre en algunos grupos de mosquitos como posibles mecanismos de sobrevivencia del virus durante el invierno y épocas secas18,19 , podría estar ocurriendo con la Bartonella baciliformis en la Lutzomyia verrucarum, y ello explicaría una persistente circulación de la bacteria y la aparición de brotes de bartonelosis en zonas que no habían reportado casos por años.
En nuestro estudio, se usó una sola hembra para la determinación de la transmisión vertical de Bartonella baciliformis en Lutzomyia verrucarum, debido a que ésta fue la única oviponedora confirmada como infectada según PCR, encontrándose que ninguno de sus descendientes resultó ser positivo al PCR.
Consideramos nuestra investigación como un estudio base (piloto), recomendando continuar la evaluación de esta posible forma de transmisión con un mayor número de hembras infectadas con Bartonella, para incrementar así la posibilidad de detectar descendientes positivos. Además, deberían ensayarse otros métodos distintos al PCR que permitan detectar infección por Bartonellas, como la disección de flebotominos con ayuda de la Microscopía electrónica o la inmunohistoquímica.
REFERENCIA
1. Cáceres A. Distribución geográfica de la Lutzomyia verrucarum, vector de la Bartonellosis humana en el Perú. Rev Inst Med Trop Sao Paulo 1993; 35(6): 485-90. [ Links ]
2. Herrer A. Epidemiología de la verruga peruana. Lima:UNMSM; 1990. [ Links ]
3. Maguiña C. Bartonellosis humana en el Perú – estudio de 145 casos de Bartonellosis en el Hospital Nacional Cayetano Heredia. (Tesis doctoral). Lima: Universidad Peruana Cayetano Heredia; 1993. [ Links ]
4. Lewis D. Phlebotomine sandfly research. London: Medical Entomology Centenary. Symposium proceedings; 1977. p. 94- 9. [ Links ]
5. Kettle DS. Medical and veterinary entomology. Cambrige: Ed. CAB International; 1995. [ Links ]
6. Kendrick K. Methods for the study of phlebotominae sandflies. Medical Research Counsil External Scientific Staff. London: Department of Pure and Applied Biology, Imperial College; 1986. [ Links ]
7. Maroli M, Ciufolini M. Vertical transmission of Toscana virus in the sandfly, Phlebotomus perniciosus, via the second gonotrophic cycle. Med Vet Entomol 1993; 7(3): 283-6. [ Links ]
8. Endris R, Young D, Butler J. The laboratory biology of the sandfly Lutzomyia anthophora (Diptera: Psychodidae). J Med Entomol 1984; 21(6): 656-64. [ Links ]
9. Miller B, Nasci R. First field evidence for natural vertical transmission of West Nile virus in Culex univittatus complexmosquitoes from Rift Valley province, Kenya. Am J Trop Med Hyg 2000; 62(2): 240-6. [ Links ]
10. Kendrick K. Investigation of sandfly vectors. TDR/SWG- Epileish 1981; 3: 1-12. [ Links ]
11. Chaniotis B. A new method for rearing Lutzomyia trapidoi (Diptera: Psychodidae), with observations on its development and behavior in the laboratory. J Med Entomol 1975; 12(2): 183-8. [ Links ]
12. Beach R, Young D, Mutinga M. New phlebotomine sand fly colonies: rearing Phlebotomus martini, Sergentomyia schwetzi, and Sergentomyia africana (Diptera: Psychodidae). J Med Entomol 1983; 20(6): 579-84. [ Links ]
13. Endris R, Perkins P, Young D, Johnson R. Techniques for laboratory rearing of sand flies (Diptera: Psychodidae). Mosquito News 1982; 42(3): 400-7. [ Links ]
14. Mebrahtu Y, Beach R, Lawyer PG, Perkins PV. The blood-feeding behavior of Phlebotomus martini (Diptera: Psychodidae): is it a question of photoperiodism or circadian rhythm?. Ann Trop Med Parasitol 1996; 90(6): 666-8. [ Links ]
15. Lawyer PG, Rowton ED, Perkins PV, Johnson RN, Young DG. Recent advances in laboratory mass rearing of phlebotomine sand flies. Parassitologia 1991; 33(Suppl): 361-4. [ Links ]
16. Bastien P. Comparison of Leishmania infections in sandflies fed with two types of feeders. Ann Trop Med Parasitol 1992; 86(3): 309-10. [ Links ]
17. Norman AF, Regnery R, Jameson P, Greene C, Krause DC. Differentiation of Bartonella-like isolates at the species level by PCR-restriction fragment length polymorphism in the citrate synthase gene. J Clin Microbiol 1995; 33(7): 1797-803. [ Links ]
18. Brinson F, Hagan D, Comer J, Strohlein D. Seasonal abundance of Lutzomyia shannoni ( Diptera: Psychodidae) on Ossabaw Island, Georgia. Med Entomol 1992; 29(2): 178-82. [ Links ]
19. Rosen L. Mechanism of vertical transmission of dengue virus in mosquitoes. CR Acad Sci III 1987; 304(13): 347-50. [ Links ]
Correspondencia: Nelson Solórzano E. Hospital de Apoyo de Caraz. Av. Circunvalación s/n Caraz.Telf: (043) 791026
E-mail: nsolorzano@oge.sld.pe; nelson_solorzano@yahoo.com
1 Este estudio contó con el apoyo técnico - financiero del Proyecto Vigía Enfrentando las Amenazas de las Enfermedades Infecciosas Emergentes y Reemergentes. MINSA-USAID.