Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.19 n.3 Lima jul./set 2002
TRABAJOS ORIGINALES
Helmintofauna de Rattus rattus (Linnaeus, 1758) y Rattus norvegicus (Berkenhout, 1769) (Rodentia: Muridae) en el distrito de San Juan de Lurigancho, Lima - Perú
José Iannacone Oliver1; Lorena Alvariño Flores1.
1 Laboratorio de Ecofisiología. Facultad de Ciencias Naturales y Matemáticas. Universidad Nacional Federico Villarreal. Lima - Perú.
RESUMEN
Objetivo: Se investigaron algunos aspectos de los componentes comunitarios e infracomunitarios de la parasitofauna de dos ratas simpátricas Rattus rattus (Linnaeus) y Rattus norvegicus (Berkenhout) en especimenes recolectados en las márgenes de la cuenca baja del río Rímac, Lima, Perú. Materiales y métodos: Todos los helmintos fueron colectados, procesados, identificados y cuantificados usando los procedimientos parasitológicos estandarizados. Resultados: Se determinaron 4 especies de parásitos con diferentes prevalencias y abundancias: Hymenolepis diminuta (Rudolphi) (Cestoda) (84% y 4,3), Protospirura chanchanensis Ibáñez (Nemátoda) (47% y 1,2), Syphacia obvelata (Rudolphi) (Nemátoda) (6,3% y 0,09) y Heterakis spumosa Schneider (Nemátoda) (3,1% y 0,03). Hymenolepis diminuta fue considerada una especie central, P. chanchanensis una especie secundaria y S. obvelata y H. spumosa especies satélites. Hymenolepis diminuta tuvo el valor más alto de frecuencia de dominancia (65,6%). No se observó correlación entre la intensidad y prevalencia de parásitos y la longitud estándar y el sexo de ambos huéspedes, a excepción de P. chanchanensis, en que los machos (promedio ± desviación estándar = 1,4 ± 1,6) presentaron mayor abundancia que las hembras (promedio ± desviación estándar = 0,33 ± 0,70). La diversidad de especies fue baja H= 0,08 ± 0,13. H. diminuta y P. chanchanensis no mostraron una asociación interespecífica. Conclusión: P. chanchanensis es un nuevo helminto registrado para R. rattus. S. obvelata y H. spumosa son nuevos helmintos registrados para R. norvegicus.
Palabras clave: Rattus / parasitología; Parásitos / prevalencias; Perú (fuente: BIREME).
ABSTRACT
Objective: A research at the component community and infracommunity level of the enteroparasite fauna of two sympatric rat species . Rattus rattus Linnaeus and Rattus norvegicus (Berkenhout)was conducted. Specimen were collected in the low basin of the Rimac river, Lima, Peru, in October 1998. Materials and methods: All the helminthes were collected, processed, identified and quantified employing standarized parasitological procedures. Results: 4 parasite species were found with different prevalence and abundance mean of infection respectively: Hymenolepis diminuta (Rudolphi) (Cestoda) (84 % and 4,3), Protospirura chanchanensis Ibañez (Nematoda) (47 % and 1,2), Syphacia obvelata (Rudolphi) (Nematoda) (6,3 % and 0,09) and Heterakis spumosa Schneider (Nematoda) (3,1 % and 0,03). Hymenolepis diminuta was a core species; P. chanchanensis a secondary species, and finally, S. obvelata and H. spumosa were rare species. H. diminuta had the highest frequency of dominance (65,6 %). No significant relationship between mean intensity and parasite prevalence with bodys standard length and sex of both hosts was observed. Only the mean abundance of P. chanchanensis was significantly higther in males (average ± DS = 1,4 ± 1,6) than females (average ± DS = 0,33 ± 0,70) rats. The species diversity was low, H± DS = 0,08 ± 0,1. There was no significant association between H. diminuta and P. chanchanensis. Conclusion: P. chanchanensis is a new registered helmith for R. rattus. S. obvelata and H. spumosa are new registered helmithes for R. norvegicus in Peru.
Key Words: Rattus / parasitology; Parasites / prevalence; Peru ( source: BIREME).
INTRODUCCIÓN
La rata negra, rata casera o rata de los desagües Rattus rattus (Linnaeus) y la rata de los tejados o rata de noruega R. norvegicus (Berkenhout) son dos vertebrados que transmiten enfermedades al ser humano1-3. Su helmintofauna parasitaria ha sido evaluada en diferentes latitudes 4-9. En Brasil, se han registrado 8 especies diferentes de nemátodos en R. rattus y 12 en R. norvegicus10.
Mafiana ha destacado el riesgo epidemiológico de las ratas al ser hospederos de Hymenolepis diminuta (Rudolphi) (Céstoda: Ciclophyllidea)3. Aunque, el análisis de la estructura comunitaria de los helmintos gastrointestinales en estas dos ratas ha sido realizado en diversas partes del mundo11-13, en Perú se han realizado pocas investigaciones14-16. El objetivo de este trabajo fue realizar un análisis cuantitativo de los helmintos enteroparásitos en dos especies de ratas, R. rattus y R. norvegicus, en la cuenca baja del río Rímac y en uno de los distritos más populosos de Lima, Nuevo San Juan. Se indagó la relación entre la helmintofauna con algunos parámetros biológicos de los hospederos (longitud estándar y sexo) y se examinó su preferencia por un determinado sitio específico en el intestino.
MATERIALES Y MÉTODOS
Se examinó el estómago, intestino delgado y grueso de 32 especimenes de Rattus spp. en búsqueda de helmintos parásitos. El muestreo se realizó entre el 8 y el 31 de octubre de 1998. Se capturaron 23 especimenes de R. rattus y 9 de R. norvegicus en el distrito de San Juan de Lurigancho, en la cuenca baja del río Rímac, en la ciudad de Lima, Perú. Para la colecta de los roedores se usó trampas de resorte con cebos rodenticidas basado en fluroacetato de sodio, los que fueron colocados adjuntos a tuberías de desagüe2. Las ratas aún sobrevivientes, fueron sacrificadas por golpe e individualizadas en bolsas plásticas para facilitar el tratamiento de los datos, según el código ético del Consejo de Organizaciones Internacionales de Ciencias Médicas, sobre experimentos con animales. Se determinó la especie y el sexo del múrido, usando las claves de Frutos2 . Posteriormente, a cada rata se le retiró el estómago e intestino delgado.
Se determinó la longitud estándar del cuerpo en centímetros (cm) sin considerar la cola, con la ayuda de una regla graduada en 0,1 cm, luego se dividió en cuatro intervalos de 2,5 cm: 15,2 ± 0,7 (14 a 16,4) cm (n=7), 17,3 ± 0,8 (16,5- 19) cm (n=12), 19,9 ± 0,8 (19-21,5) cm (n=9) y 22,9 ± 0,8 (21,5-24) cm (n=4). El intestino delgado se dividió en ocho secciones iguales que se delimitaron con la ayuda de hilos anudados. Se denominó sección I a la más cercana al cardias y VIII a la más cercana al píloro, siguiendo las recomendaciones de Bush17, Stock18 y Iannacone19. Se colocó el intestino en un frasco con formalina bufferada al 10% para la fijación y conservación de los helmintos adheridos a él. Se procedió a examinar individualmente cada una de las secciones intestinales con la ayuda de un microscopio estereoscópico. Los céstodos se cuantificaron de acuerdo a los escólices encontrados en cada una de las 8 secciones examinadas. Se consideró en conjunto los nemátodos macho y hembra por el bajo número de individuos encontrados. Todos los helmintos fueron procesados usando las técnicas parasitológicas estandarizadas para su identificación al nivel de especie. Los céstodos fueron coloreados con carmín acético de Semichon y montados en bálsamo de Canadá. Los nematodos fueron guardados en alcohol etílico al 70% con glicerina al 5% y finalmente examinados en montajes húmedos de gelatina glicerinada. Cada uno de los parásitos colectados fueron depositados en la helmintoteca del Laboratorio de Ecofisiología de la Facultad de Ciencias Naturales y Matemáticas, de la Universidad Nacional Federico Villarreal (FCNM-UNFV).
La aproximación ecológica a la helmintofauna se realizó en el ámbito de sus comunidades componentes e infracomunidades20. Se procedió a calcular la prevalencia, intensidad y abundancia según Bush21. La dominancia relativa y compartida de los componentes de la fauna parasitaria se calculó de acuerdo a Zar22. Los análisis comunitarios se realizaron con toda la helmintofauna encontrada. Para calcular la diversidad se empleó el índice de Shannon Weaver (H´) con la escala logarítmica en base 10. H´= - E pilogpi, donde, log= logaritmo en base 10; pi= ni/N, ni= número de individuos de cada especie y N= número total de individuos22. Se calculó el índice de uniformida de Pielou o índice de diversidad relativa (J) para cada infracomunidad parasitaria23. El índice de Simpson (C) se usó para determinar la dominancia de la infracomunidad parasitaria, cuando C≥ 0.25 24 . Debido al tamaño reducido de la muestra (n=32), los análisis de relación hospedero- parásito que emplean estadísticas inferenciales, se realizaron con ambas especies de Rattus en conjunto.
Se usó el coeficiente de correlación de Spearman (r s ), para determinar la correlación entre la longitud corporal están-dar del hospedero y la riqueza de especies, abundancia, intensidad, abundancia de los taxaparásitos, H´, C y J. Se usó el r s para estimar la relación entre la talla del hospedero y prevalencia de parásitos, transformada a raíz cuadrada de arcoseno de los datos expresados en proporción22.
El efecto del sexo en la abundancia, riqueza de especies, abundancia total de parásitos, H´ y J se probó usando la prueba t de Student, previa evaluación de la homogeneidad de varianzas empleando la prueba de Levene y transformación de los datos a logaritmo con el fin de ajustarlos a la distribución normal. Para evaluar el efecto del sexo en la prevalencia se usó el estadístico G25. Además, se utilizó el r s para relacionar la abundancia de las dos especies de helmintos presentes, con el sexo de los ejemplares. Adicionalmente, se evaluó si existían diferencias en la longitud corporal estándar, abundancia, H y J entre ambas especies de Rattus spp. Empleando la prueba t de Student. La preferencia de H. diminuta, por una determinada sección intestinal, fue evaluada con la prueba G. El nivel de significancia fue evaluado a á =0,05 26. La terminología ecológica siguió los criterios de Bush21,27. Los análisis de estadística inferencial incluyeron sólo a los parásitos con prevalencias mayores a 10 %27. Se definió especie común aquella con prevalencia mayor a 20%. Se usó la terminología de especie central (presente en más de 2/3 de los huéspedes), secundaria (presente entre 1/3 a 2/3 de los huéspedes) y satélite (presente en menos de 1/3 de los huéspedes) propuesta por Bush17. Se empleó el paquete estadístico SPSS 9,0 para Windows para el cálculo de las pruebas estadísticas descriptivas e inferenciales.
RESULTADOS
De los 32 ejemplares de R. rattus (n = 23; 71,8%) y R. norvegicus (n = 9; 28,1%) examinados en este estudio, 23 eran machos (71,9%) y 9 eran hembras (28,1%). Por longitudes estándar, las ratas se dividieron en cuatro categorías: I (7 especimenes) menores de 16,4 cm (21,9 %), II (12 especimenes) entre 16,5 a 19 cm (37,5 %), III (9 especimenes) entre 19 a 21,5 cm (28,1 %) y IV (4 especimenes) mayores de 21,5 cm (12,5 %). Las especies de roedores difirieron significativamente en su longitud estándar (Promedio ± desviación estándar: R. rattus 18,9 ± 2,5 y R. norvegicus 16,5 ± 1,8) (t = 2,62, P = 0,01, g.l. = 30). Además, las ratas machos presentaron una longitud estándar entre 18,3 ± 2,4 (14 a 23) cm y las hembras de 17,9 ± 3,1 (14,5 a 24) cm.
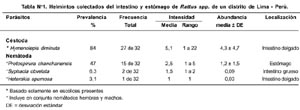
Dos ratas no estuvieron infectadas por parásitos en el estómago, intestino delgado y grueso (6,3%), 18 con una especie (56,3%) y 12 con dos especies (37,5 %). El número modal de parásitos por huésped fue 1 con un rango de 1 a 2. Un total de 178 helmintos fueron recuperados (rango= 0 - 22) (promedio ± desviación estándar = 5,5 ± 4,7). Se determinaron cuatro especies de parásitos Hymenolepis diminuta (Rudolphi) (Cestoda), Protospirura chanchanensis (Ibáñez) (Nematoda), Syphacia obvelata (Rudolphi) (Nematoda) y Heterakis spumosa (Schneider) (Nematoda). La Tabla Nº 1 muestra los valores de prevalencia, frecuencia, intensidad y abundancia con sus rangos respectivos y localización para las cuatro especies de helmintos en el estómago, en el intestino delgado y grueso. Se observó el siguiente orden decreciente de la prevalencia, intensidad y abundancia: H. diminuta > P. chanchanensis > S. obvelata > H. spumosa. La frecuencia de dominancia relativa fue para H. diminuta y para P. chanchanensis de 21 y 6, respectivamente. La frecuencia de dominancia compartida fue de 3. H. diminuta, fue el helminto con mayor frecuencia relativa (79%) y en menor cantidad P. chanchanensis (21%). El índice de Simpson presentó un valor bajo de dominancia (Promedio ± desviación estándar = 0,13 ± 0,21). La diversidad media de las infracomunidades fue H´ ± desviación estándar = 0,07 ± 0,11 y el índice de uniformidad o diversidad relativa media de Pielou fue de J ± desviación estándar = 0,31 ± 0,40. De las cuatro especies de helmintos encontrados, una especie fue considerada primaria: H. diminuta, otra secundaria: P. chanchanensis; y dos especies satélites: S. obvelata y H. spumosa.
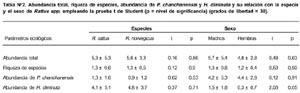
La Tabla Nº 2 nos indica la ausencia de diferencias significativas entre R. rattus y R. norvegicus con relación a la abundancia total, riqueza de especies, abundancia de P. chanchanensis y H. diminuta. Tampoco se encontraron diferencias entre el sexo y la abundancia total de parásitos, riqueza de especies y abundancia de P. chanchanensis. Sólo se encontró que los machos presentaban mayor abundancia de H. diminuta que las hembras.
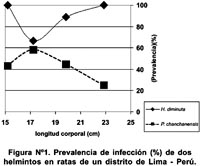
No se encontró relación lineal entre la longitud estándar de Rattus spp. y la intensidad media de H. diminuta (r s = -0,08, P = 0,69, n = 27) y de P. chanchanensis (r s = - 0,09, P = 0,74, n = 15) y tampoco relación lineal entre la longitud estándar y la prevalencia de infección de H. diminuta (r s = 0,10, P = 0,74, n = 4) y de P. chanchanensis (r s = - 0,40, P = 060, n = 4) (Figura Nº 1).
La longitud estándar corporal y la abundancia total de parásitos no se encontraron correlacionadas (r s = - 0,09, P = 0,59, n = 32) en cambio entre la riqueza de especies y la abundancia de parásitos totales se encontró relación lineal (r s = 0,43, P = 0,01, n = 32). El análisis de r s entre las prevalencias de estos dos helmintos y el estadístico G, mostraron que no existe relación o asociación significativa entre ambas especies de helmintos (r s = -0,84, P = 0,15, n = 4) y (G = 0,46, P> 0,05, g.l.= 1).
Ambos helmintos parásitos, H. diminuta y P. chanchanensis no mostraron ninguna dependencia entre la prevalencia de infección y el sexo de ambas especies de Rattus (G =3,63, P >0,05, g.l.= 1) y (G =3,22, P>0,05, g.l.= 1) respectivamente.
La diversidad parasitaria no fue estadísticamente diferente entre el sexo de los huéspedes (t = 0,37, P = 0,34, g.l.= 30) y entre ambas especies de ratas simpátricas (t = 0,10, P = 0,90, g.l. = 30). La diversidad relativa con la longitud estándar no tuvieron relación (r s =-0,09, P = 0,61); además no existieron diferencias significativas entre ambos sexos (machos, promedio ± desviación estándar 0,371 ± 0,43; hembras, 0,207 ± 0,41)(t = 0,97, p = 0,34) y entre ambas especies de roedores (machos, 0,331 ± 0,42; hembras, 0,312 ± 0,41)(t = 0,10, p = 0,91). El índice de diversidad de Simpson no mostró correlación con longitud estándar (r s = -0,04, P = 0,80), pero si con la H´ (r s = 0,97, P< 0,001) y con J (r s = 0,97, P < 0,001).
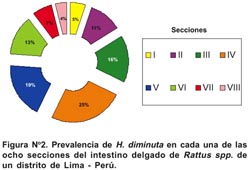
La Figura N° 2 nos muestra que existe asociación de H. diminuta a las secciones III al V del intestino delgado de Rattus spp. (60 %) (G = 32,47, P< 0,05, g.l.= 7). Como promedio, 29,3 % de las secciones en el intestino delgado de estos roedores han sido ocupados por H. diminuta.
DISCUSIÓN
Stock18, describe dos tipos de comunidades parasitarias: las interactivas (con especies centrales y evidencias de relaciones interespecíficas) y las aisladas (con ausencia de especies centrales y de relaciones interespecíficas). Sin embargo, no se dividen en forma dicotómica discreta, sino en una forma continua, formándose así, comunidades con características intermedias entre el tipo interactivo y la aislada. En nuestro caso, las comunidades enteroparasitarias de las ratas de este distrito de Lima, presentaron una sola especie central y otra secundaria y ninguna de las dos especies se encontraron asociadas, mostrando una proximidad a las comunidades aisladas24,28.
Sin embargo, los resultados del análisis de las comunidades de helmintos intestinales para ratas de otras latitudes, muestran en general, características de comunidades intermedias entre interactivas y aisladas, debido al alto número de especies secundarias3,7,8,9,29,30.
En nuestro estudio, se encontró 93,75% de los huéspedes parasitados con valores más altos con lo reportado por Seong6, que mostró una prevalencia combinada cercana a 70 % para R. norvegicus y por Mafiana 3 de 64,7 % para R. rattus. Esto se explicaría, debido a que las comunidades parasitarias de los huéspedes sujetos a la influencia de frecuentes alteraciones ambientales pueden sufrir variaciones en su riqueza y estructura comunitaria a través del tiempo31,32. En Perú, Valle33 indica que R. norvegicus se comporta como un generalista herbívoro, insectívoro-granívoro.
La riqueza parasitaria en nuestro estudio fue de 4, pero en otros estudios a escala mundial se han encontrado de 6 a 10 diferentes especies de helmintos enteroparásitos. En nuestro estudio, los nemátodos (tres especies) estuvieron mejor representados que los céstodos (una especie) (Tabla Nº 1); sin embargo, otros reportes a nivel mundial, indican que los céstodos fueron el grupo de mayor riqueza parasitaria10,28,29.
La talla de los animales no influyó en la abundancia media, intensidad media y en la prevalencia de infección en ninguna de las dos especies de helmintos parásitos (Figura N° 2). Mafiana3 mostró que la talla de R. rattus influyó en la prevalencia de infección de H. diminuta.
Ibáñez14, citó la presencia de P. chanchanensis en R. norvegicus para la ciudad de Trujillo. El presente, es el primer registro para la ciudad de Lima y para R. rattus.
La influencia del sexo de los huéspedes es un aspecto muy citado en la literatura y minimizado en los trabajos sobre análisis comunitario de endoparásitos en vertebrados23,34. El que no existan diferencias cuantitativas en relación al sexo del huésped es considerado un reflejo de ausencia de diferencias en la biología y la dinámica poblacional entre huéspedes machos y hembras. Nuestro trabajo, no armoniza con lo encontrado por Nama29 y Namue8 para la ausencia de relación entre la intensidad media y el sexo, pues el nemátodo P. chanchanensis, presentó mayor abundancia media en machos que en hembras. Mafiana3 señala para R. rattus que existen diferencias significativas entre la prevalencia de infección de H. diminuta con relación al sexo del hospedero (Machos 76,6 % y hembras 54,5 %) y no para otros helmintos. Iannacone19 encontró que los céstodos Dipylidium caninum (Linnaeus) y Taenia pisiformis (Bloch 1780) preferían las secciones finales y no tenían ninguna preferencia en el intestino delgado, respectivamente. En el presente estudio el céstodo H. diminuta prefirió las secciones intermedias del intestino delgado de Rattus spp. (Figura N° 2).
AGRADECIMIENTOS
A los señores estudiantes de la Escuela Profesional de Biología de la Universidad Nacional Federico Villarreal (UNFV, Lima, Perú): Christian Paredes, Yohvana Quiroz, Merly Sovero, Victoria Espejo y Jorge Caycho por su colaboración en las colectas de los hospederos examinados. A la Blga. Elizabeth Morales, Universidad Nacional Mayor de San Marcos (UNMSM, Lima, Perú), al Dr. Mario George-Nascimento F. de la Universidad Católica de la Santísima Concepción (UCSC), Chile, y a tres revisores anónimos por las valiosas sugerencias al presente manuscrito.
REFERENCIAS
1. Marsh RE. Vertebrate pest management. In: Advances in urban pest management. New York. Bennett G W & Owens JM eds. Van Nostrand Reinhold Company. 1986. p. 253-85. [ Links ]
2. Frutos GG. Biología y control de plagas urbanas. Madrid. Editorial McGraw-Hill- Interamericana de España: 1994. p. 355. [ Links ]
3. Mafiana CF, Osho MB, Sam-Wobo S. Gastrointestinal helminth parasites of the black rat (Rattus rattus) in Abeokuta, southwest Nigeria. J Helminthol 1997; 71: 217-20. [ Links ]
4. Fahmy MA, Rifaat MA, Arafa MS. Helminthic infection of the brown rat. Rattus norvegicus (Berkenhout, 1769) in U.A.R. J Egypt Public Health Ass 1969; 44: 147-53. [ Links ]
5. Rifaat MA, Mahdi AH, Arafa MS. Helminthic infection of the climbing rat Rattus rattus (Linneaus, 1758) in U.A.R. J Egypt Public Health Ass 1969; 44: 119-25. [ Links ]
6. Seong JK, Huh S, Lee JS, Oh YS. Helminths in Rattus norvegicus captured in Chunchon, Korea. Korean J Parasitol 1995; 33: 235-7. [ Links ]
7. Feliu C, Renaud F, Catzeflis F, Hugot JP, Durand P, Morand S. A comparative analysis of parasite species richness of Iberian rodents. Parasitol 1997; 115: 453-66. [ Links ]
8. Namue C, Wongsawad C. A survey of helminth infection in rats (Rattus spp.) from Chiang Mai Moat. Southeast Asian J Trop Med Pub Health 1997; 28: 179-83. [ Links ]
9. Warner LR. Australian helminthes in Australian rodents: an issue of biodiversity. Int J Parasitol 1998; 28: 839-46. [ Links ]
10. Vicente JJ, Rodríguez HO, Gómes DC, Pinto RM. Nematóides do Brasil. Parte V: Nematóides de mamíferos. Rev Bras Zool 1997; 14: 1-452. [ Links ]
11. Hasegawa H, Kobayashi J, Otsuru M. Helminth para-sites collected from Rattus rattus on Lanyu, Taiwan. J Helminthol Soc Wash 1994; 61: 95-103. [ Links ]
12. Hasegawa H, Syafrudin S. Nematode fauna of two sympatric rats Rattus rattus and R. exulans, in Kao District, Halmahera Island, Indonesia. J Helminthol Soc Wash 1995; 62: 27-31. [ Links ]
13. Pacheco V, Macedo H, Vivar E, Ascorra C, Arana R, Solari S. Lista Anotada de los mamíferos peruanos. Conserv Int Occ Paper 1995; 2: 1-35. [ Links ]
14. Ibañez N. Nuevo nematodo parásito de las ratas de Trujillo, Perú. Protospirura chanchanensis sp. n. (Nematoda, Spiruridae). Bol Chil Parasitol 1966; 21: 34-37. [ Links ]
15. Cabrera R, Mendoza L. Helmintos parásitos de Rattus norvegicus (Rodentia: Muridae) de la provincia de Ica. Bol Peru Parasitol 1997; 12: 82. [ Links ]
16. Sarmiento L, Tantaleán M, Huiza A. Nemátodos parásitos del hombre y de los animales en el Perú. Rev Perú Parasitol 1999; 14: 9-65. [ Links ]
17. Bush AO, Holmes JC. Intestinal helminths of lesser scaup ducks: an interactive community. Can Jour Zool 1986; 64: 142-52. [ Links ]
18. Stock TM, Holmes JC. Functional relationships and microhabitat distributions of enteric helminths of grebes (Podici-pedidae):the evidence for interactive communities. J Parasitol 1988; 74: 214-27. [ Links ]
19. Iannacone OJ, Cordova KM, Wong RV. Community structure in stray dogs from San Juan de Lurigancho, Lima-Perú. Rev Bras Zool 2001; 18: 277-88. [ Links ]
20. Esch GW, Shostak AW, Marcogliese DJ, Goater TM. Pattern and processes in helminth parasite communities. In: Parasite communities: patterns and processes. New York, G Esch, Bush AO & Aho J. eds. Chapman & Hall; 1990. p. 1-19. [ Links ]
21. Bush AO, Lafferty KD, Lotz JM, Shostak AW. Parasitology meets ecology on its own terms: J Parasitol 1997; 83: 575- 583. [ Links ]
22. Zar JH. Biostatistical analysis. 3 th ed. New Jersey: Prentice-Hall Inc; 1996.p. 662. [ Links ]
23. Poulin R. Phylogeny, ecology, and richness of parasite communities in vertebrates. Ecol Monographs 1995; 65: 283-302. [ Links ]
24. Luque JL, Chavez ND. Ecología da comunidade de metazoarios parasitos da anchova Pomatomus saltator (Linnaeus) (Osteichthyes, Pomatomidae) do litoral do estado do Río de Janeiro, Brasil. Rev Bras Zool 1999, 16: 711-23. [ Links ]
25. Franco LJ, De la Cruz G, Rocha A, Navarrete N, Flores G, Kato E, et al. Manual de ecología. 2 da ed. México: Ed. México D.F. Trillas. 1995. p. 266. [ Links ]
26. Daniel WW. Bioestadística: Base para el análisis de las ciencias de la salud. 3ra. ed. México D.F: Limusa; 1993. p. 667 . [ Links ]
27. Bush AO, Aho JM, Kennedy CR. Ecological versus phylogenetic determinants of helminth parasite community richness. Evol Ecol 1990; 4: 1-20. [ Links ]
28. Cezar AD, Luque JL. Metazoan parasites of the Atlantic spadefish Chaetodipterus faber (Teleostei: Ephippidae) from Coastal zone of the state of Rio de Janeiro. J Helminthol Soc Wash 1999; 66: 14-20. [ Links ]
29. Nama HS, Parihar A. Quantitative and qualitative analysis of helminth fauna in Rattus rattus rufescens. J Helminthol 1976; 50: 99-102. [ Links ]
30. Wilson K, Eady P, Del Nevo AJ. Origin of an insular population of the wood mouse based on parasitological evidence. J Wild Dis 1998; 34:150-54. [ Links ]
31. Cislo PR, Caira JN. The parasite assemblage in the spiral intestine of the shark Mustelus canis. J Parasitol 1993; 79: 886-99. [ Links ]
32. Brasil-Sato MC, Pavanelli GC. Ecological and reproductive aspects of Neoechinorhynchus pimelodi Brasil-Sato & Pa-vanelli (Eoacanthocephala, Neoechinorhynchidae) of Pimelodus maculatus Lacépede (Siluroidei, Pimelodidae) of Sáo Francisco River, Brazil. Rev Bras Zool 1999; 16: 73-82. [ Links ]
33. Valle BDF, Williams MC, Cossios DM, Tamashiro RK, Medina FC. Segregación especial de poblaciones de roedores en la localidad de Tambo, provincia de Canta, Lima-Perú. Ecología (Perú) 1998; 1: 84-91. [ Links ]
34. Janovy J, Clopton RE, Percival TJ. The roles of ecological and evolutionary influences in providing structure to parasite species assemblages. J Parasitol 1992; 78: 630-40. [ Links ]
Correspondencia: José Alberto Iannacone Oliver.
Universidad Nacional Federico Villarreal.
Dirección: Calle San Marcos 383, Pueblo Libre, Lima 21 - Perú.
Telefax: (51-1) 460-0930.
E-mail: joseiannacone@hotmail.com