Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.19 no.3 Lima July/sep 2002
TRABAJOS ORIGINALES
Validación de la metodología para la determinación de ácido domoico (biotoxina ASP) en moluscos bivalvos por cromatografía líquida de alto rendimiento (HPLC)
Ruth Pérez Calderón 1
1 División de Química, Centro Nacional de Alimentación y Nutrición, Instituto Nacional de Salud. Lima – Perú.
RESUMEN
El ácido domoico es una neurotoxina, competidora del glutamato, que se halla en los mares y océanos del mundo. Objetivo: Validar la metodología para determinar ácido domoico (biotoxina ASP) por cromatografía líquida de alto rendimiento (HPLC ). Materiales y métodos: Se analizó una muestra de 1 000 g de moluscos bivalvos (conchas de abanico) extraídos de la zona sur del Perú. Para la precisión del sistema se evaluó: tiempo de retención, área y altura; la exactitud del método se estimó en función de recuperación, analizándose el material de referencia (MUS 1B) y mediante la contaminación de moluscos con solución de ácido domoico. La sensibilidad del método se evaluó por la determinación del límite de cuantificación (LOQ). Resultados: En la detección lineal se obtuvo un coeficiente de correlación r=0,99 y la precisión del método tuvo un coeficiente
de correlación de 3,61%. Los porcentajes de recuperación fueron 92,52% y 91,10%, respectivamente, obtuviéndose un límite de cuantificación (LOQ) de 1,30 mg/g AD. Conclusión: Nuestra validación demostró que el método en estudio es preciso, exacto, lineal y altamente sensible para ser utilizado en el control de calidad de moluscos bivalvos.
Palabras claves: Neurotoxina; Moluscos; Cromatografía líquida (fuente: BIREME).
ABSTRACT
Objective: To validate the methology for the analysis of Domoic Acid (ASP biotoxin) by High performance liquid chroma Objective: To validate the methodology to determine Domoic Acid (ASP biotoxin) by High Performance Liquid Chromatography (HPLC). Material and methods: 1000 g of bivalved mollusks extracted from the south of Peru were analized. Three parameters for a precise system were evaluated: retention time, area and height. Accuracy of the method was determined as a function from recovery, analyzing reference material (MUS 1B) and using mollusks samples with known quantities of standard solution of domoic acid added. Sensibility of the method was evaluated by the determination of quantitive limit (LOQ). Results: The correlation coefficient for the linear analysis was 0,99 and the coefficient of variation (RSD) obtained was 3,61% for the precision of the method. Recovery rates 8% REC) were 92,52% and 91,10% and the quantification limit (LOQ) was 1,3 mg/g AD. Conclusions: The results obtained from the method developed in this study indicate that this method is precise, accurate, selective and highly sensitive and sholud be used in quality control of mollusks samples.
Key words: Neurotoxins; Mollusca; Liquid cromatography (source: BIREME).
INTRODUCCIÓN
En los últimos años se ha notado una disminución de aguas libres de riesgo de envenenamiento, probablemente debido a los cambios ambientales locales o globales, la contaminación del agua por nutrientes usados en la agricultura, por desechos industriales o urbanos, el transporte de especies nocivas y sus formas quísticas en el agua de lastre de barcos de carga y el aumento de la temperatura del mar debido al calentamiento global de la atmósfera 1 . Debido a ello, posiblemente cada vez con mayor frecuencia e involucrando a un número creciente de áreas costeras del planeta, se producen floraciones de algas nocivas. Las algas predominantes en el fitoplancton son las diatomeas, flagelados y dinoflagelados, que se distinguen por su forma de vida y estrategia de reproducción. Entre ellas, las diatomeas del género Pseudonitzschia generan una sustancia tóxica llamada ácido domoico, compuesto que causó durante 1987 en Canadá una serie de intoxicaciones en humano, asociadas a pérdidas de la memoria2.
El ácido domoico pertenece al grupo de aminoácidos llamados kanoicos, los cuales están clasificados como neuroexcitantes que interfieren con los mecanismos de neurotransmisión en el cerebro, de allí su nombre de veneno amnésico de los mariscos o biotoxina ASP (Amnesic Shellfish Poisoning). Este ácido se aisló originalmente de una macroalga llamada Chondria armata por investigadores japoneses 3 . Para multiplicarse requieren luz presente sólo en la capa superficial, nutrientes (nitratos, fosfatos, silicatos, etc.), oligoelementos (hierro, cobre, manganeso, zinc, etc.) y algunas sustancias orgánicas (vitaminas, ácidos húmicos, etc.). En el mar, estos nutrientes circulan desde las profundidades marinas a la superficie, siendo más fértiles las áreas marinas donde el agua profunda es forzada a elevarse, produciéndose una mezcla vertical o surgencia. Si bien los florecimientos de algas ocurren en muchas zonas del planeta, son más frecuentes en los mares templados, donde los cambios estacionales son intensos 1 .
El ácido domoico se une con alta afinidad a receptores de glutamato ubicados en el sistema nervioso central, los que están presentes en alta proporción en neuronas del hipocampo, en centros responsables del procesamiento de la memoria. El ácido domoico activa estos receptores, abriendo un canal iónico que deja pasar al interior de la neurona altas concentraciones del ión calcio, ocasionando la destrucción de estas células y la pérdida de la memoria de corta duración en los sujetos intoxicados; esta neurodegeneración puede ser irreversible, provocando que los pacientes más graves queden discapacitados de por vida 4.
Debido a la aparición de brotes de intoxicación por el consumo de mariscos en varias partes del mundo y no teniendo una información certera de que estos brotes se hayan presentado en el Perú o que se hayan evaluado sistemáticamente, es importante tener en cuenta su ocurrencia como problema de salud pública.
La actividad pesquera es una de las tareas económicas de mayor envergadura en el Perú, principalmente la industria de harina y aceite de pescado, le siguen en menor volumen la conservera y el congelamiento de especies hidrobiológicas. Estas actividades están orientadas en su mayoría a la exportación. Siendo una actividad en auge, es necesario brindar una cobertura sanitaria que garantice a inocuidad de sus productos, para no sufrir restricciones comerciales futuras y poner en riesgo al consumidor, que cada vez es más exigente en aspectos de salud ambiente. Es por todo ello que se requiere de la implementación de equipos y técnicas de laboratorio confiables, precisas y sensibles para la evaluación de biotoxinas como el ácido domoico.
Existen varios métodos para medir el ácido domoico: bioensayos (inyección intraperitoneal en ratones) y métodos químicos por cromatografía líquida de alta performance o HPLC (extracción clorhídrica y metanólica)5, siendo el más aceptado la extracción metalónica por HPLC 3 . En nuestro país, comúnmente se desarrolla el método de bioensayo en ratones, que tiene un límite de detección de 40 ppm, sin embargo, dada las exigencias internacionales de contar con un método más sensible para la medición de ácido domoico 6 , se realizó el presente trabajo, cuyo objetivo fue validar el método CENAN-DQ.ME.18: Método para la determinación de ácido domoico (Toxina ASP) en moluscos bivalvos (conchas de abanico, navajas, machas, choros, palabritas, almejas, etc.) por cromatografía líquida de alto rendimiento (HPLC) (límite de detección = 1,3 µg/g).
MATERIALES Y MÉTODOS
EQUIPOS
Se utilizó un equipo de cromatografía líquida de alto rendimiento (HPLC), marca Shimadzu, modelo LC-10A con inyector automático, bomba con sistema de degasificación, horno para la termostatización de la columna, sistema de registro y procesado de datos cromatográficos y detector UV de arreglo de diodos (longitud de onda variable). Además, se contó con una columna cromatográfica de acero inoxidable C-18 para fase reversa, marca SUPELCO de 15 cm x 4,6 mm de diámetro interno y 5 mm de diámetro de partícula. Las condiciones típicas de operación fueron: sistema isocrático, flujo 1,25 mL/min, volumen de inyección 10 mL, detección UV 242 nm, temperatura del horno 40° C y tiempo de corrida 15 minutos.
REACTIVOS
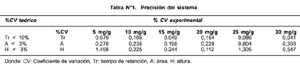
Se emplearon los siguientes reactivos: metanol grado HPLC (Merck), acetonitrilo grado HPLC (Merck), agua tridestilada o grado HPLC, ácido trifluoracético grado es-pectrofotométrico (Merck) y solución certificada de ácido domoico DACS 1(Instituto de Biociencias Marinas de Canadá). Además, se prepararon diluciones de la solución certificada del estándar entre los rangos 5-30 mg/ mL para la curva de calibración; y la fase móvil consistió de una solución de acetonitrilo: agua: ácido trifluoracético (10: 89,9: 0,1;v/v).
PROCEDIMIENTO
Preparación de la muestra
Se tomó aproximadamente 1000 gramos de moluscos bivalvos (concha de abanico) extraídos de la zona sur del Perú. El material de referencia (MUS- 1B) se importó del Instituto de Biociencias Marinas de Canadá en abril de 2001. Luego de limpiar con agua dulce el interior y exterior de los bivalvos para eliminar la arena y otras sustancias extrañas, se separó la carne de la concha, seccionando los músculos aductores y el tejido adherido a la charnela, se recogió aproximadamente entre 100-150 g de vianda en un recipiente de vidrio. Seguidamente, se acondicionó la vianda para permitir su drenado durante 5 minutos, se desechó el drenado, y se homogeneizó la muestra mediante una licuadora de cuchillas inoxidables hasta obtener una masa homogénea.
En la preparación de moluscos en conserva, se trituró la vianda mezclándola con el líquido de cobertura, posteriormente se homogeneizó en forma semejante a la descrita anteriormente. En el caso de conservas con envases de gran capacidad, se separó la carne dejándola drenar durante unos minutos, recolectando todo el líquido de gobierno. Se determinó el peso de la carne y el volumen del líquido, a fin de poder recombinar posteriormente porciones de cada fracción en cantidades proporcionales. Se trituró una porción de la vianda, se recombinó con una cantidad proporcional del líquido de gobierno y se homogeneizó como fue descrito anteriormente.
Proceso de extracción
Se pesó 4 g de muestra preparada directamente en un tubo de centrífuga al que se adicionó 16 mL de metanol 50%; esta muestra se homogeneizó durante 3 minutos en el vortex y después se centrifugó a 5000 rpm durante 15 minutos. Se filtraron 1-5 mL del sobrenadante a través de filtros de membrana de 0,45 mm y se inyectaron soluciones patrón de ácido domoico dentro del rango de 5-30 mg/µL. La identificación del ácido domoico se realizó por comparación con el tiempo de retención del patrón, la confirmación se efectuó mediante la adición del patrón a los extractos de las muestras analizadas, observándose un aumento del área del pico y la ausencia de aparición del desdoblamiento de éste. Se consideró positivo cuando el valor obtenido fue superior a 20 µg AD/g. Para el cálculo de la concentración de ácido domoico se empleó la siguiente fórmula:
Concentración de ácido domoico
Donde: Am (área del pico de ácido domoico en la muestra), As (área del pico del ácido domoico en el estándar), Cs (concentración de ácido domoico en el estándar, mg/L), D (factor de dilución, 20 mL) y Wm (peso de la muestra, g)
DISEÑO EXPERIMENTAL
Se analizaron materiales de referencia MUS 1B de procedencia canadiense, realizándose los ensayos en las muestras previamente homogeneizadas en días diferentes, para cuantificar el ácido domoico expresado en mg/g. Se realizaron 16 ensayos bajo condiciones de repetibilidad. La precisión del método analítico se estudió, sobre el sistema: evaluando la dispersión de 3 inyecciones por cada uno de los 6 niveles de concentración de la solución estándar de ácido domoico; y sobre el método: evaluando la dispersión de la preparación de la muestra (material de referencia MUS 1B), correspondiendo la evaluación a todo el procedimiento, desde la preparación de la muestra hasta la medición del analito, por parte del instrumento.
La exactitud del método se evaluó en función de recuperación. Para tal efecto, se trabajó con 3 niveles de concentración diferentes, adicionados a la muestra. Las concentraciones de trabajo adicionadas fueron las siguientes: nivel 1 = 2,41 mg/g, nivel 2 = 8,99 mg/g y nivel 3 = 19,11 mg/g. Se dejó en contacto la solución estándar con las muestras durante unas horas bajo refrigeración, se realizó el tratamiento y se hicieron las lecturas de los resultados de las 9 muestras. También se evaluó la exactitud en base a la cantidad recuperada del analito en el material de referencia MUS 1B (16 ensayos).
La especificidad del método se representó mediante los espectros de los estándares y el reporte de su correspondiente pureza en las muestras. Para evaluar la especificidad del sistema se trabajó con la solución estándar, mediante el software del equipo. Finalmente, se determinó la sensibilidad del sistema definiendo el límite de cuantificación (se evaluó sobre las muestras empleadas). Todos estos parámetros se determinaron por el software del equipo.
RESULTADOS
En la Figura N°1 se muestran los cromatogramas representativos de dos concentraciones de ácido domoico para la curva de calibración. El tiempo de retención del ácido domoico fue 12 min ± 0,5, en tanto que el tiempo total de análisis para una muestra fue 13 minutos.
La respuesta de detección fue lineal en el rango de concentraciones de 5-30 ppm (Figura N°2), obteniéndose un coeficiente de correlación r=0,99. EL límite de detección del método basándose en la relación señal/ruido(S/N) fue 1,3 mg/g, y el perfil de precisión, basado en 16 determinaciones, tuvo un coeficiente de variación (CV) de 3,614%.
La prueba de homogeneidad del peso del material de referencia fue 8,06 g (w teórico = 8,1 g), con un CV de 0,61%.
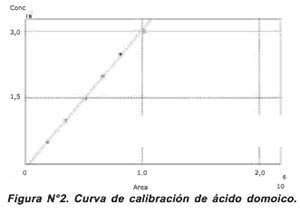
Los resultados de la precisión del sistema, basados en la variación del tiempo de retención, área y altura, se muestran en la Tabla N°1. La recuperación obtenida en el mate-rial de referencia (MUS-1B) fue 92,518% y en la muestra contaminada con los diferentes niveles de ácido domoico se obtuvo un valor promedio de 91,10% de recuperación.
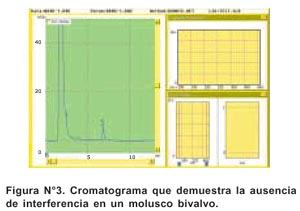
La especificidad del método se muestra en la Figura N°3, donde se observa la ausencia de interferencias debido a la adecuada extracción del analito de las muestras. En ella se demuestra la ausencia de ácido domoico y, por ende, ausencia de compuestos interferentes.
DISCUSIÓN
Varias técnicas han sido propuestas para la medición del ácido domoico en moluscos bivalvos. Cada una de ellas tiene sus ventajas y limitaciones; pero, comparado con otros métodos, la metodología propuesta tiene la ventaja de que la extracción del analito se efectúa en menos pasos en comparación con la técnica AOAC 991.26 (1991)4. Además, el ácido domoico no se descompone en este medio (metanol:agua) vs. el método con extracción clorhídrica, dado que la toxina ASP es inestable en soluciones ácidas de pH < 3 y es sensible a la luz y oxígeno, produciéndose sustancias interferentes que corresponden a sus isómeros, que para mantenerlas estable durante el análisis, requieren de otras etapas adicionales que expondrían la muestra a los factores mencionados 5 . Ambas características contribuyen al bajo costo del análisis debido al menor consumo de material de trabajo.
Comparando los resultados obtenidos con otros de la literatura, el límite de detección del método basándose en la relación señal/ ruido(S/N) fue 1,3 µg/g vs el obtenido por el Laboratorio de referencia de Vigo-España que fue de 2 mg/g 7 ; en tanto que la prueba de homogeneidad del peso del material de referencia fue en promedio de 8,06 g (w teórico =8,1 g) con un CV de 0,61% vs el obtenido por el Laboratorio de Biociencias Marinas de Canadá (0,7% sobre la base de 25 determinaciones)8 .
Entre las recomendaciones al desarrollar el método hay tener en cuenta que no se deberá utilizar calor anestésico para abrir las conchas, y tener cuidado en no cortar o dañar el cuerpo de los bivalvos en esta etapa. Asimismo, las muestras deberán analizarse tan pronto como sea posible, los extractos y los homogeneizados de vianda pueden ser almacenados congelados o refrigerados, las soluciones estándares se deberán mantener en refrigeración a 4º C y en oscuridad, sin congelarlas, dado que puede producirse su descomposición.
Otro de los aspectos a resaltar es que el analito adicionado a la matriz disuelta en el mismo solvente que es usado para la extracción, debe dejarse en contacto con ésta por muchas horas antes de la extracción para permitir la interacción del analito con la matriz 9.
Habiéndose obtenido una recuperación >90%, como lo indica la literatura 3 , se recomienda realizar la extracción o limpieza en fase sólida antes de la inyección de las muestras en el HPLC. Por otro lado, se recomienda emplear cartuchos de intercambio aniónico (SAX) y lograr una separación más selectiva del compuesto liberándolo de las sustancias interferentes en el caso de que éstas se formen. Si fuera necesario, por encontrarse en su determinación concentraciones de ácido domoico superiores a 25 µg/mL, se deben realizar diluciones con agua.
En conclusión, los resultados obtenidos en el presente estudio, documentan claramente que el método de ensayo CENAN-DQ.ME.18: método para la determinación de ácido domoico (Toxina ASP) en moluscos bivalvos por HPLC, es preciso, exacto y sensible para los parámetros evaluados en este estudio, siendo fácil de desarrollar, con una buena recuperación de ácido domoico, demostrándose además la ausencia de interferencias.
REFERENCIAS
1. Organismos acuáticos peligrosos. (Fecha de acceso 30 de noviembre de 2001).; Pág 6. URL disponible en: http://www.Organismos acuáticos peligrosos.htm [ Links ]
2. Marea Roja. (En línea). (Fecha de acceso 30 de noviembre de 2001); Pág 1. URL disponible en: http://www.marea roja.htm. [ Links ]
3. Comisión Oceanográfica Intergubenamental (IOC). Methods for Domoic Acid, the Amnesic Shellfish Poisons. París: UNESCO; 1995. Manuals and Guides Nº 33. [ Links ]
4. Suárez B. Brote de veneno amnésico detectado por laboratorio de toxinas marinas. (Fecha de acceso 30 de noviembre de 2001). URL disponible en: http://www. Brote de veneno amnésico fue detectado por laboratorio de toxinas marinas.htm [ Links ]
5. Association of Oficcial Analytical Chemists (AOAC). Domoic acid in mussels, liquid chromatographic method, first action; USA: Official Analytical Chemists; 1991. Section 991.26. [ Links ]
6. Comunidad Económica Europea (CEE). Directiva 91/492/ CEE. Madrid: Diario Oficial de las Comunidades Europeas; 2001. [ Links ]
7. Qilliam MA, Xie M, Hardstaff WR. Rapid extraction and cleanup for liquid chromatography determination of domoic acid in ussalted seafood. J AOAC 1995 ; 78: 543-54. [ Links ]
8. Instituto de Biociencias Marinas del National Research Council of Canada (NRC-CNRC). Manual de Material de Referencia de Acido Domoico (MUS-1B). Toronto: NRC-CNRC; 2000. [ Links ]
9. Prichard E. Quality in the Analytical Chemistry Laboratory. London: Jhon Wiley & Sons; 1998. [ Links ]
Correspondencia: Ruth Pérez Calderón. Centro Nacional de Alimentación
y Nutrición. Instituto Nacional de Salud.
Dirección: Tizón y Bueno 276, Lima 11, Perú.
Telf: (51-1) 463-9588 – Fax: (51-1) 463-9617.
E-mail: r_whittembury@yahoo.es