Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.19 no.3 Lima July/sep 2002
TEMA DE REVISIÓN
Hepatitis virales B y delta: epidemiología y prevención en el Perú
César Cabezas Sánchez 1,2
1 Instituto Nacional de Salud. Lima - Perú.
2 Instituto de Medicina Tropical Daniel A. Carrión, Universidad Nacional Mayor de San Marcos, Lima - Perú.
RESUMEN
Se describe la epidemiología de las hepatitis virales B (HVB) y Delta (HVD) en el Perú, destacando su disímil prevalencia según áreas geográficas que, sin embargo, tienden a ser cada vez más similares debido a la intensa migración interna. Igualmente, se mencionan mecanismos de transmisión diferentes a los clásicamente reportados en la literatura, así como las consecuencias de la infección crónica, traducidas en cirrosis hepática y hepatocarcinoma. Finalmente, se describen las intervenciones para la prevención de la HVB mediante programas piloto de inmunización integradas al programa ampliado de inmunizaciones (PAI), los cuales han mostrado su impacto en la reducción de las tasas de prevalencia en áreas hiperendémica intervenidas, y que han derivado en la incorporación de la vacuna contra HVB en el PAI del Ministerio de Salud del Perú.
Palabras clave: Hepatitis B/epidemiología, transmisión, prevención & control; Hepatitis D/epidemiología, transmisión, prevención & control; Perú (fuente: BIREME).
SUMMARY
Viral hepatitis B and Delta epidemiology in Peru is described, highlighting its dissimilar prevalence according to geographical areas that however due to the intense internal migration tend to be more similar every time. Moreover different transmission mechanisms from classically reported in the literature are mentioned, as well as the consequences of chronic infection; hepatic cirrhosis and hepatocarcinoma. Finally, the interventions for the prevention of the HBV by means of pilot programs of immunization integrated to the enlarged program of immunizations (EPI) are described. Their impact in the reduction of the prevalence rates in hyperendemic areas intervened, are showed, that derived in the incorporation of the vaccine against HBV in the EPI of the Ministry of Health of the Peru.
Key words: Hepatitis B/epidemiology, transmission, prevention & control; Hepatitis D/epidemilogy, transmission, prevention &control; Peru ( source: BIREME).
EPIDEMIOLOGÍA
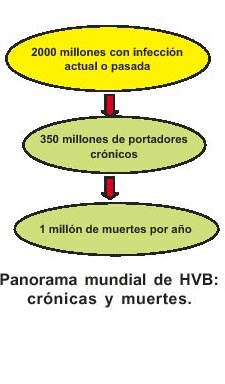
La hepatitis viral B (HVB) es una de las causas importantes de morbi- mortalidad, tanto por su presentación en las formas agudas como por sus secuelas crónicas. Expertos de la Organización Mundial de la Salud (OMS) consideran que más de dos mil millones de habitantes La hepatitis viral es una de las principales causas de enfermedad aguda y crónica con mayor mortalidad en el mundo 1,2 . Se han identificado a cinco virus como responsables de hepatitis (A, B, C, D, E), con características epidemiológicas bien definidas en las diversas zonas y poblaciones del mundo 3 , existiendo además evidencias epidemiológicas y virológicas de otros dos virus consignados como F, G y TTV 4,6 . La mayoría de hepatitis virales están asociadas a uno de estos agentes, aunque no se puede destacar otros con menor incidencia que aún no han podido identificarse. en el mundo han sido infectados por el virus de la hepatitis B (VHB), de los cuales 350 millones serán portadores crónicos del antígeno de superficie (HBsAg)2,7,8 (Figura N° 1). De otro lado, tres cuartas partes de la población mundial viven en zonas hiperendémicas y aproximadamente un millón de muertes en un año están relacionadas directamente a infección por el virus de la HVB 9 .
La infección aguda por HVB puede tener manifestaciones subclínicas, hepatitis ictérica o como hepatitis fulminante. La infección crónica por HVB puede manifestarse a manera de portador asintomático, hepatitis crónicas, cirrosis o como carcinoma hepatocelular 10,11 . Por otro lado, hay evidencias de la asociación etiológica entre la infección por HVB crónica y carcinoma hepatocelular 12-16.
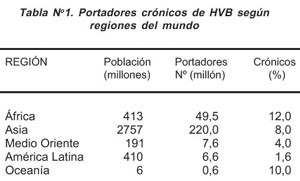
El virus de hepatitis B causa 60% a 80% de casos de cáncer de hígado en el mundo, que es uno de los tres primeros motivos de muerte por esta enfermedad en hombres del este y sudeste de Asia, la cuenca del Amazonas y Africa Subsahariana 17,18 (Tabla Nº 1).
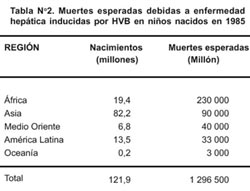
En localidades donde el estado de portador del antígeno de superficie (HBsAg) excede al 10%, la infección por HVB produce hasta 3% de la mortalidad total 18 , aunque en áreas como Huanta y Abancay en el Perú este porcentaje llega al 7%19,20 . 30% de los portadores crónicos del virus que sobreviven hasta los 30 años, están expuestos a morir de complicaciones como hepatitis crónica, cirrosis o cáncer primario de hígado 9,16,21 , como se muestra en la Tabla Nº 2.
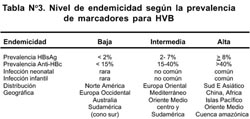
Los niveles de prevalencia y endemicidad de la HVB, pueden determinarse tomando como índice a marcadores serológicos como el antígeno de superficie (HBsAg) y anticuerpos anti HBsAg o anti-HBcAg. De acuerdo con ello se pueden ubicar las diferentes zonas endémicas (Tabla Nº 3).
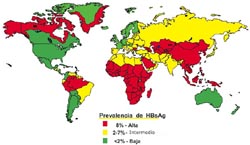
El predominio de infección de HVB varía según las áreas geográficas (Figura N° 2). En las áreas de baja endemicidad como los Estados Unidos, Europa Occidental, Australia y Nueva Zelanda, la prevalencia de portadores del antígeno de superficie de HVB (HBsAg) es aproximadamente 0,1% a 2%. En las áreas de endemicidad intermedia como los países mediterráneos, Japón, India, y Singapur, la prevalencia de portadores de HBsAg es de aproximadamente 3% a 5%. En las áreas de alta endemicidad, como en el sudeste asiático, África subsahariana y la cuenca amazónica, la prevalencia de portadores de HBsAg es de 10% a 20%. El antecedente de infección de HVB pasada se estima en 5% en los Estados Unidos y países de baja prevalencia y cerca de 100% entre los adultos en algunas partes de sudeste de Asia, África y la cuenca amazónica, áreas que son de alta endemicidad. Hay un predominio creciente de infección de HVB en general, con la edad. En los Estados Unidos, el predominio de infección de HVB es más alto entre los afro-americanos, hispanos y asiáticos que en la población blanca; sin embargo, se han informado de varias comunidades con mayores tasas de portadores crónicos de HBsAg que sus regiones vecinas, en los esquimales de Alaska, en las Islas Asiático-Pacífico y los aborígenes australianos 22 .
Las Américas, tienen regiones con diferentes niveles de prevalencia para HVB y hepatitis viral delta (HVD). En Sudamérica el número de portadores de HBsAg se incrementa de sur a norte. Se ha observado elevada prevalencia en la zona central y oeste de la región Amazónica del Brasil y ciertas zonas adyacentes de Colombia y Venezuela. Se estima que 140 000 a 400 000 nuevos casos de HVB pueden estar ocurriendo anualmente en Latinoamérica, dos tercios de ellos en América del Sur, incluyendo 440 a 1 000 casos de hepatitis fulminante. Se estima que anualmente las secuelas de infección por el virus de la HVB ascienden a 2 965 casos de hepatitis crónica, entre 12 782 a 44 737 casos de cirrosis, de 3 271 a 11 449 casos de hepatocarcinoma. Adicionalmente se conoce una elevada prevalencia de HVD en las mismas áreas de elevada prevalencia de HVB, particularmente en la cuenca amazónica, incluyendo algunas otras áreas de Colombia y Venezuela 23 .
El virus de la HVD, está asociado al de la HVB y juega un rol importante en la evolución del compromiso hepático. Se adquiere bajo dos formas, como una coinfección primaria conjuntamente con el de la HBV o como una superinfección en portadores crónicos de HbsAg; ambas formas de asociación pueden estar relacionadas con hepatitis fulminante y las formas crónicas de hepatitis, ade-más de la cirrosis y hepatocarcinoma 24,25 . Se estima que en todo el mundo la proporción de portadores del HBsAg, infectados por el virus Delta, supera 5%26 .
La HVD que tiene una distribución mundial, también tiene dos patrones epidemiológicos, uno asociado a difusión no parenteral del virus, como en el sur de Italia, el área amazónica y algunas partes de África, postulándose en este caso la transmisión de persona a persona, en ausencia de exposición percutánea 27 y el otro patrón asociado a transmisión parenteral como el caso de hemofílicos, politransfundidos y drogadictos endovenosos como ocurre en EEUU y en el oeste de Europa. Cerca del 25% de casos de HVB fulminante, están asociados a coinfección con HVD 26,27 ; además, la infección por HVD agrava la enfermedad hepática crónica en los portadores de HBsAg 28 así, aquellos portadores que tienen además anticuerpos antiDelta, tienen 4 veces más riesgo de enfermedad crónica que aquellos que no presentan dichos anticuerpos 29 .
En general, al Perú se le ha ubicado entre los países de endemicidad intermedia para HVB, tomando como promedio la prevalencia de marcadores determinados en diferentes regiones 30,31 ; sin embargo, es importante destacar que esos mismos estudios y otros posteriores, nos indican que las prevalencias son significativamente diferentes entre las tres regiones geográficas y aún dentro de ellas en los diferentes poblados, así en la selva, la endemicidad está entre media y alta 30,32-34 , con prevalencias que van de 2,5% en población de Iquitos, hasta 20% en población indígena 33,35; en la costa, prevalencias entre 1% y 3,5%.30,36 ; y en la sierra los estudios son coincidentes en cuanto a la prevalencia en esta región, siendo baja en las localidades de la vertiente occidental de los Andes y de media a alta en valles interandinos de la vertiente oriental 30,31 , siendo particularmente alta en los valles interandinos de Huanta y Abancay, ubicados cerca a los 2,400 msnm 20,37,38 .
En el país también se ha evidenciado la presencia de infección por HVD en la región de la selva, especialmente en comunidades nativas y en algunas localidades de la sierra como Abancay y Huanta, donde se ha encontrado una prevalencia de 14% de HVD en escolares aparente-mente sanos; además 17% de los que tuvieron infección por HVB tiene infección por el HVD, y 56,5% de los portadores de HBsAg también presentaron marcador de HVD 35,38.
En un estudio que incluyó 870 pobladores de 37 comunidades indígenas de la amazonía peruana distribuídas en 12 cuencas hidrográficas, encontramos antededente de infección por HBV que varía entre 24% - 83%, portadores de HBsAg entre 2,7% y 18%, e infección por el HVD entre 6,2% y 13% entre aquellos con antecedente de infección por HBD y entre 14% y 53,3% entre los portadores de HBsAg 35 .
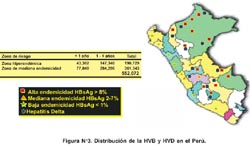
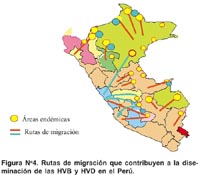
Con la información disponible se ha elaborado un mapa de la distribución de la prevalencia de infección por HVB (Figura Nº 3), el cual está sujeto a cambios, dada la dinámica poblacional, acentuada por la intensa migración de las dos últimas décadas debido a factores sociales, políticos y violencia.
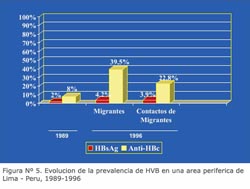
En razón de la información recogida de los estudios seroepidemiológicos en población general aparentemente sana, se puede concluir que entre 8% y 86% de esta población tienen algún marcador de HVB, esta marcada diferencia estaría relacionada al año, a la zona de estudio, al diseño, marcadores y técnicas de laboratorio utilizadas. Estudios recientes muestran cambios en el patrón epidemiológico, así, en el primer estudio seroepidemiológico realizado entre 1965-1972 por Madalengoitia 39 en población urbana y rural de la selva encontró 1,8% de portadores de HBsAg en promedio, con prevalencias máximas de 6,4%; mientras que los estudios realizados en la década del 80, muestran prevalencia de 3% - 4% en poblaciones urbanas de la selva y mayor al 10% en áreas rurales de esta región 30,31 . Adicionalmente la acentuada migración en las últimas dos décadas por problemas económicos y socio-políticos de zonas hiperendémicas a zonas de baja endemicidad, agregó focos de transmisión al mosaico que desde ya constituye la distribución de las HVB y HVD en el país (Figura N° 4). Un ejemplo de ello es que en una población residente en una localidad periurbana de Lima, luego de 7 años de convivencia con migrantes de áreas hipredendémicas, la prevalencia de portadores crónicos de HBsAg ascendió de 2% a 3,5%, indicando un importante cambio que muestra la dis-persión de la infección 37 (Figura Nº 5).
MECANISMOS DE TRANSMISIÓN
TRANSFUSIÓN SANGUÍNEA
En la década del 70, el riesgo de hepatitis (infección por HVB) en transfusión de sangre comercial llegaba a 50%, y el HBsAg fue detectado en el 60% de pacientes con hepatitis postransfusión. La exclusión de donantes pagados y la aplicación de tamizaje de marcadores para HVB, redujo dramáticamente la incidencia de HVB postransfusión, al menos en los países desarrollados 40 . Actualmente, se re-portan anualmente en EE.UU. aproximadamente 80 casos de infección de HVB asociadas a transfusión 41 . En ese país se utiliza para el tamizaje tanto HBsAg como anticuerpos anticore (anti-HBc). El anti-HBc permite detectar la infección por HVB en la fase de ventana durante la recuperación de las hepatitis agudas B o en aquellos casos en los que la infección crónica por HVB es de bajo nivel. El valor práctico de utilizar anti-HBc es dudoso debido a la baja especificidad del test 42,43 , la baja incidencia de infección de HVB asociada a transfusión en áreas de baja prevalencia donde sólo se usa el HBsAg como marcador de tamizaje 44 y la necesidad de excluir mas del 22% de la población de donantes en áreas hiperendémicas 45.
En el Perú, los niveles de prevalencia en donantes de sangre son coincidentes con los niveles de prevalencia en la población general, así en Chiclayo (Lambayeque) encontramos 0,5% de portadores de HBsAg, en Ica 2,2%, Arequipa 0,4%, Huancayo (Junín) 1,8%, Tarapoto (San Martín) 3,8% y Pucallpa (Ucayali) 3,2%46 . En el caso de áreas urbanas de las ciudades de la selva encontramos prevalencias intermedias. Un hallazgo que llama la atención es la del departamento de Ica, que está en transición de endemicidad baja a endemicidad intermedia, probablemente debido a la intensa migración receptora de áreas hiperendémicas del departamento de Ayacucho. También en el Perú, esta forma de transmisión se está limitando, debido a la obligatoriedad de tamisaje para HBsAg y anti-HBc en donantes de sangre, sin embargo, aún constituye un serio problema la disponibilidad de donantes aptos en áreas hiperendémicas de HVB, don-de el 80% a 90% de la población en condiciones de donante, tiene marcadores positivo para anti-HBc.
TRANSMISIÓN PERCUTÁNEA
La inoculación de sangre o fluidos corporales a través de la vía percutánea sigue constituyendo una forma de transmisión importante. El compartir agujas como lo hacen los drogadictos endovenosos, son una ruta importante para la transmisión de HVB, igualmente el reuso de agujas contaminadas para los tatuajes, extracciones y/o curaciones dentales, inyectables, acupuntura e implantación de adornos a través de la piel. Estas rutas son válidas prácticamente en todos los países, aunque estas prácticas son más frecuentes en países en vías de desarrollo como el nuestro, donde la práctica de la medicina no tiene un control adecuado. En poblaciones indígenas de la amazonía peruana, donde la prevalencia de HVB es alta, el tatuaje probablemente constituye uno de los factores que contribuye a la alta transmisión, además de las otras formas como el consumo de masato, mordedura por murciélagos, picadura de mosquitos y la transmisión horizontal 35 .
TRANSMISIÓN SEXUAL
En los países desarrollados, la vía sexual es la más importante forma de transmisión de HVB. La transmisión sexual corresponde a aproximadamente 30% de las infecciones agudas de HVB en los EE.UU.47 . Se observa una elevada prevalencia de portadores crónicos de HBV en homosexuales y heterosexuales con múltiples parejas, de modo que a fines de los 70 se estimó una tasa de incidencia anual de infección por HVB de 20% entre los homosexuales 47.
A fines de los años 80, esta proporción cayó a menos de 10%, probablemente como resultado de la modificación en la conducta sexual de alto riesgo de infección debido al VIH. Desgraciadamente, la incidencia de transmisión heterosexual permanece alta. El riesgo de transmisión sexual de infección de HVB se relaciona directamente al número de compañeros sexuales, el nivel de educación logrado, ocurrencia de sexo pagado e historia anterior de enfermedades sexualmente transmitidas. En el Perú, la información disponible también muestra una elevada prevalencia de HBsAg en trabajadoras sexuales y homosexuales, con tendencia a disminuir en los últimos años, probablemente debido a las medidas de prevención adoptadas por estos grupos contra las infecciones de transmisión sexual (ITS) y el VIH/SIDA. Los niveles de prevalencia de HBsAg en estos grupos de riesgo se pueden observar en la Tabla Nº 4.
TRANSMISIÓN PERINATAL
La proporción de transmisión perinatal HVB de madres infectadas a sus hijos es menor al 10% en los países occidentales. Se estima que 20 000 niños nacen anualmente de mujeres portadoras de HBsAg en EE.UU. 48 . En las áreas hiperendémicas como China, la proporción de infección perinatal puede ser tan alta como 90%, particularmente cuando las mujeres embarazadas son HBeAg positivas o tienen ADN para HVB positivo en el suero. La transmisión de la madre al infante tiene lugar en el momento de la gestación por transfusión en la circulación materno-fetal, por exposición a la sangre materna durante el pasaje a través del canal del parto, posterior al nacimiento a través del contacto íntimo entre la madre y el niño. La transmisión intrauterina es rara porque la detección del HBsAg en los infantes frecuentemente es tardía. Adicionalmente, la inmunización pasiva y activa al momento del nacimiento ha demostrado tener una eficacia mayor al 90% en la prevención de HBV 49 . La cesárea no ha mostrado eliminar el riesgo de adquirir infección perinatal por HBV50. Aunque el HBsAg puede encontrarse en la leche materna, no hay evidencia que la infección de HBV puede transmitirse a través de la lactancia materna51. La vacunación universal de todos los recién nacidos y administración adicional de immunoglobulina hiperinmune contra la HVB (HBIg) a recién nacidos de madres portadoras de HBsAg se comenzó a dar en muchos países del sudeste asiático, como Hong Kong, Taiwán, Singapur y Japón, en los años ochenta. Estos programas han llevado a reducciones significativas en las tasas de portadores de HBsAg, así como en la disminución en la incidencia de carcinoma hepatocelular en niños52. En EE.UU., la vacunación universal de todos los recién nacidos se empezó a partir de 1992, luego de probar otras estrategias que no dieron resultados respecto a las coberturas.
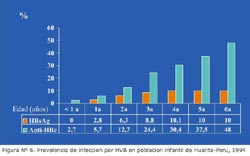
En el Perú, los estudios realizados en población infantil de áreas hiperendémicas como Huanta, muestran una baja prevalencia de HBsAg en menores de 1 año (menor al 0,1%), lo cual indica que la infección no ocurre en el periodo perinatal, sino después, en los primeros años de la vida, cuando el niño empieza la etapa de socialización y además, tiene un mayor tiempo de exposición a portadores crónicos, sea dentro o fuera del hogar 38 (Figura Nº 6). Igualmente la mayor prevalencia de HBeAg en portadores crónicos de HVB en niños, tanto en poblaciones nativas de la amazonía, como en poblaciones mestizas de áreas hiperendémicas, explicaría que la transmisión ocurre principalmente en los primeros años de vida, para ir reduciéndose progresivamente en la edad adulta, esto vinculado a una menor presencia del HBeAg, el cual es un marcador de mayor infecciosidad35.
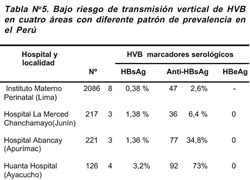
Por otro lado, estudios realizados en gestantes en localidades de las tres regiones geográficas del Perú y al margen de los niveles de endemicidad, han mostrado una baja prevalencia de antígeno HBeAg en mujeres portadoras del HBsAg, lo cual también corrobora el hallazgo de la baja prevalencia en niños (Tabla N° 5), no siendo por lo tanto muy importante la forma de transmisión perinatal53,54. Ello a diferencia de lo que ocurre en países asiáticos, probablemente debido a las variantes genotípicas entre los virus de HBV de nuestra región con los que circulan en Asia.
RIESGOS DE INFECCIÓN EN ÁREAS DE CUIDADO DE PACIENTES
El virus de la hepatitis B es el agente más común responsable de las infecciones virales nosocomiales55.
En un seguimiento de una cohorte en 10 años se encontró que la incidencia de infección por el virus de la hepatitis B era 55 veces mayor que la del virus de inmunodefi-ciencia humana (VIH), y 38 veces mayor que la del virus de la hepatitis C56. El Centers for Disease Control and Prevention (CDC) calculó que de 6 500 a 9 000 nuevas infecciones ocurrieron en trabajadores de salud en 1990 57 . Siguiendo el curso natural de la infección por el HVB, entre 300 a 950 de estos trabajadores (5% a 10%) eventualmente desarrollarían infección crónica, la que llevaría a la muerte por cirrosis entre 100 - 150 personas y por carcinoma hepatocelular fatal entre 25 - 40 sujetos57. Mundialmente, la HVB representa la principal causa de incapacidad prolongada del personal de salud como consecuencia de exposición laboral58.
El común denominador de la exposición ocupacional del personal de salud es el contacto frecuente y sistemático con sangre o líquidos serosos. Un estudio demostró que los grupos de trabajadores que están expuestos a un frecuente contacto con sangre, en vez de un tiempo de exposición prolongado, define a aquellos con mayor riesgo de exposición al HVB, sin diferencias con respecto al contacto con pacientes, con una incidencia de nuevas infecciones del 1% por año en aquellos con contacto frecuente con sangre vs. 0% por año, en aquellos con contacto limitado59. Además, reporta que la exposición al HVB estaba en función a una historia previa de hepatitis, duración de la exposición ocupacional y la edad. Sin embargo, otros autores demuestran que el riesgo de infección por HVB cambia en el tiempo59,60, es mayor durante los primeros años de trabajo61 y varía en los distintos servicios de un hospital61. El sistema de rotación del personal auxiliar por los diferentes servicios, practica acostumbrada en nuestros hospitales, aumenta el número de personas expuestas62.
En el Perú, los estudios también muestran que los trabajadores de salud de áreas con baja endemicidad por HVB tienen un mayor riesgo, particularmente los que manipulan material contaminado con sangre y secreciones, así como aquellos que desarrollan procedimientos invasivos. Sin embargo, en zonas hiperendémicas, ser trabajador no es un riesgo adicional para contraer HVB, pues han adquirido la infección en edades tempranas de la vida, como se mostró en un estudio en Huanta, donde los niveles de infección entre trabajadores de salud de un hospital general y profesores, eran similares63.
TRASPLANTE DE HÍGADO
Actualmente, a los donantes de órganos, se les hace un tamizaje rutinario para HBsAg. Se han reportado casos de infecciones secundarias a trasplantes de órganos extrahepáticos, como riñones, en personas portadoras de HBsAg. Esto puede relacionarse a sangre residual en los vasos sanguíneos que contiene partículas virales en los riñones. También puede ocurrir luego de trasplantes de tejido avascular como córnea 64 .
El rol d el tamizaje de anticuerpos anti-HBc puede tener incovenientes, debido a la posibilidad de resultados falsos-positivos, la pérdida potencial del 5% de donantes 65 y la incertidumbre sobre la infectividad de los órganos donantes en los que se encuentra anti-HBc66. La incidencia de infección de HVB de los donantes con anti-HBc positivo es muy bajo (0% a 2%) en receptores de transplantes de corazón y riñón, pero varía de 0% a 78% en receptores de hígado 65,67,68.
En el Perú, los transplantes aún están limitados a aquellas personas que tienen hepatopatías no relacionadas a hepatitis viral, y en todos los donantes se realiza tamizaje para marcadores serológicos de HVB y hepatitis viral C. Los riesgos de transmisión a través de este procedimiento son similares al de los países desarrollados, aunque si consideramos una mayor prevalencia de infección por HVB en población general, el riesgo puede ser mayor.
TRANSMISIÓN HORIZONTAL
En áreas endémicas, la transmisión horizontal en niños es un mecanismo muy común69, y está en razón del contacto directo de portadores del HVB con susceptibles, a través de solución de continuidad en la piel y las mucosas, pudiendo ser la saliva un vehículo importante, pues se ha encontrado en estas secreciones virus de hepatitis B en concentraciones infectantes. En las áreas estudiadas en el Perú, como en Huanta y en la Amazonía los mecanismos clásicos de transmisión como el de agujas, relaciones sexuales, tatuajes y transfusiones de sangre, no se dan en la medida que podrían explicar las altas tasas de prevalencia35,38 , por lo que consideramos que la transmisión horizontal juega un rol importante en estas poblaciones. Por otro lado, la migración de personas portadoras de HVB hacia áreas no endémicas, con una gran cantidad de susceptibles, condiciona la transmisión a través de este mecanismo horizontal, como se ha mostrado en un estudio donde la tasa de portadores de 2,3% se incrementa a 4,5% en un periodo de 7 años, habiendo mediado sólo la presencia de migrantes portadores del HBsAg en un área de susceptibles 37.
En las áreas endémicas, la transmisión horizontal entre los niños puede ser el resultado de contacto corporal íntimo que lleva a transferir el virus por pequeñas erosiones de la piel y las membranas mucosas.
Se ha informado que varias secreciones del cuerpo pueden contener HBsAg, pero sólo se ha demostrado en forma consistente que el semen, secreción vaginal y saliva de personas infectadas pueden albergar el virus de la hepatitis B 70,71. Aunque el ADN del virus de hepatitis B se ha descubierto en la saliva de algunos portadores, aún hacen falta más evidencias que apoyen la transmisión oral72. Este virus puede permanecer durante mucho tiempo fuera del cuerpo humano, contaminando superficies medioambientales y los artículos de uso cotidiano, como cepillos de dientes, navajas de afeitar e incluso juguetes donde es posible que persistan.
En un estudio realizado en comunidades indígenas de la amazonía, encontramos una asociación importante (OR= 4,98, IC 95%: 3,37 - 7,36) entre estado de portador crónico de HBsAg y el consumo de masato, que es una bebida preparada mediante la premasticación de la yuca, la cual luego es fermentada 35 . Por otro lado, existe la costumbre en estas comunidades, que una madre ofrezca directamente a la boca de los lactantes, alimentos premasticados. Si consideramos la elevada prevalencia de lesiones en la mucosa oral y el estado de portador del virus, este puede constituir un mecanismo adicional a los descritos.
MECANISMOS DE TRANSMISIÓN PROPUESTOS
Se ha demostrado que algunos insectos hematófagos pueden ser vectores, al menos mecánicos, para la transmisión de HVB, sin embargo es necesario contar con mayores evidencias al respecto.
Estudios realizados en poblaciones indígenas y en miembros de la fuerza armada, encontraron asociación epidemiológica entre infección aguda o crónica por HVB y la mordedura de murciélagos hematófagos ( Desmodus rotundus). En indígenas de la amazonía 35 se encontró que aquellos mordidos por murciélagos tenían casi dos veces mas riesgo de infección que aquellas no mordidas (OR=1,69, IC 95% 1,21 -2,35). Mientras que en la población militar 73 el riesgo era 6 veces mayor en aquellos mordidos en comparación a los no mordidos ( OR= 6,03, IC 95%: 2,15 -16,89); igualmente, en poblaciones indígenas de la amazonía se encontró un mayor riesgo de infección por HVB en aquellos mordidos por murciélagos. Actualmente, venimos complementando estos hallazgos con estudios de inmunohistoquímica y biología molecular para evidenciar esta forma de transmisión.
Aún cuando había referencias no comprobadas del rol que juegan los insectos en la transmisión del HBV, no existían evidencias de este mecanismo de transmisión. Últimamente, Blow JA ha descrito que el virus de HVB inoculado en el tórax de mosquitos (Cimex lectularius L) puede sobrevivir y encontrarse en sus heces hasta 21 días postinoculación, planteándose la hipótesis de que el mosquito abre una solución de continuidad en la piel de la persona, deja el virus en las inmediaciones y al rascarse la persona puede introducir el virus conllevando a la infección 74.
GRUPOS DE ALTO RIESGO
El personal involucrado en el cuidado directo de la salud de personas, tiene un mayor riesgo de tener infección por HVB, que la población general. Este riesgo es particularmente alto entre cirujanos, patólogos y médicos que trabajan en las unidades de hemodiálisis y unidades de oncología. Las laceraciones de la piel, los cortes pequeños, y los accidentes con objetos punzocortantes en general, abren la puerta de entrada para el virus. Otro personal que ha incrementado el riesgo de infección, incluye los dentistas y personal del laboratorio que tiene contacto con suero sanguíneo. Las personas con retraso mental que viven en hospicios, así como el personal que los cuida y miembros de la familia también tienen una proporción alta de HVB. A pesar de que los productos hemoderivados son tamizados, los pacientes que reciben múltiples transfusiones, tienen mayor riesgo de infección, como son los hemodializados, hemofílicos y talasémicos. Los pacientes en hemodiálisis, pueden infectarse a través de las transfusiones de sangre y/ o por contaminación de máquinas de diálisis o equipos, así como la transmisión horizontal interpersonal en las unidades de la diálisis. Los cuidados de la infección y la disponibilidad de vacunas han reducido la incidencia de infección de por HVB. Otros grupos de alto riesgo incluyen a los usuarios de droga por vía endovenosa, particularmente aquellos que reusan jeringas, homosexuales activos y los heterosexuales promiscuos. Aunque en el Perú no es frecuente el uso de drogas por vía endovenosa, los consumidores de droga por inhalación suelen ser promiscuos, lo cual también los pone en riesgo de infección.
Se han realizado varios estudios en el Perú, respecto a la prevalencia de infección por HVB en grupos de riesgo, donde en promedio hay mayor riego de infección entre los trabajadores más expuestos a sangre y/o secreciones. Asimismo, se muestra una mayor prevalencia que en población general, en hemodializados, prostitutas y drogadictos de pasta básica de cocaína, en estos últimos en relación con su promiscuidad más que al uso de drogas por vía endovenosa.
En zonas hiperendémicas, donde la infección ocurre en los primeros años de vida, no se encuentra mayor prevalencia en trabajadores de salud que en población general, aunque debe considerarse que los susceptibles a la infección mantienen un mayor riesgo en estas zonas por razo-nes vinculadas a su ocupación, como mostramos en un estudio efectuado en Huanta 63.
HISTORIA NATURAL DE LA HVB
El curso natural de infección por HVB está determinado por la interacción entre la replicación del virus y la respuesta inmune. Otros factores que pueden representar un papel en la progresión de enfermedad hepática debido a HVB, están relacionadas al género, consumo de alcohol e infección concomitante con otros virus de hepatitis. El resultado de infección de HVB crónica depende de la severidad de enfermedad hepática en el momento de la replicación viral.
La edad a la que ocurre la infección es gravitante para el desarrollo de infección crónica. Si la infeción ocurre al nacimiento, la probabilidad de quedar como portador crónico es del 90%; si la infección ocurre entre 1 - 4 años la probabilidad está entre 30% - 50%; y si ocurre en la edad adulta, se reduce a menos del 5%75 . Por otro lado, la infección en niños pequeños cursa asintomática. De modo que sólo 10% de niños menores de 10 años presentan síntomas que clínicamente orientan a una infección por HVB 76.
En general, la infección por HVB crónica pasa por dos fases: una fase replicativa temprana, relacionada con la enfermedad activa del hígado; y una fase no replicativa, más tardía, relacionada con la remisión de la enfermedad hepática 77, 78. Sin embargo, en los pacientes que adquirieron la infección en el periodo perinatal, se cree que hay una fase adicional en la que la replicación del virus no se acompaña de enfermedad hepática activa 79 . Esto es debido a la tolerancia inmune secundaria a la exposición a HVB o a los antígenos HVB relacionados, en etapas tempranas de la vida.
La HVB aguda y la coinfección con el HVD tienden a ser más severas que la infección por HVB aguda sola y más probablemente produce hepatitis fulminante 80,81. La superinfección por HVD en los pacientes con infección crónica por HVB se acompaña por la supresión replicación de HVB 82,83 . La mayoría de los investigadores han encontrado que la superinfección por HVD está asociada con la enfermedad hepática más severa y la progresión acelerada a cirrosis 84,85
INFECCIÓN POR HVB Y HEPATOCARCINOMA
En el ámbito mundial, el hepatocarcinoma es la tercera y séptima causa de muerte por cáncer en hombres y en mujeres respectivamente, reportándose aproximadamente 500 000 muertes cada año 86 . La inmensa mayoría (85%) de casos de hepatocarcinoma se concentra en Asia oriental y del sudeste y Africa Subsahariana 87 , donde la infección por HVB es endémica. Hay varios estudios, que evidencian la asociación de la infección crónica por HVB y hepatocarcinoma.
Existe una relación muy cercana entre la distribución geográfica de portadores de HBsAg y la ocurrencia de hepatocarcinoma, siendo esta última la cuarta malignidad más común en áreas endémicas como China y África subsahariana donde la proporción portadores de HBsAg es 10% a 15%, frente a 150 casos de hepatocarcinoma por 100 000 por año 88 ; en contraste con EE.UU. donde la tasa de portadores de HBsAg es menor al 1%, hay 4 casos de hepato-carcinoma por 100 000 por año y ocupa el puesto 22 como causa de cáncer en general.
El predominio de HBsAg entre los pacientes con hepato-carcinoma varía de 85 % a 95% en Asia y África; y entre 10 a 25% en EE. UU. y Europa occidental 88 . La evidencia más fuerte para una asociación etiológica entre la infección de HVB crónica y el desarrollo de hepatocarcinoma deriva de un estudio en 22 707 hombres taiwaneses que fueron seguidos por un periodo de 8,9 años 89 . La incidencia de hepatocarcinoma fue de 495 por 100 000 por año para HBsAg-positivo y 5 por 100 000 por año para los hombres HBsAg-negativos, con un riesgo relativo de 98. Ninguno de los 1 272 hombres fueron seronegativos para los marcadores de HVB desarrolló hepatocarcinoma.
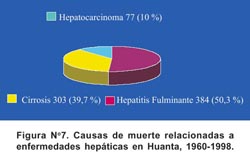
En el Perú es evidente que en las áreas hiperendémicas de HVB también es prevalente la presencia de hepatocarcinoma, como se ha mostrado en los estudios de Abancay y Huanta donde alrededor del 7% del total de fallecimientos corresponden a enfermedades hepáticas relacionadas a infección por HVB como hepatocarcinoma, cirrosis y hepatitis fulminante 19,20 . (Figura N° 7). Otros estudios realizados en el Perú, en pacientes con hepatocarcinoma y cirrosis, utilizando técnicas inmunohistoquímicas y marcadores de infección por HVB en suero, han mostrado también asociación importante 90-95.
PREVENCIÓN DE LA HVB EN EL PERÚ
Desde 1991, se iniciaron estudios piloto para la incorporación de la vacuna contra HVB en el programa ampliado de inmunizaciones (PAI), es así que en Abancay96, ubicada a 2 395 msnm en la sierra del Perú, y considerada zona hiperendémica para HVB y HVD, donde 7% de las defunciones son relacionadas a infección por HVB. Se programó para la vacunación a 1 301 niños menores de un año y 3 488 niños entre 1- 4 años. Se utilizaron 3 dosis de vacuna recombinante de DNA contraHVB para cada niño. El esquema de vacunación fue adecuado al calendario de vacunación del PAI. En los meno-res de un año el esquema fue: Recién Nacidos: BCG, Polio 1, HVB1; segundo mes: Polio2, DPT1, HVB2; tercer mes: DPT2 y Polio3; cuarto mes: DPT3, Polio4 y HVB3; y al noveno mes: sarampión. En el grupo de 1 a 4 años el esquema fue: HVB1al ser captado, HVB2 al mes de HVB1; y HVB3 al sexto mes de HVB1. Al año de iniciado el pro-grama, se inmunizaron 1 262 (97,0%) menores de un año y 2,529 (72,5%) en el grupo de 1-4 años. No se registraron efectos adversos importantes por el uso de la vacuna contra HBV. Ocurrieron 8 defunciones debidas a infección respiratoria aguda y enfermedad diarreica aguda, las cuales son las principales causas de defunción en la zona. Se objetivó una mejora en las coberturas de vacunación del PAI en menores de un año, mostrándose para la DPT una cobertura del 97,0% en 1991, en comparación a años previos: 63,0% (1988), 26,9% (1989) y 61,9% (1990).
En 1994, se realizó una intervención similar a la anterior en Huanta 97, un valle interandino ubicado a 2 400 msnm, considerada una zona hiperendémica de HVB y HVD, donde 8% del total de fallecidos corresponden a enfermedades hepáticas como hepatitis fulminante, cirrosis o hepatocarcinoma. Se incluyeron para la vacunación 1 412 niños menores de 1 año y 5 175 niños entre 1-4 años. Se aplicó a cada niño, tres dosis de una vacuna recombinante de ADN contra HVB. El esquema fue adaptado al del PAI. En niños menores de 1 año fue: Recién nacido: BCG, Polio y HBV1; 2meses: Polio1, DPT1y HVB2; 3 meses: Polio2 y DPT2; 4 meses: Polio3, DPT3 y HVB3; 9 meses: sarampión. En el grupo de 1-4 años, el esquema fue: HVB1 al ser captado, HVB2 al mes de la primera; y HVB3 al 6º mes de la HVB1.
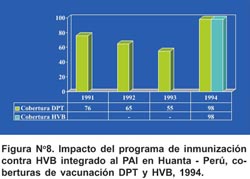
Al año de iniciado el programa, recibieron 3 dosis de la vacuna 1 386 (98,1%) niños menores de 1 año y 4 353 (84,1%) niños de 1 a 4 años. No se reportaron reacciones adversas importantes. El objetivo de mejorar las coberturas de vacunación del PAI, fue alcanzado, así las coberturas de vacunación en menores de 1 año con DPT 75% (1991), 64,5% (1992), 55,2% (1993), en 1994, en el que se incluyó la vacuna contra HVB, la cobertura fue 98,1% (Figura Nº 8).
En 1997 se evaluó la vacunación contra HVB en Huanta, la cual mostró una significativa reducción de las tasas de infección en niños de 3-4 años de 1994 (24,4%-30,4%) comparado con las tasas de infección en niños de la misma edad en 1997 (2,3-5,1%), concluyendo que la inclusión de la vacuna contra HVB en el PAI en una zona hiperendémica de HVB/HVD, es segura, eficaz y mejora las coberturas del PAI (Tabla Nº 6).
Basándose en estas dos experiencias nacionales y la experiencia internacional, el Ministerio de Salud 98 en 1996 decidió incorporar la vacuna contra HBV en el Programa Ampliado de Inmunizaciones, para niños menores de 1 año residentes en áreas de mediana y alta endemicidad, que al inicio de la vacunación constituían alrededor de 120 430 niños menores de 1 año. Esta medida se tomó considerando el mayor riesgo de los niños de estas áreas y la disponibilidad de recursos en ese momento, debiendo avanzar hacia la universalización de la vacunación contra HBV a menores de 5 años de todo el país, y para eliminar el mayor número posible de susceptibles, ampliar hasta adolecentes empezando por las áreas de alta y mediana endemicidad, como se viene realizando en los valles de Huanta y el río Apurímac desde el año 2002.
REFERENCIAS
1. Organización Panamericana de la Salud. La hepatitis en las Américas. Bol Epidemiol 1985; 6(5):30-4 [ Links ]
2. World Health Organization. Expanded programme on immunization. Geneva: WHO; 1989. UPDATE November 1989. [ Links ]
3. Deinhardt F. Human viral hepatitis: hipotesis to fact. In: Hollinger B, Lemon S, Margolis H. Viral hepatitis and liver disease. Proceeding of the 1990 International Symposium on Viral Hepatitis and Liver Disease: Contemporary issues and future prospects. Baltimore 1991:5-11. [ Links ]
4. Scalise G, Giacometti. Le epatiti non-A, non-D. Giornale Italiano di Malattie Infettive 1995 (Suppl 1): 57-60.
5. Thibault V, Dorrent R, Noizee F, Pavie A. Influence of transfussion transmitted virus (TTV) infection on heart or lung and heart allografts. Antiviral therapy 2000; 5(Suppl 1): G4.
6. Khudyakov YE, Cing M, Nichols B, Dou X-G. Transfussion transmitted virus (TTV). Antiviral therapy 2000; 5 (Suppl 1): G.9.
7. World Health Organization. Prevention of liver cancer. Report of a WHO meeting. WHO Technical Report Series. 1983; 691:8.
8. World Health Organization. Expanded Program on Immunization; Hepatitis B vaccine making global progress. Update October 1996.
9. World Health Organization. Expanded Programme on immunization. Protocol for assessing prevalence of hepatitis B infecction in antenatal patients. WHO/EPI/GEN/90.6.
10. Pearce N, Milne A, Moyes C. Hepatitis B virus: the importance of age at infection. N Z Med J 1988; 101(858): 788-90.
11. McMahon BJ, Alward WL, Hall DB, Heyward WL, Bender TR, Francis DP, et al. Acute hepatitis B virus infection: relation of age to the clinical expression of disease and subsequent development of the carrier state. J Infect Dis 1985; 151: 599-603.
12. Liaw YF, Tai DI, Chu CH, Chen TJ. The development of cirrhosis in patients with chronic type B hepatitis: a pro-spective study. Hepatology 1988; 8(3): 493-6.
13. Ikeda K, Saitoh S, Susuki Y, Kobayashi M, Tsubota A, Koida I, et al. Disease progression and hepatocellular car-cinogenesis in patients with chronic viral hepatitis: a prospective observation of 2215 patients. J Hepatol 1998; 28(6): 930-8.
14. McMahon BJ, Alberts SR, Wainwright RB, Bulkow L, Lanier AP. Hepatitis B-related sequelae. Prospective study in 1400 hepatitis B surface antigen-positive Alaska native carriers. Arch Intern Med, 1990. 150(5): 1051-4.
15 Liaw YF, Tai DI, Chu CH, Lin DY, Sheen IS, Chen TJ, et al. Early detection of hepatocellular carcinoma in patients with chronic type B hepatitis: a prospective study. Gastroenterology 1986; 90(2): 263-7.
16. Beasley RP, Hwane LY, Lin CC, Chien CS. Hepatocellular carcinoma and hepatitis B virus: a prospective study of 22707 men in Taiwan. Lancet 1981. 2(8256): 1129-33.
17. Szmuness W. Hepatocellular carcinoma and the hepatitis virus: Evidence for a causal association. Prog Med Virol 1978; 24: 40-69.
18. Kew MC. The development of hepatocellular cancer in humans. Cancer Surv 1986; 5: 719-39.
19. Cabezas C, Miranda J. A 38 year evaluation of death causes related to liver diseases in Huanta - Peru. Am J Trop Med Hyg 1999; 61 (Suppl 3): 370.
20. Indacochea S, Gotuzzo E, De la Fuente J, Phillips I, Whignal S. Elevada prevalencia de marcadores de hepatitis B y Delta en el valle interandino de Abancay. Revista Médica Herediana 1991; 2: 168-72.
21. Maynard, JE, Kane MA, Hadler SC. Global control of hepatitis B vaccine in the expanded programme on immunization. Rev Infect Dis 1989; 2 (Suppl 3): 574-5.
22. Szmuness W, Harley EJ, Ikran H. Sociodemographic aspects of the epidemiology of hepatitis B. In: Vyas GN,Cohen SN, Schmid R eds. Viral hepatitis. Philadelphia: Franklin Institute Press;1978. p. 297.
23. Fay OH, Goudeau A, Maynard J. Estrategies for implementing successful hepatitsi B vaccination program. In : Viral Hepatitis and Liver Disease. Ed. Baline Hollinger; 1991. p. 832
24. Rizzetto M, Verne G, Recchis S. Chronic hepatitis in carriers of hepatitis B surface antigen with intrahepatic expression of delta antigen: an active and progressing disease unreponsive to inmune supressive treatament. Ann Intern Med 1983; 98: 437.
25. Rasshofer R, Buti M, Esteban R, Jordi R, Roggendorf M. Demostration of hepatitis D virus RNA in patients with chronic hepatitis. J Infect Dis 1988; 157(1): 191-5.
26. Fields Ho A, Hadler S. Delta hepatitis: a review. In: Journal of clinical Inmunoassay. Reprinted by the US Departament of the Health and Human Services Public Health Service; 1990:128-42.
27. Bensabath Hadler SC, Soares MC, Fields H, Maynard JE. Epidemiologic and serologic studies of acute viral hepatitis in Brasils Amazon Basin. Bull Pan Am Health Organ 1987; 21(1): 16-27.
28. Tanaka T, Nagl M, Yoshihara S. Changing pattern of age specific prevalence of hepatitis B surface antigen and correspondin antibodi in Japan. Am J Epidemiol 1986,124: 368-71.
29. Arico S, Aragona M, Rizzeto M, Caredda F, Zanetti A, Marinucci, et al. Clinical significance of antibody to the hepatitis delta virus in symptom less HBsAg carriers. Lancet 1985; 2(8451): 356-8.
30. Méndez M, Arce M, Kruger H, Sánchez S. Prevalencia de marcadores serológicos de hepatitis vírica en diversos grupos de población del Perú. Bol Ofic Sanit Panam 1989; 106: 127-38.
31. Vildósola H, Farfán G, Colán E. Prevalencia del antígeno de superficie del virus de hepatitis B en población general de costa sierra y selva del Perú: reporte preliminar. Rev Gastroenterol Perú 1990; 10:96-101.
32. Ruiz R, Jaimes A, Montejo G, Hinostroza-Sjogren M. Marcadores serológicos de hepatitis viral en la región amazónica del Perú estudio de una población representativa. Diagnóstico 1989; 24: 5-9.
33. Colichón A, Cantella R, Campomanes E. Focos hiperendémicos de hepatitis B en la selva peruana estudio de mar-cadores de hepatitis en residentes del Ucayali (Pucallpa -Perú). Diagnóstico 1985; 16: 116-21.
34. Chang J, Zavaleta A, Phillips I. Seroepidemiología de hepatitis B en cuatro comunidades de la selva central del Perú. Rev Med Exp 1997; 14: 34-9.
35. Cabezas C, Reátegui J, Suárez M. Hiperendemicity of HBV and Delta among native communities of the amazon region of Peru. International Conference on Emerging Infectious Diseases; 1998 March 8-11, Atlanta-Georgia, USA.
36. Colichón A. Distribución seroepidemiológica de la hepatitis B y hepatitis Delta en diferentes comunidades indígenas de la selva peruana (Tesis de Doctorado). Lima: Universidad Peruana Cayetano Heredia;1989. p. 53.
37. Cabezas C, Anaya E, Bartalesi F, Sánchez J. Transmisión horizontal de hepatitis viral B en población desplazada de un área hiperendémica a sus contactos en un área de baja endemicidad del Perú. Rev Gastroenterol Perú 1997; 17(2): 128-34.
38. Cabezas C, Ramos F, Sánchez J. Elevada prevalencia de infección por virus de la hepatitis B y Delta en población infantil de Huanta-Ayacucho. IX Triennial International Symposium on viral hepatitis and liver disease. 1996 April 21-25; Rome, Italy; 1996.
39. Cabezas C, Gotuzzo E, Escamilla J, Phillips I. Prevalencia de marcadores serológicos de hepatitis viral A, B y delta enescolares aparentemente sanos de Huanta (Perú). Rev Gastroenterol Perú 1994; 14: 123-34.
40. Alter HJ, Holland PV, Purcell RH, Lander JJ, Feinstone SH, Morrow AG, et al. Posttransfusion hepatitis after exclusion of commercial and hepatitis B antigen-positive donors. Ann Intern Med 1972; 77: 691-9.
41. Dodd RY. The risk of transfusion-transmitted infection N Engl J Med 1992; 327: 419-21.
42. Lok ASF, Lai CL, Wu PC. Prevalence of isolated antibody to hepatitis B core antigen in an area endemic for hepatitis B virus infection: implication in hepatitis B vaccination programs. Hepatology 1988; 8: 766–70.
43. McMahon BJ, Parkinson AJ, Helminiak C. Response to hepatitis B vaccine of persons positive for antibody to hepatitis B core antigen. Gastroenterology 1992; 103: 590-4.
44. Preiksaitis JK, Rivet C. A history of the evolution of hepatitis C testing of blood donors: implication for the canadian blood supply system. Transfusion 1995; 35: 348-352.
45. Chung HT, Lee STK, Lok ASF. Prevention of posttransfusion hepatitis B and C by screening for antibody to hepatitis C virus and antibody to HBcAg. Hepatology 1993; 18: 1045-9.
46. Fuentes-Rivera J, Roca VO, Maldonado F, Guillén M. Seroprevalencia de enfermedades hemotransmisibles en do-nantes de sangre. Rev Soc Peru Enf Infec-Trop 2002; 2: 12-20.
47. Alter MJ, Hadler SC, Margolis HS, Alexander WJ, Hu PY, Judson FN, et al. The changing epidemiology of hepatitis B in the United States. Need for alternative vaccination strategies. JAMA 1990; 263: 1218-22.
48. Centers for Disease Control and Prevention. Prevention of perinatal hepatitis B through enhanced case management Connecticut 1994-95 and the United States 1994. MMWR 1996; 45: 584-7.
49. Wong VC, IP HM, Reesink HW, Lelie PN, Reerink-Brongers EE, Yeung CY, et al. Prevention of the HBsAg carrier state in newborn infants of mothers who are chronic carriers of HbsAg and HBeAg by administration of hepatitis-B vaccine and hepatitis B immunoglobulin. Double-blind randomised placebo-con-trolled study. Lancet 1984; 1(8383): 921-6.
50. Giraud P, Drouet J, Dupuy JM. Letter: Hepatitis-B virus infection of children born to mothers with severe hepatitis. Lancet 1975; 2: 1088-9.
51. Beasley RP, Stevens CE, Shiao IS, Meng HC. Evidence against breast-feeding as a mechanism for vertical transmission of hepatitis B. Lancet 1975; 2: 740-1.
52. Chang MH, Chen CJ, Lai MS, Hsu HM, Wu TC, Kong MS, et al. Universal hepatitis B vaccination in Taiwan and the incidence of hepatocellular carcinoma in children. Taiwan Child-hood Hepatoma Study Group. N Engl J Med 1997; 336: 1855-9.
53. Cabezas C, Romero Y, Parihuaman R, Suárez M. Bajo riesgo de transmisión vertical del virus de la hepatitis B en un área hiperendémica del Perú. V Congreso Peruano de Enfermedades Infecciosas y Tropicales. Boletin de la Sociedad peruana de enfermedades infecciosas y tropicales 1997; Lima-Perú.
54. Vásquez S, Cabezas C, García B, Torres R. Prevalencia de portadores de HBsAg y Anti-HBs en gestantes residentes en áreas de diferente endemicidad de HVB en departamentos del centro-sur del Perú. Rev Gastroenterol Perú 1999; 19: 23-7.
55. Gerberding JL. The infected health care provider. N Eng J Med 1996; 334: 594-5.
56. Gerberding JL. Incidence and prevalence of human immunodeficiency virus, hepatitis B virus, hepatitis C virus, and citomegalovirus among health care personnel at risk for blood exposure: Final report from a longitudinal study. J Infect Dis 1994; 170: 1410-7.
57. Mast EE, Alter MJ. Prevention of hepatitis B virus infection among health care workers. En: Ellis RW, ed. Hepatitis B vaccines in clinical practice. New York: Marcel Dekker; 1993. p. 295-307.
58. Grady GF, Kane MA. Hepatitis B infections accounts for multimillion dollar loss. Hosp Infect Control 1981; 8: 60-2.
59. Gibas A, Blewett DR, Schoenfeld DA, Dienstag JL. Prevalence and incidence of viral hepatitis in health workers in the prehepatitis vaccination era. Am J Epidemiol 1992; 136: 603-10.
60. Bussalleu A, Cieza J, Colichón A, Berrios J. Prevalencia de hepatitis viral tipo B en pacientes y personal de tres unidades de hemodiálisis en Lima. Rev Med Hered 1991; 4: 160-7.
61. Snydman DR, Muñoz A, Werner BG, Polk BF, Craven DE, Platt R, et al. A multivariate analysis of risk factors for hepatitis B virus infection among hospital employees screened for vaccination. Am J Epidemiol 1984; 120: 684-93.
62. Deville J, Llanos A, Campos M, Philips I, Gotuzzo E, Kilpatrick M. Factores de riesgo para infección por virus de hepatitis en personal hospitalario. Rev Gastroenterol Peru 1989; 9: 24-8.
63. Romero G. Prevalencia de marcadores serológicos de HBV en trabajadores de salud y profesores de Huanta (Perú), (Tesis para optar el grado de biólogo). Ayacucho: Universidad Nacional San Cristóbal de Huamanga; 1997.
64. Hoft RH, Pflugfelder SC, Forster RK, Ullman S, Polack FM, Schiff ER. Clinical evidence for hepatitis B transmission resulting from corneal transplantation. Cornea 1997; 16: 132-7.
65. Turner DP, Zuckerman M, Alexander GJ, Waite J, Wreghitt T. Risk of inappropriate exclusion of organ donors by introduction of hepatitis B core antibody testing. Transplantation 1997; 63: 775-7.
66. Caldwell SH. Hard times and imperfect organs. Liver Transplant Surg 1997; 3: 181-4.
67. Wachs ME, Amend WJ, Ascher NL, Bretan PN, Emond J, Lake JR. The risk of transmission of hepatitis B from HBsAg(-), HBcAb(+), HBIgM(-) organ donors. Transplantation 1995; 59: 230-4.
68. Dickson RC, Everhart JE, Lake JR, Wei Y, Seaberg EC, Wiesner RH, et al. Transmission of hepatitis B by trans-plantation of livers from donors positive for antibody to hepatitis B core antigen. Gastroenterol 1997; 113: 1668-74.
69. Davis LG, Weber DJ, Lemon SM. Horizontal transmission of hepatitis B virus. Lancet 1989 1(8643): 889-93.
70. Karayiannis P, Novick DM, Lok AS, Fowler MJ, Monjardino J, Thomas HC. Hepatitis B virus DNA in saliva, urine, and seminal fluid of carriers of hepatitis B e antigen. BMJ 1985; 290: 1853-5.
71. Scott RM, Snitban R, Bancroft WH, Alter HJ, Tingpalapong M. Experimental transmission of hepatitis B virus by semen and saliva. J Infect Dis 1980; 142: 67-71.
72. Bancroft WH, Snitbhan R, Scott RM, Tingpalapong M, Watson WT. Transmission of hepatitis B virus to gibbons by exposure to human saliva containing hepatitis B surface antigen. J Infect Dis 1977; 135: 79-85.
73. Cabezas C, Miranda J, Suárez M, Romero G. Bat bites, a risk factor associated with hepatitis B in the Amazon basin. Antiviral Therapy 2000; 5 (Suppl 1): B9.
74. Blow JA, Turel MJ, Silverman L, Walker ED. Stercorarial shedding and transtadial transmission of hepatitis B virus by common bed bugs (Hemiptera: Cimicidae). J Med Entomol 2001; 38: 694-700.
75. Pearce N, Milne A, Moyes C. Hepatitis B virus: the importance of age at infection. N Z Med J 1988; 101(858): 788-90.
76. McMahon BJ, Alward WL, HAll DB, Heyward WL, Bender TR, Francis DP, et al. Acute hepatitis B virus infection: relation of age to the clinical expression of disease and subsequent development of the carrier state. J Infect Dis 1985; 151(4): 599-603.
77. Hoofnagle JH, Dusheiko GM, Seeff LB, Jones EA, Waggoner JG, Bales ZB. Seroconversion from hepatitis B e antigen to antibody in chronic type B hepatitis. Ann Intern Med 1981; 94: 744-8.
78. Realdi G, Alberti A, Rugge M, Bortolotti F, Rigoli AM, Tremolada F, et al. Seroconversion from hepatitis B e antigen to anti-HBe in chronic hepatitis B virus infection. Gastroenterol 1980; 79(2): 195-9.
79. Lok ASF, Lai CL. A longitudinal follow-up of asymptomatic hepatitis B surface antigen-positive chinese children. Hepatology 1988; 5: 1130-3.
80. Smedile A, Farci P, Verme G, Caredda F, Cargnel A, Caporaso N, et al. Influence of delta infection on severity of hepatitis B. Lancet 1982; 2: 945-7.
81. Lettau LA, McCarthy JG, Smith MH, Hadler SC, Morse LJ, Ukena T, et al. Outbreak of severe hepatitis due to delta and hepatitis B viruses in parenteral drug abusers and their contacts. N Engl J Med 1987; 317: 1256-62.
82. Rizzetto M, Canese MG, Gerin JL, London WT, Sly DL, Purcell RH. Transmission of the hepatitis virus-associated delta antigen to chimpaneses. J Infect Dis 1980; 141: 590-602.
83. Pastore G, Monno L, Santantonio T, Angarano G, Milella M, Giannelli A, et al. Hepatitis B virus clearance from serum and the liver after acute hepatitis delta virus superinfection in chronic HBsAg carriers. J Med Virol 1990; 31: 284-290.
84. Lok AS, Lindsay I, Scheuer J, Thomas HC. Clinical and histological features of delta infection in chronic hepatitis B virus carriers. J Clin Pathol 1985; 38: 530-3.
85. Fattovich G, Boscaro S, Novena F, Pornaro E, Stenico D, Alberti A, et al. Influence of hepatitis delta virus infection on progression to cirrhosis in chronic hepatitis type B. J Infect Dis 1987; 155: 931-5.
86. Murray CJ, López AD. Mortality by cause for eight regions of the world: global burden of disease study. Lancet 1997; 349 :1269-76.
87. Parkin D, Pisani P, Ferlay J. Estimates of the worldwide incidence of 18 major cancers in 1985. Int J Cancer 1993; 54: 594-606.
88. Rustgi VK. Epidemiology of hepatocellular carcinoma. Gastroenterol Clin North Am 1987; 16: 545-51.
89. Beasley RP. Hepatitis B virus: the major etiology of hepato-cellular carcinoma. Cancer 1988; 61: 1942-56.
90. Arce R, Leon J, Cuéllar L. Antigeno de superficie del virus de la hepatitis B causantes del hepatocarcinoma. Rev Gastroenterol Perú 1986; 6: 35-45.
91. García F. Determinación del antigeno de superficie del virus de la hepatitis B por inmunoperoxidasaen un grupo de biopsias de cirrosis hepáticas.(Tesis para optar al grado de bachiller en medicina) Lima: Universidad Peruana Cayetano Heredia; 1997. p. 29.
92. Bueno H, Indacochea S, Oberst R, Chauca G. Rol de los virus de hepatitis B y delta en la etiología del hepatocarcinoma y otras hepatopatías crónicas. Rev Gastroenterol Perú 1994; 14: 135-39.
93. Ruiz E, Almonte M, Pizarro R, Celis J, Montalbeti J, Urbano R. Infección con virus de la hepatitis B y hepatitis C como factores de riesgo para hepatocarcinoma en el Perú: estudio casos y controles. Rev Gastroenterol Perú 1998; 18: 199-212.
94. Donayre M, Bussalleau A, Berrios J, Cok J. Carcinoma primario de hígado en el Hospital Nacional Cayetano Heredia (Enero 1969-Abril 1997) Hallazgos clínicos y de laboratorio. Rev Gastroenterol Perú 1999; 19: 15-25.
95. Barham W. Chronic Liver disease in Peru: Role of viral hepatitis. J Med Virol 1994; 42: 129-32.
96. Cabezas C, Echevarría C. Programa piloto de inmunización contra hepatitis viral B, integrado al Programa Ampliado de Inmunización (PAI) en Abancay (Perú). Rev Gastroenterol Perú 1995; 15: 215-22.
97. Cabezas C. Ramos F, Vega M. Impacto del programa de vacunación contra hepatitis B integrado al PAI en Huanta Perú 1994-1997. Rev Gastroenterol Perú 2000; 20: 201-12.
98. Ministerio de Salud. Control de la Hepatitis Viral B en el Perú: Conclusiones y recomendaciones de la comisión en-cargada por RM: 633-95-SA/DM. Lima: MINSA; 1995.