Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.20 no.1 Lima ene./Mar. 2003
Diseño y estandarización de una prueba de PCR para el diagnóstico de la Bartonelosis causada por Bartonella bacilliformis
Carlos Padilla R1, Gladys Ventura E2
1División de Biología Molecular, Instituto Nacional de Salud. Lima, Perú.
Resumen
Objetivo: Diseñar una prueba de PCR para el diagnóstico de la Bartonelosis causada por Bartonella bacilliformis. Materiales y métodos: Se usó la secuencia del locus de invasión ialB para diseñar los oligonucleótidos ialBF y ialBR, además del ADN geonómico purificado de una cepa referencial de B. bacilliformis para estandarizar las condiciones de la prueba. Finalmente, la prueba fue preliminarmente evaluada con 12 cepas de B. bacilliormis aisladas en 3 áreas endémicas y 10 muestras de sangre total de pacientes con Bartonelosis confirmada. Resultados: La prueba detectó el ADN de aislamientos de B. bacilliformis de 3 áreas bartonelósicas endémicas del Perú: Ancash, Cuzco y Lima; mientras que no detectó el ADN de B. hensenlae, ni de B. vinsonii, ni de otras bacterias y parásitos. Además, esta prueba fue positiva para 10 muestras sanguíneas de pacientes con bartonelosis confirmada y negativa para 5 muestras de pacientes con malaria por P. falciparum. Conclusión: Esta prueba de PCR podría ser útil para el diagnóstico de la bartonelosis causada por B. bacilliformis.
Palabras clave: Infecciones por Bartonella / diagnóstico; Reacción en cadena por la polimerasa (fuente: BIREME).
Abstract
Objective: To design a PCR test for the diagnosis of Bartonellosis produced by Bartonella bacilliformis. Material and methods: ialB locus was used to design ialBF and ialBR primers, and PCR conditions were standardized using genomic DNA from a referral strain. Furthermore, the test was preliminary assessed in 12 clinical isolates from three Peruvian endemic areas and 10 whole blood samples of bartonelosis confirmed cases. Results: This test detected DNA from B. bacilliformis strains from three Peruvian endemic places of bartonellosis: Ancash, Cuzco and Lima. Genomic DNA of B. hensenlae, B. vinsonii, and other pathogens were not detected. In addition, this test was positive for ten whole blood samples of patients with confirmed bartonellosis and it was negative for five whole blood samples of patients with P. falciparum malaria. Conclusions: This PCR test could be useful for diagnosing bartonellosis caused by B.bacilliformis.
Key words: Bartonella infections / diagnosis; Polymerase chain reaction (Source: BIREME).
Introducción
La Bartonelosis es una enfermedad considerada como reemergente en el Perú y emergente en el ámbito mundial 1-3. En el Perú, esta enfermedad es causada por Bartonella bacilliformis y está presente en 11 de 24 departamentos4. Es endémica en algunas provincias de Ancash, Cajamarca, Amazonas y Piura, habiendo resurgido en Lima, Cusco, La Libertad y Huanuco5-7.
El control de la Bartonelosis depende del tratamiento temprano de los casos y de la vigilancia vectorial. El diagnóstico se basa principalmente en el examen directo de frotis; sin embargo, éste presenta baja sensibilidad6. Las pruebas serológicas presentan el mismo problema de sensibilidad y adicionalmente baja especificidad8-10. Por otro lado, el desarrollo de este microorganismo in vitro es muy lento (5 a 45 días), por lo cual el hemocultivo sólo permite confirmar la infección.
Una prueba moderna de diagnóstico consiste en la amplificación específica de fragmentos de ADN de los patógenos mediante el uso de ADN polimerasa termoestables in vitro, este método se denomina reacción en cadena de la polimerasa o PCR. Varias pruebas de PCR han sido propuestas para el diagnóstico de la Bartonelosis, estas pruebas se basan en la amplificación de genes como el gen citrato sintetasa (gtlA)11-13, el gen de la proteína de división celular FtsZ14, el gen 16SrRNA15,16, el gen de la riboflavina ribC17 y la proteína de estrés térmico de 60 kDa18. Sin embargo, estas no están diseñadas para el diagnóstico específico de la Bartonelosis por B. Bacilliformis en muestras clínicas.
En este artículo se reporta el diseño y estandarización de una prueba de PCR en una sola etapa para el diagnóstico específico de B. Bacilliformis en sangre total usando como marcador molecular el locus de invasión ialB de esta bacteria.
Materiales y métodos
Diseño de Primers
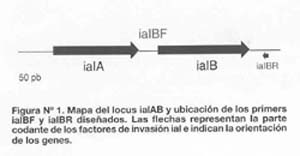
La secuencia del locus de invasión ialAB de Bartonella bacilliformis ha sido reportada al GENBANK en 1995 por Mitchell S J y Minnick M F19. A partir de esta secuencia se diseñaron los oligonucleótidos ialBF e ialBR (Tabla Nº 1) usando el programa Primer Premier; estos oligonucleótidos están ubicados en el gen ialB (Figura Nº 1) y fueron sintetizados químicamente por la compañía DNA Integrated Inc.
Muestras biológicas
Las condiciones de esta prueba se estandarizaron usando el ADN genómico de la cepa de Bartonella bacilliformis JB584. Doce aislamientos de B. Bacilliformis de 3 diferentes zonas bartonelósicas (3 de Ancash, 3 de Lima y 6 Cuzco), B. hensenlae, Salmonella, Brucella mellitensis, Salmonella paratyphi, Salmonella typhi, Vibrio cholerae, Shigella spp. y E. coli O111 se obtuvieron del cepario del Instituto Nacional de Salud (Lima, Perú). También se empleó ADN purificado de Rickettsia typhi (proporcionado por la División de Patología del Instituto Nacional de Salud); y ADN purificado de B. Vinsonii (proporcionado por el CDC, USA). El ADN humano fue extraído de una persona clínicamente sana.
Además, se incluyeron 10 muestras de sangre total periférica con anticoagulante EDTA de pacientes con Bartonelosis confirmada por frotis, 5 de ellas de Urubamba (Cusco) y otras 5 de Caraz (Ancash); y finalmente, 5 muestras sanguíneas con anticoagulante EDTA de pacientes confirmados por frotis con malaria por P. falciparum y ADN purificado de P. falciparum cepa 3D7 proporcionados por la División de Biología Molecular del Instituto Nacional de Salud.
Extracción de ADN
Las extracciones de ADN genómico a partir de cultivos bacterianos y de sangre total fueron realizadas utilizando el kit para extracción de ADN Qiamp Tissue (QIAGEN Inc.Valencia, Calif.) según instrucciones de los fabricantes. Se procesaron 200 mL de sangre o cultivos líquidos, se añadieron soluciones que contenían duodecil sulfato de sodio al 1% para lisar las células, posteriormente se digirieron las proteínas de la muestra usando 400 ug de proteinasa K e incubándose a 65 °C durante toda la noche. Luego, las muestras fueron colocadas en columnas con afinidad por ADN, el ADN fue atrapado en las columnas y las impurezas se eliminaron mediante soluciones de lavado; finalmente, el ADN purificado fue eluido de las columnas en 100 mL de agua bidestilada libre de ADNsas. La concentración de ADN de las muestras se midió por espectrofotometría y las muestras se almacenaron a 4 °C hasta su uso.
Reacción en cadena de la polimerasa (pcr)
La prueba de PCR fue diseñada para un volumen final de 25 mL. Las reacciones se realizaron en tubos polipropileno de 200 mL de pared delgada y en un termociclador modelo 9700 (PE Applied Biosystems, Foster City, Calif.). Las mezclas de reacción contenían enzima Amplitaq Gold ADN polimerasa (PE Applied Biosystems, Foster City, Calif.) entre 0,001 a 0,01 U/uL, oligonucleótidos específicos (ialBF y ialBR) entre 0,1 a 2 umolar, MgCl2 entre 0,5 a 4 mM y desoxinucleótidos trifosfato (dNTPs) entre 0,1 a 0,5 mM. Se utilizó agua bidestilada, libre de ADNsas y ARNsas (Sigma Inc, St. Louis, MO). La temperatura óptima de hibridación de los oligonucleótidos se evaluó entre 46°C a 50°C.
Los productos de amplificación fueron resueltos mediante electroforesis en geles de 1,5% de agarosa, a 75 V por 45 minutos en buffer TAE 1X (40 mM Tris-acetato, 1 mM EDTA), posteriormente los geles fueron incubados en una solución de 5 ug/mL de bromuro de etidio por 5 minutos, visualizados en una cámara de luz ultravioleta y fotografiados utilizando una cámara POLAROID MP4+ (POLAROID Co., Waltham, MA).
Resultados
Estandarización de la prueba
Las concentraciones de cada componente de la reacción fueron estandarizadas. Las concentraciones óptimas determinadas para la reacción fueron las siguientes: 0,2 mM de cada desoxinucleótido trifosfato (dNTPs), 0,004 U/uL de la enzima termoestable Amplitaq Gold ADN Polimerasa, 2,5 mM de MgCl2 y 1 uM de cada oligonucleótido (ialBF y ialBR).
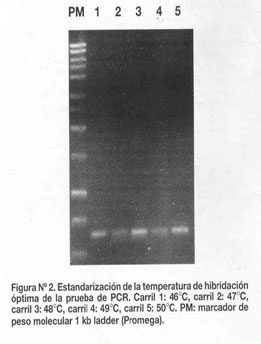
La tempratura óptima de hibridación de los oligonucleótidos fue 48°C (Figura Nº 2). Los ciclos de temperatura para la amplificación óptima fueron: una denaturación inicial de 95°C por 10 minutos, seguido de 35 ciclos de denaturación de 95°C por 30 segundos, una temperatura de hibridación de 48°C por 30 segundos y una temperatura de extensión de 72°C por 45 segundos; finalmente, una extensión de 72°C por 5 minutos.
Sensibilidad del sistema
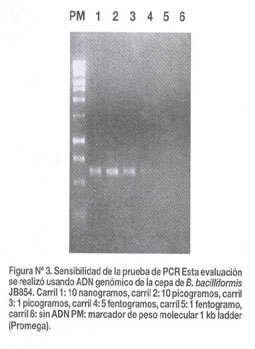
Para analizar la sensibilidad de la prueba se realizaron diluciones de ADN genómico de B. bacilliformis cepa JB584. Como está reportado, el tamaño del genoma de B. bacilliformis es aproximadamente 1617 kilo pares de bases20. Por lo tanto, una molécula del genoma de B. bacilliformis corresponde a aproximadamente 1,7 fentogramos de ADN purificado. Esta prueba es positiva a 5 fentogramos, lo cual corresponde aproximadamente a 3 genomas (Figura Nº 3).
Especificidad biológica de la prueba
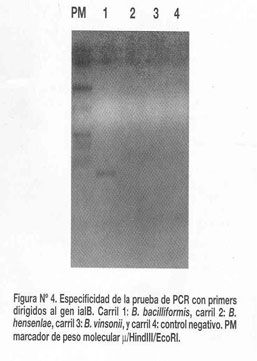
Para analizar la especificidad biológica de la prueba se evaluó 50 ng de ADN genómico purificado de cepas de otras especies bacterianas, géneros bacterianos y parásitos, como:B. hensenlae, B. vinsonii, Rickettsia Typhi, Salmonella, Brucella mellitensis, salmonella paratyphi, salmonella Typhi, vibrio cholerae, Shigella sp.,plasmodium falciparum cepa 3D7, E. Coli 0111 y ADN humano. La prueba resultó negativa a todas estas muestras ( ver algunos resultados en la figura N°4 )
Evaluación de muestras clínicas y aislamientos
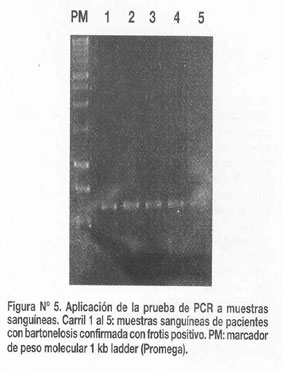
Como una evaluación preliminar, se analizaron 10 muestras de sangre periférica de pacientes con frotis positivo para bartonelosis, todas estas muestras resultaron positivas a esta prueba (Figura Nº5). Además, se evaluaron 5 muestras de sangre periférica de pacientes infectados por P. falciparum, las cuales fueron negativas a la prueba. Para evaluar la aplicabilidad de la prueba en diferentes áreas bartonelósicas del Perú, se evaluaron 12 aislamientos de B. bacilliformis de 3 diferentes zonas, resultando todas positivas.
Discusión
En nuestro país la Bartonelosis causada por Bartonella bacilliformis es un grave problema de salud y su diagnóstico muchas veces es difícil
La reacción en cadena de la polimerasa o PCR es una técnica moderna que permite la detección del material genético de microorganismos en muestras clínicas, estando ampliamente difundida su utilidad en el diagnóstico de enfermedades infecciosas. Muchas pruebas de PCR han sido reportadas para el diagnóstico de la Bartonelosis. Entre estas pruebas destaca la prueba de PCR basada en el gen ribC
Otra prueba de PCR propuesta es la variante PCR-Nested que se basa en el gen FtsZ; sin embargo, esta prueba requiere una etapa adicional de amplificación con oligonucleótidos anillados
Así, ninguna de estas pruebas de PCR han sido diseñadas para la detección específica de B. bacilliformis en muestras clínicas
Además, esta prueba de PCR es específica para la detección de B. bacilliformis, ya que está basada en la amplificación del gen ialB de B. bacilliformis
Nosotros proponemos que esta prueba sea evaluada en otras muestras como líquido cefalorraquídeo (en los casos de sospecha de neurobartonelosis), en biopsias de verrugas (para confirmación de casos crónicos de Bartonelosis), y en mosquitos (para incriminación vectorial). Además, se propone que esta prueba puede ser usada para la confirmación rápida de brotes compatibles con Bartonelosis por B. bacilliformis en el país.
Referencias
1. Maguiña C, García PJ, Gotuzzo E, Cordero L, Spach DH. Bartonellosis (Carrions disease) in the modern era. Clin Infect Dis 2001; 33(6): 772-9. [ Links ]
2. Anderson BE, Neuman MA. Bartonella sp. as emerging human pathogens. Clin Microbiol Rev 1997; 10(2): 203- 19. [ Links ]
3. Imler GM. Bartonella bacilliformis: dangerous pathogen slowly emerging from deep background. FEMS Microbiol Lett 1996; 144(1):1-11. [ Links ]
4. Ministerio de Salud. Boletín epidemiológico semanal N° 14. Lima: OGE/MINSA; 2002. [ Links ]
5. Ministerio de Salud. Boletín epidemiológico semanal N° 23. Lima: OGE/MINSA; 2002. [ Links ]
6. Ellis BA, Rotz LD, Leake JAD, Samalvides F, Bernable J, Ventura G, et al. An outbreak of acute bartonellosis (Oroya Fever) in Urubamba region of Peru, 1998. Am J Trop Med Hyg 1999; 61(2): 344-9. [ Links ]
7. Kosek M, Lavarello R, Gillman R, Delgado J, Maguiña C, Verástegui M, et al. Natural history of infection with Bartonella bacilliformis in a nonendemic population. J Infect Dis 2000; 182(3): 865-72. [ Links ]
8. Chamberlin J, Laughlin L, Gordon S, Romero S, Solórzano N, Regnery RL. Serodiagnosis of Bartonella bacilliformis infection by indirect fluorescence antibody assay: test development and application to a population in an area of bartonellosis endemicity. J Clin Microbiol 2000; 38(11): 4269-71. [ Links ]
9. Knobloch J, Solano L, Álvarez O, Delgado E. Antibodies to Bartonella bacilliformis as determined by fluorescence antibody test, indirect haemagglutination and ELISA. Trop Med. Parasitol 1985; 36(4):183-5. [ Links ]
10. Mallqui V, Speelmon EC, Verástegui M, Maguiña- Vargas C, Pinell-Salles P, Lavarello R, et al. Sonicated diagnostic immunoblot for bartonellosis. Clin Diagn Lab Immunol 2000; 7(1):1-5. [ Links ]
11. Norman AF, Regnery R, Jameson P, Greene C, Krause1 DC. Differentiation of Bartonella-like isolates at the species level by PCR-restriction fragment length polymorphism in the citrate synthase gene. J Clin Microbiol 1995;33(7): 1797-1803. [ Links ]
12. Renesto P, Gouvernet J, Drancourt M, Roux V, Raoult D. Use of rpo (gene analysis for detection and identification of Bartonella species. J Clin Microbiol 2001; 39(2):430-7. [ Links ]
13. Padilla C, Carrillo C, Ellis B, Ventura G, Montoya Y. Detección de Bartonella bacilliformis usando PCR-RFLP. Rev Med Exp 1998; 15(1): 34-6. [ Links ]
14. Kelly TM, Padmalayam I, Baumstark BR. Use of the cell division protein FtsZ as a means of differentiating among Bartonella species. Clin Diagn Lab Immunol 1998; 5(6): 766-72. [ Links ]
15. Jensen WA, Fall MZ, Rooney J, Kordick DL, Breitschwerdt EB. Rapid identification and differentiation of Bartonella species using a single-step PCR assay. J Clin Microbiol 2000; 38(5): 1717-22. [ Links ]
16. Matar GM, Koehler JE, Malcolm G, Lambert-Fair MA, Tappero J, Hunter SB, et al. Identification of Bartonella species directly in clinical specimens by PCR-restriction fragment length polymorphism analysis of a 16S rRNA gene fragment. J Clin Microbiol 1999; 37(12): 4045-7. [ Links ]
17. Bereswill S, Hinkelmann S, Kist M, Sander A. Molecular analysis of riboflavin synthesis genes in Bartonella hanselae and use of the ribC gene for differentiation of Bartonella species by PCR. J Clin Microbiol 1999; 37(10):3159-66. [ Links ]
18. Zeaiter Z, Mourner PE, Ogata H, Raoult D. Phylogenetic classification of Bartonella species by comparing groEL sequences. Int J Syst Evol Microbiol 2002; 52(Pt 1): 165-71. [ Links ]
19. Mitchell SJ, Minnick M F. Characterization of a two-gene locus from Bartonella bacilliformis associated with the ability to invade human erythrocytes. Infect Immun 1995; 63(4): 1552-62. [ Links ]
20. Krueger CM, Marks KL, Ihler GM. Physical map of the Bartonella bacilliformis genome. J Bacteriol 1995; 177(24): 7271-4. Padilla C. y col. [ Links ]