Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.20 no.1 Lima ene./Mar. 2003
Determinación mediante inmunohistoquímica de infección por virus de la fiebre amarilla y virus de la hepatitis b
Cecilia Morón C1, María Elena Muñoz Z1, Miriam Yasuda E1 , Roberto Kemper V2, Raúl Román C1.
1Departamento de Patología. Centro Nacional de Salud Pública. Instituto Nacional de Salud. Lima, Perú.
2Departamento de Patología. Hospital Arzobispo Loayza. Lima, Perú.
Resumen
La inmunohistoquímica (IHQ) constituye una herramienta para definir la etiología en el síndrome icterohemorrágico. Objetivo: Identificar mediante IHQ la presencia en hígado del antígeno de superficie de la hepatitis B y del virus de la fiebre amarilla. Materiales y métodos: Se incluyeron muestras de tejido hepático procedentes de 55 fallecidos por síndrome icterohemorrágico, remitidos entre enero de 2000 y diciembre de 2001 al Instituto Nacional de Salud, (Lima, Perú). Resultados: La prueba se realizó únicamente en 46 muestras, 33% (15/46) fueron diagnosticados por histopatología como fiebre amarilla, de ellos, 9 casos fueron positivos por IHQ para fiebre amarilla, siendo 2 de ellos también positivos para HBsAg. Histológicamente, se reportaron 6 casos como hepatitis con necrosis submasiva o masiva, que por IHQ fueron sólo 2 casos positivos para fiebre amarilla. En 39% (18/46) no se llegó al diagnóstico etiológico de la hepatitis, y finalmente hubo 2 casos con diagnóstico histopatológico de ádenocarcinoma hepático y sólo se obtuvo positividad por IHQ para HBsAg en uno. Conclusión: La IHQ es una alternativa para la confirmación diagnóstica de hepatitis B y fiebre amarilla.
Palabras clave: Fiebre amarilla / Diagnóstico; Hepatitis B/ Diagnóstico; Inmunohistoquímica (fuente: BIREME).
Abstract
Immunohistochemistry (IHC) is considered a useful tool for determining the etiology of icterohemorrhagic syndrome. We identified the surface antigen of hepatitis B virus and yellow fever virus in the liver from 55 fatal cases with icterohemorrhagic syndrome submited to INS between january 2000 and december 2001. 33% were diagnosed as yellow fever by histopathology, of these, nine cases were positive for yellow fever by IHC, with 2 cases also positive for HbsAg by IHC. Histologically 6 cases were reported as hepatitis with submassive or massive necrosis, and by IHC only two were positive for yellow fever. In 39% an etiologic diagnosis was not possible, and finally, two cases were hepatic adenocarcinoma by histopathology with positive result for HBsAg by IHC in one case.
Key words: Yellow fever / Diagnosis; hepatitis B / Diagnosis ; Immunohistochemistry (source: BIREME).
Introducción
La fiebre amarilla (FA) se caracteriza por lesiones patológicas en diversos órganos, siendo el hígado el que muestra las alteraciones más características. El diagnóstico de FA no siempre puede hacerse por examen histopatológico. Los cambios son más característicos durante el tercer al sétimo día de enfermedad, y la dificultad diagnóstica puede presentarse cuando los especímenes se obtienen mas tardíamente en el curso de la enfermedad. Existe un patrón de cambios histológicos asociados que confirman el diagnóstico histológico: necrosis mediozonal, degeneración acidofílica hepatocelular o cuerpos de Councilman y metamorfosis grasa. Solo mínima inflamación ocurre en FA, sugiriendo que los cambios patológicos son principalmente por injuria viral directa1.
Las hepatitis agudas, por infección con cualquiera de los virus hepatotrópicos, causan injuria celular de tipo degeneración acidofílica o degeneración balonante (tumefacción del hepatocito, con pérdida de su forma rectangular y con citoplasma pálido y rareficado) y necrosis resultante. Esta injuria y necrosis se acompaña de inflamación importante. Pero puede darse una variante de hepatitis aguda, la forma fulminante, con necrosis masiva, que histológicamente sería imposible de distinguir, por ejemplo, de un caso de FA en etapa tardía de enfermedad. El Perú tiene una prevalencia para el HBsAg entre 1-2%, y de 20 a 30% para anticuerpos contra HBsAg. Sin embargo, presenta zonas hiperendémicas en cuencas de Loreto, Ucayali, Madre de Dios, San Martín, y en algunos valles de la vertiente oriental de la cordillera de los Andes (Abancay, Huanta), en los cuales la prevalencia de marcadores serológicos de infección por virus de la hepatitis B (VHB) es de aproximadamente 59%, y de 9% en portadores crónicos del HBsAg2,3. La hepatitis B es causa menos frecuente de la forma aguda de la enfermedad, con excepción de la zona rural de la cuenca del Amazonas, en donde casi la mitad de los casos agudos en niños se deben al virus B. En los adultos es más variable la frecuencia de las diversas clases de hepatitis y la distribución de los tipos es más uniforme, de manera que 27- 71% de los casos agudos se deben a hepatitis A y 7-67% a hepatitis B4,5.
El Ministerio de Salud, a través de la Oficina General de Epidemiología, el Instituto Nacional de Salud (INS) y el Proyecto Vigía implementaron el proyecto piloto "Vigilancia del Síndrome Febril Icterohemorrágico" el cual investiga, diagnostica y desarrolla propuestas de medidas de control y prevención para las enfermedades emergentes y reemergentes que cursen con Síndrome Febril Hemorrágico agudo (SIH) en 4 zonas piloto: Valles de La Convención, Río Apurímac, Chanchamayo y Tingo María. En estudios serológicos realizados en el INS dentro de la Vigilancia del Síndrome Febril Icterohemorrágico se obtuvo en 51% una etiología conocida (FA, HVB, leptospirosis, entre otras), en tanto que en 49% no se pudo determinar la patología causante de tal padecimiento.
En diferentes áreas de la selva amazónica es importante plantear el diagnóstico diferencial de los cuadros icterohemorrágicos, puesto que en algunos casos por ejemplo se ha visto que se diagnosticó FA en brotes de hepatitis delta, como la ocurrida en Santa Marta, en Labrea y en la selva alta peruana6. La aparición de técnicas de diagnóstico como la inmunohistoquímica han permitido definir el diagnóstico en tejidos hepáticos obtenidos postmortem, así por ejemplo, identificar la presencia del antígeno de superficie HVB en pacientes que habían sido catalogados previamente como FA7.
El objetivo de este estudio es contar con una técnica laboratorial que permita identificar en los tejidos los antígenos de superficie de la HVB y del virus de la FA en pacientes fallecidos con síndrome icterohemorrágico procedentes de varias regiones del país, para ser aplicados en el diagnóstico.
Materiales y métodos
Se revisaron retrospectivamente 55 tejidos hepáticos fijados en formol y embebidos en parafina de pacientes que fallecieron con un cuadro clínico catalogado como síndrome icterohemorrágico, remitidos entre enero 2000 y diciembre de 2001 al Instituto Nacional de Salud (Lima, Perú) y que se encuentran en los archivos del Departamento de Patología. Además, se revisaron las fichas clínico epidemiológicas de los pacientes. La definición de caso fue: fiebre menor de tres semanas de duración, ictericia o hemorragia y ausencia de factores predisponentes conocidos.
Los tejidos fueron sometidos a: 1) estudio histopatológico para el respectivo diagnóstico; y 2) determinación mediante la técnica de inmunohistoquímica (IHQ) en cada tejido de la presencia del antígeno de superficie del HVB con el empleo empleando un anticuerpo monoclonal y un policlonal anti FA.
Para el análisis inmunohistoquímico se realizaron 3 secciones histológicas de cada caso y se colocaron en láminas silanizadas (DAKO # S3003). Luego, las láminas fueron secadas en estufa por 2 horas a una temperatura no mayor de 55ºC, deparafinizadas y rehidratadas hasta agua destilada. Las láminas fueron colocadas en buffer citrato 10 mM (pH 6,0) y llevadas al horno microondas a bajo poder durante 5 minutos por 2 veces. Después, se lavaron y cubrieron con peróxido de hidrógeno al 3% por 15 minutos, transcurrido este tiempo se lavaron nuevamente y se les aplicó el bloqueador de proteínas (DAKO # X0909) por 10 minutos; luego se cubrieron las láminas de cada caso con el anticuerpo monoclonal anti HBsAg (DAKO # M3506) en una dilución de 1:100, y con el anticuerpo policlonal anti fiebre amarilla (fluido ascitico de ratón, donado por el Dr. Robert Shope, UTMB, Galveston), en una dilución 1:600, y con el anticuerpo monoclonal anti FA (CHEMICON # MAB984) en una dilución 1:5000, por 10 minutos, respectivamente. Se lavaron, secaron y se le aplicó una gota de inmunoglobulina antiratón - anticonejo biotinilada (DAKO # K0675) por 10 minutos, seguidamente se lavaron, secaron y se les aplicó una gota del conjugado streptavidin-peroxidasa (DAKO # K0675) por 10 minutos. Nuevamente se lavó, secó y aplicó una gota de la solución sustrato-cromógeno diaminobencidina líquida (DAKO # K3467). Se colocaron en colorante de hematoxilina por aproximadamente 10 segundos y finalmente se deshidrataron y se montaron con Cytoseal 60 (Stephens Scientific # 8310-16).
La positividad estuvo dada por algún grado de tinción marrón en el citoplasma de los hepatocitos, tanto para el antígeno de FA como para HbSAg. En todas las corridas de IHQ se usó un control positivo (un tejido hepático que se sabía era positivo); y dos controles negativos (uno constituido por tejido hepático normal obtenido de necropsia de un paciente con patología no hepática, y otro que era una sección del tejido hepático en estudio en el que se sustituyó el anticuerpo primario con suero no inmune).
Resultados
Inicialmente se incluyeron 55 muestras de pacientes que cumplieron con la definición de caso de los cuales 43 (78%) fueron varones y 34 (62%) tenían edades entre 15 y 44 años. La procedencia de los casos fue la siguiente: 12 (21%) del departamento de Huánuco, 11(20%) Junín, 9(16%) Ucayali, 8(15%) San Martín, 5(9%) Ayacucho 5(9%) Cusco, 2(4%) Madre de Dios y 1(2%) Cajamarca. Las características de las enfermedades de los pacientes incluidos se muestra en la Tabla Nº 1.
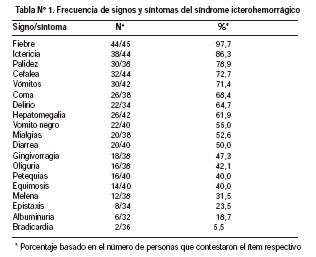
De las 55 muestras recibidas, en 9 no se realizó la prueba de IHQ para FA ni para el HbsAg, debido a que la muestra era inadecuada (malas condiciones de fijación, intestino en vez de hígado). Al analizar los diagnósticos histopatológicos se obtuvo que 33% (15/46) fueron diagnosticados como FA, de los cuales 9 casos fueron positivos por IHQ para FA, siendo dos de ellos también positivos para HBsAg por IHQ. Histológicamente, se reportaron 6 casos (13%) como hepatitis con necrosis submasiva o masiva, lo cual podría corresponder a un tipo de hepatitis fulminante tipo delta, a etapas avanzadas de FA con destrucción casi total del parénquima en donde se pierde el característico patrón de necrosis mediozonal en FA, entre otros. Al examen por IHQ de estos 6 casos, se obtuvo positividad para FA en dos casos, y ninguno dio positividad para HBsAg. En 39% (18/46) no se llegó al diagnóstico etiológico de la hepatitis, sólo se observaron cambios leves inespecíficos como inflamación portal, colestasis leve, congestión vascular, entre otros. Hubieron 2 casos con diagnóstico histopatológico de adenocarcinoma hepático, de los cuales sólo se obtuvo positividad por IHQ para HBsAg en un caso. La Tabla Nº 2 muestra los diagnósticos histopatológicos con relación al resultado de IHQ para fiebre amarilla y para el antígeno de superficie del HVB de los casos estudiados.

Discusión
Muchos estudios han confirmado a la inmunohistoquímica (IHQ) en tejidos fijados en formol y embebidos en parafina, como una herramienta diagnóstica eficaz para la identificación del agente etiológico causante de enfermedades infecciosas8,9. Los antígenos pueden ser demostrados en 80% o más de los especímenes, utilizando tinción de IHQ10, pero teniendo en cuenta que los tejidos deben ser fijados en formol neutro o "bufferado", idealmente en un tiempo no mayor a 24 horas, para evitar que estos fijadores dañen o "enmascaren" los epítopes antigénicos. Si no se dan estas condiciones, un pretratamiento del tejido por digestión con proteasas o con microondas en un buffer adecuado, pueden "desenmascarar" los epítopes. Esta situación posiblemente explique los seis casos histopatológicamente positivos para FA pero que por IHQ resultaron negativos, dado que nosotros recibimos tejidos procedentes de comunidades alejadas en los cuales seguramente estas condiciones no siempre se cumplen. Por ello, para nosotros un resultado positivo por IHQ confirma el diagnóstico, pero un resultado negativo por IHQ en un tejido no tratado idealmente no siempre es definitivo.
Para el diagnóstico de FA por IHQ se utilizó un anticuerpo monoclonal dirigido contra el antígeno E del virus de FA, y también fluido ascítico inmune de ratón (policlonal) para comparar los resultados con ambos. Si bien es cierto que los anticuerpos monoclonales son usualmente superiores a los policlonales, éstos tendrían las siguientes ventajas sobre los primeros: a) la presencia de una mezcla de anticuerpos contra varios epítopes en el policlonal incrementa las posibilidades de unión al antígeno, porque al menos algunos epítopes resistirán el procesamiento del tejido; b) más anticuerpo se depositará por molécula antigénica, incrementando la eficiencia de la detección. En nuestro estudio hubo buena correlación ente los resultados obtenidos con el policlonal y el monoclonal contra el antígeno de FA.
De los 55 casos examinados, histopatológicamente fueron diagnosticados como FA 15 casos, de los cuales sólo nueve dieron positivo para el antígeno de la FA por IHQ, siendo 2 de ellos también positivos para el antígeno de superficie de la hepatitis B. Con esto último, surge la inquietud de investigar si existiría una variación significativa en la sintomatología y tiempo de enfermedad entre los casos de FA y aquellos positivos tanto para FA como para HBsAg. En este caso no encontramos variación significativa, pero para conclusiones estadísticas requerimos de un mayor tamaño muestral. Clásicamente, la FA cursa con fiebre, malestar, postración, anorexia, nauseas y vómitos, cefalea y mialgias en los primeros tres días de enfermedad. A partir del cuarto día se agregan complicaciones hemorrágicas, además de ictericia, oliguria y delirio; y después del 7º día se llega al estupor, coma o hipotensión y shock con anuria1. Revisando la literatura, existe sólo una referencia que data de 1960, la cual sostiene que una situación de portador de la hepatitis B prexistente no afectaría la expresión o severidad de la FA11. Los adultos inmunocompetentes pueden limpiar el HBsAg del suero dentro de los 6 meses en más del 95% de los casos. El estado de portador crónico se define arbitrariamente como la persistencia del HBsAg en suero por más de 6 meses. 70 a 90% de pacientes con infección crónica con el virus de la hepatitis B tienen niveles de aminotransferasas normales, y se les denomina "portadores sanos". El curso clínico de los portadores de HBsAg es generalmente benigno. En un estudio de seguimiento a 69 portadores de HBsAg por 10 años se encontró que sólo uno de ellos desarrolló progresión a estadios más avanzados12. Ninguno desarrolló hepatocarcinoma o falleció de enfermedad hepática. Otro estudio hecho en Austria en portadores de HBsAg mostró que sólo 1,6% de casos desarrollaron hepatitis crónica activa o cirrosis. En dicho estudio, a pesar de la ausencia de síntomas, hallazgos físicos y elevaciones de aminotransferasas, se reportó histología anormal del hígado en 5% de pacientes y uno desarrolló hepatocarcinoma13, lo que llama a alerta en esta situación de portador crónico.
Es importante también destacar el alto porcentaje de casos considerados como "otras hepatitis inespecíficas" (39%). Siendo urgente ampliar nuestras capacidades diagnósticas con IHQ a otros agentes (Hepatitis A, C, leptospira, dengue) que nos permita aclarar la etiología de estas hepatitis. El hecho de que en nuestro territorio suceda que una zona hiperendémica para HVB puede ser también escenario para la presentación de casos de FA, justifica seguir investigando si nuestros resultados concuerdan con lo reportado previamente. Pero, como mencionamos antes, la casuística estudiada es pequeña, más constituye un primer paso para continuar las investigaciones sobre este tema.
Referencias
1. Monath TP. Yellow fever. In: Guerrant RL, Walker DH, Weller PF (eds). Tropical Infectious Diseases. Philadelphia; Churchill Livingstone, 1999. p. 1253-64. [ Links ]
2. Jilbert AR. In situ hybridization protocols for detection of viral DNA using radioactive and nonradioactive DNA probes. Methods Mol Biol 2000; 123: 177-93. [ Links ]
3. Méndez M, Arce M, Kruger H, Sánchez S. Prevalencia de marcadores serológicos de hepatitis vírica en diversos grupos de población del Perú. Bol Of Sanit Panam 1989; 106(2): 127-38. [ Links ]
4. Cabezas C, Suarez M, Romero G. Prevalencia de marcadores serológicos para hepatitis viral B y delta en pueblos indígenas de la Amazonía peruana. Lima: Convenio AIDESEP/Instituto Nacional de Salud; 1997. [ Links ]
5. Hadler SC, Fay OH, Pinheiro F, Maynard JE. La hepatitis en las Américas: Informe del grupo colaborador de la OPS. Bol of Sanit Panam 1987; 103(3): 185-209. [ Links ]
6. Cabezas C, Suárez M, Romero G. Prevalencia de marcadores serológicos para hepatitis viral B y delta en pueblos indígenas de la amazonía peruana. Lima: Instituto Nacional de Salud; 1997. [ Links ]
7. Torres JR, Machado I. Special aspects of hepatitis B virus and delta virus infection in Latin America. Infect Dis Clin North Am 1994; 8: 13- 27. [ Links ]
8. Walker DH, Hui-Min Feng, Ladner S. Immunohistochemical diagnosis of typhus rickettsioses using an anti-lipopolysaccharide monoclonal antibody. Mod Pathol 1997; 10: 1038-42. [ Links ]
9. Walker DH, Hudnall SD, Szniawski WK, Feng H-M. Monoclonal antibody- based immunohistochemical diagnosis of rickettsialpox: the macrophage is the principal target. Mod Pathol 1999; 12: 529-34. [ Links ]
10. Goodman Z. Viral hepatitis. In: Pathology of infectious diseases. Connor DH, Chandler FW, eds. Stamford, Connecticut; Appleton & Lange; 1997.p. 365-82. [ Links ]
11. Tiggert WD, Berge TO, Gochenour WS. Experimental yellow fever. Trans N Y Acad Sci 1960; 22: 323. [ Links ]
12. De Franchis R, Meucci G, Vecchi M. The natural history of asymptomatic hepatitis B surface antigen carriers. Ann Intern Med 1993; 118: 191. [ Links ]
13. Dragosics B, Frenci P, Hitchman E. Long-term follow-up study of asymptomatic HBsAg-positive voluntary blood donors in Austria: a clinical and histologic evaluation of 242 cases. Hepatology 1987; 7:302. [ Links ]














