Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.20 n.1 Lima ene./mar. 2003
Rol de las proteínas no estructurales en los eventos de replicación del ARN del virus dengue: propuesta de un modelo de replicación del ARN
Carlos Yábar V1
1División de Biología molecular. Centro Nacional de Salud Pública. Instituto Nacional de Salud, Lima, Perú.
Resumen
Un modelo ilustrativo de los procesos de replicación para el virus dengue y flavivirus en general ha sido diseñado con base a datos experimentales publicados en los últimos diez años. El modelo propone cuatro pasos bien definidos durante el proceso de replicación de ARN: 1) circularización del ARN viral mediada por un stem-loop del extremo 3' y la región 5' terminal TR, 2) linearización y síntesis de la forma intermedia replicativa mediada por el complejo NS3-NS5 y la glicoproteína NS1, 3) cambio de estado de NS5 a la forma rígida para la síntesis de formas replicativas y 4)Desensamblaje del sistema de replicación NS3-NS5 mediado por fosforilación y la unión específica de NS5 con un receptor beta de la importina. Este modelo podría ser útil para el planteamiento de nuevos trabajos de investigación destinados al estudio de la replicación en flavivirus.
Palabras clave: Dengue / genética; reacción en cadena por la polimerasa; Replicación viral (fuente: BIREME).
Abstract
An illustrative model for dengue virus and flavivirus replication has been designed on the basis of experimental data published in the last ten years. Four very well defined steps during the RNA replication are proposed in this model: 1) Viral RNA circularization through the stem-loop of the 3´ ending and the 5´ TR terminal region, 2) linearization and synthesis of the intermediate replicative form through NS3- NS5 complex and NS1 glycoprotein, 3) change to the rigid form of the NS5 structure for the synthesis of replicative forms, and 4) NS3- NS5 replicative system disassembly through fosforilation and NS5 specific binding with an importine Beta receptor. This model could be helpful for outlining new research on flavivirus replication.
Keys word: Dengue / genetics; Polymerase chain reaction; Virus replication (source: BIREME).
Introducción
Hasta la fecha se han realizado una serie de investigaciones destinadas a la comprensión de los procesos moleculares de replicación del ARN del virus dengue y flavivirus, en general. Sin embargo, no existe un modelo ilustrativo que resuma de manera general toda la información obtenida sobre los procesos de replicación del ARN en flavivirus. En el presente trabajo se ha intentado unir dicha información para proponer un modelo que resuma los procesos involucrados en la replicación del ARN viral. A continuación, se hace una pequeña revisión del virus dengue en general, los principales trabajos experimentales relacionados a la replicación del ARN tanto en el virus dengue como en otros flavivirus para finalmente proponer un modelo de replicación del ARN viral.
La enfermedad
El Dengue es una enfermedad causada por un virus perteneciente a la familia Flaviviridae, el cual es transmitido al hombre a través de la picadura de un mosquito del género Aedes. Una vez manifestada la enfermedad, el agente etiológico determinará el tipo de dengue ocurrente en el individuo mediante uno de sus cuatro serotipos antigénicamente distintos, denominados serotipos 1,2,3 y 41. La enfermedad del dengue, generalmente emerge en regiones tropicales y subtropicales, como el sudeste asiático y el pacífico occidental, donde la humedad, el calor y los reservorios naturales representan los elementos vitales para el desarrollo del vector y en consecuencia, la transmisión del virus1, 2.
Las manifestaciones de la enfermedad del dengue están bien caracterizadas y se presentan bajo diferentes cuadros clínicos conocidos como dengue clásico o benigno (DC), dengue hemorrágico (FHD) y el síndrome del shock por dengue (SSD).
En el Perú se han reportado casos de dengue clásico por los serotipos 1 y 2 desde 1953 principalmente en zonas de selva alta, baja y costa norte del país3. Sin embargo, no es hasta el año 2000 en que se empezaron a reportar casos de FHD y SSD. Posteriores análisis de cultivo viral y RTPCR determinarían la presencia de los cuatro serotipos de dengue y la circulación de la variante asiática de dengue 24.
El virus dengue
El virus del dengue es un miembro de la familia Flaviviridae del género flavivirus5. Presenta un genoma de ARN de cadena positiva y una membrana de naturaleza lipídica, que envuelve completamente al virión. Físicamente, el virus es circular, con un tamaño que varía de 40 a 50 nm de diámetro, presentando pequeñas proyecciones superficiales de 5 a 10 nm 6-8.
El genoma del virión tiene un tamaño de aproximadamente 11Kb y codifica para una simple poliproteína, la cual sufre diversos procesos de corte para generar proteínas virales individuales. Las tres proteínas estructurales (C, M y E) están localizadas en el extremo aminoterminal, mientras que las proteínas no estructurales (NS1, NS2A, NS2B, NS3, NS4A, NS4B,NS5) están en el extremo carboxilo de la poliproteína3(Figura N°1).

El genoma de ARN del virus dengue y de todos los flavivirus, tiene por característica presentar un cap (capucha) en su extremo 5' (m7GpppAmp) y carecer de un tracto poliadenilado en su extremo 3' 6. Presenta además un marco de lectura abierto (ORF: Open read frame por sus siglas en inglés) que varía en tamaño de acuerdo con cada serotipo del virus, incluso entre un mismo serotipo.
A continuación se mencionarán los antecedentes de las investigaciones realizadas sobre la replicación del virus dengue así como también de otros flavivirus.
Replicación del virus dengue
Formas replicativas
El virus Dengue inicia el proceso de replicación mediante la síntesis de la hebra negativa complementaria, la que utiliza como molde para la producción de nuevas moléculas de ARN positivo. Estas últimas hebras actúan como un ARN mensajero para la traducción de la poliproteína, o bien como un molde para la síntesis de la hebra negativa o simplemente para ser encapsidada dentro del virión6,8. Este proceso de replicación es de carácter semiconservativo, pues involucra intermediarios replicativos (RIs) y formas replicativas (RFs). Las RFs son definidas como moléculas de ARN de doble cadena; mientras que las RIs son moléculas de ARN de simple cadena nacientes6. Tanto las RIs como las RFs pueden ser detectadas en células infectadas o en reacciones de ARN polimerasa in vitro3.
Estudios en virus dengue 2 han sugerido la presencia de un mecanismo involucrado en la regulación de replicación entre las hebras de ARN positivas y sus complementarias. Esta sugerencia manifestada por Chambers6, encuentra apoyo por la existencia de una tasa de síntesis continua de hebras positivas y negativas, en las cuales hay una relación de 10 a 1 respectivamente de manera conservada, a diferencia de los alfavirus cuya síntesis de hebras negativas es interrumpida. Interesantes trabajos de investigación revelaron la implicancia de las proteínas NS3 y NS5 en la replicación de virus dengue y de los flavivirus en general, principalmente en la síntesis de la hebra negativa complementaria y en el paso de formas replicativas (RF) a intermediarios replicativos (RI)10-12. La presencia de doble hebras de ARN ha sido localizada mediante estudios de fraccionamiento celular específicamente en las membranas del retículo endoplásmico perinuclear6.
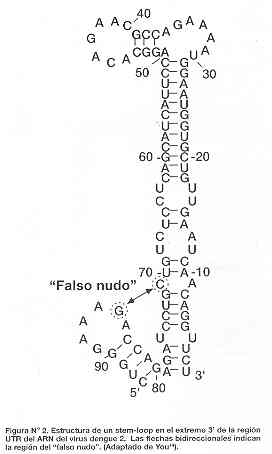
La presencia de regiones terminales 5' y 3' son también importantes en los procesos de replicación del ARN porque contienen motivos complementarios que favorecen el estado cíclico del genoma viral, así también estructuras en asa ("stem-loop"). Sin embargo, esta región requiere la presencia de la región 3' no traducible (3'-UTR) lugar por donde se originaría la fase de elongación para dar lugar moléculas de ARN de doble hebra13. Estos datos sugieren la importancia de la interacción entre ambos extremos del genoma para dar inicio a la replicación del ARN por la replicasa del virus. Recientemente se descubrió que dos motivos que generan el estado cíclico del genoma denominados CYC son importantes para la interacción física entre 5'-TR y 3'-UTR. La presencia de estructuras terciarias dentro del "stem-loop" denominadas "falsos nudos" y originadas por un falso contacto entre dos nucleótidos de guanina y citosina también cumplen un rol esencial durante la replicación del ARN, principalmente en la síntesis de ARN de cadena negativa14. (Figura N°2)
Rol de proteínas no estructurales durante la replicación del ARN viral
Las evidencias experimentales sugieren que existen tres proteínas entre los flavivirus que son muy importantes durante el proceso de replicación del ARN y que se denominan NS1, NS3 y NS5. Es preciso señalar que las funciones específicas de NS3 y NS5 se encuentran dilucidadas en aproximadamente 100%. Este no es el caso de la proteína NS1, de la cual se han realizado una serie de investigaciones, las que no llegaron ha demostrar fehacientemente un rol claro de esta glicoproteína durante los procesos de replicación.
A continuación se hará referencia de cada uno de los estudios realizados en las proteínas anteriormente mencionadas y se intentará ilustrar un mecanismo de replicación del virus dengue que podría ser extrapolado para la mayoría de los flavivirus.
La proteína NS3
NS3 es una proteína de aproximadamente 618 a 623 aminoácidos, que presenta un peso molecular de 68 K Da15. Se caracteriza por ser trifuncional ya que es una proteína que presenta actividad NTPasa, helicasa y serinaproteasa. Estas características enzimáticas sugirieron que NS3 presentaba un rol importante durante los eventos de síntesis de ARN viral conjuntamente con la ARN polimerasa del virus denominada NS56.
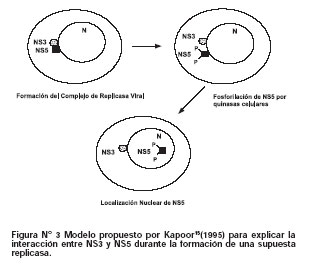
En ese sentido, se observó que NS3 mediaba el paso de la forma replicativa (RF) del ARN del virus dengue 2 a la forma intermedia de replicación12. Del mismo modo, sólo cuando NS5 pasaba a su forma defosforilada citoplasmática se observaba una co-inmunoprecipitación con NS3, lo cual sugirió que la fosforilación de NS5 era importante para interrumpir su interacción con NS315(Figura N°3).
La interacción NS3-NS5 podría estar relacionada a la unión de NS3 con las formas replicativas del ARN durante la síntesis del genoma viral y de su activación por NS5 misma. Recientes estudios usando ensayos de Band shift han demostrado que NS3 de dengue 1 puede formar un complejo con la región 3' no codificante del genoma viral, específicamente en una estructura en forma de asa (stem-loop).
Con respecto a su actividad NTPasa, se observó que mostraba preferencia por sustratos de ribonucleósidos trifosfatos aunque en diferente grado de afinidad, especialmente por nucleótidos de purina (ATP,GTP). De manera interesante, la hidrólisis de ATP experimentó una aumento del 25% en presencia de NS5. Estos datos sugieren que la actividad NTPasa de NS3 puede ser regulada por NS5 durante la replicación.
La proteína NS5
NS5 es una proteína que presenta entre 900 a 905 aminoácidos con un peso molecular entre 104 a 106 kDa. Se caracteriza por presentar un motivo Gly-Asp-Asp similar a otras ARN polimerasas de otros virus de ARN de cadena positiva. La proteína recombinante presenta actividad ARN polimerasa ARN dependiente, la cual es inhibida por anticuerpos anti-NS5 en más del 99%. Asimismo, se ha demostrado que puede generar ARN de doble hebra mediante al síntesis de ARN de sentido negativo y el ARN molde de sentido positivo11.
Ensayos de sistemas in vivo e in vitro han demostrado que NS5 presenta un linker de 37 aminoácidos X2KKX14KKKX11RKX3 ubicado entre los residuos 369 al 405. Este linker contiene una secuencia de localización nuclear (NLS) reconocida por subunidades del complejo de beta importina-NLS16. De manera interesante, esta región es también sitio de asociación de NS5 con NS3 para formar el complejo replicasa. Este suceso ocurre por una interacción entre la región C-terminal de NS3 (residuos 303-618) con la región N-terminal región de NS5 (residuos 320-368)17. Como se mencionó anteriormente, la interacción de NS5 con NS3 y su importación al núcleo también podría ser un proceso regulado por reacciones de hiperfosforilación, desde que se encontraron especies libres de NS5 en estado fosforilado a nivel nuclear15. Es probable que la interacción de NS5 con NS3 sea importante debido a que este proceso permite que la ARN polimerasa se ubique a nivel perinuclear (Figura N°3) donde normalmente se llevan a cabo los procesos de "capping" y replicación viral.
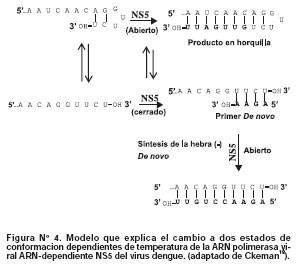
Recientemente, se ha descubierto que la forma recombinante de NS5 de dengue 2 puede catalizar la síntesis de ARN de novo y la enlogación desde el extremo 3' del ARN molde18. Este proceso es dependiente de la conformación de la proteína, la cual se puede encontrar en un estado "rígido o cerrado" (a bajas temperaturas) y un estado "móvil o abierto" (a altas temperaturas). Ambos estados se encuentran en equilibrio, sin embargo, generan productos distintos. Cuando la enzima se encuentra en estado abierto generalmente se forman muy pocos oligonucleótidos de ARN, lo cual conlleva a que NS5 se una al extremo 3' en doblez hacia atrás del ARN (Figura N°4). Este proceso se produce a altas temperaturas (< 38°C) dando origen a moléculas de ARN de cadena doble. En contraste, a bajas temperaturas (> 28°C), la enzima se encuentra es un estado rígido y está imposibilitada de unirse a la estructura doblada hacia atrás del ARN, en consecuencia se une eficientemente a la hebra simple del ARN molde dando como producto hebras de sentido negativo. (Figura N°4).
La proteína NS1
NS1 es una glicoproteína de peso molecular comprendido entre 42 y 50 kDa conteniendo un marco de lectura de aproximadamente 353 a 354 aminoácidos. El gen que la codifica no presenta codón de inicio ni de finalización y la estructura molecular de la proteína generalmente es dimérica19. Su función específica no está muy bien dilucidada; sin embargo, algunos estudios han asociado a la glicoproteína NS1 con el ensamblaje y maduración del virión8,20, asimismo, le fue atribuida la función de "chaperona" durante el ensamblaje del virus dengue, en el "encapuchamiento" del genoma21 y la replicación del ARN viral en diferentes flavivirus22-24.
Sin embargo, existen mayores evidencias experimentales que sugieren que NS1 podría cumplir un rol importante durante la replicación del virus. Mutaciones dirigidas a sitios específicos de la región codificante 3' y el sitio de corte de NS1/2A generaron una importante reducción en la replicación del virus dengue 4, produciendo su atenuación19.
Asimismo, Mackenzie22(1996) demostró la coubicación de NS1 con las formas replicativas de ARN viral de doble hebra. Mediante ese estudio también se determinó que NS1 no cumplía función de "chaperona" o asociada a partículas virales maduras.
Otros estudios usando mutantes de NS1 sensibles a la temperatura descubrieron una implicancia de esta glicoproteína en la replicación temprana, debido a que la acumulación de ARN durante la replicación fue bloqueada a una temperatura no permisiva para la proteína mutada23.
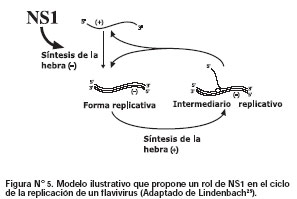
De manera interesante, un estudio determinó que el gen NS1 del virus dengue fue incompatible durante los procesos de replicación de ARN del virus de la fiebre amarilla, dado que su reemplazo conllevó a una carencia de acumulación de ARN de sentido negativo25. Estos datos no sólo demuestran que NS1 de dengue no puede interactuar con la maquinaria de replicación del virus de la fiebre amarilla, sino también esta proteína es requerida para la síntesis inicial de la hebra negativa (Figura N°5).
Los mismos autores de este trabajo demostrarían más adelante mediante generación de mutaciones puntuales en NS1, que existe una relación funcional entre NS1 y el componente de la replicasa transmembranal NS4A del virus de la fiebre amarilla24.
Evidencias experimentales de ensayos de co-localización de proteínas no estructurales en el virus Kunjin, indicaron que NS1, NS2B y NS3 se hallaban relacionados a formas de doble hebra de ARN. Las técnicas de inmunofluorescencia indirecta y microscopía inmunoelectrónica permitieron dilucidar que todo ese complejo se localizaba en la región perinuclear5.
Por otro lado, cabe señalar que en algunos flavivirus, la forma dimerizada de NS1 es importante durante los procesos de replicación. Mutantes de NS1 del virus Kunjin con una mutación en la posición 250 de leucina por prolina generó una disminución tanto de la replicación como de la virulencia26.
Otro estudio de mutagénesis en el cual se eliminó uno o los dos sitios de glicosilación de NS1 en el virus de la fiebre amarilla decreció el título de partículas virales infectantes, redujo el efecto citopático, disminuyó la acumulación de NS1 propiamente dicho y causó una depresión en la acumulación de ARN27. Este hallazgo sugiere que la integridad molecular de NS1 es importante para la síntesis de ARN viral y en consecuencia para la formación de nuevas partículas virales. En consecuencia, NS1 se debe mantener conservada, tanto a nivel genético como proteína, ya que modificaciones o cambios de residuos aminoacídicos en sus estructura molecular podrían generar una alteración en la integridad de la proteína y consecuentemente modificar la capacidad de replicación del virus dengue. Recientemente hemos demostrado la presencia de mutaciones puntuales importantes en la secuencia de aminoácidos de NS1 a partir de un aislamiento de dengue responsable de producir la forma clásica o benigna de la enfermedad, en comparación con otras secuencias de NS1 de cepas virales que generaron dengue hemorrágico28. Probablemente, algunas mutaciones genéticas en NS1 podrían están relacionadas en definir el comportamiento patogénico de un determinado agente infeccioso y desencadenar la forma benigna o maligna de la enfermedad. Sin embargo, otras proteínas virales, así como también diferentes factores ambientales y del hospedero, también podrían estar relacionados. En consecuencia, se requiere realizar mayores estudios para dilucidar estas hipótesis.
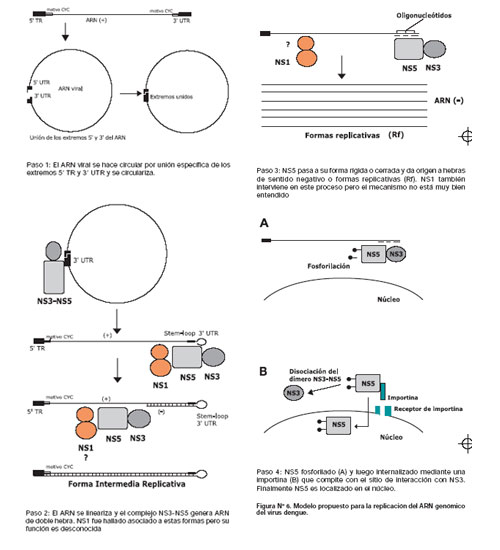
Reconstrucción del proceso de replicación
En un intento por armar el "rompecabeza" del sistema de replicación del virus dengue, se ha utilizado la información necesaria anteriormente mencionada para reconstruir cada uno de los pasos necesarios que ocurren en el sistema de replicación del ARN viral. (Figura Nº 6) Es importante mencionar que la replicación del ARN del virus dengue y de los flavivirus en general involucra tanto procesos termodinámica a nivel de ARN como eventos bioquímicos y moleculares entre las proteínas no estructurales NS1, NS3 y NS5. De todas ellas, sólo NS3 y NS5 van a intreractuar formando un complejo replicasa, mientras que NS1, podría al parecer interactuar con una región específica del ARN viral. En un primer paso del proceso de replicación se originan formas circulares del genoma viral por interacción del extremo 5´-TR con el extremo 3' UTR, el cual es un proceso favorecido por motivos complementarios CYC localizados en ambos extremos. Este proceso es importante para la generación de RIs favorecido por la presencia de un extremo stem-loop 3'. Es probable que la forma circular se haga "lineal" por acción de la actividad helicasa de NS3.intermediarios replicativos (RIs) y formas replicativas (Rfs) predominando las Rfs en cantidades diez veces más que RIs. Este proceso ocurre específicamente en el aparato de Golgi.
El segundo paso comprende la linearización del ARN, el cual como se explicó anteriormente podría ocurrir por acción de NS3. Una vez que se ha llevado a cabo este proceso, el extremo stem-loop 3' el cual se presenta "doblado hacia atrás" se une el complejo NS3-NS5. Para que ocurra la elongación a partir de este doblez es importante que NS5 esté en un "estado abierto o móvil" originandose RIs. Durante este proceso NS1 cumple un rol aún desconocido probablemente formando parte del complejo de elongación para formar las Rf. Sin embargo, no existen evidencias que demuestren que NS1 se una al complejo NS3-NS5, por lo que probablemente su interacción sea a nivel de ARN. Durante el proceso de incorporación de nucleótidos se activa el sitio activo de la NTPasa NS3 por un mecanismo enzima-sustrato, el cual ocurre a nivel perinuclear.
En un tercer paso, NS5 pasa a su estado "rígido o cerrado", en ese momento deja de unirse al extremo 3' stem-loop, para localizarse por mediación de pequeños oligoniucleótidos, en el extremo 3' de la hebra positiva dando origen a los RF, proceso por el cual ocurre en complejo con NS3. En vista que la proporción de Rf es mayor que RI, probablemente el estado rígido sea el predominante durante los procesos de replicación, sin embargo no existen evidencias experimentales que lo demuestren. Durante el proceso de síntesis de hebras negativas NS1 conjuntamente con otra proteína trasmembranal NS4A, van a cumplir una participación que hasta el momento es desconocida. Sin embargo, es importante señalar que durante estos sucesos NS1 se encuentra en su forma dimérica, una conformación que permite su secresión y maduración hacia la membrana del virus.
Finalmente, en el cuarto paso, la interacción de NS3-NS5, la cual ocurre entre una región de 37 aminoácidos localizado en la región aminoterminal de NS5 y una porción de 315 aminoácidos del extremo C-terminal de NS3, es abolida por acción de un proceso de fosforilación. Este proceso favorece que NS5 reconozca receptores beta importina generando su localización en el núcleo.
Conclusión
Las evidencias experimentales de trabajos de investigación realizados a nivel de dengue y flavivirus han permitido proponer un modelo de replicación del ARN viral. Es importante mencionar que hasta el momento no se ha ilustrado la replicación de ARN en el virus dengue y en flavivirus en general usando las últimas referencias bibliográficas.
Sin bien es cierto que este modelo propone diferentes pasos durante el proceso de replicación, no significa que esté totalmente completo, ya que se debe tomar en cuenta la falta de investigaciones necesarias para explicar algunos pasos relevantes del proceso de replicación.
Es importante resaltar que NS3 y NS5 interactúan formando un complejo de replicación del ARN y que dicho complejo está implicado en la síntesis, elongación, e hidrólisis del ARN en la mayoría de los flavivirus tal como fue demostrado por diferentes autores15,17,18. La formación de este complejo ha sido demostrado in vitro usando el sistema de doble híbrido en levadura17, por lo tanto no se descarta la posibilidad que otras moléculas in vivo también podrían interactuar con este complejo o formar parte de él, como es el caso de la proteína NS1. De hecho, algunas evidencias sugieren que la proteína NS1 podría formar parte de este complejo de replicación tanto en la fase de produción de Rf como de RI24. Sin embargo, la formación de este posible complejo trimérico y el destino final de NS1 aún no ha sido demostrado.
En síntesis, existe un real protagonismo de NS3 y NS5 en la replicación del material genético del virus dengue, pero la función directa de NS1 en este proceso aún permanece por dilucidar. Por lo tanto, es necesario realizar más estudios que permitan resolver muchas interrogantes en todo el proceso de replicación del virus dengue en general. A continuación, se plantean algunas preguntas surgidas a partir de esta revisión y que podrían ser utilizadas como tentativas de investigación: ¿Qué relevancia tiene la forma cíclica del ARN durante la fase de replicación? ¿La unión de NS3 con NS5 genera algún cambio conformacional en algunas de las proteínas involucradas? ¿Cuán significante podría ser este cambio y que efecto tendría sobre la funcionalidad de NS3 o NS5? ¿Existe algún cofactor que genere la forma rígida o la cerrada" de NS5? ¿Qué cambios ocurren a nivel de su estructura cristalizada? ¿De qué manera NS1 actúa durante la sintesis de las Rf? ¿Existe alguna interacción entre NS1 y el ARN viral? ¿Existe alguna interacción entre NS1 y el complejo replicasa NS3-NS5? ¿Qué otras proteínas no estructurales podrían estar involucradas en este proceso? ¿Cuál es la importancia de la localización de NS5 en el núcleo celular?.
Referencias
1. World Health Organization. Dengue. Weekly Epidem Rec 1981; 56: 398. [ Links ]
2. Pan American Health Organization. "Dengue in the Caribbean" Washington D. C.: PAHO; 1979. [ Links ]
3. Ministerio de Salud. Componentes de las normas para la prevención y control del dengue. En: Normas para la prevención y control del dengue. Lima: OGE/MINSA; 1990. [ Links ]
4. Mostorino R, Montoya Y, Anaya E, Mamani E, Gutiérrez V, Cobos M, et al. Dengue: una enfermedad reemergente en el Perú. Bol - Inst Nac Salud 2001; 7(1-5): 7-8. [ Links ]
5. Westaway EG, Brinton MA, Gaidamovich S Ya, Horzinek MC, Igarashi A, Käariäinen L, et al. Flaviviridae. Intervirol 1985; 24: 183-92. [ Links ]
6. Chambers T, Hahn C, Galler R, Rice C. Flavivirus genome organization, expression, & replication. Ann Rew Microbiol 1990; 44: 649- 88.
7. Putnak R, Feighny R, Burrous J, Cochran M, Hackett C, Smith G. Dengue-1 virus envelope glycoprotein gene expressed in recombinant baculovirus elicits virus-neutralizing antibody in mice and protects them from virus challenge. Am J Trop Med Hyg 1991; 45(2): 159-67.
8. Rice C. Flaviviridae: The viruses and their replication. In: Fields BN, Kripe DM; Howley PM. Fields Virology. New York: 3rd Raven Press; 1996.
9. Zhang Y, Hayes E, McCarty T, Dubois D, Summers P, Eckels K. Inmunization of mice with dengue structural proteins and nonstructural protein NS1 expresed by Baculovirus recombinant induces resistance to Dengue virus encephalitis. J Virol 1988; 62: 3027-31.
10. Raviprakash K, Sinha M, Hayes CG, Porter KR. Conversion of dengue virus replicative form RNA (RF) to replicative intermediate (RI) by nonstructural proteins NS-5 and NS-3. Am J Trop Med Hyg 1998; 58(1): 90- 5.
11. Tan B-H, Fu J, Sugrue RJ, Yap E-H, Chan Y-CH, Tan YH. Recombinant Dengue Type virus NS5 protein expresed in Escherichia coli exhibits RNA-dependent RNA polymerase acitivity. Virol 1996; 216: 317-25.
12. Bartholomeusz AI, Wright PJ. Synthesis of dengue virus RNA in vitro: Initiation and the involvement of proteins NS3 and NS5. Arch Virol 1993; 128: 111-21.
13. You S, Padmanabhan R. A novel in vitro replication system for dengue virus. Initiation of RNA synthesis at the 3'-end of exogenous viral RNA templates requires 5'- and 3'-terminal complementary sequence motifs of the viral RNA. J Biol Chem 1999; 274(47): 33714-22.
14. You S, Falgout B, Markoff L, Padmanabhan R. In vitro RNA synthesis from exogenous dengue viral RNA templates requires long range interactions between 5'- and 3'-terminal regions that influence RNA structure. J Biol Chem 2001; 276(19): 15581-91.
15. Kapoor M, Zhang L, Ramachandra M, Kusukawa J, Ebner KE, Padmanabhan R. Association between NS3 and NS5 proteins of dengue virus type 2 in the putative RNA replicase is linked to differential phosphorylation of NS5. J Biol Chem 1995; 270(32): 19100-6.
16. Forwood JK, Brooks A, Briggs LJ, Xiao CY, Jans DA, Vasudevan SG. The 37-amino-acid interdomain of dengue virus NS5 protein contains a functional NLS and inhibitory CK2 site. Biochem Biophys Res Commun 1999; 257(3): 731-7.
17. Johansson M, Brooks AJ, Jans DA, Vasudevan SG. A small region of the dengue virus-encoded RNA-dependent RNA polymerase, NS5, confers interaction with both the nuclear transport receptor importin-beta and the viral helicase, NS3. J Gen Virol 2001; 82(Pt 4): 735-45.
18. Ackermann M, Padmanabhan R. De novo synthesis of RNA by the dengue virus RNA-dependent RNA polymerase exhibits temperature dependence at the initiation but not elongation phase. J Biol Chem 2001 276(43): 3926-37.
19. Rice CM, Strauss EG, Strauss JH. Structure of the flavivirus genome. In: Schlesinger S, Schlesinger MJ, The togaviridae and flaviviridae, New York: Plenum Press; 1986 .p. 279-326.
20. Mason P.W. Maduration of Japanese encephalitis virus glycoproteins produced by infected mammalian and mosquito cells. Virol. 1989; 173: 354-364.
21. Crooks A, Lee J, Easterbrook L, Timofeev A, Stephenson J. The NS1 protein of tick-borne encephalitis virus forms multimeric species upon secretion from the host cell. J Gen Virol 1994; 75: 3453-60.
22. Mackenzie JM, Jones MK, Young PR. Inmunolocalization of the dengue virus nonstructural glycoprotein NS1 suggest a role in viral RNA replication. Virol 1996; 220(1): 232-40.
23. Muylaert I, Galler R, Rice C. Genetic analysis of the yellow fever virus NS1 protein: identification of a temperature- sensitive mutation wich blocks RNA acumulation. J Gen Virol 1997; 71 (1): 291-8.
24. Lindenbach BD. Rice CM. Genetic interaction of flavivirus nonstructural proteins NS1 and NS4A as a determinant of replicase function. J Virol 1999; 73(6): 4611-21.
25. Lindenbach BD, Rice CM. Trans-complementation of yellow fever virus NS1 reveals a role in early RNA replication. J Gen Virol 1997; 71(12): 9608-17
26. Hall RA, Khromykh AA, Mackenzie JM, Scherret JH, Khromykh TI, Mackenzie JS. Loss of dimerization of the nonstructural protein NS1 of Kunjin virus delays viral replication and reduces virulence in mice, but still allows secretion of NS1. Virol 1999; 264(1): 66-75.
27. Muylaert IR, Chambers TJ, Galler R, Rice CM. Mutagenesis of the N-linked glycosylation sites of the yellow fever virus NS1 protein: effects on virus replication and mouse neurovirulence. Virol 1996; 222(1): 159-68
28. Yábar C. Caracterización molecular de la secuencia parcial del gen de la glicoproteína NS1 del virus dengue 1 proveniente de Máncora, Peru. Rev Med Exp 2000; 18 (1-4): 35-8.