Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.20 n.2 Lima abr./jun. 2003
TRABAJOS ORIGINALES
Detección rápida de resistencia a drogas en Mycobacterium tuberculosis mediante PCR-SSCP y PCR- Heteroduplex
Róger Calderón E1; Luis Asencios S2; Neyda Quispe T2; Walter Custodio G3; Ysabel Montoya P1
1 Laboratorio de Biotecnología y Biología Molecular Instituto Nacional de Salud. Lima, Perú.
2 Laboratorio de Micobacterias Instituto Nacional de Salud. Lima, Perú.
3 Laboratorio de Microbiología Hospital Nacional Sergio Bernales. Lima, Perú.
RESUMEN
Objetivo: Detectar tempranamente la susceptibilidad a las drogas antituberculosas rifampicina e isoniacida mediante PCR y electroforesis conformacional. Materiales y métodos: Se implementaron dos ensayos de amplificación de los genes rpoB y katG y mediante Heteroduplex y SSCP se determinó la susceptibilidad antituberculosa de 31 muestras clínicas procedentes de pacientes con diagnóstico de tuberculosis pulmonar baciloscopía positiva. La caracterización fenotípica de la susceptibilidad, se realizó empleando el método de las proporciones. Resultados: Los ensayos de PCR detectaron hasta 2,5 pg de ADN genómico de M. tuberculosis; no amplificando ADN de otras micobacterias y bacterias comunes de la flora bucal. Se encontró una concordancia general entre la detección molecular y convencional de la susceptibilidad a rifampicina e isoniacida de 96,7% y 83,9% (p<0,05), respectivamente. Sin embargo, sólo en pacientes con antecedente de tratamiento se presentó una concordancia del 100% y 90,9% (p<0,05) para rifampicina e isoniacida, respectivamente. Además, este sistema de detección de resistencia puede emitir resultados 48 horas después de la recepción de la muestra clínica. Conclusiones: Estos sistemas se presentan como una excelente alternativa para la identificación temprana de pacientes infectados con bacilos de M. tuberculosis drogoresistentes. Potencialmente, se podrán dirigir óptimos y oportunos esquemas terapéuticos que contribuirán con el control y prevención de la transmisión de cepas multidrogo-resistentes que afectan en gran medida a la salud pública de nuestro país.
Palabras clave: PCR; Heteroduplex; PCRS; Tuberculosis; Resistencia; Rifampin; Isoniacida. (Fuente: BIREME)
ABSTRACT
Objective: Early detection of Mycobacterium tuberculosis susceptibility to two anti tuberculous drugs,rifampin and isoniazid using PCR and conformational electrophoresis. Material and methods: Two amplification assays were implemented for the rpoB and katG genes and susceptibility to antituberculous agents was determined by heteroduplex and SSCP in 31clinical samples obtained from patients with positive smear pulmonar tuberculosis.The phenotypical characterization of susceptibility to antituberculous agents was performed using proportion method. Results: PCR assays detected up to 2,5 pg of M. tuberculosis genomic DNA, no amplifications of DNA of other mycobacteria and common bacteria of buccal flora was performed. The general concordance between the molecular and conventional detection of rifampin and isoniazid susceptibility was 96,7% and 83,9% (p<005) respectively. However, a 100% and 90,9% concordance (p<0,05) for rifampin and isoniazid respectively was found only in patients who received previous treatment. Moreover, this resistance detection system can give results 48 hours after the clinical sample is obtained. Conclusion: These systems showed to be an excellent diagnosis alternative for the early identification of patients infected with drugresistant Mycobacterium tuberculosis.
It will potentially allow the use of timely and optimal treatment schemes that may contribute to the control and prevention of multidrug-resistant strains that affect public health in our country.
Key Words: PCR; Heteroduplex; SSCP; Tuberculosis; Resistance; Rifampin; Isoniazid. (Source: BIREME)
INTRODUCCIÓN
En los últimos años, la tuberculosis (TB) ha reemergido como una de las principales causas del incremento de las tasas de morbi-mortalidad en el mundo, con cerca de tres millones de muertes anuales 1 . Este hecho es debido a su pobre manejo, regímenes incorrectos e incumplimiento de los tratamientos 2 que vienen contribuyendo con la aparición de la resistencia a las drogas antituberculosas 1 . Otros factores importantes en el desencadenamiento de la enfermedad, lo constituyen la diseminación del HIV-SIDA y la inmigración de personas desde áreas de alta incidencia. En el Perú, la TB es un verdadero problema de salud pública; especialmente en Lima y Callao, a pesar de la implementación del DOTS para el tratamiento contra la tuberculosis como uno de los mejores esfuerzos del Programa Nacional de Control de la Tuberculosis. Ello es exhibido por el estudio de vigilancia
de la resistencia a drogas antituberculosas realizado por el Instituto Nacional de Salud en el año 1999 donde muestra que la resistencia y multidrogoresistencia afectan significativamente 3 . La resistencia primaria fue 17,8% y la multidrogoresistencia (MDR) primaria del 3,0%. Por otra parte, la resistencia adquirida fue 23,5%, mientras que la MDR adquirida fue 12,3%.
Los pacientes infectados con Mycobacterium tuberculosis (MTB) resistente a drogas presentan una menor efectividad de curación y la disponibilidad de un tratamiento
individualizado representa un elevado costo colocándose por lo tanto inalcanzable para la población infectada en los países en vías de desarrollo 4 , es así que la identificación temprana de los pacientes resistentes se presenta como una gran meta, dado que los actuales métodos diagnósticos de resistencia no son rápidos, sensibles y costo-efectivos.
Con el advenimiento de la tecnología molecular, muchos sistemas de detección de la drogoresistencia han sido implementados, ofreciendo una mejor información que la obtenida por métodos convencionales, y contribuyendo con la investigación sobre los mecanismos de transmisión de resistencia. Los principales mecanismos se definen por la acumulación secuencial de cambios, inserciones o delecciones nucleotídicas denominadas mutaciones que ocurren en los genes que codifican los elementos blanco de las drogas producidas por una presión selectiva generada por el incorrecto tratamiento 4,5 . La resistencia a rifampicina es debida a la aparición de mutaciones en el gen rpoB y la resistencia a isoniacida es debida a la existencia de mutaciones en los genes katG, ahpC, inhA, kasA, furA y oxyA 5, 6 .
Dado que la aparición de mutaciones sigue un patrón característico, mediante el presente trabajo se detectó tempranamente la resistencia a rifampicina e isoniacida en MTB a través del análisis de los genes relacionados. Para ello se implementó un PCR y posteriormente un análisis electroforético, realizado a partir de muestras clínicas de esputo de pacientes con tuberculosis pulmonar baciloscopía positiva (BK (+)).
MATERIALES Y MÉTODOS
CEPAS BACTERIANAS, MATERIALES Y ENSAYOS GENERALES
La cepa de Mycobacterium tuberculosis H37Rv (ATCC 27294) fue utilizada por su susceptibilidad antimicrobiana a todas las drogas antituberculosas, cuyo fenotipo sensible y su genotipo silvestre es considerado sin mutaciones.
Mycobacterium kansasii y Mycobacterium fortuitum fueron cepas identificadas, caracterizadas en el Laboratorio de Micobacterias del Instituto Nacional de Salud. Las cepas de Klebsiella pneumoniae, Staphylococcus aureus, Brucella sp. fueron identificadas y caracterizadas en la División de Bacteriología del Instituto Nacional de Salud. A partir de un nódulo de piel de un paciente multibacilar con diagnóstico clínico e histopatológico de lepra, fue tomada una biopsia para ser usada como fuente de ADN de Mycobacterium leprae.
Una secuencia mutante del gen rpoB (SGH-rpoB: secuencia generadora de heteroduplex para el gen rpoB) conteniendo delecciones y substituciones nucleotídicas, ha sido clonada en el vector pUC-18 en E. coli.
El ADN genómico de las cepas de las micobacterias no tuberculosas fue obtenido usando el protocolo de extracción con tiocianato de guanidina 8 . Luego, el ADN fue purificado mediante el uso de QIAMPR DNA Mini Kit (QIAGEN Inc. USA) y se almacenaron a –20°C hasta su utilización.
Los análisis electroforéticos fueron realizados en geles de poliacrilamida (PAGE) al 10 y 15% usando buffer TBE 0,6X. Los geles fueron fijados con 10% de ácido acético durante 30 minutos. Luego fueron tratados con nitrato de plata 0,1% y formaldehído 0,56% durante 30 minutos y finalmente revelados con carbonato de sodio 1% en tiosulfato de sodio y formaldehído (0,56%) (Figura N°1).
SELECCIÓN DE PACIENTES
Se incluyeron 31 pacientes con diagnóstico de tuberculosis pulmonar con BK (+) y Cultivo (+) captados por el Programa de Control de Tuberculosis (PCT) de un hospital nacional perteneciente a la Dirección de Salud Lima Norte. Se excluyeron a aquellos pacientes que se encontraban recibiendo algún esquema de tratamiento antituberculoso y con diagnóstico de VIH/SIDA.
DISEÑO DEL ESTUDIO
Estudio descriptivo analítico, en el que la resistencia a drogas fue detectada por el análisis de mutaciones en el gen katG en SSCP (para isoniacida) y en el gen rpoB en heteroduplex (para rifampicina) a partir de muestras de esputo BK (+). La discriminación entre el genotipo resistente y el sensible fue realizada comparando los perfiles problema frente al perfil susceptible del MTB H37RV. Luego se realizó
otra comparación entre los genotipos encontrados y los fenotipos obtenidos con el método de las proporciones.
Además se evaluó la sensibilidad y especificidad del sistema. Finalmente, los valores de concordancia se obtuvieron usando el total de coincidencias determinadas por el método molecular y el convencional, siendo expresados en porcentajes. Los niveles de significancia estadística fueron determinados mediante el uso del programa SPSS v. 10 para windows.
PROCEDIMIENTOS
Baciloscopía, cultivo y susceptibilidad antimicrobiana
Los procedimientos de baciloscopía y cultivo se realizaron siguiendo el método de Ziehl-Nielsen y Ogawa, respectivamente 9 . La determinación de la susceptibilidad antituberculosa fue realizada siguiendo el método de las proporciones de Canetti variante económica 10, para lo cual se usaron las siguientes concentraciones: isoniacida (H) 0,2 ug/mL, estreptomicina (S) 4 ug/mL, rifampicina (R) 40 ug/mL, etambutol (E) 2 ug/mL y como límite de susceptibilidad se utilizó un criterio de resistencia al 1% para todas las drogas.
Preparación de muestras de esputo para PCR
Volúmenes de 500 µL a 1mL de esputo se usaron para realizar una digestión con dos volúmenes de la solución decontaminante (NaOH 4%, N-acetil-L-cisteína 0,5%, citrato de sodio 2,9%) por 20 minutos a temperatura ambiente. Luego, se neutralizó con buffer fosfato 0,067M pH 6,8 y centrifugó a 5000 rpm por 20 minutos a temperatura ambiente. El sedimento fue lavado y resuspendido en 250 µL de buffer fosfato pH 6,8.
Posteriormente, se fijaron los sedimentos mediante la adición de 583 µL de etanol absoluto y se incubaron 1 hora a temperatura ambiente. Después, se centrífugo a 10000 rpm por 10 minutos, el sedimento fue resuspendido en agua y hervido a >95°C durante 10 minutos 11 . Luego, los lisados celulares fueron purificados mediante el uso de QIAMPR DNA Mini Kit (QIAGEN Inc. USA), almacenándose a – 20°C.
REACCIÓN EN CADENA DE LA POLIMERASA (PCR) PARA LA AMPLIFICACIÓN DEL GEN RPOB
Una región de 195 pb del gen rpoB fue amplificada mediante un Heminested-PCR asimétrico 12 utilizando los oligonucleótidos: rpo105, rpo273, rpo293 (Integrated DNA Technologies Inc. Iowa) cuyas secuencias son descritas por Williams 13 . La mezcla de reacción del primer PCR en un volumen final de 25 uL por cada muestra de esputo de cada paciente, estuvo constituida de la siguiente forma: 2,5 mL de buffer 10X; 2 µL de desoxinucleótidos fosfato 2,5 mM; 1,5 µL de MgCl2 25 mM; 1 pmol del oligonucleótido rpo105; 0,125 pmol del oligonucleótido rpo293 y 0,5 U de enzima Taq ADN polimerasa. Las temperaturas usadas para la amplificación fueron: 95°C por 5 minutos, veinticinco ciclos de 95°C por 30 segundos y 72°C por 1 minuto y posteriormente una extensión final de 72°C por 10 minutos.
La mezcla de reacción del segundo PCR fue constituida en un volumen final de 100 µL por cada muestra problema: 7,5 µL de buffer 10X; 6 µL de desoxinucleótidos fosfato 2,5 mM; 4,5 µL de MgCl2 25 mM; 2 pmol de los oligonucleótidos rpo105 y rpo273 y 1 U de enzima Taq ADN polimerasa. Las temperaturas usadas para la amplificación fueron: 95°C por 5 minutos, treinta y cinco ciclos de 95°C por 30 segundos y 75°C por 1 minuto y posteriormente una extensión final de 72°C por 10 minutos.
La amplificación de la secuencia SGH-rpoB fue realizada mediante la siguiente reacción en un volumen final de 100 uL: 10 µL Buffer 10X; 8 µL de desoxinucleótidos fosfato 2,5 mM; 5,5 mL de MgCl 2 25 mM; 2 pmol de cada oligonucleótido rpo105 y rpo273 y 1 U de enzima Taq ADN polimerasa. Las temperaturas de amplificación usadas fueron similares a las del segundo PCR del heminested.
REACCIÓN EN CADENA DE LA POLIMERASA (PCR) PARA LA AMPLIFICACIÓN DEL GEN KATG
Una región de 209 pb del gen katG fue amplificada mediante un PCR utilizando los oligonucleótidos: TB86 Y TB87 (Integrated DNA Technologies Inc. Iowa) cuya secuencia describe Telenti 14 . La reacción del PCR (volumen final 25 mL) estuvo constituida por: 2,5 µL de buffer 10X; 2,0 µL de desoxinucleótidos fosfato 2,5 mM; 1,5 µL de MgCl2 25 mM; 1 pmol de primer TB86 y TB87 y 1 U de enzima Taq ADN polimerasa. Las temperaturas usadas para la amplificación fueron: 95°C por 5 minutos, treinta y cinco ciclos de 95°C por 30 segundos, 60°C por 30 segundos y 72°C por 1 minuto y posteriormente una extensión final de 72°C por 10 minutos14 .
DETECCIÓN DE MUTACIONES MEDIANTE HETERODUPLEX
La formación de heteroduplex se realizó por hibridación de los productos de PCR de cada muestra de esputo (15 µL) y el SGH-rpoB (5 µL) para un volumen final de 20 µL de reacción. Para ello se utilizó un programa del termociclador que consistió en: 5 minutos a 95°C y luego se disminuyó la temperatura hasta 25°C, haciendo que el descenso de cada 5°C tomase un tiempo de 2 minutos y permanezca 30 segundos en cada temperatura 13 . Luego los heteroduplex fueron separados en PAGE 10% no denaturante en TBE 0,6X usando minicámaras de electroforesis (BioRad Life Technologies Inc.) a 150 V y durante 105 minutos.
DETECCIÓN DE MUTACIONES MEDIANTE SSCP
La formación de simples hebras para el SSCP se realizó por la denaturación de 10 µL de producto de PCR de cada muestra, mezclando en buffer-SSCP (Formamida 95%, azul de bromofenol y xilencyanol FF 25 µg/mL, NaOH 10 mM y EDTA 20 mM) en un volumen final de 20 µL. Luego se incubaron a 95ºC por 5 minutos y seguidamente se colocaron en hielo por 5 minutos. Luego el análisis de SSCP fue realizado en geles de electroforesis de poliacrilamida al 15% no denaturantes en TBE 0,6X usando minicámaras de electroforesis (BioRad Life Technologies Inc). Las condiciones de electroforesis fueron 50 V durante 840 minutos.
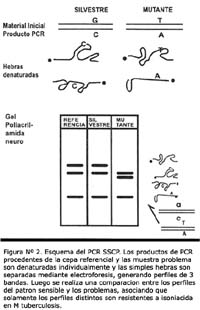
INTERPRETACIÓN DE LOS PERFILES DE PCR-HETERODUPLEX Y PCR-SSCP
Para determinar la susceptibilidad a rifampicina por PCR-Heteroduplex e isoniacida por PCR-SSCP, se compararon los perfiles de cada muestra frente al perfil de MTB H37Rv.
Aquellos perfiles que coincidieron en tamaño con el MTB H37Rv (susceptible) correspondieron al genotipo susceptible. En caso contrario, los perfiles que no coincidieron fueron considerados resistentes.
RESULTADOS
DETECCIÓN CONVENCIONAL DE LA SUSCEPTIBILIDAD ANTITUBERCULOSA
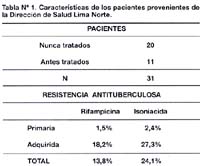
De 31 pacientes con tuberculosis pulmonar, 20 nunca fueron tratados y 11 tenían antecedentes de tratamiento antituberculoso. Mediante el método de las proporciones se encontró que 8 cepas fueron resistentes a isoniacida (24,1%) y 5 cepas fueron resistentes a rifampicina (13,8%). Al evaluar la resistencia primaria se encontró que la resistencia a rifampicina se mostró en 1,5%, mientras que a isoniacida se mostró en 2,4%. En cambio la resistencia adquirida se mostró mayor que la anterior, siendo 27,3% y 18,2% para isoniacida y rifampicina respectivamente (Tabla N°1).
AMPLIFICACIÓN DE GENES ASOCIADOS A LA RESISTENCIA A PARTIR DE MUESTRAS CLÍNICAS
Fueron suficientes 2 µL de ADN de cada muestra de esputo BK (+) para obtener un resultado satisfactorio en los sistemas de PCR descritos (genes rpoB y katG).
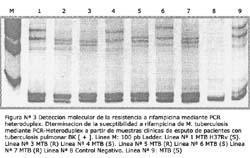
El resultado del PCR-Heteroduplex del gen rpoB en el caso MTB H37Rv y en los aislamientos susceptibles estuvo constituido por un perfil de 4 bandas, las cuales se presentaron en los PAGE 10% en el siguiente orden aproximadamente: 1 banda de 185 pb; 1 banda de 195 pb, 1 banda de 470 pb y una de 520 pb (Figura Nº 3: Líneas 1, 4, 6 y 9). En cambio en los aislamientos resistentes se observó que las bandas superiores aparecieron distintas a 500 pb (Figura Nº 3: Líneas 2, 3, 5 y 7).
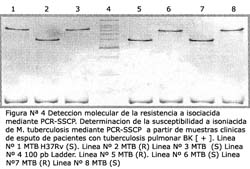
El resultado del PCR SSCP del gen katG en el caso MTB H37Rv y los aislamientos susceptibles estuvo constituido por un perfil de 3 bandas, las cuales se presentaron en los geles de poliacrilamida en el siguiente orden: 1 banda de 209 pb y 2 bandas cercanas, de 800-900pb aproximadamente (Figura Nº 4: Líneas 1, 3, 6 y 8). En cambio en los aislamientos resistentes se observó que las bandas de 800-900 pb aparecieron menores a 700 pb (Figura N°4: Líneas 2, 5 y 7).
ANÁLISIS MOLECULAR DE LA SUSCEPTIBILIDAD ANTITUBERCULOSA
En el análisis de los genes rpoB y katG, los genotipos sensibles y resistentes fueron fácilmente discriminados, mostrando perfiles completamente distinguibles (Figura Nº 3 y Nº 4). Así, la metodología de discriminación entre genotipos no requeriría ningún entrenamiento especial para el analista.
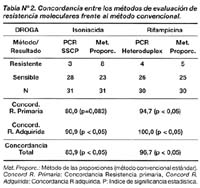
La concordancia entre el método molecular y convencional en la detección de susceptibilidad antimicrobiana fue 96,7% (29/30, p<0,05), sin embargo, al analizar sólo los pacientes nunca tratados la concordancia fue de 94,7% (18/19; p<0,05), mientras que al analizar a los pacientes antes tratados la concordancia fue de 100% (11/11; p<0,05) (Tabla Nº 2).
La concordancia entre el método molecular y convencional en la detección de susceptibilidad antimicrobiana fue de 83,9% (26/31; p<0,05). Sin embargo, al analizar solamente en los pacientes nunca tratados la concordancia fue de 80% (16/20; p<0,05), mientras que al analizar a los pacientes antes tratados la concordancia fue de 90,9% (10/11; p<0,05) (Tabla N°2).
SENSIBILIDAD Y ESPECIFICIDAD
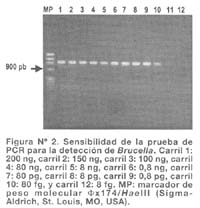
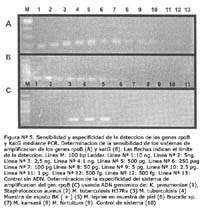
Los sistemas de detección basados en la amplificación de los genes rpoB y katG fueron capaces de detectar 2,5 pg y 50 pg de ADN genómico de MTB H37Rv respectivamente (Figura Nº 5 A y B).
El sistema de PCR para el gen rpoB no generó productos de amplificación usando ADN genómico de bacterias no tuberculosas procedentes de muestras clínicas y cultivo.
Así, se utilizó ADN genómico de M. kansasii, M. fortuitum, M. leprae, Brucella spp., Staphylococcus aureus y Klebsiella pneumoniae resultando negativas a la reacción de amplificación del gen rpoB (Figura N°5 C).
EMISIÓN DE RESULTADOS
La caracterización de la resistencia antituberculosa realizada mediante el método de las proporciones otorgó un resultado satisfactorio en un promedio de 3-4 meses partiendo de la obtención de la muestra clínica. Sin embargo, la caracterización molecular de la resistencia a rifampicina emitió resultados satisfactorios en un promedio de 48 horas después de la obtención de la muestra. La preparación de la muestra de esputo y purificación del ADN para PCR toma en promedio 3 horas. Por su parte, el sistema de PCR para la amplificación del gen rpoB y katG tomaron 3,5 horas, mientras que el heteroduplex y el SSCP tomaron entre 6 y 18 horas respectivamente.
DISCUSIÓN
La información de la secuencia nucleotídica de los genes rpoB y katG en MTB ha permitido establecer los mecanismos de la resistencia a rifampicina e isoniacida respectivamente. Nuestro sistema de PCR para el gen rpoB, generó un producto de amplificación de 195 pb que contenía la región de 81pb del gen rpoB, entre los codones 507 y 533, en donde la aparición de las mutaciones correlacionan en >95% con el fenotipo resistente a rifampicina 1 .
En 1993, Telenti 15 identificó 8 mutaciones conservadas en el gen rpoB, lo cual contribuyó considerablemente a la implementación de sistemas de detección rápida de la resistencia a rifampicina en MTB. Posteriormente, los autores implementaron un PCR-SSCP, cuya especificidad fue del 100% y una sensibilidad poco mayor de 96%14 .
De igual forma un novedoso sistema comercial de identificación rápida de resistencia a rifampicina, Inno LiPA Rif TB, basado en hibridación inversa, fue evaluado en aislamientos tuberculosos 16-21 encontrando una concordancia del 90,2% - 98,5% frente a los exámenes convencionales de susceptibilidad a rifampicina.
Nuestro sistema de análisis de la resistencia a rifampicina, la estrategia de detección de mutaciones del gen rpoB usando heteroduplex expone la existencia de uno o muchos cambios nucleotídicos, los cuales son revelados en geles de electroforesis en poliacrilamida. Con respecto al secuenciamiento y al LiPA, el sistema presentado no detecta mutaciones predeterminadas. El costo generado por el uso del PCR-Heteroduplex para la detección de la resistencia es mucho menor y tanto el entrenamiento como la disponibilidad son inmediatos para la implementación en laboratorios en el ámbito nacional.
Whelen 12 reportó el sistema de PCR para la amplificación del gen rpoB de MTB, el cual fue utilizado por nosotros para el mismo fin. La metodología referencial y nuestra experiencia muestran que no es posible la detección usando ADN perteneciente a otras bacterias especialmente las del género Mycobacterium, correspondiendo así a un sistema 100% específico. Sin embargo, el límite de detección del sistema descrito por Whelen 12 es de 8 pg de ADN genómico de MTB, mientras que nuestro sistema pudo ser capaz de detectar aproximadamente 3 veces menos de ADN genómico de M. tuberculosis. Así, el PCR Heteroduplex se presenta un sistema altamente sensible, detectando aproximadamente 25 x 103 bacilos por cada mililitro de muestra.
Este ensayo pudo generar perfiles completamente sencillos, en donde los genotipos resistentes fácilmente son discriminados del susceptible (Figura Nº 3) por lo que se presenta como una metodología aplicable en la detección de la resistencia a rifampicina con un nivel de concordancia total muy elevado (96,7%; p<0,05). Muy diferente a ello, un ensayo de PCR-ELISA también referido en la bibliografía, dirigido a la detección de la resistencia a rifampicina a partir de aislamientos y muestras clínicas de esputo, mostrándose altamente sensible con una concordancia menor al 100%. Sus autores indican que los resultados deben ser analizados en forma muy objetiva para eliminar la posibilidad de interpretaciones incorrectas 22.
Heep 23 reportó la aparición de una mutación relacionada con la resistencia a rifampicina, la cual se encuentra fuera de la región de análisis de 81pb. Ese trabajo muestra que la frecuencia de esa mutación es muy baja, pero revela una alternativa al mecanismo de resistencia que no se había considerado en el presente trabajo, sugiriéndose por ello la realización de investigación en la que se muestre si este nuevo cambio nucleotídico puede ser responsable de resistencia en los aislamientos de MTB de nuestro país.
Otras dos referencias claras sobre la necesidad de conocer la secuencia de los genes relacionados con la drogoresistencia en M. tuberculosis son mostrados en los trabajos de Escalante 24 y posteriormente Van Rie25 quienes describen hasta 6 cambios nucleotídicos que predicen la resistencia antituberculosa; siendo clave para el desarrollo de metodologías de detección temprana de pacientes infectados con bacilos resistentes. Además de ello, debe considerarse que Rattan 1 refiere que factores alternativos como alteraciones en la permeabilidad a la rifampicina y mutaciones en subunidades alternas de la ARN polimerasa que pueden también involucrar al fenotipo resistente. Ello requiere investigación, para poder establecer ciertamente las ventajas y desventajas que ofrece el uso de metodologías moleculares en la detección de la resistencia antituberculosa.
Es necesario resaltar que nuestro sistema de detección de la resistencia a rifampicina predice perfectamente la resistencia en los grupos de más riesgo, como es el caso de los pacientes antes tratados, presentando una concordancia del 100% (p<0,05). Paralelamente a ello, nuestro sistema presentado también se podría aplicar en muestras clínicas de diverso origen, dado que el procedimiento de extracción de ADN es altamente sensible y factible 11 . El tratamiento del ADN mediante etanol, convierte a esta metodología en más aplicable, puesto que en el estado de fijación etanólica las muestras pueden ser mantenidas a temperatura ambiente. Ello nos podría generar una ventaja en el transporte de regiones alejadas a los laboratorios de procesamiento del PCR. Scarpellini 26 usando PCR-SSCP para la detección de la resistencia a rifampicina usando muestras de fluido cerebroespinal, sugiere que la extracción de ADN es altamente limitante.
Por ello, la aplicabilidad de esta metodología apunta a poblaciones de pacientes cuyas características epidemiológicas evidencien una elevada posibilidad de
resistencia antituberculosa.
La detección de la resistencia a isoniacida está ampliamente documentada, sobre todo el análisis del gen katG. El sistema de caracterización de la susceptibilidad a isoniacida mediante SSCP de Telenti 14 ha sido empleado como patrón en este trabajo. Dado que los mecanismos de resistencia a isoniacida involucran a más de un gen, es entendible que la predicción de la susceptibilidad a esta droga mediante este análisis de mutaciones en el gen katG sea menor a 100% (87,7%; p=0,083). Es importante anotar que la resistencia a isoniacida encontrada por nuestro sistema en pacientes antes tratados mostró una concordancia de 90,9% (p<0,05) con el análisis convencional. Ello sugiere que este procedimiento podría contribuir con la predicción de la resistencia y multidrogoresistencia en pacientes con riesgo, al igual que el PCR-Heteroduplex, anteriormente descrito en este trabajo.
Uno de los principales problemas que pueden presentar estos sistemas de PCR es la contaminación cruzada de las muestras clínicas. Sin embargo, con un buen control en el flujograma de trabajo y evaluando exhaustivamente los controles negativos y de sistema del PCR, se podrá asegurar la calidad de los ensayos diagnósticos.
En resumen, los análisis moleculares de detección de la susceptibilidad a rifampicina e isoniacida son una atractiva alternativa a los exámenes convencionales de evaluación de la susceptibilidad antituberculosa, debido a su capacidad de emitir resultados en forma rápida (48 horas), sensible y específica. Este sistema puede contribuir al control de la tuberculosis, identificando tempranamente y en un alto porcentaje de confianza a aquellos individuos que potencialmente fracasen a los tratamientos antituberculosos y dirigiendo terapias efectivas y a tiempo.
Si bien existen muchos sistemas implementados para el diagnóstico de resistencia, el nuestro intenta ser evaluado en pacientes del país, por lo que se realizaron algunas modificaciones que son descritas en este artículo, esperando sea de utilidad para la salud pública del país.
Así proyecta la aplicabilidad de estos ensayos en pacientes con baciloscopía negativa y con tuberculosis extrapulmonar. El PCR en la detección de la resistencia
antituberculosa debe estar dirigido a pacientes con alta sospecha de tuberculosis resistente, entre los cuales se pueden tener a los pacientes antes tratados y contactos de pacientes con tuberculosis resistente.
AGRADECIMIENTOS
Agradecemos a la Dra. Diana Williams (Molecular Biology Research Department, G. W. Long Hansens Disease Center at Louisiana State University, USA); por facilitar la secuencia SGH-rpoB, los protocolos, sus comentarios y el esclarecimiento de nuestras dudas metodológicas; al técnico de Laboratorio David García, por su aporte técnico para la realización de este trabajo.
REFERENCIAS
1. Rattan A, Kalia A, Ahmad N. Multidrug resistant Mycobacterium tuberculosis: Molecular perspectives. Emerg Infect Dis 1998; 4(2): 195-209. [ Links ]
2. Van Rie A, Warren R, Richardson M, Gie RP, Enarson Da, Beyers N, et al. Classification of drug-resistant tuberculosis in an epidemic area. Lancet. 2000; 356(9223): 22-5. [ Links ]
3. Ministerio de Salud. Evaluación del programa nacional de control de la Tuberculosis en el Perú- Año 1999. Lima: MINSA; 2000. [ Links ]
4. Ramaswamy S, Musser J. Molecular genetic basis of antimicrobial agent resistance in Mycobacterium tuberculosis: 1998 update. Tuber Lung Dis 1998; 79(1): 3-29. [ Links ]
5. Fluit AC, Visser MR, Schmitz FJ. Molecular detection of antimicrobial resistance. Clin Microbiol Rev 2001; 14(4): 836-71. [ Links ]
6. Rouse D, Zhongming Li, Bai G-H, Morris S. Characterization of the katG and inhA genes of isoniazid-resistant clinical isolates of Mycobacterium tuberculosis. Antimicrob Agents Chem 1995; 39(11): 2472-7. [ Links ]
7. Farmer P, Shin S, Bayona J, Kim J, Furin J, Brenner J. Making DOTS Plus work. In. Multidrug–resistant tuberculosis. Edited Bastian I, Portaels F. Kluewer Acad. Publishers; 2000. [ Links ]
8. Popovic T, Bopp C, Olsvik O, Kiehbaluch J. Ribotyping in molecular epidemiology, p. 573. In Persing DH, Smith TH, Tenover FC, White TJ (ed.). Diagnostic molecular microbiology: principles and applications Washington, D.C: American Society for Microbiology; 1993. [ Links ]
9. Instituto Nacional de Salud-MINSA. Manual de normas y procedimientos en bacteriología de tuberculosis. Lima: INS; 1995. Serie de Normas técnicas Nº 10. [ Links ]
10. Centro Panamericano de Zoonosis. Manual de normas y procedimientos técnicos para la bacteriología de la tuberculosis. Parte III: Sensibilidad del Mycobacterium tuberculosis a las drogas. La identificación de Micobacterias. Buenos Aires: CEPANZO; 1986. [ Links ]
11. Williams DL, Gillis TP, Dupree WG. Ethanol fixation of sputum sediments for DNA-based detection of Mycobacterium tuberculosis. J Clin Microbiol 1995; 33(6): 1558-61. [ Links ]
12. Whelen AC, Felmlee TA, Hunt JM, Williams DL, Roberts GD, Stockman I, et al. Direct genotypic detection of Mycobacterium tuberculosis rifampin resistance in clinical specimens by using single-tube heminested PCR. J Clin Microbiol 1995; 33(3): 556-61. [ Links ]
13. Williams DL, Limbers C, Spring I, Jayachandra S, Gillis T. PCR/Heteroduplex detection of rifampin-resistant Mycobacterium tuberculosis. In PCR protocol for emergenging infectious diseases.. Ed. Persing D; 1994.p. 122-9. [ Links ]
14. Telenti A, Honore N, Bernasconi C, March J, Ortega A, Heym B, et al. Genotypic assessment of isoniazid and rifampin resistence in Mycobacterium tuberculosis: a blind study at reference laboratory level. J Clin Microbiol 1997; 35(3): 719-23. [ Links ]
15. Telenti A, Imboden P, Marchesi F, Lowrie D, Cole S, Colston MJ, et al. Detection of rifampicin-resistance mutations in Mycobacterium tuberculosis. Lancet 1993; 341(8846): 647-50. [ Links ]
16. Cooksey R, Morlock G, Glickman S, Crawford J. Evaluation of a Line Probe Assay Kit for characterization of rpoB mutations in rifampin-resistant Mycobacterium tuberculosis isolates from New York City . J Clin Microbiol 1997; 35(5): 1281-3. [ Links ]
17. Bartfai Z, Somoskovi A, Kodmon C, Szabo N, Puskas E, Kosztolanyi L, et al. Molecular characterization of rifampin-resistant isolates of Mycobacterium tuberculosis from Hungary by DNA sequencing and the line probe assay. J Clin Microbiol 2001; 39(10): 3736-9. [ Links ]
18. Abe C, Ogata H, Kawata K, Hiraga T, Takashima T, Suetake T. Detection of rifampin-resistant Mycobacterium tuberculosis by line probe assay (LiPA). Kekkaku 2000; 75(10): 575-81. [ Links ]
19. Traore H, Fissette K, Bastian I, Devleeschouwer M, Portaels F. Detection of rifampin resistance in Mycobacterium tuberculosis isolates from diverse countries by a commercial line probe assay as an initial indicator of multidrug resistance. Int J Tuberc Lung Dis 2000; 4(5): 481-4. [ Links ]
20. Gonzáles N, Torres M, Aznar J, Palomares J. Molecular analysis of rifampin and isoniazid resistance of Mycobacterium tuberculosis clinical isolates in Seville, Spain. Tuber Lun Dis 1999; 79: 187-90. [ Links ]
21. Marttila HJ, Soini H, Vyshnevskaya E, Vyshnevskiy Bi, Otten TF, Vasilyef AV, et al. Line probe assay in the rapid detection of rifampin-resistant Mycobacterium tuberculosis directly from clinical specimens. Scand J Infect Dis 1999; 31(3): 269-73. [ Links ]
22. García L, Alonso-Sanz M, Rebollo M, Tercero J, Chaves F. Mutations in the rpoB gene of rifampin-resistant Mycobacterium tuberculosis isolates in Spain and their rapid detection by PCR-Enzyme Linked Immunosorbent assay. J Clin Microbiol 2001; 39(5): 1813-8. [ Links ]
23. Heep M, Brandstatter B, Rieger U, Lehn N, Richter E, Rusch-Gerdes S, et al. Frequency of rpoB mutations inside and outside the cluster I region in rifampin resistant clinical Mycobacterium tuberculosis isolates. J Clin Microbiol 2001; 39(1): 107-10. [ Links ]
24. Escalante P, Ramaswamy S, Sanabria H, Soini H, Pan X, Valiente- Castillo O, et al. Genotypic characterization of drugs resistant Mycobacterium tuberculosis isolates from Peru. Tuber Lung Dis 1998; 79(2): 111-8. [ Links ]
25. Van Rie A, Warren R, Mshanga I, Jordaan A, Van Der Spuy G, Richardson M, et al. Analysis for a limited number of gene codons can predict drug resistance of Mycobacterium tuberculosis in a high-incidence community. J Clin Microbiol 2001; 39(2): 636-41. [ Links ]
26. Scarpellini P, Braglia S, Brambilla AM, Dalessandro M, Cichero P, Gori A, et al. Detection of rifampin resistance by single-strand conformation polymorphism analysis of cerebrospinal fluid of patients with tuberculosis of the central nervous system. J Clin Microbiol 1997; 35(11): 2802-6. [ Links ]
Correspondencia: Calderón Espinoza, Róger Iván. Centro Nacional de Salud Pública. División Biología Molecular. Instituto Nacional de Salud.
Dirección: Cápac Yupanqui 1400 Lima 11, Perú.
Telf.: (51-1) 4719920. Fax: (51-1) 4710179
Correo electrónico: rcalderon@ins.gob.pe