Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.20 n.2 Lima abr./jun. 2003
TRABAJOS ORIGINALES
Caracterización e inmunoreactividad de la proteína acídica Ribosomal P2ß de L. (V.) braziliensis
Carlos Padilla R1; Ysabel Montoya P1.
1 División de Biología Molecular. Centro Nacional de Salud Pública. Instituto Nacional de Salud. Lima, Perú.
RESUMEN
Introducción: El diagnóstico serológico de la leishmaniasis usando proteínas totales presenta reacciones cruzadas. La caracterización de nuevos antígenos de Leishmania mejorará el uso de herramientas serológicas en el diagnóstico de esta enfermedad. Objetivo: Caracterizar un nuevo antígeno de Leishmania. Materiales y métodos: Se seleccionó el bacteriófago T166-U19 de una biblioteca de cADN de L. (V.) braziliensis el cual es reactivo a mezclas de sueros de leishmaniasis cutánea y mucocutánea. El cADN del clon T166-U19 fue subclonado en el plásmido pGEX, luego secuenciado y la proteína recombinante fue expresada. La reactividad de esta proteína recombinante se evaluó por ELISA. Resultados: El cADN del clon T166- U19 presentó un marco de lectura abierto de 318 pb que traduce una proteína de 105 aminoácidos con 81,1%, 82,9% y 60,7% de identidad total con la proteína acídica ribosomal LiP de L. (L.) infantum, P2 de L. (L.) donovani, y P2 de T. cruzi, respectivamente. Además, la proteína recombinante presentó baja reactividad (50%) con sueros de pacientes con leishmaniosis, mientras que presentó reactividad cruzada con sueros de pacientes chagásicos. Conclusiones: Se caracterizó por primera vez la proteína acídica ribosomal P2B de L. (V.) braziliensis, y presentando baja reactividad con sueros de pacientes con leishmaniasis.
Palabras clave: Proteínas ribosomales; Leishmanía braziliensis; Leishmaniasis (Fuente: BIREME)
ABSTRACT
Introduction: The serologic diagnosis of leishmaniosis using total proteins shows cross reactions. The characterization of new Leishmania antigens will improve the use of serological tools for the diagnosis of this disease. Objetive: To haracterizate a new antigen of Leishmania. Materials and methods: the T166-U19 bacteriophage was characterizated from a cDNA L. (V.) braziliensis library which reacted against pooled sera from patients with cutaneous and mucocutaneous leishmaniasis. The T166-U19 cDNA clone was subcloned in a pGEX plasmid, sequenced, and the recombinant protein was expressed. The reactivity of this recombinant protein was assessed by ELISA. Results: The T166-U19 cDNA clone contained a 318- bp open reading frame (ORF) encoding 105 amino acid residues which has 81,1%, 82,9% and 60,7% identity with L. (L.) infantum LiP, L.(L.) donovani P2, and T. cruzi P2, respectively. Furthermore, the recombinant protein showed low reactivity (50%) with sera from patients with Leishmaniasis and it has croos-reactivity against sera from patients with Chagas disease. Conclusion: the P2_acidic ribosomal protein of L. (V.) braziliensis has been characterized for the first time and it has shown low reactivity against sera from patient with leishmaniasis.
Key words: Ribosomal proteins; Leishmania braziliensis; Leishmaniasis (Source: BIREME)
INTRODUCCIÓN
Leishmaniasis es un conjunto de enfermedades trasmitidas por picadura de mosquito y causada por protozoarios kinetoplástidos del género Leishmania. Estas enfermedades se caracterizan por presentar un amplio espectro de manifestaciones clínicas que abarca desde heridas cutáneas autocurables hasta compromiso visceral grave. Estas enfermedades son transmitidas por la picadura de mosquitos flebótomos1 .
La leishmaniasis es endémica en 88 países en 4 continentes, de los cuales 16 están en vías de desarrollo. Existe aproximadamente de 12 a 14 millones de personas infectadas en el mundo y 350 millones de personas que viven en esos países están en riesgo de contraer la enfermedad, de los cuales 2 millones se infectarán anualmente. Más de 90% de los casos de leishmaniasis cutánea ocurren en Irán, Afganistán, Nepal, Siria, Arabia Saudita, Brasil y Perú. Mientras que 90% de casos de leishmaniasis visceral ocurren en Bangladesh, Brasil, India y Sudán1 .
La leishmaniasis está ampliamente distribuida en el Perú; las únicas direcciones de salud que no reportaron casos de leishmaniasis en 1999 fueron Huancavelica, Moquegua y Tacna 2 .
Un criterio fundamental para el diagnóstico de la leishmaniasis es la demostración de la presencia del parásito. Los parásitos pueden detectarse usando frotis directo, cultivo, histopatología, inoculación en animales y la prueba de PCR 2,3 . Las pruebas serológicas apoyan el diagnóstico de la leishmaniasis, siendo las más importantes la leishmanina o test de Montenegro, el ELISA con antígeno total, y la inmunoflourescencia indirecta 4-9 . Sin embargo, el principal problema de las pruebas serologicas es su reacción cruzada.
Con el objetivo de mejorar la especificidad de las pruebas serológicas para el diagnóstico de la leishmaniasis, en los últimos años se ha seleccionado y caracterizado antígenos recombinantes a partir de bibliotecas de expresión de Leishmania usando para su selección sueros de pacientes con leishmaniasis 9-13 . Estos antígenos recombinantes han demostrado que pueden ser útiles para el diagnóstico de la leishmaniasis.
Entre los principales antígenos clonados y caracterizados de Leishmania están las proteínas acídicas ribosomales P14 , la leishmanolisina o gp6315 , las histonas9 , la familia de las proteínas de shock térmico9,16 , la cistein proteinazas17 y el antígeno K3918 .
En tripanosomátidos se ha reportado el aislamiento de proteínas acídicas ribosomales P debido a que son antigénicas. En L. (L.) infantum, se ha descrito que las proteínas acídicas ribosomales P2 alfa y P2 beta (LiP y LiP, respectivamente) son inmunogénicas en perros naturalmente infectados19 . También se han descrito las secuencias parciales de las proteínas acídicas P2 alfa y P2 beta de L (V.) peruviana, estas proteínas presentan reactividad frente a sueros de leishmaniosis20 .
Con el propósito de identificar nuevos antígenos para el diagnóstico de la leishmaniosis se seleccionó, identificó y caracterizó la proteína acídica ribosomal P2 B de L. (V.) braziliensis.
MATERIALES Y MÉTODOS
BACTERIÓFAGOS Y SUEROS
El bacteriófago T166-U19 proviene de una biblioteca (22 clones) de fragmentos de cADN de L. (V.) brazilensis cepa LH166 en el vector lgt11, este bacteriófago fue seleccionado por su reactividad con una mezcla de sueros de leishmaniasis cutánea y mucocutánea mediante la técnica de infección de bacteriofagos sobre placas de E. coli cepa Y109011 (Datos no presentados). Estos bacteriofagos fueron replicados y conservados según procedimientos ya reportados 9-13 .
18 sueros de personas con leishmaniasis cutánea (5 sueros) o mucocutánea (13 sueros) fueron colectados en el Instituto Nacional de Salud y el Instituto de Medicina Tropical «Alexander Von Humboldt», Lima, Perú. En todos los casos, la infección por Leishmania sp fue determinada por signos clínicos, y confirmación de positividad a ELISA con proteínas totales.
8 sueros de personas con la enfermedad de Chagas provienentes de Arequipa fueron obtenidas de la seroteca del Instituto Nacional de Salud, Lima, Perú. Adicionalmente, 10 sueros de personas clinicamente sanas fueron usados como controles negativos.
AMPLIFICACIÓN DE FRAGMENTOS cADN POR PCR
Con el propósito de subclonar el fragmento de cADN del bacteriófago T166-U19, se amplificó este cADN por PCR según procedimiento ya reportados9-13 con ligeras modificaciones. Para ello, se utilizó 20 ng de ADN de bacteriófago, buffer de amplificación (50 mM KCl; 10 mM Tris.Cl pH 8,3; 0,1% gelatina), oligonucleótidos λgt11F (5-GGTGGCGACGACTCCTGGAGCCCG-3) y λgt11R (5-TTGACACCAGACCAAC TGCTAATG-3) a una concentración final de 0,2 umoles/uL, 0,5 unidades por tubo de reacción de ADN polimerasa termoestable, mezcla de nucleótidos (dNTPs) a una concentración final de 0,2 mM, MgCl2 a una concentración final de 1,5 mM y agua tridestilada. Además, a cada tubo de reacción se añadió aceite mineral. Cada ensayo de PCR fue realizado con sus respectivo control de amplificación positivo y control de la contaminación del sistema.
El programa de ciclos de temperatura usado fue: denaturación inicial de 95ºC por 5 minutos, 30 ciclos de amplificación (una denaturación de 95°C por 30 segundos, una temperatura de hibridación de los primers de 58°C por 1,5 minutos, y una extensión de 72°C por 1,5 minutos) y una extensión final de 72°C por 10 minutos. Finalmente, las reacciones de amplificación fueron analizados por electroforesis en geles de agarosa al 1%.
SUBCLONAMIENTO CADN EN pGEX
El fragmento amplificado del bacteriófago T166-U19 fue digerido con la endonucleasa EcoRI, para eliminar los extremos del producto de amplificación innecesarios. Para la reacción de ligación se usó un kit de ligación comercial (Stratagene Co., CA, USA) según recomendaciones de los fabricantes, esta reacción contenía buffer de ligación a una concentración final de 1X (50 mM Tris-HCl (pH 7.5), 7 mM MgCl 2 , 1 mM TdT, 1 mM rATP), 50 ngr de vector pGEX1- xT/EcoRI/BAP, el fragmento purificado y la ADN ligasa. Luego, 5 mL de la reacción de ligación fueron usados para transformar E. coli JM109 mediante electroporación. La proteína que expresa el bacteriofago T166-U19 se le denominó U19 y es expresada como proteína de fusión con la proteínas glutation-S-transferasa (GST). Esta proteína de fusión fue expresada usando 10 mM de IPTG (Isopropil-ß-D- tiogalactopiranosido) y purificada usando glutation agarosa según procedimientos recomendados por los fabricantes (Pharmacia Biotech Inc.).
EVALUACIÓN DE LA REACTIVIDAD DE LA PROTEÍNA RECOMBINANTE U19-GST POR ELISA
La reactividad de la proteína recombinante U19 frente a sueros de pacientes con leishmaniasis y con la enfermedad de Chagas fue evaluada por ELISA segun procedimientos ya reportados 16 con modificaciones. La proteína recombinante U19 fusionada a GST y la proteína GST fueron fijadas a placas de poliestireno en la solución tampón carbonato. Luego de bloquear las zonas libres con BSA y lavados con PBS-T; las placas fueron incubadas con los sueros diluidos 1/200. Posteriormente, las placas fueron lavadas y se añadió una dilución 1/500 de conjugado anti-IgG marcado con peroxidasa. Finalmente, se añadió peróxido de hidrógeno y OPD, como sustrato y se midieron las absorbancias en un lector de ELISA a 450 nm. Todas las muestras fueron corridas por duplicado y con sus respectivos controles positivos y negativos por placa. Cada suero fue evaluado frente a la proteína de fusión U19- GST y a la proteína glutation S tranferasa (GST), simultáneamente. Las absorbancias obtenidas de los pocillos con GST sólo fueron restadas de las absorbancias de los pocillos donde se colocó la proteína de fusión U19. La línea de corte fue calculada usando las absorbancias de los sueros normales en cada evaluación, la línea de corte es considerada como el promedio de las absorbancias de los sueros normales más 2 veces su desviación estándar.
SECUENCIAMIENTO AUTOMÁTICO Y ANÁLISIS DE SECUENCIAS
El cADN subclonado en pGEX fue secuenciado usando el kit AutoRead sequencing kit (Pharmacia Biotec Inc.) siguiendo las indicaciones de los fabricantes. Cinco µg de ADN plasmídico fueron denaturados con NaOH; y precipitados con acetato de sodio y etanol. Luego el plásmido fue resuspendido en agua, se añadieron 10 pmoles de oligonucleótidos pGEX-5' (5-GGGCTGGCAAGCCACGTTTGGTG- 3) o pGEX-3' (5-CCGGGAGCTG CATGTGTCAGAGG-3), la solución de hibridación y se incubó a 37°C por 20 minutos. Para marcar los fragmentos de secuencia se añadió el reactivo Cys5- dATP labelling mix y 8 unidades de T7 DNA Polimerasa. Luego, se añadió solución de extensión y DMSO. Se repartió en mezclas de dNTP/ddNTPs y se incubó a 37°C por 5 minutos. Para el secuenciamiento, se utilizó un secuenciador automático (ALF express, Pharmacia Biotech Inc.) y geles denaturantes de poliacrilamida al 6%. La condiciones de electroforesis usadas fueron 58°C, 12 horas de duración, 1500 V, 60 mA y 25 W. Las secuencias obtenidas fueron procesadas con el programa SeqEd 1,0,3 DNA Strider para determinar la secuencia codante y para deducir la secuencia de aminoácidos. Luego fueron comparadas con las reportadas en las bases de datos internacionales de secuencias GENBANK (USA), EMBL (European Molecular Biology Laboratory Data Library) y DDBJ (DNA Data Base of Japan) usando programa BLASTn y BLASTp (Basic Local Aligment Search Tool, página web: www.ncbi.nlm.nih.gov) para comparar la secuencia de nucleótidos y aminoácidos respectivamente.
RESULTADOS
EXPRESIÓN DEL BACTERIÓFAGO T166-U19
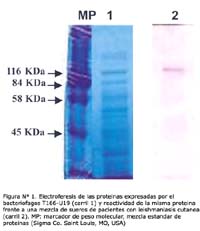
El bacteriófago T166-U19 expresa una proteína de fusión con un peso molecular aproximado de ~135 KDa y es reconocida por una mezcla de sueros de leishmaniasis cutánea en el formato Western blot (Figura Nº 1).
UN PRODUCTO DE APROXIMADAMENTE 620 pb SE OBTUVO DEL BACTERIÓFAGO T166-U19 USANDO PCR
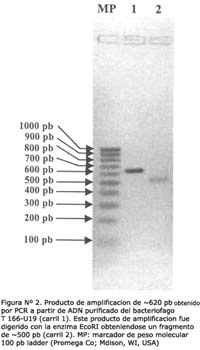
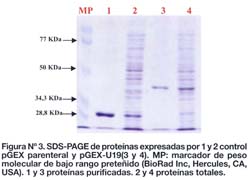
El fragmento de cADN clonado en el bacteriófago T166-U19 se amplificó mediante la reacción en cadena de la polimerasa, obteniéndose un producto de amplificación de aproximadamente 620 pb. Luego de digerir este fragmento con EcoRI se produjo una banda de aproximadamente 500 pb (Figura Nº 2) el cual fue subclonado a pGEX. Los resultados indican que éste fragmento se subclonó correctamente por la expresión de una proteína de fusion con GST con el peso molecular ~39 KDa (Figura Nº 3).
EL FRAGMENTO DE cADN CLONADO EN EL BACTERIÓFAGO T166-U19 ES HOMÓLOGO A LAS PROTEÍNAS ACÍDICAS RIBOSOMALES DE TRIPANOSOMÁTIDOS
Los resultados de secuenciamiento indican que el fragmento de cADN presenta un único marco de lectura abierto de 318 pb (Figura Nº 4). El marco de lectura abierto traduce una secuencia de aminoácidos que al ser comparada con los bancos de secuencias internacionales (GENBANK, EMBL y DDBJ) usando el programa BLASTp es homóloga a la proteínas acídicas ribosomales P2 de tripanosomatidos. Siguiendo pautas de homología se determinó que esta secuencia corresponde a la proteína acídica ribosomal P2 tipo b de L. (V.) braziliensis a la cual se denominó LbP2b. La proteína LbP2b presenta 92,5% de homología total con la proteína acídica ibosomal P2 de L. (L.) infantum LiP2-1, 92,4% con la proteína P2 de L. (L.) donovani LdP2, 74,1% con la proteína P2 de T. brucei TbP2, 72,9% con la proteína P2 de T. cruzi TcP2a, y 64,3% con la proteína P2 de Homo sapiens HsP2. Además, LbP2b presenta un alto contenido de alaninas (24,8%), leucinas (9,5%), glicinas (8,6%), ácido glutámico (8,6%), serinas (7,6%) y ácido aspártico (7,6%). La región central de LbP2b es particularmente rica en alaninas y glicinas, mientras que su punto isoeléctrico teórico es ácido pI=4,38 (calculado por el programa Compute pI/MW tool). Además, LbP2b presenta un dominio COOH terminal característico de las proteínas acídicas ribosomales MGFGLFD.
DISCUSIÓN
El valor de las bibliotecas de cADN para seleccionar antígenos útiles para el diagnóstico de las enfermedades parasitarias es ampliamente reconocido, los principales antígenos seleccionados comprenden proteínas de membrana, citosólicas y nucleares9-13 .
El análisis de la reactividad humoral de bacteriófagos provenientes de una biblioteca de cADN de L. (V.) braziliensis ha permitido identificar al bacteriófago T166-U19, el cual es reactivo a sueros de pacientes con leishmaniasis cutánea y mucocutánea. Este bacteriófago contenía un fragmento de cADN homólogo a las proteínas acídicas ribosomales tipo P2b de tripanosomatidos.
Este es el primer reporte sobre el análisis de la proteína acídica ribosomal tipo P2ß de Leishmania (V.) braziliensis (LbP2b). Esta secuencia ya ha sido registrada en la base de secuencias internacional GENEBANK, siendo su clave de acceso AF045020.
Existe poca información acerca de los dominios de las proteínas acídicas ribosomales de tripanosomatidos.
LBP2B PRESENTA UNA BAJA REACTIVIDAD A SUEROS DE LEISHMANIA EN ENSAYOS DE ELISA
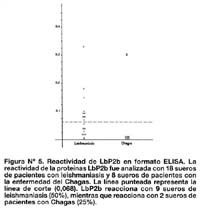
Se analizaron 18 sueros de pacientes con leishmaniasis provenientes de Huanuco (sierra del Perú), todos ellos con diagnóstico clínico de leishmaniasis y positivos por ELISA con antígeno total de Leishmania. 50% de estos sueros reaccionaron a la proteína LbP2b. Además, se analizó la especificidad de la prueba frente a 8 sueros de pacientes con enfermedad de Chagas provenientes de Arequipa, de los cuales 2 sueros (25%) reaccionaron con la proteína LbP2b (Figura Nº 5).
Esfuerzos por identificarlos sólo de una manera general indican que presentan el extremo C terminal característico, la región de bisagra rica en alaninas, y una estructura posiblemente globular en el extremo N terminal14,19-23 .
LbP2b presenta dominios característicos de proteínas acídicas ribosomales de eucariotes. Asimismo, presenta 2 dominios muy conservados con respecto a los eucariotes: el dominio C terminal EEADDDMGFGLFD, y el dominio N terminal YLAAYALVALSG. Posiblemente estos dominios jueguen un rol estructural y funcional importante para LbP2b, cabe la posibilidad que el dominio C terminal le permita a esta proteína interactuar con factores de la traducción y que el dominio N terminal le permita interactuar con la proteína acídica ribosomal P019 .
Es interesante notar que estas proteínas conservadas presenten alta reactividad humoral en la leishmaniasis, este fenómeno es notado también en otras proteínas conservadas como las proteínas de estrés térmico y las histonas. Posiblemente, el hecho de que usualmente estas proteínas conservadas están formando complejos proteicos (como por ejemplo, el ribosoma) podría facilitar la fagocitosis y el procesamiento de estos antígenos por células presentadoras de antígeno y posteriormente estas células promuevan la activación de una respuesta humoral, como es propuesto por Requena21 .
Se ha propuesto que el epítope inmunoreactivo de T. Cruzi es diferente al de Leishmania 22 . Se ha demostrado usando ensayos de inhibición con péptidos sintéticos que los anticuerpos en la leishmaniasis están dirigidos a una región adyacente al extremo C terminal, mientras que los sueros chagásicos reaccionan contra el epítope altamente conservado MGFGLFD 23 . Perros naturalmente infectados con L (L.) infantum tienen anticuerpos que reaccionan contra las proteínas ribosomales LiP2a y LiP2b. Usando péptidos sintéticos se mapeó el epítope antigénico en una región adyacente al extremo carboxilo terminal. Inclusive los anticuerpos generados en una infección con Leishmania no reconocen proteínas P humanas ni de T. cruzi22 .
Las proteínas acídicas ribosomales han demostrado ser antígenos de moderada reactividad en la leishmaniasis visceral y la leishmaniasis canina19,20,22 . La proteína recombinante LbP2b presenta también baja reactividad frente a sueros de leishmaniasis. Debido a la baja reactividad y la reacción cruzada, LbP2b no es recomendable su uso en el diagnóstico de la leishmaniasis, a menos que sea utilizada junto con otros antígenos recombinantes reportados y se elimine su epitope C terminal, el cual es el principal epítope reconocido por sueros chagásicos.
AGRADECIMIENTOS
A los técnicos de laboratorio Juana Choque y David García del Laboratorio de Biología Molecular de Instituto Nacional de Salud. Esta investigación fue parte de un proyecto que recibió apoyo financiero de un re-entry Grant otorgado por la UNDP/Banco Mundial/OMS Programa Especial para la investigación y el Manejo en Enfermedades Tropicales y además de la Unión Europea a través del Programa STD-3, contrato Nº TS3*CT 92-0123.
REFERENCIAS
1. World Health Organization. The World Health Report 2001. Mental Health: new understanding, new hope. Geneva: WHO; 2001. [ Links ]
2. Ministerio de Salud. Leishmaniasis. Serie de documentos monográficos. Lima: MINSA/OGE/INS; 2000. Módulo Técnico Nº 8. [ Links ]
3. Lopez M, Inga R, Cueva N, Alvarez E, Arevalo J. PCR: a tool for diagnosis of american tegumentary leishmaniasis in a health post of rural endemic areas. Arch Inst Pasteur Tunis 1993; 70(3- 4): 499-504. [ Links ]
4. Marty P, Lelievre A, Quaranta JF, Rahal A, Gari-Toussaint M, Le Fichoux Y. Use of the leishmanin skin test and western blot analysis for epidemiological studies in visceral leishmaniasis areas: experience in a highly endemic focus in Alpes-Maritimes (France). Trans R Soc Trop Med Hyg 1994; 88(6): 658-9. [ Links ]
5. Kar K. Serodiagnosis of leishmaniasis. Crit Rev Microbiol 1995; 21(2):1 23-52. [ Links ]
6. Thierry J, Borel E, Courrier P L, Courtois D, Mojon M. Cutaneous South- American leishmaniasis. Parasitological and serological diagnosis by indirect immunofluorescence and enzyme linked immunoassay (ELISA). 94 cases. Med Trop (Mars) 1991; 51(1): 43-8. [ Links ]
7. Guimaraes MC, Celeste BJ, Franco EL. Evaluation of dot enzyme-linked immunosorbent assay for mucocutaneous leishmaniasis and comparison with microplate enzyme immunoassay. J Clin Microbiol 1986; 24(3): 364-7. [ Links ]
8. Guimaraes MC, Celeste BJ, de Castilho EA, Mineo JR, Diniz JM. Immunoenzymatic assay (ELISA) in mucocutaneous leishmaniasis, kala-azar, and Chagas disease: an epimastigote Trypanosoma cruzi antigen able to distinguish between anti-Trypanosoma and anti-Leishmania antibodies. Am J Trop Med Hyg 1981; 30(5): 942-7. [ Links ]
9. Montoya Y. Molecular analysis of antigen genes in Peruvian leishmaniasis. (Doctoral thesis). London: University of Cambridge; 1993. [ Links ]
10. Osland A, Beyene D, Ashenafi S, Beetsma A. Isolation and characterization of recombinant antigens from Leishmania aethiopica that react with human antibodies. Infect Immun 1992; 60(4): 1368-74. [ Links ]
11. Blaxter ML, Miles MA, Kelly JM. Specific serodiagnosis of visceral leishmaniasis using a Leishmania donovani antigen identified by expression cloning. Mol Biochem Parasitol 1988; 30(3): 259-70. [ Links ]
12. Soto M, Requena JM, Gomez LC, Navarrete I, Alonso C. Molecular characterization of a Leishmania donovani infantum antigen identified as histone H2A. Eur J Biochem 1992; 205(1): 211-6. [ Links ]
13. MacFarlane J, Blaxter ML, Bishop RP, Miles MA, Kelly JM. Identification and characterization of a Leishmania donovani antigen belonging to the 70-kDa heat-shock protein family. Eur J Biochem 1990; 190(2): 377-84. [ Links ]
14. Soto M, Requena JM, Quijada L, Alonso C. Specific serodiagnosis of human leishmaniasis with recombinant Leishmania P2 acidic ribosomal proteins. Clin Diag Lab Immunol 1996; 3 (4): 387-91. [ Links ]
15. Button LL, McMaster WR. Molecular cloning of the major surface antigen of Leishmania. J Exp Med 1988; 167(2): 724-9. [ Links ]
16. Amorim AG, Carrington M, Miles MA, Barker DC, de Almeida ML. Identification of the C-terminal region of 70 kDa heat shock protein from Leishmania (Viannia) braziliensis as a target for the humoral immune response. Cell Stress Chaperones 1996; 1(3): 177-87. [ Links ]
17. Rafati S, Salmanian A, Hashemi K, Schaff C, Belli S, Fasel N. Identification of Leishmania major cysteine proteinases as targets of the immune response in humans. Mol Biochem Parasitol 2001; 113 (2001) 35–43. [ Links ]
18. Burns JM Jr, Shreffler WG, Benson DR, Ghalib HW, Badaro R, Reed SG. Molecular characterization of a kinesin-related antigen of Leishmania chagasi that detects specific antibody in African and American visceral leishmaniasis. Proc Natl Acad Sci USA 1993; 90(2): 775-9. [ Links ]
19. Soto M, Requena JM, García M, Gómez LC, Navarrete I, Alonso C. Genomic organization and expression of two independent gene arrays coding for two antigenic acidic ribosomal proteins of Leishmania. J Biol Chem 1993; 268(29): 21835-43. [ Links ]
20. Panebra A. Respuesta humoral en leishmaniasis del Perú: proteínas HSP-70 y ribosomales P. (Tesis doctoral). Buenos Aires: Universidad de Buenos Aires. 1996. [ Links ]
21. Requena JM, Alonso C, Soto M. Evolutionarily conserved proteins as prominent immunogens during Leishmania infections. Parasitol Today 2000; 16 (6): 246-50. [ Links ]
22. Soto M, Requena JM, Quijada L, Angel SO, Gomez LC, Guzmán F, et al. During active viscerocutaneous leishmaniasis the anti-P2 humoral response is specifically triggered by the parasite P proteins. Clin Exp Immunol 1995; 100: 246- 52. [ Links ]
23. Skeiky YAW, Benson DR, Elwasila M, Badaro R, Burns JM, Reed SG. Antigens shared by Leishmania species and Trypanosoma cruzi: immunological comparasion of the acidic ribosomal P0 proteins. Infect Immun 1994; 62(5): 1643- 51. [ Links ]
Correspondencia: Carlos P. Padilla Rojas. División de Biología Molecular
Instituto Nacional de Salud.
Dirección: Cápac Yupanqui 1400 Jesús María. Lima, Perú
Teléfono: (511) 4719920 Anexo 129. Fax: (511) 4710179.
Correo electrónico: cpadilla@ins.gob.pe