Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.20 n.3 Lima jul./set. 2003
COMUNICACIÓN CORTA
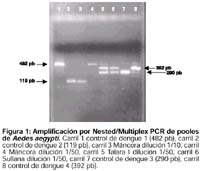
Detección rápida de los serotipos del virus dengue en el mosquito Aedes aegypti Omar Cáceres R1. 1 División de Biología Molecular. Instituto Nacional de Salud. Lima, Perú. RESUMEN Doce pools de Aedes aegypti fueron evaluados por RT-PCR y Nested/Multiplex PCR para detectar la presencia del virus dengue y determinar el serotipo. El nivel de detección de este sistema molecular fue de un serotipo de dengue en un pool de 20 mosquitos. Se detectó en dos mosquitos la presencia de dos serotipos, este hallazgo podría ser la explicación de la ocurrencia conjunta de los diferentes serotipos en una misma área geográfica aumentando la probabilidad de la presentación de dengue hemorrágico. Finalmente se ha evaluado un sistema molecular que puede ser utilizado en la vigilancia vectorial de Aedes aegypti. Palabras clave: Aedes; Reacción en cadena de la polimerasa de transcriptasa reversa; Virus del dengue. (Fuente: BIREME) ABSTRACT Twelve pools of Aedes aegypti were assessed using RT-PCR and Nested/Multiplex PCR to detect dengue virus and to determine which serotype is present. The detection level of this molecular technique was one dengue serotype detected in a pool of 20 mosquitoes. Two dengue serotypes were detected in two mosquitoes; this finding could be the explanation of the co-occurrence of more than one serotype in the same geographic area increasing the chance of occurrence of dengue hemorrhagic fever. Finally, there is a molecular system that can be used in Aedes aegypti vectorial surveillance. Key Words: Aedes; Reverse transcriptase polymerase Chain reaction; Dengue virus. (Source: BIREME) INTRODUCCIÓN El dengue es una enfermedad viral tropical reemergente trasmitida por la picadura del mosquito Aedes aegypti, el cual a sido implicado como el principal vector de la enfermedad; afecta a países de las regiones tropicales y subtropicales del mundo 1. El agente etiológico es el virus dengue que pertenece a la familia Flaviviridae, el cual presenta cuatro serotipos antigénicamente distintos conocidos como DEN-1, DEN-2, DEN-3 y DEN-4. La infección con cualquiera de ellos ocasiona una enfermedad febril benigna auto limitante conocida como dengue clásico o fiebre dengue (DC), además existen formas severas de la enfermedad: dengue hemorrágico (DH) y síndrome de shock por dengue (SSD), que pueden comprometer la vida del paciente 2. Los casos de fiebre dengue y dengue hemorrágico se han incrementado desde que el vector se ha dispersado, alcanzando nuevos hábitats en América, partes de África y Asia. En los últimos 40 años La transmisión de la enfermedad ocurre cuando la hembra pica a una persona enferma en fase de viremia (primeros 5 días de iniciada la enfermedad), causando la infección del mosquito, luego transcurren entre 2 y 15 días, tiempo en el cual el virus pasa desde el aparato digestivo hasta las glándulas salivales; en este período el mosquito adquiere la capacidad de trasmitir el virus durante toda su vida (2 meses) a individuos susceptibles 4. En los años 50 se planteó un programa de erradicación del vector para evitar la propagación de la fiebre amarilla, así en 1958 se le erradicó. Desde entonces no hubo referencias de la presencia de A. aegypti hasta 1984, año en el cual fue reportada en Loreto y luego en Huanuco 4, a partir de entonces el vector se ha dispersado hasta lograr infestar 15 departamentos de los 24 que tiene el país incluyendo a 3 distritos de la capital (Rimac, San Juan de Lurigancho y La Victoria)4. Debido a esta expansión progresiva y a que el vector se encuentra presente en áreas que anteriormente estaban libres de dengue, es que surge la preocupación de que las zonas libres de la enfermedad pudieran convertirse en nuevas áreas de transmisión. Se han realizado muchos trabajos para detectar patógenos en vectores ya sean parásitos o virus 5-8, así se ha reportado que el aislamiento viral, la prueba de la reacción en cadena de polimerasa de la transcriptasa reversa y ELISA son tres técnicas muy útiles para detectar el virus LaCrosse en A. triseriatus y A. aegypti 9. Kuno y colaboradores 10 diseñaron un sistema de vigilancia molecular y evaluaron 8 pares de primers para detectar 44 diferentes virus del género Bunyavirus (causantes de encefalitis) aplicando RT-PCR, los autores señalan que son capaces de detectar un mosquito infectado en 99 mosquitos no infectados; por lo tanto, RT-PCR es una técnica con 100% de sensibilidad y muy específico dado que ensayos de ELISA dan reacciones cruzadas con los diferentes serogrupos de este género de virus. El objetivo del presente trabajo fue optimizar la técnica de reacción en cadena de la polimerasa de la transcriptosa reversa (RT-PCR) Nested/Multiplex PCR usualmente utilizadas como diagnóstico rápido 11, para la detección del virus en el vector, que puede ser utilizado posteriormente como herramienta de vigilancia vectorial molecular. METODOLOGÍA Un total de 93 mosquitos hembras de A. aegypti fueron capturados, entre enero y abril del año 2001, en diferentes áreas endémicas del país y agrupados en doce pools. Previamente los mosquitos fueron identificados taxonómicamente por los entomólogos del Instituto Nacional de Salud y mantenidos en viales con alcohol al 70%; cuando la población fue numerosa los vectores fueron agrupados en pooles de 25 individuos como máximo. Los viales se mantuvieron a -20 ºC hasta su procesamiento. Los mosquitos fueron retirados del alcohol, colocados sobre papel absorbente y luego trasladados a un nuevo vial, se le añadió 300 µL de Trizol (Invitrogen) y se homogeneizaron utilizando un microhomogeneizador. Luego se agregó 700 µL más de Trizol, se agitó vigorosamente utilizando un vórtex y se dejó reposar por 10 minutos a temperatura ambiente; se añadió luego 300 µL de cloroformo, se agitó con un vórtex fuertemente y se dejo reposar nuevamente por 10 minutos. Los viales con las muestras fueron centrifugados, se retiró la capa superior y se colocó en otro vial estéril al cual se le agrego 700 µL de isopropanol y se guardo a -20 ºC por 30 minutos. Los viales fueron centrifugados a 14 000 rpm por 5 minutos para obtener el ARN el cual se deja secar a 42 ºC por 5 minutos para luego ser resuspendido con agua grado biología molecular y finalmente guardado a -80 ºC. Se realizó la transcripción reversa (RT) para convertir el RNA total extraído de los mosquitos a cDNA para luego realizar el PCR, brevemente: 11 µL de RNA extraído de cada muestra y 1,5 µL Primer D2 2,5uM fueron calentados en viales a 70 ºC por 10 minutos en un termociclador (Perkin Elmer 2400), luego estos viales fueron mantenidos en hielo a los cuales se les agrego 4 µL de Buffer 5X, 2 µL de dNTP mix 10 mM, 0,2 µL de la enzima AMV transcriptasa reversa 9 U/µL (Promega) y agua hasta completar un volumen final de 20 ml por tubo de reacción. Los viales fueron colocados en el termociclador con los siguientes parámetros: 1 ciclo a 42 ºC por 1 hora y 1 ciclo a 70 ºC por 15 minutos. El PCR y el Nested/Multiplex PCR fue realizado siguiendo la metodología descrita 12 modificada por nosotros para aumentar la especificidad de los primers, brevemente: Para el PCR se prepararon tubos de reacción conteniendo 2 µL de buffer 10X, 1,6 µL de dNTP mix 10mM, 1,6 µL de los primers D1y D2 a 2,5 uM cada uno, 1,2 µL de MgCl2 25mM, 0,2 mL de enzima TaqGold DNA polimerasa 5U/µl (Applied Biosystems), 3 mL del cDNA obtenido y agua suficiente para 20 mL de reacción final. Los viales fueron ciclados a 95 ºC x 10 minuto, 30 ciclos de 95 ºC x 50 seg, 57 ºC x 1 minuto 20 s y 72 ºC x 30 s y finalmente una extensión final de 72 ºC x 10 minutos. La reacción para el Nested/Multiplex PCR es similar a la prueba de PCR pero en vez de utilizar el primer D2 se usó una mezcla de cuatro primers internos específicos para cada serotipo (1,6 µL de cada uno de los primers TS1, TS2, TS3 y TS4)12; se cuadruplicó el volumen del primer D1 (6,4 µL) para tener cantidades equimolares de los primers y se utilizó 2 ó 4 ml del producto de PCR diluido 1/10 y 1/50 en agua. Se siguió el mismo ciclaje descrito anteriormente. Los productos de reacción del PCR y Nested/Multplex PCR fueron corridos en gel de agarosa al 1,5%, teñidos con bromuro de etidio 10µg/mL, visualizados en un transiluminador UV y fotografiados con una cámara Polaroid. RESULTADOS Se ha observado que fijar los mosquitos en alcohol al 70% es un método práctico y seguro para conservar el ADN y el ARN y es mejor aún si se mantiene en frío (-20ºC), aunque si se mantiene a temperatura ambiente por poco tiempo no afecta la calidad de los ácidos nucleicos. Una consideración importante es que al obtener el ARN total de los mosquitos se observó una coloración violeta cuya intensidad varía con el número de mosquitos procesados, pero esta coloración no afectó las técnicas moleculares descritas. Se evaluaron 12 pooles de A. Aegypti capturados en diversas áreas endémicas de dengue (Tabla). Se probaron dos diluciones diferentes del producto de PCR antes de realizar el Nested/Multiplex PCR, el resultado del análisis es mostrado en la figura 1, donde se observa que la muestra de Sullana y Trujillo (1 individuo) presentan dos bandas compatibles con Den-3, Den-4 y Den-2, Den-3, respectivamente (Figura 1). El análisis mostró también que de los pooles analizados se obtuvieron un amplio espectro de resultados que van desde la ausencia de serotipos, la presencia de un solo serotipo hasta la presencia de tres serotipos, que fueron detectados al analizar las diluciones hechas en cada muestra (Tabla). DISCUSIÓN Este sistema descrito a probado ser muy útil para el diagnóstico rápido del dengue con gran sensibilidad y especificidad 11, es por ello que se probó para detectar la presencia del virus en su vector. El ARN obtenido fue de buena calidad y aunque presentó una coloración violeta esto no afectó al PCR; se presume que la coloración se debe al pigmento presente en la quitina de A. aegypti y que coprecipita con el ARN al momento de su purificación. Se desconoce la naturaleza química de este pigmento. Al evaluar las muestras se detectaron la presencia de dos serotipos en un solo mosquito, esto es un indicativo de que A. aegypti es capaz de llevar más de un serotipo a la vez. La explicación más razonable es que debido a la larga vida del vector (2 meses) este puede infectarse con dos o más serotipos al picar enfermos infectados con diferentes serotipos pudiendo trasmitirlos posteriormente a personas susceptibles. Esta susceptibilidad del A. aegypti a infectarse estaría asociada a la capacidad vectorial y genética, así se ha observado que al estudiar A. Aegypti capturado en Tarapoto 13 y compararlo con la descripción dada por la OPS 14 se encuentran diferencias: a) Períodos de desarrollo más cortos, b) Marcada antropofilia y c) No existe selectividad exclusiva de recipientes para la oviposición. Estas características del A. aegypti en el Perú y su genética, explicarían en parte la alta capacidad de transmisión del virus dengue en localidades con bajos niveles de infestación, además de ser susceptible a la infección por más de un serotipo a la vez. Este hallazgo podría ser la explicación de la circulación conjunta de diferentes serotipos en un área determinada, aumentando la probabilidad de la aparición de dengue o dengue hemorrágico en áreas libres o en áreas sin presencia todavía de la forma grave de la enfermedad, respectivamente. Se tuvo que hacer diluciones de los productos de PCR antes de hacer el Nested/Multiplex PCR, pues ante la incógnita de no saber cuanta carga viral pudiera existir en cada mosquito y de no saber cuantos mosquitos de un pool pudieran estar infectados, es que se realizaron dos diluciones (1/10 y 1/50) para tener una mejor oportunidad de detectar aquel serotipo con menor número de partículas virales entre aquellos que tuvieran mayor número de partículas virales. Se realizó una dilución intermedia por ejemplo 1/25 cuando el resultado fue dudoso. Finalmente, se ha evaluado un sistema de detección utilizando metodología molecular para detectar el virus en el vector, por lo que se podría utilizarse como un sistema de vigilancia vectorial molecular para monitorear la presencia del virus en poblaciones de A. aegypti y advertir tempranamente el riesgo de aparición de la enfermedad en áreas no afectadas. REFERENCIAS 1. Gubler DJ, Trent DW. Emergence of epidemic dengue/dengue hemorrhagic fever as a public health problem in the americas. Infect Agents Dis 1993; 2(6): 383-93. [ Links ] 2. Henchal EA, Putnak JR. The dengue viruses. Clin Microbiol Rev. 1990; 3(4): 376-6. [ Links ] 3. World Health Organization (WHO). Report on infectious diseases: Removing obstacles to Healthy Development. 1999. Cap. 10. [ Links ] 4. Ministerio de Salud. Dengue clásico y dengue hemorrágico Módulos Técnicos. Serie de Documentos Monográficos 7, Lima: OGE, INS; 2000. [ Links ] 5. Pierre V, Drouet MT, Deubel V. Identification of mosquito-borne flavivirus sequences using universal primers and reverse transcription/polymerase chain reaction. Res Virol 1994, 145(2): 93-104. [ Links ] 6. Harris E, Roberts TG, Smith L, Selle J, Kramer LD, Valle S, et al. Typing of dengue viruses in clinical specimens and mosquitoes by single-tube multiplex reverse transcriptase PCR. J Clin Microbiol 1998; 36(9): 2634-9. [ Links ] 7. Rodriguez N, Aguilar CM, Barrios MA, Barker DC. Detection of Leishmania braziliensis in naturally infected individual sandflies by polymerase chain reaction. Trans R Soc Trop Med Hyg 1999; 93(1): 47-9. [ Links ] 8. Snounou G, Pinheiro L, Goncalves A, Fonseca L, Dias F, Brown KN, et al. The importance of sensitive detection of malaria parasites in the human and insect hosts in epidemiological studies, as shown by the analysis of field samples from Guinea Bissau. Trans R Soc Trop Med Hyg 1993; 87(6): 649-53. [ Links ] 9. Wasieloski LP, Rayms-Keller A, Curtis LA, Blair CD, Beaty BJ. Reverse transcription-PCR detection of LaCrosse virus in mosquitoes and comparison with Enzyme Immunoassay and virus isolation. J Clin Microbiol 1994; 32 (9). 2076-80. [ Links ] 10. Kuno G, Mitchell CJ, Chang GJ, Smith GC. Detecting bunyaviruses of the bunyamwera and california serogroups by a PCR technique. J Clin Microbiol 1996; 34(5): 1184-8. [ Links ] 11. Nolasco O, Carrillo C, Gutierrez V, Yabar C, Douglas S, Garcia M, et al. Diagnóstico temprano en un brote epidémico de virus dengue en Piura usando RT-PCR y Nested-PCR. Rev peru med exp 1997; 14(2): 13-7. [ Links ] 12. Lanciotti RS, Calisher CH, Gubler DJ, Chang GJ, Vorndam AV. Rapid detection and typing of dengue viruses from clinical samples by using reverse transcriptase-polymerase chain reaction. J Clin Microbiol 1992; 30(3): 545-51. [ Links ] 13. Bueno C, Vela F, Llontop A, Carranza J. Dengue en San Martín: seis años de experiencia. Serie Hojas Amazónicas de Salud Pública 2. San Martín: MINSA; 1998: 31-6. [ Links ] 14. Michael J. Nelson. Aedes aegypti: biología y ecología. U.S.A. Organización Panamericana de la Salud; 1986. [ Links ] Correspondencia:
Omar Cáceres Rey.
División de Biología Molecular,
Dirección: Cápac Yupanqui 1400. Lima 11, Perú
Teléfono: (511) 4719920 Anexo: 149
Correo electrónico: ocaceres@ins.gob.pe