Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.20 no.3 Lima July/Sept. 2003
TEMA DE REVISIÓN
Daniel Neyra1; César Cabezas2; Trenton K. Ruebush II3,4.
1 Dirección Regional de Salud de Amazonas. Ministerio de Salud. Chachapoyas, Perú
2 Instituto Nacional de Salud. Lima, Perú
3 Office of the Director. National Center for Infectious Diseases. Atlanta, Georgia, U.S.A.
4 Instituto de Investigación de Enfermedades Tropicales de la Marina de los Estados Unidos, Lima, Perú
RESUMEN
Durante la década de 1990 el Perú experimentó la reemergencia de la malaria en la cuenca amazónica y la costa norte de su territorio; observándose simultáneamente la aparición y extensión de resistencia del Plasmodium falciparun a los medicamentos antimaláricos en ambas áreas geográficas. El Ministerio de Salud respondió al problema fortaleciendo las medidas de control disponibles y llevando a cabo una serie de estudios para precisar mejor la extensión geográfica y intensidad de la resistencia a los antimaláricos, con el objetivo de revisar y adecuar la política de tratamiento para enfrentar esta situación sanitaria emergente en el país. Se presenta una revisión del proceso de cambio de la política de tratamiento de la malaria entre 1990 y 2001 por el Ministerio de Salud del Perú, cuando decidió implementar una nueva terapia de combinación que incluye un medicamento de la familia de las artemisininas para el tratamiento de P. falciparum. Con este cambio en la política del tratamiento antimalárico, el Perú es actualmente el primer país en las Américas en utilizar la terapia de combinación con artemisininas como tratamiento de primera línea para P. falciparum no complicado. La experiencia peruana es mostrada como un modelo para otros países en la región que también están enfrentando la emergencia de malaria por P. Falciparum farmacoresistente.
Palabras clave: Malaria; Plasmodium falciparum; Resistencia a las drogas; Política de salud; Política de tratamiento de malaria, Perú (fuente: BIREME)
SUMMARY
During the 1990 decade Peru experienced malaria re-emergence in the Amazon Basin and in the northern coast of its territory, and the occurrence and extension of Plasmodium falciparum resistance to antimalarial drugs in both geographical areas were simultaneously observed. The Ministry of Health faced the problem strengthening the available control measures and performing research in order to better determine the geographical extension and the intensity of the resistance to antimalarial drugs, with the purpose of reviewing and adjusting the treatment policies facing this emergent sanitary condition in the country. A review of the Ministry of Health changes in the treatment policies against malaria between 1990 and 2001 is presented, focusing that currently a new therapy including one drug of the arthemisine family for the treatment of P. falciparum was implemented. Due to this change in antimalarial treatment policiy, Peru is currently the first country in America using combination therapy including arthemisine as a first line treatment for non complicated P. falciparum malaria. The Peruvian experience is shown as a model for other countries in the region which also face drug-resistant P. falciparum malaria emergence.
Key Words: Malaria; Plasmodium falciparum; Drug Resistance; Health Policy; Malaria Treatment Policy, Perú (Source: BIREME)
INTRODUCCIÓN
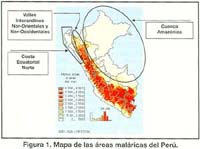
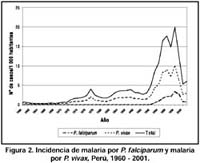
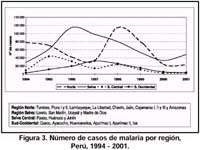
La malaria es un importante problema de salud pública en el Perú y se ha tratado de erradicarla desde la década de los 40. Por esta razón, las autoridades sanitarias nacionales desarrollaron entre 1955 y 1970 diversas acciones para alcanzar este objetivo y proyectarse al control sostenible del daño durante la década de los 1980. A inicios de los 90, hubo un incremento de la incidencia sin precedentes en las regiones de mayor endemicidad del país, la Amazonia y la Costa Norte (Figuras 1 y 2). En la cuenca amazónica, el incremento se asoció probablemente con la reintroducción y dispersión de un vector muy eficiente como el Anopheles darlingi 1, 2 en esta zona del país. Entre 1991 y 1996, los casos de malaria reportados anualmente por la Región de Loreto se incrementaron en más de 100 veces; de 850 a 102 000 casos (Figura 3). Más alarmante fue el incremento de casos de Plasmodium falciparum, que se elevaron de 125 casos en 1991 a más de 30 000 casos en 1996 3. Durante los últimos 5 años, el número de casos de P. falciparum y P. vivax en la cuenca amazónica ha disminuido en cierto modo, pero las condiciones climáticas y ambientales favorables; asociadas a la presencia de un vector extremadamente eficiente, aseguran que la malaria continuará siendo un problema de salud pública en esta región del país.
En la costa norte, tradicionalmente una zona endémica de malaria del Perú, hubo una reemergencia de malaria por P. Falciparum y P. vivax entre 1998 y 1999, como consecuencia de las lluvias e inundaciones ocasionadas por el fenónemo "El Niño". El número total de casos de malaria se incrementó de 15 000 en 1997 a 101 000 en 1998, descendiendo a 65 000 casos en 1999; en este contexto, los casos de P. falciparum se elevaron rápidamente de 6 000 en 1997 a 51 000 en 1998 (Figura Nº 3).
Durante la década de 1990, la reemergencia de malaria en la costa norte y cuenca amazónica peruana estuvo asociada a una dispersión e intensificación de la resistencia de cepas de P. falciparum a la cloroquina (CQ) y sulfadoxina-pirimetamina (SP)4-6, limitando el impacto de los esfuerzos efectuados por el Estado y los servicios generales de salud para reducir este problema sanitario. Para responder a este problema, era necesario para el Ministerio de Salud (MINSA) conocer la extensión geográfica del fenómeno, la intensidad de la resistencia; y establecer una política nacional de medicamentos antimaláricos, como una respuesta operativa adecuada para reducir o prevenir la morbilidad y mortalidad por malaria grave y contener la diseminación de la malaria fármacorresistente en el resto del país.
Se presenta una revisión del proceso de cambio de los elementos de política de antimaláricos para el tratamiento de la malaria en el Perú que abarca tres etapas, desde el uso de monoterapia, a la terapia múltiple implementada durante el primer y segundo quinquenio de la década de 1990 hasta el desarrollo de un proceso final de evaluación, diseño e implementación de una nueva política de medicamentos antimaláricos basada en la terapia de combinación con artemisininas durante el período 1998-2001. Con este cambio en la política del tratamiento antimalárico, el Perú es actualmente el primer país en las Américas en utilizar la terapia de combinación con artemisininas, como tratamiento de primera línea para infecciones de P. falciparum no complicados. La experiencia peruana es mostrada como una respuesta sanitaria sistemática para enfrentar y controlar la emergencia de malaria por P. falciparum fármacoresistente, en base a evidencias científicas, epidemiológicas y operacionales.
ANTECEDENTES
La estrategia mundial de erradicación de la malaria, aplicada desde 1954 hasta principios de la década de 1980, estableció el rol del tratamiento antimalárico en el reservorio humano infectado. El objetivo final del programa de erradicación era interrumpir la transmisión en una campaña limitada en el tiempo, con un grado de eficiencia y oportunidad óptimo que al terminar haga imposible el restablecimiento de la transmisión de la malaria. El rol del tratamiento estuvo orientado a eliminar los reservorios de parásitos presentes en los pacientes infectados y en el vector a través de su efecto contra los parásitos en fase asexuada en la sangre (trofozoitos y esquizontes), las formas latentes en el hígado (hipnozoitos) y los gametocitos 7.
El proceso de adecuación mundial de la estrategia de erradicación de la malaria basada en modelos de intervención a través de programas verticales hacia una estrategia de control mediante modelos de intervención descentralizados durante las décadas de 1980 y 1990, fue reforzado en el contexto de la Nueva Estrategia Global para el Control de la Malaria en 1992 8. Esta estrategia enfatizó la atención curativa de la malaria, mejorando el acceso al diagnóstico precoz, a un tratamiento oportuno y eficaz como elementos estratégicos primordiales para reducir la morbilidad y mortalidad causada por la malaria.
La Política Nacional de Control de la Malaria de un país debe incluir una política de medicamentos antimaláricos consistente en un conjunto de recomendaciones y reglamentos acerca de los antimaláricos y su utilización racional en el país 9. Los objetivos de esta política son: asegurar un tratamiento inmediato, eficaz y seguro para prevenir la mortalidad y reducir la morbilidad ocasionada por la malaria, lograr la cura parasitológica de la infección; optimizar la adherencia y aceptabilidad de los regímenes de tratamiento; reducir al mínimo la presión de selección de la fármacorresistencia y prolongar la vida útil de los antimaláricos; finalmente, en situaciones epidemiológicas de alta resistencia, disponer de esquemas terapeúticos alternativos. Para desarrollar una política racional de medicamentos antimaláricos, las autoridades sanitarias y los programas de malaria deben disponer de datos actualizados sobre la distribución geográfica y el nivel de resistencia a los antimaláricos de primera y segunda línea de tratamiento en el país. Aunque existen varios métodos para evaluar la fármacoresistencia de cepas de Plasmodium spp., incluyendo métodos in vivo; pruebas in vitro, y la identificación de mutaciones genéticas en el parásito asociadas a la resistencia, se considera al método de los estudios in vivo como el de elección por su similitud con lo que ocurre cuando un paciente febril recibe un tratamiento antimalárico en un establecimiento de salud. La Organización Mundial de la Salud (OMS) y la Organización Panamericana de la Salud (OPS) han publicado protocolos estandarizados validados para estos estudios 10-11, y actualmente, se considera al método recomendado por la OMS/OPS como el más indicado para un programa de control de la malaria y los organismos nacionales de salud que necesiten obtener información para evaluar y actualizar sus políticas nacionales para el tratamiento de la malaria.
Como consecuencia de la extensión e intensificación de la resistencia a los medicamentos antimaláricos en los últimos años, la OMS/OPS han empezado a recomendar que los países que están cambiando su política de tratamiento de la malaria, deben usar esquemas de tratamiento en base a terapia de combinación en vez de mantener esquemas de monoterapia; buscando retardar la selección de cepas resistentes del parásito 12. La justificación para usar terapia de combinación en el tratamiento de la malaria, es similar a la recomendada para el tratamiento de la tuberculosis, cáncer e infecciones por VIH 13. Cuando se usa un medicamento antimalárico solo, aumenta la probabilidad de seleccionar parásitos resistentes. Este problema es particularmente común con medicamentos con largo tiempo de vida media, como la sulfadoxina- pirimetamina (SP) y la mefloquina (MQ) que tienen una eliminación muy lenta de la sangre. El uso de otro medicamento en combinación con la SP o MQ reduce significativamente la probabilidad de seleccionar parásitos resistentes a ambos. La familia de medicamentos frecuentemente recomendados para esta terapia de combinación son las artemisininas, como artesunato (AS) y artemeter, que son sumamente eficaces y tienen una acción muy rápida contra Plasmodium. En Tailandia, la adición de AS a la MQ para la terapia de infecciones por P. falciparum, fue asociada a la estabilización y reducción del aumento de resistencia a la MQ observada cuando se lo usaba en monoterapia 14. Las artemisininas también actúan contra los gametocitos jóvenes, ofreciendo la posibilidad teórica de prevenir o reducir la transmisión de la malaria fármacorresistente 15.
LA EVOLUCIÓN DE LA POLÍTICA DE MEDICAMENTOS
ANTIMALÁRICOS EN EL PERÚLa década de 1980
La década de 1980 estuvo dominada por la aplicación de una estrategia de tratamiento en base a monoterapia con CQ para el tratamiento de la malaria por P. vivax y P. falciparum. Se asoció la primaquina (PQ) para prevenir las recaídas de la malaria por P. vivax, eliminar los gametocitos de P. falciparum y prevenir la transmisión. El tratamiento era administrado a los febriles sospechosos y casos confirmados de malaria. Los febriles sospechosos fueron definidos como aquellos sujetos que tenían fiebre >37,5 ºC con un tiempo de evolución no mayor a 15 días. Los casos confirmados eran aquellos que tenían diagnóstico de gota gruesa positiva a Plasmodium spp. El tratamiento fue administrado exclusivamente por funcionarios del antiguo Servicio de Erradicación de la Malaria (SNEM), manteniéndose la provisión y administración de antimaláricos gratuitamente al margen de los servicios generales de salud, y prohibiéndose el uso de otros antimaláricos que no estuviesen normados. Se dieron indicaciones para tratar la malaria complicada o resistente con quinina parenteral y SP respectivamente 16.
Se estableció el tratamiento radical y presuntivo (Tabla 1). El tratamiento radical consistió en la administración de CQ en boca, en un esquema de tres días a dosis de 10 mg/kg de peso por día el 1er y 2do día; y 5 mg/kg de peso el 3er día. Si la malaria era por P. vivax, se añadía un tratamiento anti-rrecidivante en base a PQ a dosis de 0,25 mg/kg de peso-día por 14 días. Si la malaria era por P. falciparum, se añadía una dosis única gametocitocida de 0,75 mg/kg de peso de PQ. La finalidad del tratamiento radical era la cura clínica y parasitológica de la malaria, administrándose exclusivamente a los casos de malaria confirmados por gota gruesa 16
El tratamiento presuntivo consistía en la administración de una dosis única de 600 mg de CQ base en una sola toma por vía oral, a todo febril sospechoso de malaria a quien se tomaba una gota gruesa. Si la gota gruesa era positiva, el personal continuaba administrando CQ y PQ hasta completar el esquema. Si la gota gruesa era negativa, el personal suspendía la administración de los antimaláricos. La finalidad epidemiológica y operativa del tratamiento presuntivo era remitir los síntomas clínicos y prevenir que el caso sospechoso fuera una fuente de infección de malaria para el mosquito, hasta tener el resultado de la gota gruesa 16.
En la década de 1980 no se emitieron normas técnicas nacionales destinadas a vigilar la eficacia del tratamiento antimalárico; tampoco la calidad o reacciones adversas; al parecer, una situación similar a la observada para el resto de fármacos en el país. Además de la oferta de antimaláricos administrados por el SNEM, existió una alterna suministrada por el comercio farmacéutico privado de CQ y PQ en cantidades no precisadas que saturaban la demanda local.
El proceso de desactivación y descentralización de las intervenciones de control vectorial del SNEM, como consecuencia de la horizontalización del servicio de erradicación en la década de 1980 estuvo asociado a una reducción drástica de la cobertura de detección de casos y administración del tratamiento antimalárico, haciendo difícil una evaluación del impacto de la política de medicamentos antimaláricos en base a monoterapia 17. En 1982, el SNEM fue descentralizándose y en 1987 fue cambiado completamente a un Programa de Control de Malaria.
Las autoridades sanitarias responsables del control de la malaria, asumieron a priori una elevada eficacia de la CQ para el tratamiento de la malaria por P. vivax y P. falciparum. La administración masiva de esquemas presuntivos en desmedro de esquemas radicales en las áreas con transmisión inestable de malaria, con reducción de la vigilancia hemática, una cobertura baja y suspensión de los rociamientos residuales en las áreas endémicas, probablemente contribuyeron en forma importante a mantener la transmisión de la malaria; ocasionando serios problemas para su control durante la siguiente década.
La década de 1990
Epidemiológicamente durante la década de 1990 se observó un aumento alarmante en la incidencia de malaria por P. vivax y P. falciparum en la costa norte y la cuenca amazónica del país; al finalizar este período, los indicios de una falta de respuesta adecuada a los esquemas antimaláricos utilizados eran evidentes y requería de una evaluación y revisión de la política de medicamentos antimaláricos vigente.
En este período, los elementos necesarios para integrar una política de medicamentos antimaláricos variaron en función a exigencias epidemiológicas y operacionales que sucedieron en tres fases distintas, cada una de ellas asociada a procesos de cambio estratégico y organizacional del Programa de Control de Malaria, de los servicios de salud, y la evolución de la resistencia de la malaria al tratamiento con CQ y SP. Estas exigencias técnicas y operativas fueron manejadas elaborando instrumentos técnicos, protocolos, normas y directivas nacionales caracterizadas en tres etapas; las que denominaremos: de monoterapia, de terapia múltiple y terapia de combinación. Estas se diferencian entre sí por los objetivos operacionales del tratamiento, la forma de prescribir y administrar los antimaláricos, la composición y duración de los esquemas de tratamiento, la forma de monitorear su eficacia y el impacto de cada una de estas fases sobre el control de la malaria 18.
La etapa de la monoterapia (1990-1994): La monoterapia antimalárica continuó administrándose en el país hasta finalizar el año 1994, caracterizándose por usar exclusivamente CQ como antimalárico esquizonticida en un esquema terapéutico único para tratar la malaria tanto por P. vivax como por P. falciparum. Al tratamiento de la malaria por P. vivax, se agregó 14 días de PQ como antirrecidivante; no se prescribía tratamiento gametocida para P. falciparum con PQ. Se usó aisladamente y sin un protocolo específico de procedimientos otros esquemas de tratamiento en base a SP (25 mg/kg de peso del componente sulfadoxina) para infecciones de P. falciparum que no respondían a la CQ y quinina para formas graves de malaria 16.
La CQ era programada, adquirida y distribuída en los niveles regionales con presupuesto nacional descentralizado a las unidades administrativas por el Programa Nacional de Control de la Malaria. La planificación y programación del suministro de medicamentos antimaláricos era regional, no se dispuso de un seguimiento o control central que evaluara y monitoreara las demandas y consumos regionales. La provisión era gratuita a través de los servicios generales de salud; no se efectuó una vigilancia sistemática de la resistencia y reacciones adversas al tratamiento, porque no estaban disponibles sistemas de pesquisas y/o controles de calidad. Aunque no se disponía de un sistema de vigilancia de la resistencia a la CQ, se empezó a reportar oficialmente y por primera vez en el Perú, evidencia de fallas terapéuticas en el tratamiento del P. falciparum con CQ, en varios estudios in vivo usando diversas metodologías 19, 20.
El cumplimiento de los protocolos de tratamiento fueron débiles durante este periodo, predominando las interpretaciones y adaptaciones regionales de los esquemas de tratamiento. Por ejemplo, en la costa norte del país, se utilizaron esquemas acortados de tratamiento para malaria por P. vivax con la administración de PQ por 5 días como antirrecidivante 17; en la cuenca amazónica se siguieron usando los tratamientos presuntivos en base exclusivamente a CQ.
La etapa de la terapia múltiple (1994-1999): Entre 1994 y 1999 se cambió a la terapia múltiple, ampliándose a tres los esquemas de tratamiento y ordenándolos en líneas terapéuticas de aplicación única y obligatoria en todo el territorio nacional (Tabla 2). Los esquemas básicos en este periodo eran CQ-PQ como 1ra línea terapéutica, SP-PQ como 2da línea terapéutica y quinina-tetraciclina o quinina-clindamicina más PQ como 3ra línea terapéutica. Estos esquemas estaban ordenados en forma secuencial para su elección 21. En el nivel local, según el comportamiento de la falla terapéutica, podían usarse electivamente estos tres esquemas. También se incorporaron protocolos para tratar la malaria grave y resistente. El objetivo del tratamiento antimalárico fue la cura clínica y parasitológica de todos los pacientes con malaria; no se recomendaron esquemas de tratamiento presuntivos. Por consiguiente, todo paciente afectado por malaria, aún en presencia de una adecuada respuesta clínica al tratamiento, debía ser retratado con esquemas alternos, si se demostraba reaparición de parasitemia por gota gruesa durante el seguimiento.
El MINSA mediante una Resolución Ministerial (R. M. Nº 249-94-SA/DM) reorientó las acciones de prevención y control de la malaria en el país creando el Programa Nacional de Control de Malaria y Otras Enfermedades Metaxénicas (PCMOEM), incorporando importantes elementos políticos, doctrinarios, estratégicos y técnico-operativos relacionados con la lucha antimalárica en base a la incorporación, organización y participación de los servicios de salud. El MINSA desarrolló de esta forma un proceso de expansión de la cobertura de atención de los servicios de salud acorde con la situación de pacificación política, estabilidad económica y social, en un contexto prestacional sanitario que privilegiaba la atención curativa de la malaria.
El diagnóstico de la malaria era parasitológico, a través de gota gruesa y clínico-epidemiológico. El tratamiento se prescribió y administró gratuitamente a todos los casos confirmados por diagnóstico parasitológico según especie plasmodial y casos probables. El caso confirmado de malaria se definió como todo sujeto febril con un examen de gota gruesa positivo a Plasmodium spp; un caso probable era todo febril con gota gruesa negativa a quien se administraba tratamiento completo bajo criterios clínicos.
En relación a la programación, logística y dotación de antimaláricos, el MINSA se convirtió en el único demandante de estos medicamentos en el país, absorbiendo el total de los antimaláricos disponibles en el mercado; ofertando masivamente antimaláricos gratuitos a la población en las áreas endémicas de malaria, reduciendo a su mínima expresión la oferta local y la automedicación. Esto favoreció la centralización de la logística y la sistematización de una programación nacional para atender la demanda del sector público y privado, el ordenamiento del uso y prescripción de los antimaláricos en el país. Al mismo tiempo, facilitó al MINSA su condición de conductor en materia de política de los medicamentos antimaláricos.
El PCMOEM en 1994 implementó un nuevo instrumento de vigilancia del comportamiento de la falla terapéutica al tratamiento antimalárico administrado por los servicios generales de salud, llamado estudio de "cohorte" de tratamiento antimalárico. Este sistema registraba e identificaba los pacientes que recibían tratamiento con diagnóstico confirmado por gota gruesa, para cada especie plasmodial en los establecimientos de salud; se registraba los resultados clínicos y de laboratorio durante 14 días para casos de malaria por P. vivax y por 28 días para los casos de malaria por P. falciparum 22. El fracaso terapéutico estuvo definido como la reaparición del Plasmodium en las gotas gruesas de control el 14º día para malaria por P. vivax y durante el 7º, 14º, 21ro, y 28vo día para P. falciparum. En 1996, el seguimiento de gota gruesa en la malaria por P. falciparum fue reducido de 28 a 14 días 23.
Se usó este estudio para monitorear la eficacia operacional de las diferentes líneas de tratamiento a nivel regional. El nivel máximo de falla terapéutica necesario para rotar una línea de tratamiento fueron establecidos inicialmente en 50% por el PCMOEM; en 1998 se modificó a más de 30% y que comprometiera un ámbito geográfico mayor a un distrito 23.
El monitoreo de la efectividad de los servicios de salud en la administración del tratamiento antimalárico se hizo utilizando datos del mismo estudio. La cobertura de ingreso al estudio de cohorte fue manejada como un indicador de la calidad con que los enfermos eran incorporados al diagnóstico, curación y seguimiento por los servicios de salud. Se consideraban un abandono al tratamiento y ausencia de curación cuando la administración del medicamento no era supervisada y/o no se realizaron las gotas gruesas de control durante el seguimiento 24.
LA RESISTENCIA A LOS ANTIMALÁRICOS EN EL PERÚ
A partir de 1994, la prestación de una atención curativa protocolizada para malaria en los servicios generales de salud y la implementación de un sistema de registro e información confiable, generó datos operacionales y epidemiológicos sobre casuística, mortalidad, letalidad y atenciones sanitarias. Esto facilitó la evaluación dinámica del comportamiento epidemiológico y de las actividades de control incorporadas en los servicios generales de salud, entre estas, el tratamiento y su respuesta clínico-terapéutica; expandiéndose la cobertura de exploración hemática, el diagnóstico parasitológico y el tratamiento, exponiendo la real magnitud y dispersión de la malaria en el Perú 25.
La terapia antimalárica múltiple, conjuntamente con otras actividades de intervención contribuyeron a controlar la mortalidad y morbilidad por malaria, particularmente en la costa norte durante el fenómeno "El Niño" en 1998, cuando se reconoció que la CQ había perdido su eficacia. En la cuenca amazónica, una de las probables causas del impacto parcial de la terapia múltiple en el control de la malaria, fueron las elevadas tasas de abandono al tratamiento que fluctuaron entre 30% y 40% y que no han sido superadas hasta ahora 25, 26.
Durante el período 1997-1998, la información obtenida a través de tres diferentes fuentes jugaron un rol importante en la respuesta del MINSA frente a la emergencia de fármacorresistencia de P. falciparum a la CQ: el sistema de información operacional del estudio de cohorte, la notificación periódica de las observaciones clínicas hechas por los
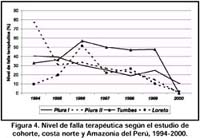
servicios de salud que experimentaban las fallas terapéuticas con la CQ y el aumento de la incidencia de malaria en el país a pesar de las medidas de control efectuadas.Durante 1994-1999, los estudios de cohorte mostraron niveles de falla terapéutica nacionales para P. falciparum a CQ de 22.0% a 27.0%. El análisis de los datos de la región amazónica a nivel regional y local mostró un nivel de falla terapéutica para la CQ en las provincias de Maynas, Loreto y Ramón Castilla del Departamento de Loreto que se elevaba de 10% a 51%; entonces se efectuó un cambio de la 1ra línea terapeútica para el tratamiento de la malaria por P. Falciparum no complicada de CQ a SP en 1997. En el ámbito geográfico poblacional de Requena, Ucayali y Alto Amazonas, por tener niveles de falla terapéutica inferiores a 20%, se continuó ultizando la CQ como 1ra línea de tratamiento hasta 1998, cuando se cambió a SP. En el período 1998-2000, el nivel operacional de falla terapéutica a la SP fluctuó entre 5% y 20% en la cuenca amazónica 27, 28 (Figura 4).
En la costa norte del país se mantuvo un nivel creciente de falla terapéutica a la CQ que se elevó de 20% a 40% y de 0 a 5% a la SP durante 1994-1998 27, 28. La decisión de cambiar la 1ra línea terapeútica en base a CQ por SP en la costa norte se efectuó a inicios de 1998 como medida de emergencia en el contexto del fenómeno "El Niño". Esta medida se aplicó por la sobresaturación de los servicios de salud ante el incremento
de casos y una elevada tasa de reingresos a retratamiento antimalárico de 40% a 50%. Aunque se habían registrado anteriormente niveles de falla terapéutica mayores a 50% con la CQ, el cambio de tratamiento de primera línea no se efectuó en años anteriores en forma extensa y amplia, porque los reportes eran locales y focalizados; considerándose que el acceso y cobertura de los afectados era óptimo, el reingreso y retratamiento de pacientes era cubierto adecuadamente por los servicios de salud, y no se notificaba una alta incidencia de malaria grave, ni un incremento de la mortalidad por ésta.En 1998 el Ministerio de Salud del Perú, frente a los datos de los estudios operacionales de cohorte, las observaciones clínicas de la falla terapeútica no sistematizadas y la epidemia de malaria en la Amazonia peruana; consideró pertinente hacer una evaluación
científica formal de la eficacia de los medicamentos antimaláricos de uso principal en la cuenca amazónica por lo que el MINSA y el Instituto Nacional de Salud (INS) con apoyo del Centers for Disease Control and Prevention (CDC), Atlanta, y financiamento de la Agencia Internacional para el Desarrollo de los Estados Unidos (USAID) tomaron acuerdos de carácter técnico y operativo orientados a evaluar, a través de estudios de eficacia in vivo, la resistencia de P. falciparum a CQ y SP en el área de Iquitos. Debido a que el protocolo existente de la OMS para los estudios in vivo fue desarrollado específicamente para áreas de alta transmisión de P. falciparum como el África, fue necesario hacer algunas modificaciones para el estudio planificado en Iquitos. Durante el periodo marzo a junio de 1998, el INS, apoyado por el CDC y con la participación de la Dirección de Salud Loreto, efectuó un estudio in vivo de la eficacia de CQ y SP en el Hospital de Apoyo Iquitos y el Centro de Salud Moronacocha, encontrándose un alto nivel de resistencia con fracasos parasitológicos mayores de 30% para ambos medicamentos 5.Al mismo tiempo que el Perú planificaba los estudios in vivo, varios otros países de la región enfrentaban problemas similares asociados con la extensión e intensificación de la resistencia de P. falciparum; pero por los diferentes métodos usados para los estudios in vivo y in vitro, era difícil comparar los datos o usarlos para tomar decisiones. Como respuesta a este problema, en marzo de 1998 la OPS organizó una Reunión Técnica en Manaos, Brasil, para discutir y llegar a un consenso sobre un protocolo estandarizado para evaluar in vivo la eficacia de los medicamentos antimaláricos para el tratamiento de infecciones no complicadas de P. falciparum en las Américas 11, y discutir los pasos técnicos que debería seguir un Ministerio de Salud para estudiar la distribución geográfica de la resistencia en su territorio.
En setiembre de 1998, el INS en coordinación técnica con la Dirección General de Salud de las Personas (DGSP), Oficina General de Epidemiología, Direcciones Regionales de Salud y el PCMOEM y el apoyo del Proyecto Vigía (MINSA-USAID), acordaron extender la evaluación de la eficacia y tolerancia de CQ y SP a otras áreas maláricas del país e incluir la evaluación de MQ como una posible alternativa para la SP. Se conformó un Comité Técnico para la Vigilancia de la Fármaco Resistencia de la Malaria integrado por las instancias técnicas anteriormente mencionadas. Siguiendo las recomendaciones de la Reunión Técnica de la OPS en Manaos, se validó un protocolo de investigación denominado, "Evaluación Terapéutica de los Medicamentos Utilizados para el Tratamiento del Paludismo por P. falciparum No Complicado en el Perú," como instrumento aplicativo necesario para ejecutar este proyecto 29.
Durante marzo a mayo de 1999, el INS, con apoyo técnico del CDC, efectuó un estudio multicéntrico de evaluación in vivo en tres distritos ubicados en la costa norte del país; en Zarumilla (Tumbes), Bellavista y La Arena (Piura) y en dos distritos de la cuenca amazónica; en Santa María de Nanay y Santa Clara (Loreto). De este modo, se estableció la presencia de fármacorresistencia a CQ en niveles superiores a 30% en ambas áreas geográficas 30, 31. Con respecto a SP, se demostró una resistencia mayor al 30% en la Amazonia, manteniendo su sensibilidad en la costa norte. Los resultados de estos estudios fueron confirmados por otros 3 estudios in vivo, demostrando > 60% resistencia a la SP en las afueras de Iquitos 4, 6 y > 30% resistencia a la CQ, sin ningún fracaso terapeútico a SP en 9 pacientes del departamento de Piura 32.
A partir del segundo semestre de 1998, el MINSA y la Dirección Regional de Salud Loreto tomaron la decisión de cambiar la primera línea de tratamiento en base a SP por quinina-clindamicina en las provincias de Maynas, Loreto y Ramón Castilla al demostrarse un nivel de resistencia mayor al 30% a la SP en los estudios in vivo efectuados. El cambio no se implementó en todos los servicios por problemas operacionales asociados a la administración de quinina por los efectos colaterales del cinchonismo y la duración del esquema de tratamiento (7 días), observándose altas tasas de abandono y pérdida de pacientes al seguimiento en los estudios de cohorte. En el ámbito geográfico poblacional de Requena, Ucayali y Alto Amazonas, se continuó utilizando SP por tener niveles de falla terapeútica en el estudio de cohorte inferiores a 20%. Según los datos del estudio de cohorte, los esquemas de quinina-clindamicina y quinina-tetraciclina mantuvieron su eficacia para el tratamiento de P. falciparum resistente tanto en la costa ecuatorial norte como en la cuenca amazónica del país 28, 33.
LA NUEVA POLÍTICA DE MEDICAMENTOS ANTIMALÁRICOS, 1999-2001
En agosto de 1999, teniendo como antecedente los datos científicos acerca de la eficacia de CQ y SP en la cuenca amazónica y la costa norte, el MINSA convocó a una Reunión Técnica de Evaluación y Validación de la Política Nacional de Medicamentos Antimaláricos en Lima. Se evaluó la situación epidemiológica de la malaria por P. falciparum fármaco resistente y se presentó una propuesta para una nueva política de medicamentos antimaláricos basada en la terapia de combinación. La propuesta técnica fue preparada por el Grupo Técnico Nacional de Malaria, para discusión de los administradores, epidemiólogos y médicos del nivel central, los equipos técnicos de los niveles regionales involucrados en el cambio, asesores externos y miembros de las instituciones académicas y sociedades científicas que participaron en los estudios de investigación. En esta reunión se afirmó la necesidad de cambiar a una nueva política de
medicamentos antimaláricos en base a terapia de combinación, recomendando la introducción de MQ más AS en la cuenca amazónica y SP-AS en la costa norte. Los objetivos principales del cambio en la política eran asegurar un tratamiento altamente eficaz y, al mismo tiempo, retardar la extensión de la fármaco resistencia y prolongar la vida útil de los antimaláricos con el uso de terapia de combinación, según recomendaciones de la OMS/OPS 34.El Grupo Técnico Nacional identificó las áreas geográfico-poblacionales afectadas por la resistencia plasmodial correspondientes a la costa norte y cuenca amazónica, definiendo la extensión geográfica de las áreas de introducción de los nuevos esquemas de tratamiento basados en terapia de combinación (Tabla 3). En la costa, concordante con el estrato operativo denominado Macro Región Norte, se utilizaría como primera línea de tratamiento para la malaria por P. falciparum no complicado la combinación de SP-AS, como segunda línea de tratamiento el esquema MQ-AS y como tercera línea de tratamiento el esquema quinina-clindamicina. En la cuenca amazónica, concordante con el estrato operativo denominado Macro Región Amazónica, se utilizaría como primera línea de tratamiento la combinación de MQ-AS y como segunda línea de tratamiento la quinina-clindamicina. Para el tratamiento de la malaria grave se conservó el esquema de quinina-clindamicina endovenosa según protocolo nacional para todos los servicios de salud del país 24, 35. Esta reunión técnica también estableció la necesidad de establecer un sistema de vigilancia de la eficacia de los medicamentos antimaláricos sostenible en el país, en base a monitoreo en establecimientos centinelas, pero no se definieron más detalles 24.
Cuando se recomendó el cambio del tratamiento múltiple a terapia de combinación antimalárica en la costa norte con el esquema de SP-AS, no había mucha experiencia a nivel mundial en relación a la eficacia o tolerancia de esta combinación y nunca antes había sido usada en el Perú. Entre marzo y julio de 2000 el INS, las DISAs Tumbes y Loreto con apoyo financiero del Proyecto VIGIA y la asistencia técnica del Instituto de Investigaciones de Enfermedades Tropicales de la Marina de los Estados Unidos (NMRCD - Perú), se llevó a cabo una evaluación de la eficacia y tolerancia de la monoterapia con SP y la terapia de combinación SP-AS en los centros de salud de Bellavista y Querecotillo en Piura. Dos (2%) pacientes de los 91 estudiados durante 28 días fracasaron con SP sola y sólo uno de 94 (1%) con la combinación de SP-AS 36. Aunque no se observaron reacciones adversas graves, los pacientes que recibieron SP-AS tuvieron más náuseas, vómitos y dolor abdominal (4%) o una erupción en la piel y/o
picazón (4%) que aquellos tratados sólo con SP.En la cuenca amazónica, la decisión de introducir la terapia de combinación con MQ-AS se debió a los efectos colaterales y baja adherencia con los esquemas quinina-tetraciclina y quinina-clindamicina, y con el objetivo de preservar la eficacia de la combinación de quinina-clindamicina para el tratamiento de la malaria grave. Para asegurar la eficacia y tolerancia de la combinación de MQ-AS en el Perú, los mismos participantes llevaron a cabo entre marzo y agosto del 2000 un estudio en el Hospital de Apoyo Iquitos y el Centro de Salud Moronacocha de MQ sola y MQ-AS. El resultado de este estudio fue que tanto la MQ sola como la combinación de MQ-AS fueron 100%
eficaces y no dieron reacciones adversas graves 37.En setiembre de 1999, asociado al proceso de evaluación de la terapia de combinación; en el contexto político, técnico y normativo del MINSA a través del PCMOEM se actualizó la Norma Nacional para la Prevención y Control de la Malaria en el Perú, modificando los contenidos de la atención curativa de la malaria en base a la terapia de combinación recomendada. La nueva Política Nacional de Medicamentos Antimaláricos para el Control de la Malaria fue aprobada por R.M. 497-99-SA/DM.
En octubre, el Ministerio de Salud y el PCMOEM abordaron los procedimientos técnico-administrativos para programar, adquirir y distribuir los nuevos esquemas antimaláricos, incluyéndolos en el Plan Operativo para el Control de la Malaria 2000-2001. Se estimó la adquisición de 66 304 tratamientos de SP-AS y 35 925 tratamientos de MQ-AS necesarios para abastecer el país para los siguientes dos años (2000-2001). Simultáneamente, la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID), el organismo técnico responsable del registro y regulación de los fármacos
y medicamentos utilizados por los Programas de Salud Pública, actualizó e incorporó en el Petitorio Nacional de Medicamentos y el Registro Nacional de Medicamentos del MINSA el uso de la MQ y el AS como antimaláricos aprobados y registrados en el país 24.En diciembre de 2000, al terminar los estudios de evaluación de la terapia de combinación en base a MQ-AS y SP-AS, el MINSA-PCMOEM convocó a una reunión técnica en Lima para presentar y discutir los resultados y conclusiones de los dos estudios. Basándose en los resultados y las discusiones técnicas, se acordó implementar las dos nuevas terapias de combinación en el país. La cuidadosa discusión que había ocurrido anteriormente, sobre los nuevos fármacos antimaláricos MQ y AS, redujo el tiempo y el impacto negativo que podrían haberse originado frente a problemas de oportunidad, abastecimiento y disponibilidad durante el proceso de cambio que debía efectuarse en base a los tratamientos remanentes de SP y MQ existentes en el país.
En esta misma reunión se discutió la organización y características técnicas de un Sistema de Vigilancia de la Resistencia a Medicamentos Antimaláricos en el Perú y una
Comisión Técnica Nacional de Fármacovigilancia de la Resistencia a Medicamentos Antimaláricos que fueron establecidos por R.M. No 447-2001 SA/DM en julio de 2001. Este sistema de vigilancia contempló la identificación y selección de tres puestos centinelas fijos basados en centros de salud de la red de servicios en la Macro-Región Norte y en la Macro-Región Amazónica del país. Se consideraron que éstas fueron las unidades centinelas mínimas necesarias para efectuar la vigilancia de la resistencia a través de estudios in vivo de eficacia en intervalos de 3 años.LA IMPLEMENTACIÓN DE LA NUEVA POLÍTICA DE MEDICAMENTOS ANTIMALÁRICOS
En agosto de 2001 el MINSA a través de la DGSP - PCMOEM mediante R.D. Nº 094-2001-DGSP aprobó la Directiva Nacional Nº005-2001-DGSP-DEAIS-DPRD-PCMOEM, actualizando los esquemas de terapia de combinación con SP-AS y MQ-AS y ordenando su implementación en el país. El PCMOEM con apoyo del Grupo Técnico Nacional de Malaria fueron responsables de implementar la nueva terapia de combinación mediante el desarrollo de seis seminarios regionales de capacitación en la Macro Región Norte y la Macro Región Amazónica, un proceso que se inició en setiembre de 2001 y culminó en marzo de 2002 con eventos similares efectuados en la Macro Región Nororiental, Macro Región Central y Macro Región Sur y Sud Oriental del país. Este proceso de capacitación en la nueva política de tratamiento antimalárico demoró 8 meses; el retraso temporal de la implementación, se debió en parte, al proceso de reorganización de la Dirección General de Salud de las Personas (DGSP) y los Programas de Salud Pública entre ellos Malaria y Otras Enfermedades Metaxénicas, los cuales fueron fusionados e integrados en nuevas unidades técnicas.
Los seminarios regionales abordaron aspectos básicos de epidemiología de la fármaco resistencia en el país, la nueva política de medicamentos antimaláricos, bases farmacológicas de los antimaláricos; efectos colaterales, diagnóstico y tratamiento de la malaria no complicada, atención y manejo de la malaria grave, malaria en gestantes, organización de servicios, sistemas de información y vigilancia epidemiológica. Los técnicos que participaron incluyeron personal del PCMOEM del nivel central, nivel regional y representantes de las instituciones científicas que participaron en los estudios in vivo de los medicamentos. La duración de los seminarios regionales de capacitación fue en promedio de 3 días, capacitándose un total 300 funcionarios entre médicos, enfermeras, responsables del diagnóstico de laboratorio del nivel regional y local. Inicialmente, la capacitación estuvo dirigida a profesionales responsables regionales del control de la malaria y luego continuó haciéndose en cascada del nivel regional al local. Los costos de inversión para la capacitación fueron de USD $65 000,00; el financiamiento fué atendido con fondos de tesoro público del MINSA y Proyecto VIGIA.
Para el año 2000, los costos del cambio de la política de medicamentos antimaláricos contemplaron una inversión inicial de USD $ 635 507 para adquirir los nuevos medicamentos; cinco veces más que los costos estimados para adquirir los antimaláricos
para el año 1999; en el cual se invirtieron USD $ 107 959. Para el año 2001, el costo de los antimaláricos de combinación se redujo a $ 269 375 USD. El análisis de costos por antimalárico adquirido mostró que el 80% de los costos se destinó para adquirir MQ y AS, el 11% para quinina-clindamicina y el 7% para CQ-PQ. Los costos unitarios de los nuevos esquemas de combinación fueron de $ 4,29 USD para SP-AS, de $ 18,65 USD para el esquema MQ-AS, de $ 1,56 USD para el esquema quinina-clindamicina y $ 0,58 USD para el esquema CQ-PQ.Las adquisiciones se efectuaron mediante compra internacional y en el mercado farmaceútico nacional por los laboratorios que ofertaban MQ y AS localmente. El tiempo de demora entre el requerimiento y recepción de los nuevos antimaláricos fue de 6 meses para el periodo 1999-2000, con un considerable retraso para la adquisición de AS por falta de disponibilidad en el mercado nacional y dificultades en su adquisición internacional por problemas administrativos del MINSA. Para el periodo 2000-2001 el retraso en el abastecimiento de MQ y AS fue entre 6 y 8 meses por dificultades administrativas y logísticas asociadas al cambio de política de adquisiciones en el MINSA.
DISCUSIÓN
Durante el periodo 1990-1999, el Perú sufrió un fenómeno de reemergencia de malaria por P. falciparum y P. vivax en la cuenca amazónica y la costa norte del país. Este fenómeno estuvo asociado con la aparición y extensión de la fármaco resistencia a antimaláricos. Los estudios in vivo de eficacia de los medicamentos antimalaricos llevados a cabo entre los años 1998 y 2000 demostraron dos patrones geográficos de fármaco resistencia del P. falciparum. En la costa norte, las cepas tenian alta resistencia a la CQ pero la SP siguió siendo efectiva 30. En la Amazonia los estudios mostraron alta resistencia tanto a la CQ como a la SP 5, 31. Como resultado de este problema, fué
necesario implementar un cambio en los medicamentos de primera línea para el tratamiento de infecciones de P. Falciparum no complicado en ambas regiones (Figura 5).
Los cambios en la política de medicamentos antimaláricos implementados en el Perú tienen varios objetivos. Primero, se espera que la incorporación de la terapia de combinación para tratar malaria por P. falciparum no complicado en base a SP-AS y MQ-AS ayude a prevenir el desarrollo de la resistencia a los medicamentos antimaláricos y prolongar la vida útil de la SP y la MQ 12, 13. Segundo, el uso de una artemisinina como parte de la terapia de combinación ofrece la ventaja teórica de reducir la transmisión por su efecto contra los gametocitos 15. Finalmente, el reordenamiento de las líneas terapeúticas para la malaria por P. falciparum no complicado, proteje la eficacia de la combinación de quinina-clindamicina como segunda línea de tratamiento antimalárico en la cuenca amazónica y como la terapia de elección para la malaria grave a nivel nacional 24.
Los Programas de Control de la Malaria no deben asumir a priori la eficacia y efectividad de los antimaláricos y esquemas de tratamiento que utilizan. Aunque el estudio operacional de la falla terapéutica (estudio de cohorte) no es concluyente para orientar cambios en una política de medicamentos antimaláricos, ha demostrado ser un buen trazador de la falla terapéutica y sus variaciones cuando la cobertura y calidad de
información sean fidedignas 22. Estos estudios sirven también para guiar la selección de los establecimientos centinelas para estudios in vivo. Sin embargo, cuando existen evidencias operacionales de una pérdida de la eficacia en el tratamiento antimalárico, los estudios in vivo son indispensables y concluyentes para guiar el proceso de cambio y actualización de una política nacional de medicamentos antimaláricos.El Plan Nacional de Control de la Malaria de un país debe establecer los límites permisibles de falla terapéutica de los estudios in vivo que orienten el momento de revisión y cambio de las líneas terapéuticas. La OMS ha recomendado una proporción de fallas terapeúticas de 25% como límite superior permisible, aunque este nivel dependerá de varios factores; incluyendo los objetivos del Programa Nacional para el Control de la Malaria, el costo, la aceptabilidad y la seguridad de los medicamentos alternativos 38, 39. En el Sudeste Asiático los cambios en los medicamentos de primera línea se han hecho usualmente con niveles menores de resistencia; mientras que en Africa, el costo de los nuevos regímenes de medicamentos es determinante y muchos Ministerios de Salud no han cambiado sus medicamentos de primera línea, aún cuando más de 40-50% de los pacientes no hayan eliminado sus parasitemias o tengan una recurrencia en los primeros 14 días 40, 41.
Aunque el proceso de revisión y adecuación de una política nacional de medicamentos antimaláricos no es complicado técnicamente, puede llevar varios años. En el Perú, la planificación, ejecución y evaluación de los estudios de eficacia in vivo a los antimaláricos tomó tres años (1998-2000). La revisión de las normas nacionales tomó 4 meses, la implementación operativa y capacitación de personal al nivel regional de las nuevas normas demoró 8 meses. Por lo tanto, en nuestra experiencia, el proceso de evaluación, revisión, adecuación e implementación de la nueva política de medicamentos antimaláricos demoró 4 años en las condiciones políticas, técnicas, administrativas y logísticas que sucedieron en el Perú en ese momento.
El proceso para cambiar una política nacional de medicamentos antimaláricos no termina con la aprobación del cambio por el Ministerio de Salud. Para su adecuada y oportuna implementación, es imprescindible enfatizar en la disponibilidad de los tratamientos, desde su adquisición en el mercado nacional o externo hasta su distribución, disponibilidad y oferta en los establecimientos de salud locales. Son también aspectos críticos que deben asegurarse en este proceso la capacitación del personal de salud que administrará los nuevos medicamentos y la educación sanitaria de los pacientes que los van a recibir.
Al implementar una nueva política de medicamentos antimaláricos, los Programas de Control de Malaria deben establecer un plan de revisión y actualización de la política de medicamentos antimaláricos, con una frecuencia de 2 a 3 años, utilizando los métodos operacionales y científicos convencionales de evaluación disponibles para garantizar la calidad, eficacia y efectividad del tratamiento antimalárico que administran.
El MINSA del Perú ha establecido un Sistema Nacional de Vigilancia de la Eficacia y Resistencia a Drogas Antimaláricas, basado en el monitoreo operacional de la falla terapéutica (estudio de cohorte) y los estudios in vivo de la eficacia en sitios centinelas, apoyado por estudios de resistencia utilizando marcadores moleculares. Sin embargo, el cambio de los esquemas terapéuticos puede ser decidido sólo en base a los resultados de los estudios in vivo.
El proceso de desarrollo de la política de medicamentos antimaláricos en el Perú durante los últimos años ha fortalecido la capacidad institucional y técnica del MINSA; propiciando la integración de un grupo científico nacional con amplia experiencia en la vigilancia de fármaco resistencia, política de medicamentos antimaláricos, capacitación y asesoría de los técnicos de campo. Como resultado, el Perú ha llegado a ser considerado por la OPS/OMS como un centro regional de capacitación para el personal técnico-profesional de los Programas de Control de Malaria de otros países de la región que enfrentan problemas similares de resistencia a los medicamentos antimaláricos. En los últimos 3 años, equipos científico-profesionales del MINSA del Perú han capacitado personal profesional de los Programas de Control de Malaria de Bolivia, Ecuador y Surinam; habiendo retornado a sus países para planificar y llevar a cabo estudios similares orientados al control de la malaria en sus propios países.
AGRADECIMIENTOS
Los autores quieren agradecer a todos los médicos, enfermeras y microscopistas en los centros de salud y hospitales donde se llevaron a cabo los estudios in vivo que respaldaron los cambios de la política de medicamentos antimaláricos en el Perú entre 1998 y 2001. Queremos agradecer también a los Drs. Carlos Carrillo Parodi, Eduardo Falconí Rosadio y Wilmer Marquiño del Instituto Nacional de Salud; el Sr. Richard Martín y los Drs. Susan Brems y Jaime Chang de USAID; los Drs. Carlos Calampa del Águila y Jorge Reyes Dávila de la Dirección Regional de Salud Loreto; los Drs. Milton Feijoó Morán de la Dirección Regional de Salud Tumbes, Luis Beingolea More de la Dirección Regional de Salud Piura I y Ana María Palacios Farfán de la Dirección Regional de Salud Piura II y el Dr. Jesús Toledo Tito de la Dirección General de Salud de las Personas del Ministerio de Salud en Lima, que apoyaron estos esfuerzos. Este trabajo ha sido respaldado parcialmente por el Programa de Vigilancia Global de Infecciones Emergentes del Departamento de Defensa (DoD-GEIS No. 847705 82000 25GB B0016) de los Estados Unidos y el manuscrito aprobado por la Junta de Revisión Institucional del NMRC (Protocolo # 31529) en cumplimiento con todos los reglamentos federales que rigen la protección de sujetos humanos. Las opiniones y afirmaciones contenidas aquí son propias de los autores y no pueden interpretarse como posición oficial o reflejar la opinión del Departamento de la Marina o del Servicio Naval.
REFERENCIAS
1. Need JT, Rogers EJ, Phillips IA, Falcon R, Fernandez R, Carbajal F, Quintana J. (1993). Mosquitoes (Diptera: Culicidae) captured in the Iquitos area of Peru. J Med Entomol 30: 634-8. [ Links ]
2. Fernández R, Carbajal F, Quintana J, Chauca H, Watts DM (1996). Presencia del A. (N) darlingi (Diptera: Culicidae) en los alrededores de la ciudad de Iquitos, Loreto-Perú. Soc Peruana Enferm Inf Trop 5: 10-2. [ Links ]
3. Aramburú-Guarda J, Ramal-Asayag C, Witzig R. 1999; Malaria reemergence in the Peruvian Amazon region, Emerg Inf Dis 5: 209-15. [ Links ]
4. Navitsky RC, Witzig RS, Quintana-Zurita J, Ríos M, Aramburú-Guarda JS, et al. In vivo resistance of Plasmodium falciparum to pyrimethamine-sulfadoxine in children of the Amazon region of Peru. Abstract #378, American Society of Tropical Medicine and Hygiene Meeting; Dec 7-11; Orlando EEUU. [ Links ]
5. Stennies GM, Marquiño W, Pardavé B, Roper M, Cabezas C, Kolczak M, et al. Efficacy and molecular epidemiology of chloroquine and sulfadoxine-pyrimethamine for the treatment of uncomplicated Plasmodium falciparum infections in the Peruvian Amazon. Abstract #343, American Society of Tropical Medicine and Hygiene Meeting, November 28-December 2, 1999; Washington D.C. [ Links ]
6. Magill AJ, Garcia C, Solari L, Ylquimiche L, Vásquez M, Carey C, et al. Therapeutic efficacy of pyrimethamine-sulfadoxine in the Peruvian Amazon. Abstract #329, American Society of Tropical Medicine and Hygiene Meeting, Washington D.C. November 28-December 2, 1999. [ Links ]
7. Pampana E. A Textbook of malaria eradication. Oxford University Press, 1963 pp 508. [ Links ]
8. World Health Organization. A global strategy for Malaria control. Geneva: WHO, 1993. [ Links ]
9. Organización Mundial de la Salud. Políticas sobre medicamentos antimaláricos: necesidades de información, tratamiento de la malaria no complicada y manejo de la malaria en el embarazo. Ginebra: OMS; 1994. WHO/MAL/94.1070. 1994. [ Links ]
10. World Health Organization. Assessment of therapeutic efficacy to antimalarial drugs for uncomplicated falciparum malaria in areas with intense transmission. (WHO/MAL/96.1007), Geneva: OMS; 1996. [ Links ]
11. Organización Panamericana de la Salud. Evaluación de la eficacia terapeútica de los medicamentos para el tratamiento del paludismo por Plasmodium falciparum sin complicaciones en las Américas. Washington D.C: OPS; 1998 (OPS/HCP/HCT/113/98). [ Links ]
12. World Health Organization. The use of artemisinin and its derivatives as antimalarial drugs: report of a joint CTD/DMP/TDR informal consultation. Geneva: WHO; 1998. WHO/MAL/98.1086. [ Links ]
13. White NJ. Preventing antimalarial drug resistance through combinations. Drug Resist Updat 1998; 1: 3-9. [ Links ]
14. Nosten F, van Vugt M, Price R, Luxemburger C, Thway KL, Brockman A. Effects of artesunate-mefloquine combination on incidence of Plasmodium falciparum malaria and mefloquine resistance in western Thailand: a prospective study. Lancet 2000 356: 297-302. [ Links ]
15. Price RN, Nosten F, Luxemburger C, ter Kuile FO, Paiphun L, Chongsuphajaisiddhi T, White NJ. Effects of artemisinin derivatives on malaria transmissibility. Lancet 1996; 347: 1654-1658. [ Links ]
16. Ministerio de Salud del Perú. Dirección General de Atención a las Personas, Dirección de Enfermedades Transmisibles. Manual de normas y procedimientos técnicos para ejecutar las actividades antimaláricas en los niveles de atención I y II. Lima: MINSA; 1993. [ Links ]
17. Ministerio de Salud del Perú. Oficina de Planes y Programas. Oficina Sectorial de Planificación. Estado actual del programa de control de malaria en el Perú. Lime: MINSA; 1983. [ Links ]
18. Neyra D. The peruvian experience 1995-2000. Process of drug policy evolution in Peru over the last ten years from chloroquine to the present policy. World Health Organization. Informal consultation on the use of the antimalarial drugs. 2000; nov 13-17; Geneva, Suiza. [ Links ]
19. Colán-Bernal E, Quintana J. Malaria por P. falciparum en la Amazonía Peruana. Rev Farmacol Terap 1993; 3 (1): 11-6. [ Links ]
20. Chauca H, Quintana J. Evaluación in vivo de la respuesta de Plasmodium falciparum a la cloroquina en el foco de la Carretera Yurimaguas-Tarapoto (Región Loreto). Rev Perú Epidemiol 1993; 6: 34-9. [ Links ]
21. Ministerio de Salud del Perú, Dirección General de Salud de las Personas Dirección del Programa de Control de Enfermedades Transmisibles. Doctrina, normas y procedimientos para el montrol de la malaria en el Perú. Lime: MINSA; 1984. [ Links ]
22. Ruebush TK II, Levin A, Gonzaga V, Neyra D, Marquiño W. Evaluation of a simple operational approach for monitoring resistance to antimalarial drugs in Peru. Trop Med Int Health. En prensa 2003. [ Links ]
23. Ministerio de Salud del Perú. Directiva nacional Nº 005-1996 del PNCMOEM. Ministerio de Salud-Programa Nacional de Control de Malaria y Otras Enfermedades Metaxénicas. Lime: MINSA; 1996. [ Links ]
24. Ministerio de Salud del Perú. Política nacional de medicamentos para el control de la malaria en el Perú. Lime: MINSA; 1999. [ Links ]
25. Neyra D. Evaluación de la estrategia global para el control descentralizado y municipal de la malaria, Experiencia en varios países. Resultados y limitaciones del Programa Nacional de Control de la Malaria en los servicios generales de salud, Perú 1994-1996. II Congreso de Latinoamericano de Malaria - IX Congreso Colombiano de Parasitología. 1997. [ Links ]
26. Organización Panamericana de la Salud Informe de la evaluación del Programa de Control de la Malaria en la república del Perú, Washington, D.C: OPS; 1997 OPS/HCP/HCT/88/97. [ Links ]
27. Ministerio de Salud del Perú. Dirección General de Salud de las Personas. Programa Nacional de Control de Malaria y Otras Enfermedades Metaxenicas Metas de gestión nacional, Directiva No 002-96-PCMOEM. Lima: MINSA; 1996. [ Links ]
28. Ministerio de Salud. Programa de Control de Enfermedades Transmisibles, Programa Nacional de Control de Malaria y Otras Enfermedades Metaxénicas. Estudios de cohorte de tratamiento antimalárico por línea de tratamiento y tipo de malaria (1994-2000). Lima: MINSA; 2000. [ Links ]
29. Ministerio de Salud del Perú. Protocolo de Investigación "Evaluación Terapeútica de los Medicamentos Utilizados para el Tratamiento del Paludismo por P. falciparum No Complicado en el Perú". Informe Técnico. Instituto Nacional de Salud -Proyecto VIGIA. Lima: MINSA; 1998. [ Links ]
30. Marquiño W, MacArthur JR, Barat LM, Oblitas FE, Arrunátegui M, Garavito G, et al. Efficacy of chloroquine, sulfadoxine-pyrimethamine, and mefloquine for the treament of uncomplicated Plasmodium falciparum malaria on the north coast of Peru. Am J Trop Med Hyg 2003; 68: (1): 120-123. [ Links ]
31. Ministerio de Salud del Perú. Resistencia del Plasmodium falciparum a medicamentos antimalários en el Perú, Proyecto VIGIA. Lima, Minsa 1999. [ Links ]
32. Llanos-Cuentas A, Campos P, Clendenes M, Canfield CJ, Hutchinson DBA. Atovaquone and proguanil hydrochloride compared with chloroquine or pyrimethamine/sulfadoxine for treatment of acute Plasmodium falciparum malaria in Peru. Brazil J Infect Dis 2001; 5: 67-72. [ Links ]
33. Ministerio de Salud del Perú. Programa Nacional de Control de Malaria y Otras Enfermedades Metaxénicas. Informes de Gestión del Programa Nacional de Control de Malaria, Años 1994-2000. Lima, MINSA 2000. [ Links ]
34. World Health Organization. Antimalarial drug combination therapy. Geneva: WHO; 2001. WHO/CDS/RBM/201.35. 2001. [ Links ]
35. Ministerio de Salud del Perú. Dirección General de Salud de las Personas. Atención Curativa de la malaria, Nuevos esquemas terapeúticos en el tratamiento de la malaria en el Perú." Directiva Nº 005-2001-DGSP-DEAIS-DPCRD-PCMOEM. Res. Dir. Nº 094-2001-DGSP. Agosto 2001. [ Links ]
36. Marquiño W, Ylquimiche L, Hermenegildo Y, Palacios AM, Falconí E, Cabezas C, et al. Efficacy and tolerability of artesunate plus sulfadoxine-pyrimethamine and sulfadoxine-pyrimethamine alone for the treatment of uncomplicated Plasmodium falciparum malaria in Peru. Am J Trop Med Hyg (submitted). [ Links ]
37. Marquino W, Huilca M, Calampa C, Falconi E, Cabezas C, Naupay R, Ruebush TK II. Efficacy of mefloquine and mefloquine-artesunate combination therapy for the treatment of uncomplicated Plasmodium falciparum malaria in the Amazon Basin of Peru. Am J Trop Med Hyg 2003; 68: (5): 608-12. [ Links ]
38. Bloland PB, Ettling M. Making malaria-treatment policy in the face of drug resistance. Ann Trop Med Parasitol 1999; 93: 5-23. [ Links ]
39. Bloland PB, Kazembe PN, Oloo AJ, Himonga B, Barat LM, Ruebush TK. Chloroquine in Africa: critical assessment and recommendations for monitoring and evaluating chloroquine therapy efficacy in sub-Saharan Africa. Trop Med Internat Health 1998; 3: 543-552. [ Links ]
40. Barat LM, Himonga B, Nkunika S, Ettling M, Ruebush TK, Kapelwa W, Bloland PB. A systematic approach to the development of a rational malaria treatment policy in Zambia. Trop Med Int Health 1998; 3: 535-542. [ Links ]
41. Bloland PB, Lackritz EM, Kazembe PN, Were JBO, Steketee R, Campbell CC. Beyond chloroquine: implications of drug resistance for evaluating malaria therapy efficacy and treatment policy in Africa. J Infect Dis 1993; 167: 932-937. [ Links ]
Correspondencia:
Dr. Daniel Neyra.
teléfono: 041-778423 Fax: 041-777446
Correo electrónico: dneyrae@hotmail.com