Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.22 no.1 Lima Ene./Mar. 2005
TRABAJOS ORIGINALES
Distribución de los subtipos del VIH-1 en nueve países de América del Sur, 1995-2002*
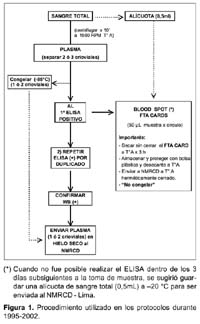
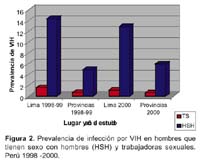
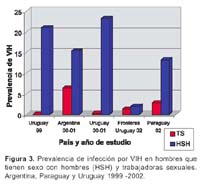
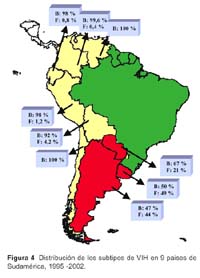
V. Alberto Laguna-Torres 1; James Olson 1; José L. Sánchez 2; Silvia Montano 1; Gloria Chauca 1; Gladys Carrión 1; Ada Romero 1; Jane Ríos 1; Maria E. Gamero 1; Merly Sovero 1; Juan Pérez-Bao 1; Jean Carr 2 y el Grupo de Trabajo de Genotipificación de VIH en Sudamérica**. 1 Centro de Investigación de Enfermedades Tropicales de la Marina de los EEUU -NMRCD. Lima, Perú. * Este trabajo ha sido financiado por la unidad de trabajo (Work Unit No. 62787A S17 H B0002). Las opiniones y afirmaciones contenidas aquí son propias de los autores y no deben interpretarse como posición oficial o que reflejan la opinión del Departamento de la Marina o del servicio naval de los Estados Unidos. Este estudio fue aprobado por la Junta de Revisión Institucional del NMRC (Protocolo # NMRCD.1998.0001 DoD 30578; Protocolo # NMRCD.1999.0001 DoD 30587; Protocolo # NMRCD.1999.0002 DoD 30590, Protocolo # NMRCD.2000.0004 DoD 31513; Protocolo # NMRCD.2000.0002 DoD 31523; Protocolo # NMRCD.2000.0003 DoD 31533, Protocolo # NMRCD.2002.0006 DoD 31590), en cumplimiento con todos los reglamentos federales que rigen la protección de sujetos humanos. RESUMEN Objetivo: Determinar la distribución de los subtipos del virus de la inmunodeficiencia humana (VIH-1) y las presencia de cepas recombinantes en Argentina, Bolivia, Colombia, Chile, Ecuador, Paraguay, Perú, Uruguay y Venezuela a través de estudios epidemiológicos y de genotipificación. Materiales y Métodos: Se incluyeron a los participantes de los protocolos realizados en los nueve paises, incluyendo poblaciones de trabajadoras sexuales (TS), hombres que tienen sexo con hombres (HSH), individuos VIH positivos, gestantes y paciente con tuberculosis (TB). Se utilizó la prueba de movilidad heteroduplex de envoltura (env HMA), ProRT, secuenciamiento completo o ambas para determinar los subtipos de VIH 1. Resultados: Se identificaron 3081 individuos positivos al VIH (de un total de 42 290 voluntarios), las prevalencias oscilaban entre menos de 1% a 29% según población estudiada, siendo mayor en los HSH. Un total de 1654 muestras (54%) fueron genotipificadas. Se encontró el subtipo B en 1380 (83%) muestras, el subtipo F en 218 (13%), así como los subtipos A y C en 0,1% y 0,4% respectivamente. Se hallaron subtipos recombinantes BF en 39 muestras (2%) y formas recombinantes CRF01_AE(0,1%), CRF17_BF(0,4%) y CRF02_AG(0,1%). En Venezuela, Colombia, Ecuador, Perú, Bolivia y Chile (paises andinos) predominó el subtipo B, mientras en Argentina, Uruguay y Paraguay hubo un alto porcentaje del subtipo F. Conclusiones: En la mayoría de países andinos la epidemia de VIH-1 se concentró en los HSH con un predominio del subtipo B. El subtipo F es más frecuente en las TS en Argentina y Uruguay. Esta información es útil para implementar planes de prevención y futuros ensayos de vacunas en esta región. Palabras clave: VIH-1; Genotipificación; Subtipos del VIH; América del Sur (fuente: DeCS BIREME). ABSTRACT Objectives: To determine human immunodeficiency virus type 1 (HIV-1) subtype distribution, and the presence of recombinant strains in Argentina, Bolivia, Colombia, Chile, Ecuador, Paraguay, Peru, Uruguay, and Venezuela using epidemiological and genotyping studies. Materials and Methods: Participants in the studies performed in nine countries were included, amongst them female sex workers, men who have sex with men (MSM), HIV-positive individuals, pregnant women, and patients with tuberculosis (TB) were included. Envelope-base heteroduplex mobility assay (env HMA) testing was used, as well as ProRT, complete sequencing, or both for determining HIV-1 subtypes. Results: 3081 HIV positive individuals were identified (out of 42 290 volunteers), prevalences from less than 1% to 29% in the different populations studied, and it was higher among MSM. 1654 samples (54%) underwent genotyping. B subtype was found in 1380 (83%) samples, F subtype was found in 218 (13%) samples, and A and C subtypes were found in 0,1% and 0,4%, respectively. BF recombinant serotypes were found in 39 samples (2%), and CRF01_AE (0,1%), CRF17_BF (0,4%), and CRF02_AG (0,1%) were also found. In Venezuela, Colombia, Ecuador, Peru, Bolivia, and Chile (Andean countries) subtype B predominated, while in Argentina, Uruguay, and Paraguay there was a high frequency of F subtype. Conclusions: In most Andean countries, HIV-1 epidemic concentrated among MSM, who are predominantly infected with B subtype. F subtype is more frequent among female sex workers in Argentina and Uruguay. This is useful information in order to implement prevention plans and future vaccine tests in this region. Key words: HIV-1; genotyping; HIV subtypes; South America (source: DeCS BIREME). INTRODUCCIÓN A fines del año 1985 1, el Centro de Investigación de Enfermedades Tropicales de la Marina de los de Estados Unidos (NMRCD-Lima) con sede en el Hospital Naval de Lima, Perú, participó en un estudio colaborativo con el Ministerio de Salud (MINSA) y la Universidad Peruana Cayetano Heredia (UPCH) a fin de realizar un gran estudio de prevalencia del virus de la inmunodeficiencia adquirida (VIH-1) en muestras de sangre obtenidas de población general y en población con riesgo de adquirir esta infección. Este primer trabajo colaborativo dio inicio a los estudios epidemiológicos relacionados con el VIH en el Perú. Estudios posteriores se condujeron en colaboración con autoridades del MINSA y se analizaron entre 1986 y 1990, más de 14 0000 muestras procedentes de Lima y de varios departamentos del país 1. A finales del año 1988 el NMRCD - Lima había transferido al MINSA la responsabilidad de tamizaje de las pruebas de sangre para el VIH y durante 1989 y 1990 limitó su función a confirmar las pruebas por Western Blot (WB). Desde entonces, participó en varios estudios de investigación de VIH-1 en alianza estratégica con el MINSA y diferentes organizaciones no gubernamentales (ONG) en el Perú 2. A partir de 1995, con el reconocimiento de la importancia que tiene el conocer la distribución de los subtipos del VIH en América del Sur, el NMRCD - Lima inició estudios prospectivos y de seroprevalencia en poblaciones en riesgo 3, los cuales tuvieron el fin de establecer estrategias adecuadas para implementar medidas de prevención futuras, tales como vacunas. Estos estudios se hicieron en colaboración con la Organización Panamericana de la Salud (OPS), ministerios de salud, universidades y ONG de nueve países de América del Sur 4. Entre 1995 y 2002, como producto de estas alianzas estratégicas, que incluyeron el uso mutuo de fondos y la participación conjunta en estudios epidemiológicos con genotipificación, se ha conseguido trabajar en 9 años, en varios países sudamericanos a excepción de Brasil, Surinam y las Guyanas. Se describió la diversidad genética del VIH-1 en América del Sur incluyendo a Argentina, Bolivia, Colombia, Chile, Ecuador, Paraguay, Perú, Uruguay y Venezuela 4-6. La identificación de cepas recombinantes del VIH-1 es de gran importancia debido a que estas cepas pueden diseminarse rápidamente en redes sociales asociadas a poblaciones de alto riesgo, en especial entre usuarios de drogas intravenosas (UDI) En redes de transmisión sexual, donde cocirculan diferentes subtipos del VIH-1 se originan formas recombinantes de los subtipos circulantes. Las cepas recombinantes también se pueden diseminar y originar patrones complejos de transmisión del VIH-1 en la región 7. Reconocer la diversidad genética del VIH es importante para el desarrollo de vacunas contra este virus, lo que permitiría en un futuro establecer que tipo de vacunas pueden ser eficaces contra los genotipos predominantes en las diferentes áreas de Sudamérica, por ello planteamos este estudio con el objetivo principal de deteminar la distribución de los subtipos de VIH en nueve países de América del Sur. MATERIALES Y MÉTODOS METODOLOGÍA Estudio observacional, descriptivo, transversal, en el que se incluyeron a los participantes de los diferentes estudios realizados en Argentina, Bolivia, Colombia, Chile, Ecuador, Paraguay, Perú, Uruguay y Venezuela entre 1995 y el 2002. El proceso de genotificación del periodo que incluye este manuscrito ha sido realizado aún en el año 2003. La captación de voluntarios en estos estudios fue realizada por el organismo oficial gubernamental de cada país o por las ONG involucradas en los estudios. Se incluyeron trabajadoras sexuales (TS), hombres que tienen sexo con hombres (HSH), gestantes y con tuberculosis (TB). Además, mediante un muestreo por conveniencia, se incluyeron a individuos VIH positivos para garantizar un número suficiente de muestras para genotipificar, permitiendo una mejor evaluación de la variabilidad genética de las cepas de VIH en cada país. Con respecto a los estudios epidemiológicos, diferentes estrategias fueron empleadas para el cálculo muestral en cada protocolo o en cada país participante. Los colaboradores locales mostraban su interés en trabajar con una o más de las poblaciones anteriormente mencionadas y además se escogía las ciudades a ser muestreadas basándose en poblaciones según el caso. Los datos de las prevalencias se calculaban para cada población, datos que son de interés y manejo por cada país o institución participante. Los estudios fueron de tipo transversal, buscando seroprevalencias y son motivo también de otras publicaciones 8. ASPECTOS ÉTICOS En cada uno de los protocolos, personal entrenado explicó la metodología, aplicó el consentimiento informado escrito (CI) y realizó la consejería pre y El personal de los ministerios de salud encargado de los programas de prevención y control de la infección por VIH coordinó el seguimiento y consejería de los voluntarios, utilizando un código identificador único que no debía ser vinculado con la muestra analizada en el NMRCD-Lima. Se enfatizó en la importancia de la entrega de resultados de beneficio para el voluntario y en que los resultados serían entregados en una o dos semanas (diagnóstico de VIH y niveles de CD4/CD8 en los positivos). Los positivos al VIH fueron derivados a los ministerios de salud y ONGs para su cuidado y seguimiento segun las regulaciones gubernamentales locales. Tuvieron exámenes médicos periódicos, profilaxis para infecciones oportunistas y la terapia antirretroviral disponible en cada país. Una copia del CI, el cuestionario y una alícuota de la muestra llegaba al NMRCD-Lima, Perú siempre codificada, para proteger la confidencialidad del individuo. PROCESAMIENTO DE LAS MUESTRAS De una muestra de sangre de 5-10 mL en un tubo con anticoagulante (EDTA) se separó plasma para detección de anticuerpos, realizando la prueba de inmunoensayo enzimático (Enzym Linked Immune Assay -ELISA). Si ésta resultaba reactiva procedía a ser corrida por duplicado para luego ser confirmada por medio de la prueba de Western Blot (Figura 1), las alícuotas fueron compartidas con las autoridades de los ministerios de salud y ONG dependiendo del protocolo. Las pruebas de ELISA y Western Blot para VIH fueron realizadas en los laboratorios locales de cada pais participante. Las marcas utilizadas variaron según los años de trabajo y el país participante. Frecuentemente para la prueba de ELISA fue utilizado el kit de VIRONOSTIKA® y para Western Blot el kit de BIO RAD®. La genotipificación fue hecha a partir de sangre total fresca (obtenida antes de 48 horas de su procesamiento) usando linfocitos-células mononucleares periféricas (PBMC) para la identificación del genotipo viral. El uso de manchas de sangre en papel de filtro (FTA Cards Whartman Bioscience®) fue eficiente y práctico cuando el transporte de las muestras al laboratorio requería más de 48 horas. Fue útil obtener las manchas de sangre al primer contacto con el voluntario, las cuales fueron codificadas y procesadas después de la confirmación por Wester Blot, al conocer el resultado positivo del primer ELISA, así no se requería una segunda muestra de sangre. Se usó una tarjeta de mancha de sangre seca donde se colocaba 50µL de muestra en cada círculo (cartilla con cuatro círculos) y una pipeta de transferencia por paciente (Figura1). El secuenciamiento se realizó en los laboratorios de NMRCD-Lima, se asignaron los genotipos mediante la Prueba de Movilidad Heteroduplex (env HMA) a través de un procedimiento de reacción en cadena de la polimerasa (PCR) donde los fragmentos seleccionados del gen de la envoltura (env) fueron amplificados. El secuenciamiento automatizado del genoma de longitud completa permite identificar y describir la filogenia de las posibles cepas recombinantes. El Programa de Investigacion de VIH del Instituto Walter Reed del Ejército de EEUU realizó el secuenciamiento parcial del gen ANÁLISIS ESTADÍSTICO A partir de una base de datos construída en Visual Fox Pro V. 6,0 se hicieron los análisis descriptivos y cuando fue necesario se aplicó el test de significancia Chi cuadrado (p<0,05). RESULTADOS Desde 1995, un total de 42 290 voluntarios incluyendo trabajadores sexuales masculinos y femeninas, hombres que tienen sexo con hombres, gestantes y pacientes con tuberculosis (TB) han participado en los protocolos de investigación desarrollados en 9 países sudamericanos. Todos los individuos estudiados eran mayores de 18 años. La edad promedio de los HSH fue de 29 años y de las TS femeninas fue de 34 años (p<0,01). La prevalencia de VIH, ha oscilado entre menos de 1 y 29%, con un total de 3081 individuos positivos a la infección por VIH-1. Se encuentra que la infección es más prevalente en las poblaciones de HSH que en las TS(p <0,001), tanto en los estudios realizados en el Perú (Figura 2), como en los realizados en países del cono sur de Sudamérica (Figura 3). Las muestras de 1654 (54%) de los 3081 voluntarios positivos fueron genotipificadas mediante la técnica de HMA (env) o secuenciamiento completo, de ellos 1380 (83%) fueron del subtipo B mientras que 218 (13%) fueron del subtipo F. Los subtipos A, C se encontraron en una minoría de individuos infectados con VIH (0,1% y 0,4%, respectivamente) (Tabla 1). Se hallaron subtipos recombinantes BF en 39 muestras (2%) y formas recombinantes CRF01_AE(0,1%), CRF17_BF(0,4%) y CRF02_AG (0,1%). La distribución de los subtipos de VIH fue diferente en los países donde se han realizado los trabajos de investigación. Los países de la región andina (Venezuela, Colombia, Ecuador, Perú, Bolivia y Chile) tienen una mayor prevalencia del subtipo B (entre 92 y 100%) y en los países de la cuenca del Río de La Plata (Argentina, Paraguay y Uruguay) hay una prevalencia importante del subtipo F, que varía entre 21 y 49 % (Figura 4). DISCUSIÓN La recombinación es un fenómeno evolutivo importante que ha experimentado el virus del VIH. Esto dificulta que el sistema inmune reconozca y elimine el virus utilizando el sistema inmune celular. La recombinación ocurre cuando una célula es coinfectada por dos cepas de VIH-1 diferentes pero relacionadas entre sí. Esto puede llevar a la formación de cadenas de ADN mixto, las cuales pueden conferir resistencia a varias drogas antirretrovirales en los pacientes que portan dichas cepas lo que tiene gran implicancia clínica 9,10. Desde el punto de vista clínico y epidemiológico, la aparición de cepas recombinantes plantea dificultades para el desarrollo de una vacuna eficaz contra el VIH. El entendimiento progresivo de la secuencia replicativa del VIH que origina la formación del sincitio y la transactivación, es de importancia puesto que esta estrategia replicativa sugiere la capacidad de poseer la carga genética de ambos provirus infectantes, lo cual lleva a la formación de un virión "heterocigoto". A partir de esta secuencia replicativa se pueden generar mutaciones 11. El monitoreo de la prevalencia de cepas de VIH mediante el establecimiento de una vigilancia sistemática en diversos grupos de riesgo a través de la región es de gran importancia. La distribución de los subtipos de VIH-1 muestra la diseminación diferencial de estas cepas en diversos grupos de riesgo y puede llamar la atención hacia la aparición de epidemias inminentes. Los resultados obtenidos provienen de estudios de poblaciones en riesgo de las principales ciudades latinoamericanas realizados en diferentes años. En algunos países como Chile y Venezuela, pudo haber un sesgo durante la obtención de la muestra poblacional por lo que no son muestras representativas. En Ecuador, Colombia, Uruguay, Perú y Argentina los trabajos han sido sostenidos y muestran resultados que se correlacionan con los datos oficiales que manejan estos países. En Paraguay los datos provienen de todo el país, los resultados han sido obtenidos durante el último trimestre del año 2002 y reflejan la situación de la capital y siete ciudades principales 12. En Bolivia la gran mayoría (93%) de las muestras obtenidas proviene de la ciudad de Santa Cruz y pueden no representar la distribución real 13. Nuestros resultados muestran que el subtipo B continúa siendo el genotipo prevalente en la mayoría de los países estudiados de América del Sur. Se han detectado diferencias menores en las secuencias de los aminoácidos en la cadena V3 del VIH-1 5 en el Perú y en otros países, lo cual constituye un reporte precoz en el sistema de vigilancia. En Argentina y Uruguay, el subtipo F parece ser más común, especialmente en las poblaciones heterosexuales estudiadas. Además la mayoría de los subtipos F estudiados parecen ser recombinantes de subtipos B/F. Las muestras VIH positivas fueron enviadas al Laboratorio de Retrovirología del Instituto de Investigación del Ejercito Walter Reed (WRAIR) donde se realizó el secuenciamiento del genoma completo (full genome) o pro/RT. Este proceso lleva varios meses y es un pro-ceso largo, hasta tener el resultado final. Algunos de los subtipos B son también recombinantes de tipo B/ F. Sin embargo, cabe resaltar que aún para estas cepas recombinantes, su composición genética varia de No hemos estudiado poblaciones de Brasil, pero se han descrito los subtipos B, C, D y F en ese país 14. En 1996, por ejemplo, entre las muestras de donantes de sangre de Río de Janeiro 77% de las cepas fueron subtipo B mientras que el subtipo F se presentó en 14%15. Por otro lado, entre 1994 y 1997, en un estudio realizado en el área de Río Grande del Sur, estado fronterizo con Uruguay 16, los científicos brasileños encontraron que 22% de las muestras estudiadas eran subtipo C. Estos hallazgos son importantes porque nuestros estudios preliminares en Uruguay mostraron que 2 (3,1%) de los casos VIH positivos correspondieron al subtipo C. Argentina también presentó un caso del subtipo C a diferencia de los países andinos donde no hemos encontrado este subtipo. Ninguna de las poblaciones estudiadas por el NMRCD-Lima presentó una frecuencia de subtipo C 17 tan alta como en esa población del Sur de Brasil 16. El tipo C parece haber sido introducido en el área a través del uso de drogas intravenosas con la posterior transmisión a las parejas sexuales femeninas y a la población general. La aparición de formas recombinantes circulantes de tipo BF debe preocuparnos e indica que la vigilancia de los grupos de alto riesgo debe continuarse en la región de Sudamérica. Una limitación de nuestros estudios es que las poblaciones estudiadas por nosotros no incluyeron a los usuarios de drogas intravenosas. Las drogas intravenosas son costosas por lo general, y en los países andinos donde los estándares de vida no permiten adquirir drogas intravenosas, se consumen drogas por vía oral o inhaladas. En el caso de Ecuador se han notificado casos de subtipos recombinantes CRF02_AG 18 y CRF01_AE lo cual debe llamar la atención del sistema de vigilancia, puesto que ninguno de estos dos tipos aparece aún en los países vecinos. Se ha identificado recombinantes CRF17_BF en Paraguay y Bolivia 19 además de Argentina. Futuras publicaciones analizarán estos resultados y sus implicancias. Finalmente, todos estos esfuerzos tienen como objetivo final correlacionar el tipo de vacuna a utilizar en las diferentes poblaciones de riesgo de acuerdo con el subtipo de VIH predominante en una región. Si las formas recombinantes continúan diseminándose en la región, probablemente será necesario usar las vacunas multivalentes contra el VIH-1 en Latinoamérica.
2 Instituto de Investigación del Ejército Walter Reed, Maryland, Estados Unidos.
Los datos presentados en este artículo muestran la importancia de conocer sobre los subtipos presentes en nuestros países y cómo va cambiando el patrón según se diseminan las formas recombinantes, por lo que hay aún mucho por estudiar de este tema. ** GRUPO DE TRABAJO DE GENOTIPIFICACIÓN DE VIH EN SUDAMÉRICA Maria M. Ávila, Centro Nacional de Referencia para el SIDA. Buenos Aires, Argentina. Mercedes Weissenbacher, Departamento de Microbiología (CNRS) Facultad de Medicina. Universidad de Buenos Aires, Argentina. Alberto Gianella, Centro de Medicina Tropical (CENETROP). Santa Cruz, Bolivia. Ronald Andrade, INLASA. La Paz, Bolivia. Gloria I Sánchez, Grupo Infección y Cáncer. Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia. Jaqueline Acosta, Instituto Nacional de Salud. Bogotá, Colombia. Claudia Ayala, Liga Colombiana de la Lucha Contra el SIDA. Eugenio Ramírez, Instituto de Salud Publica (ISP). Ministerio de Salud de Chile. Aracely Alava Alprecht, Instituto Nacional de Higiene y Medicina Tropical "Leopoldo Izquieta Pérez". Guayaquil, Ecuador. Orlando Montoya, Fundación Equidad. Quito, Ecuador. Nicolás Aguayo, Margarita Villafane, Alma Barboza, L. Sosa, Programa Nacional de Control del VIH/SIDA. Ministerio de Salud, Paraguay. Adolfo H. Galeano, Instituto de Medicina Tropical. Asunción, Paraguay. Jorge O. Alarcón, Instituto de Medicina Tropical Daniel A. Carrión, Universidad Nacional Mayor de San Marcos. Lima, Perú. Mónica Negrete, MD MPH. Epidemióloga Consultora. Ex Coordinadora Asistente del Programa de VIH NMRCD-Lima. Hugo Manrique, Programa Nacional de Control del VIH/SIDA. Ministerio de Salud, Perú. Eduardo Gotuzzo, Universidad Peruana Cayetano Heredia, Hospital Nacional Cayetano Heredia. Lima, Perú. Jorge Sánchez, Asociación Civil Impacta y Educación. Perú. José C. Russi, Laboratorio Nacional de Referencia de Salud Pública. Montevideo, Uruguay. José Viñoles, Fundación SIDA. Montevideo, Uruguay. Margarita Serra, Programa Nacional de Control del VIH/ SIDA. Ministerio de Salud, Uruguay. Carlos Aponte, Instituto Nacional de Higiene "Rafael Rangel". Caracas, Venezuela. Participaron también: Fundación Esperanza y Hospital Vozandez. Quito, Ecuador; y, Corposalud. Isla Margarita, Venezuela. REFERENCIAS BIBLIOGRÁFICAS 1. Cueto M. Confirmando la epidemia en el Perú. El papel de NAMRID. En: Culpa y Coraje: Historia de las políticas sobre el VIH/SIDA en el Perú.1era ed. Lima: Consorcio de Investigación Económica y Social / Facultad de Salud Pública y Administración, Universidad Peruana Cayetano Heredia; 2001. p. 63-71. [ Links ] 2. Perú. Ministerio de Salud. Evolución del SIDA en el Perú, 1983-1998. Panorama Epidemiológico. En: Estado de Situación: El SIDA en el Perú al año 2000. Lima: Programa de control de ETS y SIDA, ONUSIDA; 2001. p. 67. [ Links ] 3. Louwagie J, Delwart EL, Mullins JI, McCutchan FE, Eddy G, Burke Ds. Genetic analysis of HIV-1 isolates from Brazil reveals presence of two distinct genetic subtypes. AIDS Res Hum Retroviruses 1994; 10(5): 561-67. [ Links ] 4. Hierholzer J, Montano S, Hoelscher M, Negrete M, Hierholzer M, Ávila NM, et al. Molecular epidemiology of HIV Type 1 in Ecuador, Peru, Bolivia, Uruguay and Argentina. AIDS Res Human Retroviruses 2002; 18(18): 1339-50. [ Links ] 5. Russell K, Cárcamo C, Watts D, Sanchez J, Gotuzzo E, Euler A, et al. Emerging genetic diversity of HIV-1 in South America. AIDS 2000; 14(12): 1785-91. [ Links ] 6. Carr J, Ávila M, Gómez M, Salomón H, Hierholzer J, Watanaveeradej V, et al. Diverse BF recombinants have spread widely since the introduction of HIV-1 into South America. AIDS 2001; 15(15): F41-47. [ Links ] 7. Burke DS. Recombination in HIV: An Important viral evolutionary strategy. Emerg Infect Dis 1997; 3(3): 253-58. [ Links ] 8. Bautista CT, Sanchez JL, Montano SM, Laguna-Torres VA, Lama JR, Sanchez JL, et al Seroprevalence of and risk factors for HIV-1 infection among South American men who have sex with men. Sex Transm Infect 2004, 80(6): 498-504. [ Links ] 9. Kellam P, Larder BA. Retroviral recombination can lead to linkage of reverse transcriptase mutations that confer increased zidovudine resistance. J Virol 1995; 69(2): 669-74. [ Links ] 10. Gu Z, Gao Q, Faust EA, Wainberg MA. Possible involvement of cell fusion and viral recombination in generation of human immunodeficiency virus variants that display dual resistance to AZ T and 3TC. J Gen Virol 1995; 76(Pt 10): 2601-05. [ Links ] 11. Wain-Hobson S. The fastest genome evolution ever described: HIV variation in situ. Curr Opin Genet Dev 1993; 3(6): 878-83. [ Links ] 12. Laguna-Torres VA, Aguayo N, Galeano A, Villafane M, Montano SM, Chauca G, et al. Molecular and epidemiological characteristics of HIV-1 infection among female commercial sexual workers, men who have sex with men and HIV positive patients in seven cities of Paraguay. Rev Soc Bras Med Trop 2004; 37 (Suppl I): 104. (Abstract). [ Links ] 13. Laguna-Torres VA, Gianella A, Andrade R. Tambare A, Velasquez N. Chauca G, Montano S, et al. Molecular and epidemiological characteristics of HIV-1 infection among female commercial sex workers and men who have sex with men, Bolivia. Rev Soc Bras Med Trop 2003; 36 (Suppl I): 100. (Abstract). [ Links ] 14. HIV/AIDS/STD Epi Fact Sheet. Brazil, 1997. Monitoring the AIDS Pandemic Symposium. Rio de Janeiro-Brazil, November 4-5, 1997. [ Links ] 15. Tanuri A. HIV-1 subtypes among blood donors from Rio de Janeiro, Brazil. J Acquir Immune Defic Syndr Hum Retrovirol 1999; 20(1): 60-66. [ Links ] 16. de Martínez AM, Barbosa EF; Ferreira PC, Cardoso F, Silveira J, et al. Molecular epidemiology of HIV-1 Rio Gran-de, Brazil. Rev Soc Bras MedTrop 2002; 35(5): 471-76. [ Links ] 17. Carrión G, Eyzaguirre L, Montano S, Laguna-Torres VA, Serra M, Aguayo N, et al. Documentation of subtype C HIV type 1 strains in Argentina, Paraguay and Uruguay. AIDS Res Hum Retroviruses 2004; 20(9): 1022-25. [ Links ] 18. Carrión G, Hierholzer J, Montano S, Alava A, Perez J, Guevara, A, et al. Circulating recombinant form CRF02_AG in South America. AIDS Res Hum Retroviruses 2003; 19(4): 329-32. [ Links ] 19. Carrión G, Laguna-Torres VA, Barboza A, Sovero M, Jiménez L, Velásquez N, et al. Molecular Characterization of Non B HIV-1 subtypes from Paraguay and Bolivia. Am J Trop Med Hyg 2004; 71(4 Suppl): 135.
Correspondencia:
Víctor Alberto Laguna Torres.
Coordinador asistente programa VIH NMRCD-Lima
Dirección postal: Av. Venezuela s/n Hospital Naval. Lima, Perú.
Teléfono: (511) 561-2733 anexo 166
Correo electrónico: alaguna@nmrcd.med.navy.mil