Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.22 no.1 Lima Ene./Mar. 2005
TRABAJOS ORIGINALES
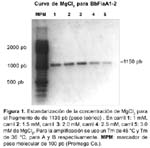
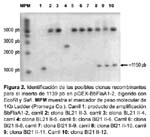
Clonamiento, expresión y seroreactividad del antígeno recombinante flagelina de Bartonella bacilliformis Karen Gallegos V 1; Christian Baldeviano V 1; Adolfo Marcelo Ñ 2; Carlos Padilla R 1 1 Laboratorio de Biotecnología y Biología Molecular. Centro Nacional de Salud Pública. Instituto Nacional de Salud. Lima, Perú. RESUMEN Objetivos. Clonar el gen de la flagelina A (flaA) de Bartonella bacilliformis, expresar y evaluar preliminarmente la seroreactividad de la proteína recombinante a sueros de pacientes con Bartonelosis por B. bacilliformis. Materiales y Métodos. Se diseñó una pareja de oligonucleótidos iniciadores -BbFlaA1 y BbFlaA2- para la amplificación del gen completo de la flagelina flaA de B. bacilliformis. El producto de amplificación obtenido se clonó en pGEM y luego se subclonó en el vector de expresión pGEX4T-1. Se indujo la expresión de la proteína de fusión rBbFlaA-GST con isopropil tio-β -D-galactosido (IPTG). La proteína de fusión producida fue digerida con trombina para liberarla de GST. Finalmente, una prueba de ELISA fue estandarizada para detectar los anticuerpos IgG contra la proteína de fusión rBbFlaA-GST y rBbflaA libre de GST. Se evaluaron sueros de pacientes con diagnóstico de Bartonelosis por B. Bacilliformis (n= 30), sueros de individuos sanos (n= 20) y sueros de pacientes con otras enfermedades de posible reactividad cruzada; entre ellas, Brucelosis (n= 3), leptospirosis (n= 3) y salmonelosis (n=7). Resultados. Se determinó que para la expresión óptima en E. coli BL21 de la proteína de fusión rBbFlaA se requiere que el cultivo crezca en caldo LB/ampicilina a 30 °C suplementado con 2% de glucosa a partir de un preinóculo de 100 µL (crecido por toda la noche), hasta que alcance una densidad óptica de 1 OD600 y se induzca por dos horas con 2,5 mM de IPTG. Finalmente, el 57,6 % (17 de 30) sueros de pacientes con diagnóstico confirmado de bartonelosis reaccionaron con la proteína recombinante BbFlaA en el formato de ELISA. Conclusiones. Se logró expresar exitosamente en E. coli la proteína recombinante BbFlaA de B. bacilliformis, determinándose un protocolo de expresión y de purificación de rBbFlaA para la producción de esta proteína. Así también, el antígeno rBbFlaA es reconocido por anticuerpos de sueros de pacientes con Bartonelosis causada por B. bacilliformis. Palabras Clave: Bartonella bacilliformis; Diagnóstico; Flagelina; Test de ELISA; Proteínas Recombinantes, Enfermedad de Carrión (fuente: DeCS BIREME). ABSTRACT Objectives: To clone the Bartonella bacilliformis flagellin gene (flaA), and to preliminarily express and assess reactivity of the recombinant protein against B. bacilliformis bartonellosis patients' sera. Materials and Methods: A couple of initiating oligonucleotides was designed -BbFlaA1 and BbFlaA2- for complete B. bacilliformis flagelline A gene amplification. The amplification product obtained was cloned in pEGM, and later it was subcloned in pGEX4T-1 expression vector. Fusion protein rBbFlaA-GST expression was induced with isopropyl thio-β -D-galactoside (IPTG). The fusion protein produced was digested with thrombin in order to release its GST contents. Finally, an ELISA test was standardized in order to detect IgG antibodies against fusion protein rBbFlaA-GST and rBbflaA GST-free. Sera from patients with bartonellosis caused by B. bacilliformis (n= 30), sera from healthy individuals (n= 20), and sera from patients with a possible cross-reactivity; i.e., brucellosis (n= 3), leptospirosis (n= 3), and salmonellosis (n= 7) were assessed. Results: It was determined that for optimal expression of fusion protein rBbFlaA in E. coli BL21, it is required that the culture grows in LB/ampicillin broth at a 30º C temperature, supplemented with 2% glucose from a 100 µL pre-inoculum (left to grow overnight), until it reaches a 1 optical density (OD 600), and being induced for two hours at 2,5 mM IPTG. Finally, 57,6% (17 of 30) sera from patients with a confirmed bartonellosis diagnosis reacted with BbFlaA recombinant protein in an ELISA format. Conclusions: B. bacilliformis BbFlaA recombinant protein was successfully expressed in E. coli, and an rBbFlaA expression and purification protocol was determined for producing this protein. Also, rBbFlaA antigen is recognized by antibodies present in sera from bartonellosis patients infected with B. bacilliformis. Key words: Bartonella bacilliformis; Diagnosis; Flagellin; Enzime-Lynked Immunosorbent Assay; Recombinant Proteins, Carrion's Diseases (source: DeCS BIREME). INTRODUCCIÓN La enfermedad de Carrión o Bartonelosis causada por B. bacilliformis es un problema de salud importante en el Perú, y es considerada como reemergente 1,2. Los métodos convencionales existentes para el diagnóstico de la enfermedad de Carrión presentan muchas limitaciones, la principal de ellas es la baja sensibilidad, en el caso del frotis y el tiempo que demanda el crecimiento de la bacteria en el caso del cultivo (entre 14 a 45 días)2,3. Actualmente, se ha propuesto diversos métodos para el diagnóstico de la Bartonelosis que incluyen técnicas serológicas y moleculares. Estas técnicas, en su mayoría, por su alto costo o por su complejidad sólo se usan en laboratorios de referencia, entre estas tenemos las técnicas de inmunofluorescencia indirecta 4, la prueba de Western blot 5 y la prueba de PCR 6. Los métodos de diagnóstico basados en serología tienen el inconveniente de tener una baja especificidad debido a que presentan reacción cruzada con enfermedades causada por patógenos filogenéticamente emparentados tales como: Brucelosis y salmonelosis 4,5. Un método serológico basado en proteínas recombinantes o epítopes específicos mejoraría la especificidad de los métodos serológicos convencionales. Por tanto, es importante identificar antígenos que sirva para desarrollar una prueba serológica sensible y específica para el diagnóstico de infecciones por B. bacilliformis. La flagelina es el componente mayoritario del flagelo, esta proteína ha sido propuesta con antígeno para pruebas serológicas en diversas enfermedades como borreliosis 7, infecciones con Helicobacter pylori 8, infecciones con Burkholderia pseudomallei 9, leptospirosis e inclusive con linfoadenopatía asociada a infecciones con Bartonella clarridgeiae 10. En este artículo nosotros notificamos el clonamiento de la proteína recombinante flagelina de B. Bacilliformis (BbFlaA), el método de producción de ésta, así como la evaluación de la serorreactividad de sueros de pacientes con Bartonelosis aguda por B. bacilliformis y otras enfermedades a la proteína rBbFLaA. MATERIALES Y MÉTODOS DISEÑO DE OLIGONUCLEÓTIDOS INICIADORES Se diseñó una pareja de oligonucleótidos iniciadores basada en la secuencia reportada por Arévalo-Jiménez en 1993 (con código de acceso del Genbank L20677), para esto se usó el programa Primer Select versión 4.05 (DNASTAR Inc., Madison, WI, USA) (Tabla 1). Los oligonucleótidos BbFla-01 y BbFla-02 fueron modificados para incluir los sitios de cortes para enzimas de restricción EcoRI y SalI, respectivamente. CEPAS Y SUEROS Se usó ADN purificado de B. bacilliformis la cepa JB584 (cepa gentilmente donada por el Dr. Minninck). Además se usó las cepas de E. coli XL1-blue y BL21, las cuales fueron adquiridas comercialmente a las compañías Stratagene (Stratagene Co, La Jolla, CA, USA) y Amersham (Amersham Bioscience Co., Piscataway, NJ, USA). Los sueros usados provienen de una seroteca del Laboratorio de Biotecnología y Biología Molecular, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Sueros casos. 30 sueros de pacientes con Bartonelosis aguda por B. bacilliformis, provenientes de zonas endémicas en Ancash, colectados entre los años 2000 y 2001 y confirmados por clínica, frotis y ELISA IgG con proteínas totales. Sueros control. 20 sueros de personas clínicamente sanas provenientes de la ciudad de Lima, estas no mostraban ningún síntoma clínico al momento de la colecta de muestra y no habían viajado anteriormente a ninguna zona endémica. Además para evaluar la especificidad se usaron sueros de pacientes confirmados con otras enfermedades: tres sueros de pacientes con Brucelosis (confirmado por clínica y serología), tres sueros de pacientes con Leptospirosis (confirmado por clínica y serología ELISA IgM) y siete sueros de pacientes con salmonelosis causada por Salmonella tiphy (confirmado por clínica y serología). AMPLIFICACIÓN DEL GEN FLaA DE B. Bacilliformis Para la amplificación y estandarización del gen mediante PCR se usó el ADN genómico de la cepa de B. bacilliformis JB584. Los ensayos de PCR fueron diseñados para un volumen final de 50 µL. Las reacciones se realizaron en tubos para PCR de polipropileno y en un termociclador modelo 9700 (PE Applied Biosystems Inc. Forter City, CAL, USA). Las condiciones por tubo de reacción fueron las siguientes: solución tampón de reacción 1x (PE Applied Biosystems), 0,2 mM dNTP, 2,0 mM MgCl 2, 1 µM BbFlaA1, 1 µM de BbFlaA2, 1 U de Amplitaq ADN polimerasa (PE Applied Biosystems) y 200 ng de ADN. El ciclaje final para la amplificación del fragmento incluye una desnaturalización inicial de 5 minutos a 95 °C; 30 ciclos de 30 segundos a 95 °C, 30 segundos a 36 °C y 1 minuto a 72 °C y una extensión final de cinco minutos a 72 °C. Cada prueba se realiza incluyendo controles de contaminación. Los productos de amplificación obtenidos fueron examinados mediante electroforesis en geles de agarosa al 1,5 %. OBTENCIÓN DE CÉLULAS RECOMBINANTES DE E. coli XL-1 BLUE PARA pGEMT-BbFLaA1-2 El producto de amplificación obtenido con los primer BbFlaA1 y BbFlaA2 fue purificado usando el kit comercial Wizard PCR preps (Promega Biosciences Inc. San Luis Obispo, CA, USA), siguiendo las recomendaciones del fabricante. Posteriormente, se ligó este producto al plásmido de clonamiento pGEMT-easy (Promega Biosciences Inc.) usando la enzima ligasa T4 siguiendo las recomendaciones de los fabricantes. La proporción de inserto-vector fue de 5:4. Una alícuota de esta reacción de ligación se utilizó para transformar cepas competentes de E. coli XL1-Blue, según el método modificado de cloruro de calcio 11. Luego se procedió a realizar una selección de clonas recombinantes por PCR con protocolos establecidos 11. Los resultados se examinaron por electroforesis en gel de agarosa al 1,5% a 100 voltios constantes por 50 minutos. Finalmente se seleccionó la clona recombinante pGEM-BbFlaA1-2.I para los siguientes procedimientos. SUBCLONAMIENTO DEL GEN FLaA EN pGEX 4T-1 El plásmido recombinante pGEM-BbFlaA1-2.I y el plásmido pGEX 4T-1 (Amersham Biosciences UK Limited, Buckinghamshire, England) se digirieron con las enzimas de restricción EcoRI y SalI, siguiendo las recomendaciones de los fabricantes. Luego de purificar el fragmento obtenido de la digestión de pGEM-BbFlaA1-2.I, y el plásmido pGEX/EcoRI/ SalI, se procedió con la reacción de ligación entre el inserto y el plásmido pGEX 4T-1. La proporción de inserto-vector fue de 1:1. Se consideró un control autoligado y se siguió los protocolos sugeridos en el manual técnico del kit para pGEX 4T-1. Una alícuota de esta reacción de ligación (5 µL) se usó para transformar cepas competentes de E. Coli BL21, luego las colonias obtenidas fueron cultivadas en tubos individuales aplicando procedimientos validados 11. Luego purificó el plásmido que contenían mediante el método de lisis alcalina 11 y se seleccionó las posibles recombinantes por tamaño mediante electroforesis en geles de agarosa al 1%. IDENTIFICACIÓN DEL INSERTO EN pGEX 4T-1 Para verificar los posibles plásmidos recombinantes obtenidos, se purificaron usando el kit Wizard Minipreps (Promega Biosciences Inc.) siguiendo las recomendaciones de los fabricantes, y luego digeridos con enzimas de restricción para la liberación del fragmento utilizando EcoR I y SalI. Según condiciones recomendadas por los fabricantes. Para verificar en que posición fue ligado el inserto a pGEX se realizó cortes con enzimas de restricción: EcoRI, BgLII y BstEII (Promega Biosciences Inc.) según las recomendaciones de los fabricantes. Los resultados de estos ensayos fueron examinados mediante electroforesis en geles de 1% de agarosa a 100 voltios por 45 minutos en solución tampón TAE 1x. Los geles fueron incubados en una solución de bromuro de etidio para su visualización en cámara de luz ultravioleta y finalmente fueron fotografiados. Con la finalidad de verificar si el inserto estaba adecuadamente ligado al plásmido pGEX4T-1 y confirmar la identidad del fragmento clonado se realiza en secuenciamiento del inserto. Se siguió el protocolo sugerido por los fabricantes de Kit Thermo Sequenase Cy5 Dye Terminador utilizando el secuenciador automático ALFexpress (Amersham Biosciences UK Limited). ESTANDARIZACIÓN DE LA EXPRESIÓN DE LA PROTEÍNA RECOMBINANTE EN E. coli BL21 Las condiciones de expresión de la proteína recombinante se estandarizaron evaluando la densidad óptica del inóculo (OD 600) óptima para la inducción, la cantidad de inductor, tiempo de expresión, cantidad de preinóculo sobre la expresión de la proteína de fusión. Los pesos moleculares esperados son: 67,38 kDa para la proteína de fusión (Flagelina-GST), 42 kDa para la proteína recombinante (flagelina) y 27,89 kDa para el GST. Inicialmente la expresión de la proteína de fusión de las clonas recombinantes se dieron según las condiciones sugeridas en el manual de pGEX usando resina glutation sefarosa 4B (Amersham Pharmacia Biotech, 2000). Luego debido a la escasa expresión de la proteína recombinante se modificó el protocolo siguiendo las recomendaciones reportadas 12. Para la estandarización se evaluaron diferentes densidades ópticas (0,5-1,0-1,5 y 2 OD 600), concentraciones de inductor (0,5 - 1,0 - 1,5 - 2 - 2,5 y 3 mM de IPTG), horas de inducción (1, 2, 3, 4 y 5 horas con IPTG) y volúmenes de preinóculo (50, 100, 150, 200 y 300 µL de preinóculo dejado toda la noche). Luego de estandarizarse la expresión de la proteína de fusión y lisis de las células en lote pequeño se usó estas condiciones para la expresión de la proteína de fusión a mayor escala (con un volumen de los inóculos de 0,5 L). ESTANDARIZACIÓN DEL ENSAYO ELISA PARA LA EVALUACIÓN DE LA REACTIVIDAD ANTIGÉNICA MEDIANTE SUEROS DE PACIENTES CON BARTONELOSIS Ensayos de ELISA indirectos fueron estandarizados para detectar anticuerpos en muestras serológicas contra la proteína recombinante (Flagelina) de B. bacilliformis, la proteína la fusión (Flagelina-GST) y la glutation S tranferesa GST. Se ensayaron diferentes concentraciones del antígeno de recubrimiento (50 ng, 100 ng, 150 ng, 200 ng por pocillo), diluciones de los sueros evaluados (1/25, 1/50, 1/100, 1/200 y 1/400) y diluciones del conjugado (1/500, 1/1000 y 1/2000). Además, se estableció un valor de corte para los ensayos. Para ambos casos (Flagelina-GST y Flagelina) se realizaron las estandarizaciones considerando: tres sueros de pacientes con la enfermedad de Carrión aguda y tres sueros de personas clínicamente sanas. Además, se evaluó la reactividad frente a GST como control. El antígeno fue diluido en solución tampón carbonato-bicarbonato pH 9,6; (0,159% de Na2CO3 y 0,294% de NaHCO3); luego se añadió 100 µL del antígeno en cada pozo de una microplaca de ELISA y se incubó toda la noche a 4 °C. Luego, se lavaron los pocillos 3 veces con PBS-T (0,5% NaCl, 1,15% de Na2HPO4, 0,224% de Na 2 HPO4 y Tween 20 a 0,005 %, pH 7,4) y se incubaron con diluciones en PBS de sueros. Se incubaron por una hora en cámara húmeda a 37 °C. Posteriormente, se lavó la microplaca tres veces con PBS-T y se incubó con 100 µL de una dilución en PBS de anti IgG conjugado con peroxidasa. Luego, la microplaca se incubó por una hora en cámara húmeda a 37 °C. Después de dos lavados con PBS-T y uno con PBS (0,5% NaCl, 1,15% de Na2HPO4 y 0,224% de Na 2 HPO4, pH 7,4), se le añadió 100 µL de sustrato (0,05% de H2O2, 0,5 mg/mL de OPD, en solución tampón fosfato-citrato 0,1 M pH 5,4). ANÁLISIS DE DATOS Cada suero fue evaluado frente a la proteína recombinante flagelina, la proteína de fusión GST-Flagelina y a la proteína glutation S tranferasa (GST). La línea de corte utilizada para evaluar el límite de detección el control negativo y positivo se evaluó en sueros de personas sanas con ficha técnica por duplicado. Se calculó la media y la desviación estándar (DE) de los valores de DO obtenidos con 20 sueros de personas sanas y se estableció como valor límite la concentración que se corresponde con el valor de la media más dos desviaciones estándar. Para evaluar si la prueba de ELISA estandarizada podía discriminar entre sueros de personas sanas, pacientes con otras enfermedades y pacientes con la enfermedad de Carrión se realizó un análisis estadístico de la diferencia entre los promedios de la absorbancias obtenidas aplicando la prueba t-test usando el software estadístico Minitab. RESULTADOS AMPLIFICACIÓN DEL GEN DE LA FLAGELINA DE B. Para amplificar el gen FlaA usando los oligonucleótidos BbFlaA-1 y BbFlaA-2 se usó inicialmente una temperatura de hibridación de los primer de 40 °C, considerando 7,5 °C por debajo de la menor temperatura de hibridación óptima teórica de los oligonucleótidos. Al no obtenerse un producto de amplificación se evaluó nuevamente la amplificación usando una temperatura de hibridación de 36 °C en la que sí se obtiene el producto de amplificación esperado. Se determinó que la concentración adecuada de MgCl2 para los ensayos de amplificación era de 2 mM (Figura 1). OBTENCIÓN DE CEPAS E. coli RECOMBINANTES TRANSFORMADAS CON pGEM. La primera selección de recombinantes que se realizó mediante su análisis del tamaño de plásmidos purificados de las clonas candidatas en electroforesis en geles de agarosa. BbFlaA1-2. Se seleccionaron dos clonas y se procedió a evaluarlas por PCR para confirmar que el tamaño del fragmento clonado. Las clonas seleccionadas que dieron bandas con un peso aproximado de 1150 pb en la evaluación por PCR, fueron: BbFlaA1/2-I, BbFlaA1/2-II y BbFlaA1/2-IV. SUBCLONAMIENTO DEL FRAGMENTO A pGEX Y SELECCIÓN DE RECOMBINANTES La primera selección de colonias recombinantes se hace mediante análisis del tamaño de sus plásmidos mediante electroforesis en gel de agarosa. Se seleccionaron nueve clonas posibles recombinantes a las cuales se les realizó un análisis de restricción para confirmar la presencia de fragmento. Finalmente, las clonas seleccionadas fueron: BL21.II-10, BL21.II-11 y BL21.II-12 (Figura 2). Para confirmar la adecuada ligación del fragmento a pGEX se secuenciaron las clonas BL21 II-10 y BL21 II-11, confirmándose que poseían el fragmento esperado. Además, que el fragmento estaba ligado en fase de expresión. ESTANDARIZACIÓN DE LA EXPRESIÓN DE LA PROTEÍNA RECOMBINANTE EN E. coli BL21 Se determinó que el método de lisis celular en los ciclos de frío/calor es más eficiente que la sonicación, debido a que permite recuperar mayor cantidad de proteínas (datos no presentados). Se logró expresar y purificar la proteína fusión de la clona BL21 II-10, mas no de la clona BL21 II-11, a pesar que el secuenciamiento del inserto en el plásmido lo ubicaba en fase de expresión. Finalmente, se requiere como condiciones óptimas para la expresión de la proteína de fusión rBbFlaA en pGEX4T-1 que el cultivo crezca en caldo LB - ampicilina a 30 °C suplementado con 2% de glucosa a partir de un preinóculo de 100 µL (crecido por toda la noche), que el inóculo alcance una densidad óptica de 1 OD 600 y se induzca por 2 horas con 2,5 mM de IPTG (Figura 3). En los primeros ensayos de expresión realizados se observó la presencia de GST libre en los purificados, lo que indicaba que parte de la proteína de fusión era degradada por proteasas disminuyendo así su rendimiento. Por ello, se decidió usar el inhibidor de proteasas PMSF, el cual mejoró la purificación de proteína de fusión (datos no presentados) y disminuyó la presencia de GST libre. ESTANDARIZACIÓN DEL ENSAYO ELISA PARA LA EVALUACIÓN DE LA REACTIVIDAD ANTIGÉNICA USANDO SUEROS DE PACIENTES CON BARTONELOSIS Las condiciones para las pruebas de ELISA fueron estandarizadas. La concentración óptima para la proteína rBbFlaA-GST en ELISA fue de 100 ng/pozo, la dilución de suero fue de 1/50 y la dilución de conjugado fue de 1/500. Se determinó la línea de corte (cut off) de las pruebas de ELISA con la proteína fusión a 0,370 OD 492, usando las absorbancias obtenidas con nueve sueros de personas sanas. La concentración óptima para rBbFlaA en ELISA fue de 100 ng/pozo, la dilución de suero fue de 1/50 y la dilución de conjugado fue de 1/500. La determinación de la línea de corte para la proteína recombinante flagelina se realizó también con 9 sueros de personas sanas, determinándose OD 492 0.162.
2 Laboratorio de Inmunología. Facultad de Ciencias. Universidad Peruana Cayetano Heredia. Lima, Perú.
EVALUACIÓN PRELIMINAR DE LA PROTEÍNA DE FUSIÓN RECOMBINANTE DE LA FLAGELINA DE B. Bacilliformis La sensibilidad de la prueba de ELISA usando la proteína de fusión BbFlaA-GST fue de 65%, 13 sueros de pacientes con Bartonelosis aguda por B. bacilliformis fueron positivos de un total de 20 evaluados. Mientras que la especificidad frente a sueros de personas sanas fue de 85% (3 de 20 sueros) que resultaron positivas. Al evaluarse ELISA usando como antígeno GST purificado, 5% de sueros de personas sanas resultaron positivos (1 suero de 20), mientras que 20% de sueros de pacientes con la enfermedad de Carrión fueron positivos (4 de 20 sueros). Estos resultados indican que GST purificada presenta cierta reactividad por sí sola, es por ello que se decide liberar a la proteína recombinante BbFlaA-GST de GST. La sensibilidad de la prueba de ELISA usando BbFlaA liberado fue de 57,6% (17 de 30 sueros) de los pacientes con Bartonelosis aguda por B. Bacilliformis fueron positivos. La especificidad del ELISA usando BbFlaA liberado frente a sueros de personas sanas fue de 85% (3 de 20 sueros) que fueron positivos a la prueba. La especificidad de ELISA usando BbFlaA liberado es de 69,2%; en esta evaluación cuatro sueros de pacientes con salmonelosis (de siete sueros evaluados) fueron positivos a esta prueba, mientras que todos los sueros de pacientes con leptospirosis (tres sueros) y Brucelosis (tres sueros) fueron negativos. Los resultados se muestran en las figuras 4 y 5. En esta evaluación se determinó que sí existe diferencia significativa (p = 0,004) entre los promedios de las absorbancias de los sueros de personas normales contra sueros de pacientes con Bartonelosis aguda por B. bacilliformis. También se comparó el promedio de las absorbancias obtenidas con sueros de personas normales contra las obtenidas con sueros de pacientes con leptospirosis (n=3) y Brucelosis (n=3) y se determinó que no existen diferencia significativa entre estos (p=0,741, p=0,884 respectivamente). En la comparación del promedio de las absorbancias obtenidas con sueros de personas normales contra sueros de paciente con salmonelosis (n=7) se obtuvo diferencia significativa (p=0,004). DISCUSIÓN En el presente estudio, se demostró que el clonamiento del gen flaA en el plásmido de pGEX permitió la expresión de la proteína recombinante BbFlaA. Se demostró también que la expresión de la flagelina en este sistema está primariamente regulada por la fase de crecimiento del hospedero, estímulos ambientales como la temperatura y nutrientes los cuales modulan la expresión. El plásmido pGEX provee altos niveles de expresión de proteínas de fusión bajo condiciones de inducción; pero, bajo condiciones de no inducción, niveles de expresión basal del promotor lac podría interferir en la expresión de las posibles clonas y mas aún si la proteína expresada es tóxica 8. Posiblemente existen proteasas en el hospedero que degradaban la proteína de fusión GST-BbFlaA. Mernaugh e Ihler 13 notificaron que la invasión de B. bacilliformis era insensible al tratamiento con tripsina (1 mg/mL), así mismo Scherer et al.14 informaron una resistencia parcial (50%) de la flagelina de B. bacilliformis al tratamiento con tripsina (2 mg/ mL). Sin embargo, la flagelina de B. Bacilliformis es una proteína que posee una gran cantidad de sitios de corte teóricos para proteasas como pepsina, LysC, proteinasa K, termolisina y chimostripsina entre otras. Otro de los factores que influyen en la expresión de la proteína recombinante es la temperatura de expresión, con la disminución de la temperatura de crecimiento se mejoró el rendimiento. Probablemente a esta temperatura se disminuya la actividad de la proteasas intracelulares 12. Nuestros resultados indican que el GST presenta una alta reactividad antigénica que posiblemente altera la reactividad de la proteína de fusión. Es por ello que antígenos recombinantes clonados en este sistema deben ser necesariamente liberados de GST. Así mismo, la seroreactividad inespecífica de GST ya ha sido observada 15 (Padilla Carlos, comunicación personal 2002). Durante la evaluación serológica se observó que existe reactividad cruzada con sueros de salmonelosis y Brucelosis. Por otro lado, es posible que personas sanas presenten anticuerpos contra BbflaA de manera cruzada por infecciones con salmonelosis ocurridas anteriormente. La aparición de reactividad cruzada no es de asombro, debido a que la flagelina de B. bacilliformis posee mucha similaridad con flagelinas de otras bacterias filogenéticamente relacionadas y es posible que también comparta epítopes con estas bacterias 16. Este antígeno presenta reacciones cruzadas, por ello su aplicación diagnóstica debe ser acompañada de un análisis e interpretación de la historia clínica del paciente. La implementación de una prueba serológica específica y sensible para el diagnóstico de la Bartonelosis causada por B. bacilliformis podría complementar el diagnóstico convencional que actualmente se realiza de manera rutinaria para esta enfermedad. En el presente artículo nosotros describimos la posible utilidad de la proteína recombinante BbFlaA, sin embargo cabe señalar que es necesario evaluar otras proteínas recombinantes de B. bacilliformis, con el objetivo de mejorar la sensibilidad o la especificidad de la prueba serológica que queremos implementar, asimismo, para lograr este propósito podríamos usar un cóctel de proteínas recombinantes o péptidos sintéticos. Actualmente, nuestro grupo de investigación esta evaluando la seroreactividad de otras proteínas recombinantes. AGRADECIMIENTOS Agradecemos la colaboración de la Sra. Tec. Lab. Juana Choque Portilla. Esta investigación es parte del proyecto: Desarrollo y evaluación de una prueba rápida para el diagnóstico de la Bartonelosis (Código OGITT 2-01-05-02-110), la cual ha sido financiada por el Instituto Nacional de Salud. REFERENCIAS BIBLIOGRÁFICAS 1. Perú, Ministerio de Salud. Norma técnica para el diagnóstico y atención curativa de la bartonelosis o enfermedad de Carrión en el Perú. Lima: MINSA; 2003. NT Nº 001-MINSA / DGSP - v.01 [ Links ] 2. Anderson BE, Neuman MA. Bartonella spp. As emerging human pathogens. Clin Microbiol Rev 1997; 10(2): 203-19. [ Links ] 3. Ellis A, Rotz LD, Leake JA, Samalvides F, Bernable J, Ventura G, et al. An outbreak of acute bartonellosis (Oroya fever) in Urubamba region of Peru. 1998. Am J Trop Med Hyg 1999; 61(2): 344-49. [ Links ] 4. Chamberlin J, Laughlin L, Gordon S, Romero S, Solorzano N, Regnery RL. Serodiagnosis of Bartonella bacilliformis infection by indirect fluorescence antibody assay: test development and application to a population in an area of bartonellosis endemicity. J Clin Microb 2000; 38(11): 4269-71. [ Links ] 5. Mallqui V, Speelmon E, Verastegui M, Maguina-Vargas C, Pinell-Salles P, Lavarello R, et al. Sonicated diagnostic immunoblot for bartonellosis. Clin Diagn Lab Immunol 2000; 7(1):1-5. [ Links ] 6. Padilla C, Ventura G. Diseño y estandarización de una prueba PCR para el diagnóstico de bartonelosis causada por Bartonella bacilliformis. Rev Peru Med Exp Salud Publica 2003; 20(1): 5-8. [ Links ] 7. Krbkova L, Stroblova H. [Comparison of EIA Borrelia recombinant IgM of the 3rd generation with EIA test based on whole cell antigen in the diagnosis of Lyme borreliosis]. Klin Mikrobiol Infekc Lek 2004; 10(6): 271-78. [ Links ] 8. Yan J, Liang SH, Mao YF, Li LW, Li SP. Construction of expression systems for flaA and flaB genes of Helicobacter pylori and determination of immunoreactivity and antigenicity of recombinant proteins. World J Gastroenterol 2003; 9(10): 2240-50. [ Links ] 9. Chen YS, Shiuan D, Chen SC, Chye SM, Chen YL. Recombinant truncated flagellin of Burkholderia pseudomallei as a molecular probe for diagnosis of melioidosis. Clin Diagn Lab Immunol 2003;10(3): 423-25. [ Links ] 10. Sander A, Zagrosek A, Bredt W, Schiltz E, Piemont Y, Lanz C, Dehio C. Characterization of Bartonella clarridgeiae flagellin (FlaA) and detection of antiflagellin antibodies in patients with lymphadenopathy. J Clin Microbiol 2000; 38(8): 2943-48. [ Links ] 11. Sambrook J, Fritsch E, Maniatis T. Plasmid vectors. In: Molecular cloning: A laboratory manual. 2 nd Ed. New York: Cold Spring Harbor Laboratory Press; 1989. p. 1.1-1.110. [ Links ] 12. Saluta M, Bell P. Troubleshooting GST fusion protein expression in E. coli. Life Science News 1998; (1):1-3K-12. [ Links ] 13. Mernaugh G, Ihler G. Deformation factor: an extracellular protein synthesized by Bartonella bacilliformis that deforms erythrocyte membranes. Infect Immun 1992; 60(3): 937- 43. [ Links ] 14. Scherer D, DeBuron-Connors I, Minnick M. Characterization of Bartonella bacilliformis flagella and effect of antiflagellin antibodies on invasion of human erythrocytes. Infect Immun 1993; 61(12): 4962-71. [ Links ] 15. Zhang M, Schillberg S, Zimmermann S, Liao Y, Breuer G, Fischer R. GST fusion protein cause false positives during selection of viral movement protein specific single chain antibodies. J Virol Methods 2001, 91(2): 139-47. [ Links ] 16. Bardy SL, Ng SY, Jarrell KF. Recent advances in the structure and assembly of the archaeal flagellum. J Mol Microbiol Biotechnol 2004; 7(1-2): 41-51. [ Links ] Correspondencia:
Blgo. Carlos P. Padilla Rojas.
Laboratorio de Biotecnología y Biología Molecular. Centro Nacional de Salud Pública. Instituto Nacional de Salud. Lima, Perú.
Dirección: Calle Cápac Yupanqui 1400, Jesús Maria, Lima.
Teléfono: (511) 4719920 anexo 129.
Correo electrónico: cpadilla@ins.gob.pe ;