Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.22 n.3 Lima jul./sep 2005
ARTÍCULO REVISIÓN
Dengue en el Perú: Aportes para su diagnóstico y control
Dengue in Peru: contributions for its diagnosis and control
César Cabezas S 1,2; Grupo de trabajo de dengue*
1 Instituto Nacional de Salud. Lima, Perú.
2 Instituto de Medicina Tropical «Daniel A Carrión», Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
* Grupo de trabajo de dengue INS: Virología. Victoria Gutiérrez, Maria P. García, Enrique Mamani, Miguel Cobos, Omar Cáceres, Miguel Farfán. Entomología. Rosario Balta, Miriam Palomino, Rosa Casternoque, Norma García, Pablo Villaseca.
RESUMEN
El dengue es la arbovirosis más importante en salud pública; reingresó al Perú en 1990 y se encuentra presente en la Amazonía y costa norte, incluyendo, recientemente a Lima. En este artículo se abordan aspectos sobre la historia, fisiopatología, entomología, vigilancia y control, enfatizando en los aportes del Instituto Nacional de Salud (INS), para el control del dengue en el Perú, entidad que ha cumplido un papel importante en el esfuerzo por controlar al dengue, a través de investigaciones e incorporando progresivamente en la Red Nacional de Laboratorios, técnicas de diagnóstico desde el ELISA para la detección de anticuerpos, el aislamiento viral y últimamente el RT-PCR y la genotipificación, así también en el área entomológica, para la verificación de la presencia del Aedes aegypti, su susceptibilidad a los insecticidas y nuevas técnicas para este propósito.
Palabras clave: Dengue; /prevención & control; /diagnóstico; Sistema de vigilancia sanitaria; Aedes aegypti; Perú (fuente: DeCS BIREME).
ABSTRACT
Dengue is the most important arbovirosis in public health; in 1990 its reappearance in Peru and it is present in the Amazon region and North Coast of the country, including, recently Lima. In this article aspects are approached on the history, physiopathology, entomology, surveillance and control, emphasizing the contributions of the Instituto Nacional de Salud (INS), for the control of the dengue in Peru, entity that has fulfilled an important role in the effort for controlling to dengue, across researches and incorporating progressively in the national net of laboratories, techniques of diagnosis from the ELISA for the detection of antibodies, the viral isolation and lately the RT-PCR and the genotyping, this way also in the entomological area, for the monitoring of the presence of the Aedes aegypti, its susceptibility to insecticide and new techniques for this intention.
Key words: Dengue; /prevention & control; /diagnosis; Health surveillance system; Aedes aegypti; Perú (source: DeCS BIREME).
INTRODUCCIÓN
Las enfermedades infecciosas constituyen la primera causa de muerte en el mundo, tanto en adultos como enniños. Más de 13 millones de personas mueren anualmente por enfermedades infecciosas emergentes y reemergentes, tales como la malaria, la tuberculosis, el síndrome de la inmunodeficiencia adquirida (SIDA), la fiebre hemorrágica producida por el virus Ébola, el síndrome respiratorio agudo grave (SARS), la infección por el virus del Nilo occidental y el dengue 1 .
En este contexto, el dengue es un problema creciente para la salud pública en las áreas tropicales del mundo. En la región de las Américas el patrón es similar a la situación que se observó en Asia hace 30 años, siendo actualmente el dengue la enfermedad viral transmitida por mosquitos, más importante que afecta a los seres humanos. El Aedes aegypti, el vector del virus dengue, se encuentra en casi cien países tropicales y se calcula que 2,5 billones de personas habitan en áreas donde existe el riesgo de transmisión de la epidemia 2 .
El Aedes aegyti fue eliminado del Perú en 1956, pero reingresó en 1984 trayendo consigo al dengue, cuya manifestación máxima ocurrió en forma explosiva en 1990 al presentarse el dengue clásico, debido al serotipo 1 del virus dengue, en las principales ciudades de nuestra Amazonía 3 .
A partir de entonces, somos testigos de su inexorable expansión por las ciudades de la costa norte y de la Amazonía, en las cuales han circulado en los últimos años, los cuatro serotipos del virus, y han aparecido en ambas regiones, casos de dengue hemorrágico.
Complicando este escenario, el Aedes aegypti reapareció el año 2000 en Lima 4 , pues también estuvo desde la Colonia hasta el siglo XIX y fue el transmisor de la fiebre amarilla urbana 5 , producto de factores como la intensa migración interna desde áreas endémicas de dengue tanto de la costa norte como de áreas de selva, temperatura ambiental cada vez mayor no sólo debida a cambios estacionales, así como las deficientes condiciones de saneamiento y disponibilidad de agua potable que obliga a los pobladores a almacenarla.
Estando el vector Aedes aegypti en Lima y existiendo entre los inmigrantes, personas infectadas por el virus del dengue en etapa de viremia, era previsible la infección del vector y su transmisión a pobladores residentes en Lima, lo cual ocurrió entre marzo y abril de 2005 en Comas, un distrito densamente poblado, al norte de esta metrópoli que es Lima (Figura 1)6 .

Desde que el dengue ingresó al Perú, se han desarrollado e implementado diferentes estrategias para su control, sin embargo, factores como la intensa migración interna de áreas endémicas hacia áreas libres del vector y del dengue mismo, así como los cambios climáticos, hacen que su real control sea un reto y que siempre exista el riesgo de su expansión a nuevas áreas, como se ha venido dando en casi todas las ciudades grandes y pequeñas de la Amazonía y de la costa norte de Tumbes a Lima.
HISTORIA
Entre 1779 y 1780 se describió en Asia, África y América del Norte una epidemia, debida a una enfermedad con manifestaciones parecidas al dengue; sin embargo, cuadros clínicos semejantes a los de dengue se encuentran reportados en la Enciclopedia China de la Dinastía Chin (265-420 A. E. C.). Los antiguos chinos ya suponían que la enfermedad estaba relacionada con insectos voladores asociados al agua 7 .
El término «dengue» se originó en América entre 1827 y 1828, a raíz de una epidemia en el Caribe que cursaba con fiebre, artralgias y exantema. Los esclavos provenientes de África identificaron a esta entidad patoló-gica como dinga o dyenga, homónimo del Swahili Ki denga pepo, que significa ataque repentino (calambre o estremecimiento) provocado por un «espíritu malo»7,8 .
Hay reportes clínicos de dengue entre 1779 y 1780, aunque las primeras epidemias compatibles con den-gue clásico en Latinoamérica y el Caribe se dieron en las Antillas Francesas en 1635 y en Panamá en 1699 7,9 . Por otro lado el primer reporte de fiebre hemorrágica del dengue/síndrome de choque por dengue que se definieron como tales, se describieron en una epidemia ocurrida en 1954 en Filipinas 10,11 .
La primera epidemia de dengue clásico, del siglo XX, en América, comprobada por laboratorio, ocurrió en la región del Caribe y en Venezuela en los años 1963-64, donde el virus dengue 3 fue el serotipo circulante. Años antes, entre 1953-54, en situación no epidémica, se había descrito en Trinidad. Entre los años 1968-69 otra epidemia afectó algunas islas del Caribe, aislándose los serotipos de dengue 2 y 3. En 1977 el serotipo Den-1 fue introducido en América a través de Jamaica, el que se diseminó por la mayoría de las islas del Caribe causando epidemias y también afectó a algunos países centroamericanos (Belice, Honduras, El Salvador, Guatemala, México) y sudamericanos (Colombia, Venezuela, Guyana, Suriname), abarcando in-cluso a Texas en EEUU 12 .
En la década de 1980 la magnitud del dengue se incrementó, llegando en 1982 al norte de Brasil con los serotipos 1 y 4; en 1986 afectó Río de Janeiro con el serotipo 1, posteriormente, se presentaron brotes en Bolivia (1987) Paraguay (1988), Ecuador (1988) y el Perú (1990) en todas con el serotipo 1 12,13 . Si bien hubo una comunicación de serotipo 4 en el brote del Perú (NAMRID), este hallazgo no fue confirmado posterior-mente y el serotipo que circuló en 1990 en Iquitos y otras ciudades de la Amazonia correspondieron al serotipo 1 (Comunicación personal, Watts Douglas).
El serotipo Den-4 fue introducido en 1981 y desde entonces los tipos 1, 2 y 4 han sido transmitidos simultáneamente en muchos países de las Américas donde Aedes aegypti estaba presente. El serotipo 3 reaparece desde 1994 en Nicaragua, este serotipo constituye un riesgo importante ya que pro-totipos de este han sido asociadas con la forma hemorrágica de la enfermedad 14 . En 1981 el brote de dengue hemorrágico (DH) ocurrido en Cuba estuvo asociado al serotipo 2, y produjo 158 defunciones, de los cuales 101 fueron niños. Posteriormente, entre 1989 y 1990 ocurrió otro brote de DH en Venezuela, luego aparecieron casos de DH en países de centro y Sudamérica que previamente habían tenido casos de dengue clásico. En Río de Janeiro, luego de la introducción del serotipo 2, se notificaron casos de DH en 1990 y 1991, en esos mismos años se reportaron en Colombia 12 .
En el Perú, los primeros reportes de brotes de un síndrome febril compatible con dengue clásico, fueron descritos en 1700, 1818,1850 y 1876, aunque no se tuvo confirmación laboratorial 16,17 .
La introducción del dengue en el Perú en el siglo XX está ligado a la reintroducción del Aedes aegypti. Este vector, luego de su eliminación en el Perú en 1956 reingresó en 1984, siendo inminente el ingreso del dengue. En 1990 ocurrió un explosiva epidemia de dengue clásico debido al serotipo 1 del virus dengue, en las principales ciudades de nuestra Amazonía y posteriormente se extendió a las ciudades de la costa norte del pais 3,13 .
Como mencionamos al introducir esta revisión, para complicar este escenario el Aedes aegypti reapareció el año 2000 en Lima 4 , y como era de esperar el dengue ingresó a Lima el 2005 con una epidemia al norte de esta metrópoli, en el distrito de Comas. Debemos anotar que en Lima no hay precipitaciones pluviales importantes, y la presencia del Aedes esta ligado a la falta de disponibilidad del agua en populosos distritos periféricos 17 .
AGENTE ETIOLÓGICO
El virus del dengue es un arbovirus («arbo» acrónimo del inglés arthropod-borne, transportado por artropodos) y pertenece al género de Flavivirus familia Flaviviridae un grupo de más de 68 agentes virales agrupados por su relación serológica y por la determinación de secuencias genómicas; al menos 30 de estos virus causan enfermedad en los humanos 18,19 .
La familia Flaviviridae agrupa virus ARN de cadena simple en sentido positivo que se multiplican en células de vertebrados y de insectos vectores. Esta familia esta representada por tres géneros: Flavivirus (lt flavus, amarillo), Pestivirus (lt pestis, peste, plaga) y virus he-patitis C (gr hepato, hígado; también conocidos como hepatacivirus) (Rice, 1996). El género Flavivirus reúne en su mayoría (55%) a virus asociados con enfermedades humanas y algunos patógenos de animales domésticos o de interés económico. Además, consta de más de 70 virus clasificados en diez grupos (o especies), entre ellos el virus dengue 20 .
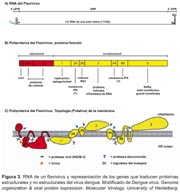
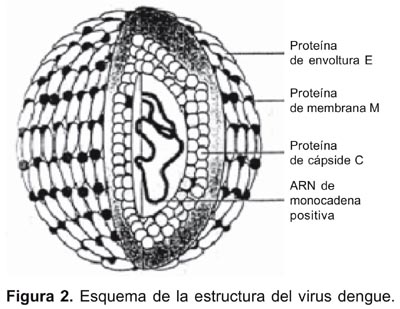
La partícula viral del dengue es de forma esférica y mide entre 40 y 60 nm de diámetro. Tiene una envoltura formada por proteínas [proteína E (principalmente), y proteína M] que cubre completamente la superficie del virus (Figura 2). El material genético se encuentra protegido por una nucleocápside circular de simetría poliédrica; el diámetro del núcleo es de 25-30 nm. Entre la envoltura y la nucleocápside se encuentra una bicapa lipídica, cuyos lípidos se derivan de la membrana celular del hospedero. El genoma está compuesto por una sola molécula de RNA de cadena sencilla lineal, de sentido positivo, de 10703 nucleótidos y de alta variabilidad genómica.
El grupo virus dengue esta representado por cuatro serotipos (o subespecies): virus dengue 1, virus dengue 2, virus dengue 3 y virus dengue 4; los cuales tienen características antigénicas y serológicas diferentes, además pueden presentar variantes genéticas (genotipos y topotipos) dentro de un mismo serotipo, relacionadas con la virulencia y la procedencia geográfica de la cepa 21,22 . Se ha descrito una homología de secuencia de aproximadamente 70% entre los diferentes serotipos de dengue, siendo dicha homología mayor entre los serotipos 1, 2, y 3 22 . Tanto la presentación clínica de dengue clásico como el dengue hemorrágico y el síndrome de choque por dengue son causados por el virus del dengue.
El virión es infeccioso y está compuesto por 6% de ARN, 66% de proteínas, 9% de carbohidratos y 17% de lípidos 20 . El genoma tiene una longitud de 9500 a 12500 nucleótidos, y da lugar a tres proteínas estructurales: la proteína E de envoltura, la proteína M de membrana y la proteína C de cápside y a siete proteínas no estructurales (NS1, NS2a, NS2b, NS3, NS4a, NS4b y NS5), como se muestra en la figura 3.
El ciclo replicativo está marcado por la traslación del ARN genómico del virus al citoplasma celular del huésped, síntesis de cadenas negativas y positivas de ARN, y ensamblaje con liberación de partículas virales maduras 23 .La glicoproteína E cumple un papel importante durante la penetración del virus en la célula y en la respuesta inmunitaria 24 . De otro lado, la proteína no estructural NS1 participa en la maduración viral 25 .
También se ha demostrado la presencia de varias poblaciones virales en un mismo hospedero 26 y puede darse recombinación entre cepas, probablemente en razón a la circulación simultánea de genotipos diferentes de un serotipo en un mismo hospedero 27,28 , esto puede hacer pensar que la diversidad genética de este virus del dengue puede inducir a la aparición de cepas que puede replicarse mas rápidamente o ser más patógenas. Es importante destacar las variaciones genotípicas en los diferentes serotipos de dengue, que puedan tener una mayor influencia en el desarrollo del dengue hemorrágico o del síndrome de choque por dengue, como es el caso del serotipo 2 genotipo americano, que no indujo al dengue hemorrágico en el Perú, a diferencia del genotipo asiático del mismo serotipo 2 que sí desarrolló dengue hemorrágico en personas con infección previa por dengue por otros serotipos como el 1 29,30 .
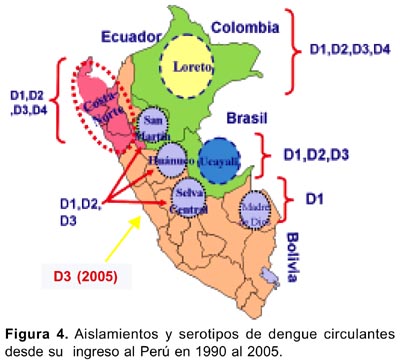
El virus de dengue serotipo 1 fue el primero que reingresó al Perú en 1990, desde ese año, han circulado los cuatro serotipos ya sea por separado o de manera conjunta, en los últimos años ha predominado la infección por el serotipo 3 (Tabla 1), la distribución de serotipos a su vez es variada en las diferentes regiones del país (figura 4)31 .
En el año 2005 usando la técnica RSS-PCR (diagnóstico y genotipificación) se determinó que el brote ocurrido en Lima correspondió al serotipo 3, el cual tuvo concordancia con los aislamientos virales 32 ;adicionalmente, el análisis filogenético del virus dengue 3 aislado en Lima mostró 98% de similaridad en la secuencia genética con el dengue 3 genotipo III aislado en Sullana-Piura y también con el aislamiento hecho en Ucayali, lo cual concuerda con la migración de personas infectadas de estas áreas hacia Lima, sugiriendo que esta fue la vía de entrada del virus 33 .
ASPECTOS ENTOMOLÓGICOS
El Aedes aegypti, originario de África, es el vector transmisor del dengue, pero también de la fiebre amarilla urbana (FAU). En 1881 Carlos Finlay propuso la teoría de que Ae. aegypti transmitía la FAU 34 . En las Améri-cas durante 1920 se llegó a controlar; en el año 1965, 17 de 49 naciones lo erradicaron, pero en 1980 Bolivia se reinfestó, en 1981 Paraguay y en 1984 la región amazónica del Perú 35 . El Aedes aegypti, se encuentra distribuido en las principales ciudades de la Amazonía y la costa norte del Perú, desde Tumbes hasta Lima 36 .
CICLO BIOLÓGICO
El huevo. Mide aproximadamente 1 mm, es ovalado, blanco y luego se torna a negro al desarrollar el embrión. Es depositado individualmente en diferentes recipientes por encima del nivel del agua. El ciclo desde la postura a la eclosión en condiciones óptimas de humedad y temperatura dura 48 horas, pero puede prolongarse hasta cinco días. La hembra puede ovipositar de 100-200 huevos por postura, pudiendo resistir las sequías hasta un año (Figura 5A)37 .
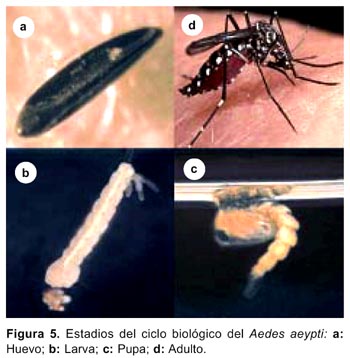
La larva. Tiene tres fases: Fase acuática, de alimentación y de crecimiento. Se divide en cabeza, tórax y nueve segmentos abdominales; el segmento posterior y anal tienen cuatro branquias lobuladas; un sifón respiratorio corto por el cual respira y se mantiene en la superficie casi vertical. Poseen cuatro espinas torácicas, dos a cada lado. El octavo segmento con una hilera de siete a doce dientes formando el peine y sifón con el pecten. Tiene un movimiento serpenteante y fotofobia. La fase completa demora entre ocho a doce días (Figura 5B)37 .
La pupa. En esta fase no se alimenta y su función es la metamorfosis de larva a adulto. Se mueve rápidamente ante un estímulo y cuando están inactivas flotan en la superficie. Trompeta respiratoria corta y con un solo pelo en el borde de la paleta natatoria. En la base del abdomen tiene un par de aletas o remos que le sirven para nadar. Este estadio dura de dos a tres días (Figura 5C)37 .
El adulto. Es la fase reproductora del Aedes aegypti. Las hembras se distinguen de los anofelinos por tenerpalpos más cortos y por adoptar una posición horizontal durante el reposo. Se caracteriza por tener un abdomen agudo. Es de color negro con manchas blancas y plateadas en diferentes partes del cuerpo. En el tórax (mesonoto) tiene un dibujo característico con franjas claras a manera de «lira» (Figura 5D)37 .
CRIADEROS
El Aedes aegypti es un mosquito que se cría en recipientes sombreados y con agua, en los cuales las hembras depositan sus huevos por encima del nivel del líquido, en las paredes de dichos recipientes. En lugares lluviosos, como la selva, los recipientes predilectos son los objetos desechados como llantas, latas, botellas o floreros (Figura 6)38,39 ; en lugares no lluviosos como la costa, son los recipientes caseros para almacenar agua como barriles, tanques bajos y altos, tinajas y baldes (Figura 7)17,40,41 .

ECOLOGÍA DEL ADULTO
Emergencia. Luego de emerger de la pupa, el insecto se posa sobre las paredes del recipiente durante varias horas hasta el endurecimiento de sus alas y su exoesqueleto.
Apareamiento. Dentro de las 24 horas, después de la emergencia, puede ocurrir el apareamiento. El macho es atraído por el sonido emitido por el batir de las alas de la hembra durante el vuelo.
Alimentación. Las hembras se alimentan de la mayoría de vertebrados, pero prefieren a los humanos, vuelan en sentido contrario al viento y son atraídas por los olores y gases del hombre. La sangre sirve para el desarrollo de los huevos.
Ciclo gonadotrófico. Después de cada alimentación se desarrolla un lote de huevos. Si la hembra completa su alimentación sanguínea (2-3 mg) desarrollará y pondrá 100-200 huevos, el intervalo dura de dos a tres días. La hembra grávida buscará recipientes oscuros o sombreados para depositar sus huevos, prefiriendo aguas limpias y claras.
Rango de vuelo. La hembra no sobrepasa los 50-100 m durante su vida (puede permanecer en la misma casa donde emergió). Si no hay recipientes, una hembra grávida puede volar tres kilómetros para poner sus huevos. Los machos se dispersan menos que las hembras.
Conducta de reposo. Descansan en lugares sombreados como alcobas, baños, patios o cocinas. Se les captura sobre ropas colgadas, debajo de muebles, toallas, cortinas y mosquiteros.
Longevidad. Los adultos pueden permanecer vivos en el laboratorio durante meses y en la naturaleza pocas semanas. Con una mortalidad diaria de 10%, la mitad de los mosquitos morirán durante la primera semana y 95 % en el primer mes.
VIGILANCIA Y CONTROL VECTORIAL
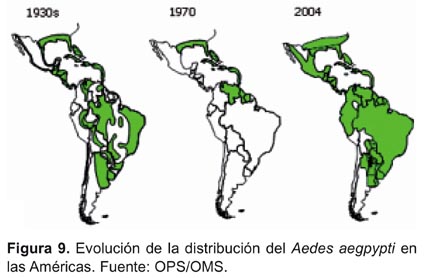
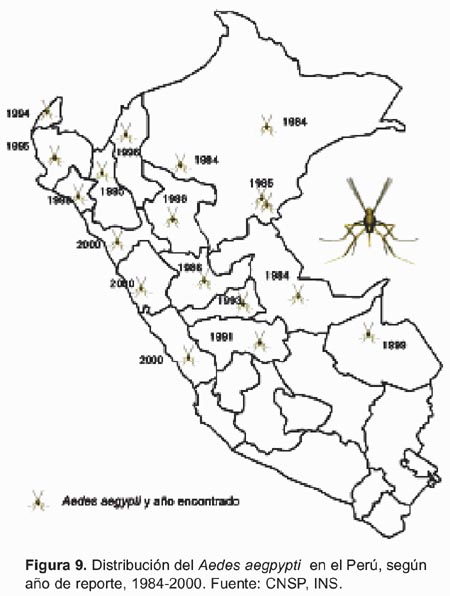
El Aedes aegypti, pese a los esfuerzos para su control, ha ido dispersándose por los países de América, (Figura 8); así mismo, desde su reingreso al Perú en 1984, se ha dispersado, a través de los años, al resto de país como en la Amazonia y la costa norte hasta Lima (Figura 9).
En áreas infestadas es necesario determinar la distribución, densidad y efectos de medidas de control. En áreas no infestadas establecer un programa de vigilancia para detectar la introducción del mosquito 42 .
En Lima se encontró al A. aegypti en el año 2000 4 . En el 2004 se evaluó su distribución en el cono norte, habiéndose inspeccionado 47 localidades en cuatro distritos de nivel socio-económico D (Inde-pendencia, Comas, Carabayllo y Puente Piedra), con población de un millón de habitantes. Una de cada 25 viviendas fue escogida aleatoriamente y los recipientes de esta fueron inspeccionados por técnicos/ promotores de salud para evaluar la presencia de larvas/pupas de Aedes. La especie de Aedes fue confirmada en laboratorio. Se calcularon los índices de viviendas (viviendas positivas / total inspeccionadas) para cada localidad. De agosto a octubre de 2004, se evaluaron 21 500 viviendas. La temperatura promedio fue de 18 °C. En cuatro distritos hubo presencia de Aedes aegypti; la positividad se dio en 30/47 localidades. Los índices de vivienda distritales fueron de 3,18 para Independencia; 1,77para Comas; 0,17para Carabayllo y 0,04para Puente Piedra. En Comas e Independencia, más de la mitad de localidades mostraron índices de vivienda > 2. Entre 70 - 80% de los recipientes positivos fueron tanques y cilindros llenados manualmente 17 .
Dada la gran variabilidad en los índices de vivienda entre localidades, incluso dentro del mismo distrito, era conveniente dirigir actividades de control hacia localidades más afectadas antes que distritos enteros. El tipo de contenedores con mayor frecuencia positivos (tanques y cilindros) sugieren que el control químico con larvicidas y campañas de participación comunitaria para control físico ayudarían a reducir estos niveles de infestación. Este hallazgo ya preveía el ingreso del dengue a Lima 17 .
Uno de los larvicidas más usados en el control del vector del dengue es el temephos, por lo que era importante evaluar la susceptibilidad del A. aegypti a este insecticida.
Los diferentes estudios hechos en el Perú muestran que este larvicida mantiene una eficacia adecuada 43,44 , un último estudio fue hecho en San Juan de Lurigancho, en Lima, en el que el temephos mostró una mortalidad de la larva a las 24 horas, de 99,7 %. No existiendo evidencia, en condiciones de campo, de disminución de la eficacia residual a las nueve semanas 45 .
Para la determinación de la susceptibilidad de vectores a insecticidas se usa el papel impregnado recomendado por la OMS 46 , y en los últimos años se viene implementando el uso de la técnica de la botella propiciada por el CDC 47,48 (Figura 10); al respecto, es necesario concluir los estudios comparativos entre estos dos métodos para ser usados en el país, mientras tanto, se ha considerado el uso de la técnica de la botella como una prueba de tamizaje, para su confirmación posterior por el papel impregnado 48 .

RESPUESTA INMUNE Y PATOGENIA
La respuesta inmunológica a la infección por el virus del dengue tiene un patrón diferente al común de los producidos por otros virus, dada su variabilidad genotípica la respuesta inmune en el dengue, en lugar de desarrollar una efectiva protección para infecciones futuras puede ser contraproducente para el huésped 49 . Los mecanismos que permiten la recuperación de un individuo con infección por virus dengue o el consecuente desarrollo de fiebre hemorrágica por dengue/ síndrome de choque por dengue, no se conocen con precisión; sin embargo, la patogénesis del dengue puede estar relacionada con algunos factores como la virulencia del virus, la edad y el estado nutricional, genético e inmunológico del hospedero, y la presencia de otras infecciones recurrentes y concomitantes 50 .
La asociación de epidemias y mayor gravedad de la enfermedad del dengue en ciertas áreas geográficas, con las variaciones genotípicas y la virulencia de la cepa, fue descrita en 1977 por Rosen 51 , esto probablemente debido a la introducción de genotipos más virulentos procedentes de regiones endémicas hacia regiones donde la enfermedad no ocurría antes, teniendo como resultado epidemias con más casos de FHD y la persistencia de estas cepas en estas áreas geográficas 19,21,52 .
Halstead observó que personas con infecciones secundarias o lactantes con presencia de anticuerpos maternos circulantes eran más propensos a desarrollar cuadros de FHD / SSD y estableció que infecciones sucesivas por diferentes serotipos de virus dengue están asociados con estas formas graves de la enfermedad. Según esta teoría, cantidades subneutralizantes de inmunoglobulinas específicas del tipo IgG, no protegen frente a un segundo serotipo distinto al de la primera infección, y por el contrario al reaccionar con el segundo serotipo forman complejos virus-anticuerpo que facilitan la entrada del virus a célula del linaje fagocito mononuclear a través de la unión del fragmento Fc de la inmunoglobulina y el FcR de la célula diana 50,53,54 .
Hay factores de riesgo para tener DH, siendo el más importante el de tener una segunda infección por un serotipo diferente al que causó la infección primaria en el mismo individuo 54-56 ; igualmente, tener menos de 15 años de edad, ser de raza blanca, tener enfermedades crónicas como el asma, diabetes o anemia por células falciformes son factores de riesgo 55-57 .
Durante la infección primaria, el virus ingresa a la célula diana a través de su unión con un receptor celular produciendo anticuerpos neutralizantes capaces de proteger por largo tiempo contra la reinfección con ese mismo serotipo. Estos anticuerpos pueden neutralizar a otros serotipos sólo durante dos a tres meses; sin embargo, en una infección secundaria con un serotipo diferente, se forman complejos virus-anticuerpos que ingresan a las células del sistema fagocítico mononuclear (monocitos y macrófagos) a través de la unión del fragmento constante de la inmunoglobulina con los receptores celulares del tipo gamma. Como resultado de este fenómeno se infectan un mayor número de células y por tanto hay una mayor diseminación viral, conocido como amplificación dependiente de anticuerpos 59,59 .
Se ha encontrado que células asesinas naturales (NK, natural killer) presentes en poblaciones de células mononucleares de sangre periférica de individuos infectados con virus dengue, lisan mayor número de células infectadas que células no infectadas 60,61 . En infecciones secundarias, la presencia de anticuerpos antidengue aumenta la lisis celular por células NK a través del mecanismo conocido como citotoxicidad celular dependiente de anticuerpos 62 .
La respuesta celular específica frente al virus dengue se inicia con la activación de LT CD4+ durante la viremia y posteriormente con la activación de LT CD8+. En individuos con FHD por infecciones secundarias, se ha demostrado la presencia de LT CD4+/CD8+ de memoria y LT CD4+/CD8+ citotóxicos 63,64 , por lo que la activación de los linfocitos T y también la producción de citocinas son factores importantes en la patogenia del DH 65,66 .
Además de la respuesta inmune celular en los casos de DH se exacerba la activación y liberación de citocinas, lo que se relaciona con la mayor gravedad del cuadro clínico. También en el DH se ha demostrado la activación del sistema del complemento, pudiéndose detectar en los casos graves concentraciones elevadas de las proteínas C3 y C1q, planteándose como una explicación, que los complejos virus-anticuerpos circulantes serian los que activan la reacción en cascada del complemento 49,67-69 .
Igualmente, existe la posibilidad que en el DH se presenten reacciones autoinmunes, que pueden estar dadas por la presencia de anticuerpos contra las pro-teínas virales que presenten reactividad cruzada contraplaquetas y factores de coagulación 49,70 . Algunas proteínas no estructurales como NS1, NS2 y NS3 parecen tener cierta homología estructural con factores de coagulación, plaquetas, integrinas y adhesinas de células endoteliales humanas, permitiendo la activación de clonas LT autorreactivas que participan en la patología del dengue 70-75 .
Además, la activación de linfocitos de reactividad cruzada o serotipo-específicos pueden llevar a la consecuente formación de anticuerpos de reactividad cruzada, inespecíficos y autorreactivos involucrados con la gravedad de la enfermedad 71,74 .
Es importante destacar la hipótesis integral planteada por Kouri, que a diferencia de lo mencionado por Halstead y Rosen, que planteaban que el dengue hemorrágico se producía como resultado de una infección secundaria o por la virulencia del virus respectivamente, plantea que ambos factores aunados a las características del huésped muestran la causa multifactorial del DH 56 .
Dentro de esta propuesta es necesario mencionar el papel del virus del dengue en la presentación del DH, así tenemos la asociación de algunos genotipos con el desarrollo de epidemias de DH o de mayor gravedad, como son las variantes genotípicas asiáticas del serotipo 2 de dengue y también la procedencia asiática del serotipo 3 29,76 , y de otro lado la mayor carga viral en los casos de DH en comparación con los casos de dengue clásico 77 .
Estudios realizados a partir de cepas de virus de dengue de Perú, México y Venezuela han mostrado la presencia de componentes determinantes de virulencia en la proteína E y en el extremo 3 del genoma viral 73 .
DIAGNÓSTICO LABORATORIAL
Como en la mayoría de enfermedades de etiología viral, es necesaria la confirmación en el laboratorio, cuando se sospecha de infección por el virus dengue; para ese fin se cuenta con pruebas que pueden detectar la presencia del virus, como es el aislamiento viral y pruebas moleculares o la determinación de anticuerpos a través de pruebas serológicas, que a continuación se describen.
AISLAMIENTO VIRAL
Para este efecto se usan diferentes sistemas, entre ellos hay cuatro métodos de aislamiento viral usados rutinariamente: inoculación intracerebral de ratones recién nacidos, inoculación en cultivos celulares de mamíferos, inoculación intratorácica de mosquitos adultos, e inoculación en cultivos celulares de mosquito. Después de la inoculación de la muestra sos-pechosa, se obtienen evidencias de replicación viral alrededor del día cinco o siete de haber inoculado la muestra en el medio de cultivo. Al aislarse una muestra se identifica al virus del dengue usando anticuerpos monoclonales o alternativamente mediante pruebas de fijación de complemento.
Inoculación intracerebral en ratones. Aunque inicialmente los cuatro serotipos fueron aislados por inoculación intracerebral de los ratones, esta técnica tiene varias desventajas, incluyendo alto costo, el tiempo largo para el aislamiento, y su baja sensibilidad, por lo que se recurre a otros métodos.
Cultivos celulares de mamíferos. Presentan las mis-mas desventajas que la inoculación intracerebral, pues los virus requieren con frecuencia pasos múltiples antes de inducir efectos citopáticos en las células infectadas, no siendo recomendado actualmente 78 .
Inoculación en mosquitos. La inoculación en mosquitos es el método más sensible, sin embargo, es el menos usado para el aislamiento del virus del dengue 79 . Se han utilizado cuatro especies del mosquito: Aegypti aegypti, A. albopictus, Toxorhynchities amboinensis y T. splendens. Los mosquitos de ambos sexos son susceptibles y se obtienen títulos altos en periodos de cuatro a cinco días, dependiendo de la temperatura de la incubación. La detección final del virus se hace mediante inmunofluorescencia indirecta (IFA) de los tejidos del mosquito, generalmente cerebro o glándulas salivales. Una de las desventajas es que es muy trabajoso y la necesidad de que los insectarios produzcan una gran cantidad de mosquitos para la inoculación, además de las precauciones del aislamiento y el riesgo de la liberación de mosquitos infectados 80-82 .
Cutivo en células de mosquito. Los cultivos en células de mosquito han sido recientemente desarrollados y existen tres líneas de células con sensibilidad comparable; sin embargo, las más difundidas y utilizadas son las C6/36 que han sido elaboradas a partir de células de Aedes albopictus 83-86 .
El uso de esta línea celular ha proporcionado un método rápido, sensible y económico para el aislamiento del virus del dengue. Los antígenos del dengue se pueden detectar en los cultivos celulares infectados mediante IFA. Esta técnica es menos sensible que la inoculación intratorácica de los mosquitos del adulto, pero debido a su capacidad de procesar varias muestras en el mismo tiempo, se ha convertido en la técnica estándar para el aislamiento del virus del dengue. Las ventajas de las células del mosquito son: una sensibilidad más alta que la línea de célula de vertebrado para la recuperación de los virus del den-gue, son relativamente fáciles de mantener y de crecer en la temperatura ambiente y es posible mantener los cultivos hasta por 14 días sin cambiar el medio 84,85.
Aunque se describe un efecto citopático con presencia de células gigantes multinucleadas, este efecto puede ser difícil de detectar y ser variable. El efecto citopático se considera generalmente cuando estas células se cultivan en tubos (Figura 11)86 .

Durante la epidemia de dengue ocurrida en Lima se logró mostrar una técnica de aislamiento rápido del virus dengue 3 por el método de shell vial, los resultados mostraron que al quinto día de la cosecha 48,7% (57/117) de los sueros resultaron positivos para el virus DEN-3, y de los 22 sueros positivos al tercer día se obtuvo más de 80% (18/22) de aislamientos. Estos resultados sugieren que la técnica de shell vial por el menor tiempo de aislamiento y costo comparado con el método tradicional, puede ser implementada como método de diagnóstico y usada en la vigilancia epidemiológica del virus dengue 87.
DIAGNÓSTICO MOLECULAR
El los últimos años, varias nuevas técnicas de diagnóstico molecular se han desarrollado y se ha probado su utilidad para el diagnostico del dengue. Estos métodos pueden detectar fácilmente los virus del dengue principalmente durante la fase aguda de la enfermedad 88,89 .
Hibridación del ácido nucleico. Se realiza a partir del RNA extraído del virus del dengue procedente de los sobrenadantes de cultivos celulares o de grupos de mosquitos como Aedes albopictus. Se usa para estu-dios epidemiológicos y también se puede utilizar para diagnóstico viral a partir de tejidos obtenidos de autopsias, sin embargo, no se ha utilizado para identificación viral directa en muestras 90 . La hibridación de RNA-RNA es una técnica sensible que se puede aplicar directamente en muestras frescas o en análisis retrospectivos de muestras fijadas 91 .
Debido a las dificultades en el trabajo con RNA, como el de contar con técnicos experimentados que se requieren para obtener resultados reproductivos, este método se ha usado más a menudo como herramienta de la investigación que como un método de diagnóstico rutinario 92,93 .
Transcripción reversa de la Reacción en Cadena de la Polimerasa (RT- PCR). Se ha desarrollado para el diagnóstico de varias enfermedades, y en los últimos años ha evolucionando hacia el diagnóstico laboratorial de enfermedades infecciosas. Este método es rápido, sensible, simple, y si está estandardizado correctamente, puede ser usado para la detección del genoma en las muestras clínicas humanas, las biopsias, los tejidos de autopsias y de mosquitos 94 .
Se han divulgado varios procedimientos de RT-PCR que detectan e identifican serotipos de dengue a partir de especímenes clínicos 95,96 . Estos métodos de PCR varían algo en términos de las regiones amplificadas del gen del genoma, de las maneras como se detectan los productos del RT-PCR, y de los métodos como se tipifican los virus. Según la Organización Mundial de la Salud (OMS), el PCR es un método de gran alcance para el diagnóstico del dengue, sin embargo, es aún necesaria una mejor estandardización.
Un gran problema para el diagnóstico del dengue ha sido la confirmación etiológica de casos fatales. Con frecuencia, solamente se obtiene una sola muestra del suero, y la prueba serológica se encuentra en el valor límite. En estos casos, es posible ahora detectar los antígenos en una gran variedad de muestras fijas con los nuevos métodos immunohistoquímicos 97,98 .Otra característica importante de PCR es su capaci-dad de identificar el serotipo del dengue responsablede la enfermedad en curso 99 .Además de análisis enzimáticos específicos de la amplificación y de la restricción, otros estudios han demostrado que el ordenar los nucleótidos de los fragmentos amplificados del gen por RT-PCR se puede usar como método rápido de clasificación genética de los serotipos del virus del dengue 100,101 .
En nuestro país tenemos disponibles pruebas de biología molecular, que han permitido el diagnóstico oportuno de epidemias como la ocurrida en Lima el 2005, donde se usó las técnicas de RT-PCR y RSS-PCR.Durante dicha epidemia, fueron colectadas veinte muestras de suero del primer día del brote en pacien-tes febriles, las que fueron procesadas mediante trascripción reversa-reacción en cadena de la polimerasa (RT-PCR) por electroforesis en gel de agarosa 1,5% para determinar el serotipo del virus dengue circulante, esta técnica se realizó en un solo paso y se usó un set de cinco primers 32 .
La identificación del genotipo circulante del virus dengue se realizó por la técnica de sitios específicos de restricción- reacción en cadena de la polimerasa (RSS-PCR), descrita por Harris et al.102 . Adicionalmente, se realizaron aislamientos en líneas celulares C6/36 del serotipo DEN-3, tipificadas por IFI y secuenciadas genéticamente para confirmar los resultados de las pruebas anteriores. El análisis del producto de RT-PCR del ARN extraído de las muestras presentó un producto amplificado de 290pb que corresponde al serotipo del virus DEN-3. El análisis de los productos de RSS-PCR por electroforesis del ARN extraído a partir de aislamientos de dengue serotipo DEN - 3 correspondieron al Patrón C, el cual está incluido en el genotipo III 32 .
Los aislamientos del serotipo DEN-3 en líneas celulares, tipificadas por IFI y el secuenciamiento genético confirmaron los resultados obtenidos. La aplicación del RT-PCR en un solo paso permitió determinar en un tiempo corto (ocho horas) al virus dengue 3 como agente causal del brote. El RSS-PCR es una buena opción de genotipificación del virus Den-3, porque no requiere de equipos sofisticados y es de bajo costo, es un aporte de INS a la detección temprana de epidemias que pueden tener una gran magnitud y orientar las medidas de control 32 .
DETERMINACIÓN DE ANTICUERPOS CONTRA DENGUE
Existen cinco pruebas serológicas usadas para el diagnóstico de infección por el virus del dengue: Inhibición de la hemaglutinacion (HI), fijación de complemento (FC), prueba de neutralización (TN), ELISA de captura de IgM, y ELISA indirecta para determinación de anticuerpos IgG. La prueba de ELISA se ha considerado la más útil para el diagnóstico del dengue, debido a su alta sensibilidad y a la facilidad de su empleo.
Inhibición de la Hemoaglutinación (IH). Esta prueba por muchos años constituyó el método estándar para el diagnostico de dengue debido a su alto grado de sensibilidad y su ejecución relativamente fácil. Este método ha tenido y tiene utilidad para la detección de anticuerpos contra dengue, siendo de gran valor para estudios seroepidemiológicos y para distinguir infecciones primarias de secundarias. En las infecciones primarias, los anticuerpos en la fase aguda se detectan al quinto o sexto día de inicio de los síntomas, generalmente cuando los títulos del anticuerpo están sobre 1:10. Los títulos de anticuerpos en la fase de convalecencia están generalmente por debajo de 1:640 en infecciones primarias. Por otra parte, en infecciones secundarias o terciarias los anticuerpos contra dengue se detectan fácilmente, y hay un aumento rápido del título durante los primeros días de la infección, generalmente a un título por encima de 1:120. Así, un título de 1:1,280 o mayor en las muestras recogidas durante la fase aguda o al principio de la fase convaleciente de la enfermedad es una indicación de una infección secundaria por el virus del dengue. Los altos niveles de anticuerpos siguen siendo constantes por dos a tres meses en algunos pacientes, periodo luego del cual el título de anticuerpos comienza a bajar. Las desventajas principales de la prueba del HI son su carencia de la especificidad, la nece-sidad de muestras pareadas, y la imposibilidad de identificar el serotipo del virus dengue infectante 103 .
Fijación de Complemento (FC). Esta prueba no se usa generalmente para el diagnóstico rutinario del dengue, por lo difícil de su ejecución y el requerimiento de personal altamente calificado y entrenado para obtener buenos resultados. La prueba se basa en el principio que el complemento será consumido durante la reacción antígeno – anticuerpo. Los anticuerpos detectados por la FC aparecen generalmente después que los anticuerpos detectados por IH y persisten por períodos cortos, teniendo un valor limitado para estudios seroepidemiológicos. Son muy específicos en las infecciones primarias, y contribuyen a la determinación de serotipo infectante, según lo demostrado por las respuestas monotípicas observadas en las infecciones primarias 103 .
Prueba de Neutralización (PN). Es la prueba serológica más sensible y más específica para la diagnóstico de la infección por el virus del dengue, y se detecta por un período largo. Debido a su alta especificidad, esta prueba de puede usar para identificar el serotipo en infecciones primarias del dengue, puesto que una respuesta relativamente monotípica se observa en el suero de los pacientes durante la fase convaleciente. En infecciones secundarias y terciarias, la determinación del serotipo de infección mediante la PN, no es siempre confiable. Las desventajas de este método son su elevado costo, el tiempo prolongado que es necesario para realizarla, y las dificultades técnicas asociadas 78 .
Debemos considerar que la producción de IgM varía considerablemente entre los pacientes. Algunos pacientes tendrán IgM perceptible entre el segundo al cuarto día después del principio de los síntomas, mientras que otros no desarrollan IgM perceptible hasta el octavo día después del inicio de la enfermedad. En el caso del Perú se ha mostrado que la prueba de ELISA puede ser positiva incluso antes de los cinco días de iniciados los síntomas, lo cual fue probado en el brote de dengue en Lima en el año 2005.
En efecto, con el fin de determinar la presencia de anticuerpos contra IgM del virus dengue según el tiempo de enfermedad en un área con primoinfección por el serotipo DEN-3, se evaluaron 135 sueros colecta-dos de otras tantas personas del brote de dengue ocurrido el 2005 debido al serotipo DEN-3 en el distrito de Comas, Lima. Las muestras fueron distribuidas en seis grupos según el número de días de enfermedad: grupo A con uno a dos días (44 sueros), grupo B con tres a cuatro (38 sueros), grupo C con cinco a seis días (23 sueros), grupo D con siete a ocho días (13 sueros), grupo E con nueve a diez días (7 sueros) y grupo F con once a más días (12 sueros).
Estas muestras fueron procesadas por la técnica de ELISA IgM de captura, usando un pool de antígenos de dengue. Habiéndose encontrado para cada grupo lo siguiente: A seis positivas (13,64%), Bd oce positivas (30,77%), C doce 12 positivas (47,83%), D trece positivas (100%), E siete positivas (100%) y F doce positivas (100%). Este estudio concluye que hay 44% de positividad en sueros de pacientes con un tiempo de enfermedad menor a los cinco días, porcentaje significativo como para considerar la necesidad de buscar anticuerpos IgM, aún en este período de la enfermedad 104 .Los títulos del anticuerpo de IgM en infecciones primarias son perceptiblemente más altos que en infecciones secundarias, aunque la detección de títulos de 1:320 en algunos casos no es infrecuente 103 . La producción de IgM es mucho más baja y transitoria en las infecciones secundarias y terciarias 105 .
Un porcentaje pequeño de pacientes con infección secundaria, cursa con anticuerpos de IgM indetectables. En este tipo de situaciones, se ha encontrado que MAC-ELISA puede ser menos sensible que la prueba de hemoaglutinación indirecta en las muestras pareadas del suero recogidas durante la fase aguda de la enfermedad 89 . Considerando que el tiempo de procesamiento de los métodos de ELISA en el diagnóstico serológico del dengue demora como mínimo cinco horas, se realizó un estudio en el INS para evaluar la concordancia de de dos métodos de ELISA-IgM para el diagnóstico serológico de dengue. Se evaluaron 148 sueros, 63 positivos a dengue y 85 negativos, analizados por la prueba de ELISA IgM de captura con pool de antígeno (cinco horas de duración) como método de referencia, las mismas muestras fueron analizadas por IgM dengue PANBIO® (kit comercial-2,5 h) y ELISA IgM de captura (2,5 h). Se demostró una buena concordancia para ambos métodos frente al método de referencia, sin embargo, el kit comercial presenta un valor inferior de concordancia (kappa: 0,92 para el PANBIO y de 1,0 para ELISA IgM de captura)106 .
La limitación de estas técnicas son las reacciones cruzadas observadas, por lo que se requiere de un pool de antígenos que incluyan los cuatro serotipos de dengue además de otros flavivirus (fiebre amarilla, virus de encefalitis japonesa, San Luis) y en algunas áreas como en la Amazonía otros virus que causan similares manifestaciones clínicas al dengue como Oropouche, Mayaro o Chikungunya 78,88,89 .
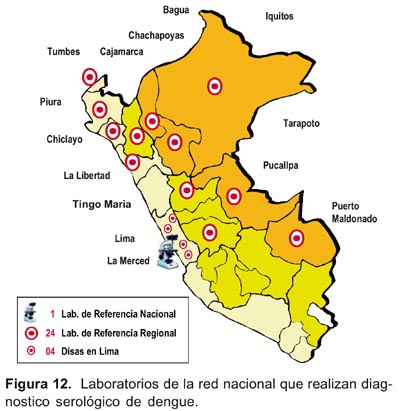
Como mencionamos antes, la determinación de anticuerpos IgM específicos contra dengue, por métodos serológicos como el IgM-ELISA, contribuyen al diagnóstico presuntivo rápido a partir de una muestra de suero, la cual debe ser obtenida a partir del quinto día de enfermedad. La presencia de anticuerpos IgM indica infección actual o una memoria reciente (dos a tres meses), por ello es importante contar con una historia clínica adecuada y completa para una inter-pretación también adecuada de los resultados de laboratorio. Particularmente es importante la determinación de la fecha de inicio de los síntomas y la fecha de obtención de la muestra sanguínea, datos que deben figurar en la ficha de envío de muestras. En caso de tener una muestra de antes del quinto día, es probable que los resultados para IgM antidengue sean negativas, pero si se trata de la enfermedad no la descarta y es necesario obtener una segunda muestra a las dos o tres semanas después para hacer la titulación de anticuerpos. Un incremento de los títulos de anticuerpos en cuatro veces el titulo inicial, también confirma el diagnóstico. En el Perú se han ido implementando estas técnicas de diagnóstico de manera progresiva a medida que el dengue se fue dispersando, actualmente tenemos disponibles las técnicas para diagnostico de IgM de captura e IgG antidengue, en los diferentes laboratorios de referencia regional, donde el dengue es endémico (Figura 12).
AGRADECIMIENTOS
A todo el personal profesional y técnico de que ha contribuido con su esfuerzo al desarrollo del diagnóstico e investigación en dengue en el Instituto Nacional de Salud y de la Red Nacional de Laboratorios en el Perú.
REFERENCIAS BIBLIOGRÁFICAS
1. World Health Organization. Scaling up the response to infectious diseases[página de internet]. Geneva: WHO; 001. [Fecha de acceso: marzo del 2004]. Disponible en: www.who.int/infectious–disease-report/2002/ introduction.html [ Links ]
2. Halstead SB. More dengue, more questions. Emerg Infect Dis 2005; 11(5): 740-41. [ Links ]
3. Watts D, Ramírez G, Cabezas C, Wooster MT. Arthropod- borne diseases in Peru. In: Ed. Travassos da Rosa AP, Vasconcelos PF, Travassos da Rosa JF. An overview of arbovirology in Brazil and neighboring countries. Belem: Instituto Evandro Chagas; 1998. p. 193-218. [ Links ]
4. Andrade C, Cáceres A, Vaquerizo A, Ibañez-Bernal S, Sulca L. Reappearance of Aedes aegypti (Diptera: Culicidae) in Lima, Peru. Mem Inst Oswaldo Cruz 2001; 96(5): 657-58. [ Links ]
5. Neyra J, Sipán F. La fiebre amarilla, pasado y presente en el Perú. Diagnóstico 1983; 12(3): 86-96. [ Links ]
6. Cabezas C, Solari L, Solano, Suárez V, León-Cueto W, Cobos M, et al. La emergencia de dengue en Lima durante una campaña de prevención mediante abatización. Bol Inst Nac Salud 2005; 11(5-6): 132. [ Links ]
7. Gubler DJ. Dengue and dengue hemorrhagic fever. Clin Microbiol Rev 1998; 11(3): 480-96. [ Links ]
8. Halstead SB. Dengue hemorrhagic fever-a public health problem and a field for research. Bull World Health Organ 1980; 58: 1-21. [ Links ]
9. Isturiz RE, Gubler DJ, Brea del Castillo J. Dengue and dengue hemorrhagic fever in Latin America and the Caribbean. Infect Dis Clin North Am 2000; 14(1): 121-40. [ Links ]
10. Rigau-Pérez JG, Clark GG, Gubler DJ, Reiter P, Sanders EJ, Vorndam AV. Dengue and dengue haemorrhagic fever. Lancet 1998; 352(9132): 971-77. [ Links ]
11. Chan VF. Virological and epidemiological studies of dengue haemorrhagic fever in the Philippines. Southeast Asian J Trop Med Public Health 1987; 18(3): 275-7. [ Links ]
12. Organización Panamericana de la Salud. Dengue y dengue hemorrágico en las Américas: guías para su prevención y control. Washington DC: OPS; 1995. p. 3-22. [ Links ]
13. Phillips I, Need J, Escamilla J, Colan E, Sanchez S, Rodríguez M, et al. First documented outbreak of dengue in the Peruvian Amazon region. Bull Pan Am Health Organ 1992; 26(3): 201-7. [ Links ]
14. Uzcategui NY, Comach G, Camacho D, Salcedo M, Cabello de Quintana M, et al. Molecular epidemiology of dengue virus type 3 in Venezuela. J Gen Virol 2003; 84(Pt 6): 1569-75. [ Links ]
15. Gubler DJ. Dengue and dengue hemorrhagic fever: Its history and resurgence as a global public health. In: Gubler DJ, Kuno G (eds). Dengue and dengue hemorrhagic fever. New York: CAB International press; 1997. p. 1-22. [ Links ]
16. Schneider J, Droll D. A time line for dengue in the Americas to december 31, 2000 and noted first occurrences [documento en internet]. Washington DC: Pan American Health Organization; 2001. [Fecha de ac-ceso: junio del 2005]. Disponible en: www.paho.org/English/HCP/HCT/VBD/dengue_finaltime.doc. [ Links ]
17. León-Cueto W, Cubillas L, Rubin M, Mostorino R, Balta R, Cabezas C, et al. Presencia y distribución de Aedes aegypti en localidades de cuatro distritos en Lima Norte (agosto-octubre 2004). Bol Inst Nac Salud (Perú) 2005; 11(5-6): 133. [ Links ]
18. Calisher CH, Karabatsos N, Dalrymple JM, Shope RE, Porterfield JS, Westaway EG, et al. Antigenic relationships between flaviviruses as determined by cross-neutralization tests with polyclonal antisera J Gen Virol 1989;70 (Pt 1): 37-43. [ Links ]
19. Lewis JA, Chang GJ, Lanciotti RS, Kinney RM, Mayer L, Trent D. Phylogenetic relationships of dengue-2 viruses. Virology 1993; 197(1): 216-24. [ Links ]
20. Rice CM. Flaviviridae: The viruses and their replication. In: Fields BN, Knipe DM, Howley PM, Chanock RM, Melnick JL, Monath TP, et al (ed.). Fields virology. 3 rd ed. Philadelphia: Lippicontt-Raven Publisher; 1996. p. 931-60. [ Links ]
21. Rico-Hesse R. Molecular evolution and distribution of dengue viruses type 1 and 2 in nature. Virology 1990;174(2): 479-93. [ Links ]
22. Monath, TP, Tsai T. Flavivirus. In: Richman DD, Whitley RJ, Hayden FG (ed.). Clinical Virology. New York: Churchill Livinstone Inc; 1997. p. 1133-85. [ Links ]
23. Chambers TJ, Hahn CS, Galler R, Rice CM. Flavivirus genome organization, expression, and replication. Ann Rev Microbiol 1990; 44:649-88. [ Links ]
24. Rey FA. Dengue virus envelope glycoprotein structure: new insight into its interactions during viral entry. Proc Natl Acad Sci USA. 2003; 100(12): 6899-901. [ Links ]
25. Mackenzie JM, Jones MK, Young PR. Immunolocalization of the dengue virus nonstructural glycoprotein NS1 suggests a role in viral RNA replication. Virology 1966; 220(1): 232-40. [ Links ]
26. Wang WK, Lin SR, Lee CM, King CC, Chang SC. Dengue type 3 virus in plasma is a population of closely related genomes: quasispecies. J Virol 2002; 76(9): 4662-65. [ Links ]
27. Twiddy SS, Holmes EC. The extent of homologous recombination in members of the genus Flavivirus. J Gen Virol 2003; 84(Pt 2): 429-40. [ Links ]
28. Holmes EC, Twiddy SS. The origin, emergence and evolutionary genetics of dengue virus. Infect Gen Evol 2003; 3(1): 19-28. [ Links ]
29. Watts DM, Porter KR, Putvatana P, Vasquez B, Calampa C, Hayes CG, et al. Failure of secondary infection with American genotype dengue 2 to cause dengue haemorrhagic fever. Lancet 1999; 354(9188): 1401-2. [ Links ]
30. Kochel TJ, Watts DM, Halstead SB, Hayes CG, Espinoza A, Felices V, et al. Effect of dengue-1 antibodies on American dengue-2 viral infection and dengue haemorrhagic fever. Lancet 2002; 360(9329): 310-12. [ Links ]
31. Mostorino R, Rosas A, Gutiérrez V, Anaya E, Cobos M, García M. Manifestaciones clínicas y distribución geográfica de los serotipos de dengue en el Perú. Año 2001. Rev Peru Med Exp Salud Pública 2002; 19(4): 171-80. [ Links ]
32. Mamani E, Cáceres O, García M, Gutiérrez V, Cabe-zas C, Harris E. Tipificación molecular del virus dengue 3 durante el brote epidémico de dengue clásico en Lima, Perú 2005. Rev Peru Med Exp Salud Pública 2005; 22(3): 161-64. [ Links ]
33. Cáceres O, Mamani E. Análisis filogenético del virus dengue 3 aislado en casos de dengue clásico en Comas. Lima, Perú 2005. Bol Inst Nac Salud (Perú) 2005; 11(5-6): 121-22. [ Links ]
34. Finlay C. El mosquito hipotéticamente considerado como agente transmisor de la fiebre amarilla. An Acad Cien Med La Habana 1881; 18: 147-69. [ Links ]
35. Organización Panamericana de la Salud. Resurgimiento del dengue en las Américas. Bol Epidemiol Of Panam Salud 1997; 18(2): 4-5 [ Links ]
36. Leiva N, Cáceres O. Variabilidad genética de Aedes aegypti en algunas áreas del Perú usando Single Stranded Conformational Polymorphism (SSCP). Rev Peru Med Exp Salud Publica 2004; 21(3): 157-66. [ Links ]
37. Balta R. Guía práctica para la identificación de Aedes aegypti. Lima: Instituto Nacional de Salud; 1997. Serie de Guías Entomológicas N° 2. [ Links ]
38. Fernández W, Iannacone J, Rodríguez E, Salazar N, Valderrama R, Morales AM. Distribución espacial, efecto estacional y tipo de recipiente más común en los índices entomológicos larvarios de Aedes aegypti en Yurimaguas, Perú 2000-2004. Rev Peru Med Exp Salud Publica 2005; 22(3): 191-99. [ Links ]
39. Morrison AC, Gray K, Getis A, Astete H, Sihuincha M, Focks D, et al. Temporal and geographic patterns of Aedes aegypti (Diptera: Culicidae) production in Iquitos, Peru. J Med Entomol 2004; 41(6): 1123-42. [ Links ]
40. Perú, Ministerio de Salud. Conocimientos, actitudes y prácticas de la población frente al dengue: Lima y Macro Región Norte del Perú. Lima: MINSA/Proyecto Vigía; 2004. [ Links ]
41. Jamanca R, Touzett A, Campos L, Jave H, Carrion M, Sanchez S. Estudio CAP de dengue en los distritos de Cercado de Lima, La Victoria y San Luis. Lima, Perú junio 2004. Rev Peru Med Exp Salud Publica 2005; 22(1): 26-31. [ Links ]
42. Rodríguez R. Estrategias para el control del dengue y del Aedes aegypti en las Américas. Rev Cubana Med Trop 2002; 54(3): 189-201. [ Links ]
43. Chávez J, Córdova O, Vargas F. Niveles de susceptibilidad a temefos en el vector transmisor del dengue en Trujillo, Perú. An Fac Med 2005; 66(1): 53-56. [ Links ]
44. Chávez J, Vargas F. Niveles de resistencia a dos insecticidas en poblaciones de Aedes aegypti (Diptera: Culicidae) en el Perú. Rev Colomb Entomol 2005; 31(1): 75-78. [ Links ]
45. Balta R, Mosqueda R. Evaluación de la susceptibilidad a insecticidas del mosquito Aedes aegypti adulto y sus larvas en San Juan de Lurigancho- DISA Lima Norte. Bol Inst Nac Salud (Peru) 2005; 11(5-6): 115. [ Links ]
46. World Health Organization. Instructions for determining the susceptibility or resistance of adult mosquitoes to organochlorine, organophosphorous and carbamate insecticides. Geneva: WHO; 1981. [ Links ]
47. Brogdon WG, McAllister JC. Simplification of adult mosquito bioassays through use of time-mortality determinations in glass bottles. J Am Mosq Control Assoc 1998; 14(2): 159-64. [ Links ]
48. Brogdon WG, McAllister JC. Insecticide resistance and vector control. Emerg Infect Dis 1998; 4(4): 605-13. [ Links ]
49. Lei HY, Yeh TM, Liu HS, Chen SH, Liu CC. Immunopathogenesis of dengue virus infection. J Biomed Sci 2001; 8(5): 377-88. [ Links ]
50. Bielefeldt-Ohmann H. Pathogenesis of dengue virus diseases: missing pieces in the jigsaw. Trends Microbiol 1997; 5(10): 409-13. [ Links ]
51. Rosen L. The emperors new clothes revisited, or reflections on the pathogenesis of dengue hemorrhagic fever. Am J Trop Med Hyg 1977; 26(3): 337-43. [ Links ]
52. Lanciotti RS, Lewis JG, Gluber DJ, Trent DW. Molecular evolution and epidemiology of dengue-3 viruses. J Gen Virol 1994; 75(Pt 1): 65-75. [ Links ]
53. Halstead SB. Pathogenesis of dengue: challenges to molecular biology. Science 1988; 239(4839): 476-81. [ Links ]
54. Halstead SB, Nimmannitya S, Cohen SN. Observations related to pathogenesis of dengue hemorrhagic fever. IV. Relation of disease severity to antibody response and virus recovered. Yale J Biol Med 1970; 42(5): 311-28. [ Links ]
55. Wichmann O, Hongaieiwon S, Bowonwatanuwong C, Chotivanich K, Sukthana Y, Pukrittayankamee S.Risk factors and clinical features associated with severe dengue infection in adults and children during the 2001 epidemic in Chonburi, Thailand. Trop Med Int Health 2004; 9(9): 1022-29. [ Links ]
56. Bravo JR, Guzman MG, Kouri GP. Why dengue haemorrhagic fever in Cuba? 1. Individual risk factors for dengue haemorrhagic fever/dengue shock syndrome (DHF/ DSS). Trans R Soc Trop Med Hyg 1987; 81(5): 816-20. [ Links ]
57. Tanphaichitr VS, Chonlasin R, Suwantol L, Pung-Amritt P, Tachavanich K, Yogsan S, et al. Effect of red blood cell glucose-6-phosphate dehydrogenase deficiency on patients with dengue hemorrhagic fever. J Med Assoc Thai 2002; 85(Suppl 2): S522-29. [ Links ]
58. Halstead SB. Immune enhancement of viral infection. Prog Allergy 1982; 31: 301-64. [ Links ]
59. Morens DM, Halstead SB. Measurement of antibody-dependent infection enhancement of four dengue virus serotypes by monoclonal and polyclonal antibodies. J Gen Virol 1990; 71(Pt 12): 2909-14. [ Links ]
60. Kurane I, Ennis FA. Immunopathogenesis dengue virus infection. In: Gubler DJ, Kuno G (eds.). Dengue and den-gue hemorrhagic fever. New York: CAB International press; 1997. [ Links ]
61. Homchampa P, Sarasombath S, Suvatte V, Vongskul M. Natural Killer cells in dengue hemorrhagic fever/dengue shock syndrome. Asian Pac J Allergy Immunol 1988; 6(2): 95-102. [ Links ]
62. Kurane I, Hennlewaite D, Brandt WE, Ennis FA. Lysis of dengue virus-infected cells by natural cell-mediated cytotoxicity and antibody-dependent cell-mediated cytotoxicity. J Virol 1984; 52(1): 223-30. [ Links ]
63. Berrios V, Kurane I, Ennis FA. Immunomodulatory effects of IL-7 on dengue virus-specific cytotoxic CD4+ T cell clones. Immun Invest 1996; 25(3): 231-40. [ Links ]
64. Zivny J, DeFronzo M, Jarry W, Jameson J, Cruz J, Ennis FA, et al. Partial agonist effect influences the CTL response to a heterologous dengue virus serotype. J Immunol 1999; 163(5): 2754-60. [ Links ]
65. Hober D, Poli L, Roblin B, Gestas P,Chungue E, Granic G, et al. Serum levels of tumor necrosis factor-alpha (TNF-alpha), interleukin 6 (IL-6), and Interleukin 1 beta (IL-1beta) in dengue infected patients. Am J Trop Med Hyg. 1993; 48(3): 324-31. [ Links ]
66. Kurane I, Innis BL, Nimmannitya S, Nisalak A, Meager A, Janus J, et al. Activation of T-lymphocytes in dengue virus infection. High levels of soluble interleukin 2 receptor, soluble CD4, soluble CD8, interleukin 2, and interferon gamma in sera of children with dengue. J Clin Invest. 1991; 88(5): 1473-80. [ Links ]
67. Malasit P. Complement and dengue haemorrhagic fever/ shock syndrome. Southeast Asian J Trop Med Public Health 1987; 18(3): 316-20. [ Links ]
68. Shaio MF, Chang FY, Hou SC. Complement pathway activity in serum from patients with classical dengue fever. Trans R Soc Trop Med Hyg 1992; 86(6): 672-75. [ Links ]
69. Rothman AL, Ennis FA. Immunopathogenesis of den-gue hemorrhagic fever. Virology 1999; 257(1): 1-6. [ Links ]
70. Markoff JL, Innis LB, Houghten R , Henchal SL.Development of cross-reactive antibodies to plasminogen during the immune response to dengue virus infection. J Infect Dis 1991; 164(2): 294-301. [ Links ]
71. Li CF, Lei HY, Shiau AL, Liu CC, Liu HS, Yeh TM, et al. Antibodies from dengue patient sera crossreact with endothelial cells and induce damage. J Med Virol 2003; 69(1): 82-90. [ Links ]
72. Lin CF, Lei HY, Shiau AL, Liu HS, Yeh TM, Chen SH, et al. Endothelial cell apoptosis induced by antibodies against dengue virus nonstructural protein 1 via production of nitric oxide. J Immunol 169(2): 657-64. [ Links ]
73. Leitmeyer KC, Vaughn DW, Watts DM, Salas R, Villalobos I, de Chacon, et al. Dengue virus structural differences that correlate with pathogenesis. J Immunol 1999; 73(6): 4738-47. [ Links ]
74. Falconar AK. The dengue virus nonstructural-1 protein (NS1) generates antibodies to common epitopes on human blood clotting, integrin/adhesin proteins and binds to human endothelial cells: potential implications in hemorrhagic fever pathogenesis. Arch Virol 1997; 142(5): 897-916. [ Links ]
75. Wang S, He R, Patarapotikul J, Innis BL, Anderson R. Antibody-enhanced binding of dengue-2 virus to human platelets. Virology 1995; 213(1): 254-57. [ Links ]
76. Cologna R, Armstrong PM, Rico-Hesse R. Selection for virulent dengue viruses ocurrs in human and mosquitoes. J Virol 2005; 79(2): 853-59. [ Links ]
77. Vaughn DW, Green S, Kalayanarooj S, Innis BL, Nimmannitya S, Suntyakorn S, et al. Dengue viremia titer, antibody response pattern, and virus serotype correlate with disease severity. J Infect Dis 2000; 181(2): 2-9. [ Links ]
78. Guzmán MG, Kouri G. Advances in dengue diagnosis. Clin Diagn Lab Immunol 1996; 3(6): 621-27. [ Links ]
79. Sabin AB. Research on dengue during World War II. Am J Trop Med Hyg 1952; 1(1): 30-50. [ Links ]
80. Rosen L, Gluber D. The use of mosquitoes to detect and propagate dengue viruses. Am J Trop Med Hyg 1974; 23(6): 1153-60. [ Links ]
81. Rosen L. The use of Toxorhynchites mosquitoes to detect and propagate dengue and other arboviruses. Am J Trop Med Hyg 1981; 30(1): 177-83. [ Links ]
82. Gluber DJ, Suharyono W, Sumarmo, Wulur H, Jahja E, Sulianti Saroso J. Virological surveillance for dengue haemorrhagic fever in Indonesia using the mosquito inoculation technique. Bull World Health Organ 1979; 57(6): 931-36. [ Links ]
83. Kuberski TT, Rosen L. A simple technique for the detection of dengue antigen in mosquitoes by immunoflorescence. Am J Trop Med Hyg 1977; 26(3): 533-37. [ Links ]
84. Glubber DJ, Kuno G, Sather GE, Velez M, Oliver A. Mosquito cell cultures and specific monoclonal antibodies in surveillance for dengue viruses. Am J Trio Med Hyg 1984; 33(1): 158-65. [ Links ]
85. Tesh RB. A method for the isolation and identification of dengue viruses, using mosquito cell cultures. Am J Trop Med Hyg 1979; 28(6): 1053-59. [ Links ]
86. Igarashi A. Isolation of a Singh´s Aedes albopictus cell clone sensitive to dengue and Chikungunya viruses. J Gen Virol 1978; 40(3): 431-44. [ Links ]
87. Gutiérrez V, Palomino M, Olivares M, Noroña G. Ais-lamiento rápido del virus dengue 3 por el método de shell vial en el brote de dengue en Lima. Rev Peru Med Exp Salud Publica 2006; 22(3): 233-35. [ Links ]
88. Shu PY, Huang JH. Current advances in dengue diagnosis. Clin Diagn Lab Immunol 2004; 11(4): 642-50. [ Links ]
89. De Paula SO, Fonseca BA. Dengue: a review of the laboratory test a clinician must know to achieve a correct diagnosis. Braz J Infect Dis 2004; 8(6): 390-98. [ Links ]
90. Henchal EA, Narupiti S, Feighny R, Padmanabhan R, Vakharia V. Detection of dengue virus RNA using nucleic acid hybridization. J Virol Methods 1987; 15(3): 187-200. [ Links ]
91. Khan AM, Wright PJ. Detection of flavivirus RNA in infected cells using photobiotin-labelled hybridization probes. J Virol Methods 1987; 15(2): 121-30. [ Links ]
92. Monath TP, Ballinger ME, Miller BR, Salaun JJ. Detection of yellow fever viral RNA by nucleic acid hybridization and viral antigen by immunocytochemistry in fixed human liver. Am J Trop Med Hyg 1989; 40(6): 633-38. [ Links ]
93. Deubel V. The contribution of molecular techniques to the diagnosis of dengue infection. In: Gubler DJ, Kuno G (eds). Dengue and dengue hemorrhagic fever. New York: CAB International press; 1997. p. 355-66. [ Links ]
94. Deubel V, Laille M, Hugnot JP, Chunque E, Guesdon JL, Drouet MT, et al. Identification of dengue sequences by genomic amplification: rapid diagnosis of dengue virus serotype in peripheral blood. J Virol Methods 1990; 30(1): 41-54. [ Links ]
95. Deubel V, Pierre V. Molecular techniques for rapid and more sensitive detection and diagnosis of flavivirus. In: Specner RC, Wrigth EP, Newsom SWB (ed). Rapid methods and automation in microbiology and immunology. Andover, UK: Intercept; 1994. p. 227-37. [ Links ]
96. De Paula SO, Pires Neto RJ, Correa JA, Assumpcao SR, Costa ML, Lima DM, et al. The use of reverse transcription-polymerase chain reaction (RT-PCR) for the rapid detection and identification of dengue virus in an endemic region: a validation study. Trans R Sco Trop Med Hyg 2002; 96(3): 266-69. [ Links ]
97. Hall WC, Crowell TP, Watts DM, Barros VL, Kruger H, Pinheiro F, et al. Demonstration of yellow fever and dengue antigens in formalin-fixed paraffin-embedded human liver by immunohistochemical analysis. Am J Trop Med Hyg 1991; 45(4): 408-17. [ Links ]
98. Zaki SR, Peter CJ. Viral hemorrhagic fevers. In: Connor DH, Chandler FW, Schwartz DA, Manz HJ, Lack EE (ed.), Diagnostic pathology of infectious diseases. Stamford: Appleton & Lange; 1997. p. 347-64. [ Links ]
99. Vorndam V, Kuno G, Rosado N. A PCR-restriction enzyme technique for determining dengue virus subgroups within serotypes. J Virol Methods 1994; 48(2- 3): 237-44. [ Links ]
100. Chow VT, Seah CL, Chan YC. Comparative analysis of NS3 sequences of temporally separated dengue 3 virus strains isolated from Southeast Asia. Intervirology 1994; 37(5): 252-58. [ Links ]
101. Deubel V, Nogueira RM, Drouet MT, Zeller H, Reynes JM, Ha DQ. Direct sequencing of genomic cDNA fragments amplified by the polymerase chain reaction for molecular epidemiology of dengue-2-viruses. Arch Virol 1993; 129(1- 4): 197-210. [ Links ]
102. Harris E, Sandoval E, Johnson M, Xet-Mull AM, Riley LW. Rapid subtyping of dengue viruses by restriction site-specific (RSS)-PCR. Virology 1999; 253(1): 86-95. [ Links ]
103. Vorndam V, Kuno G. Laboratory diagnosis of dengue virus infections. In: Gubler DJ, Kuno G (eds). Dengue and dengue hemorrhagic fever. New York: CAB International press; 1997. p. 313-34. [ Links ]
104. García M, Merino N, Mamani E, Gutiérrez V, Pare-desT, Farfán M, et al. Importancia de la determinación de anticuerpos IgM contra el virus dengue en pacientes con menos de cinco días de enfermedad. En: Libro de resúmenes del taller internacional: Prevención y control del dengue, un reto para el siglo XXI. Lima: INS/OGE; 2005. p. 39. [ Links ]
105. Chanama S, Anantapreecha S, A-nuegoonpipat A, As-gnasang A, Kurane I, Sawanpanyalert P. Analysis of specific IgM responses in secondary dengue virus infections: levels and positive rates in comparison with primary infections. J Clin Virol 2004; 31(3): 185-89. [ Links ]
106. García M, Merino N, Mamani E, Gutiérrez V, Pare-des T, Farfán M, et al. Buena concordancia de un método acortado para determinación de anticuerpos IgM antidengue. Bol Inst Nac Salud (Perú) 2005; 11(5-6): 135. [ Links ]