Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.22 n.4 Lima oct./dic 2005
ARTÍCULO DE REVISIÓN
Leptospirosis: Enfermedad Zoonótica Emergente
Manuel Céspedes Z1
1 Laboratorio de Leptospiras, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
RESUMEN
La leptospirosis es un problema de salud pública a nivel mundial, en particular en áreas tropicales y subtropicales y en países en vías de desarrollo. La magnitud del problema es atribuido a las condiciones climáticas y ambientales, pero también al contacto que se tiene con ambientes contaminados por Leptospira, esto se observa en las actividades agrícolas, ganadera, minera, recreacionales, deportivas y condiciones de salubridad en la vivienda. Es una enfermedad potencialmente mortal pero tratable; su espectro clínico va desde la enfermedad asintomático, síntomas mínimos similares a un resfrió común, hepatitis, dengue clásico o pueden ser graves como las fiebres hemorrágicas virales y meningitis. Al ser frecuente en zonas tropicales donde confluyen otras infecciones como el dengue, tienden a confundirse sus cuadros clínicos, siendo generalmente subdiagnósticada, sin embargo estudios recientes han demostrado su importancia en la salud pública. Los nuevos y menos complicados métodos de diagnóstico se han desarrollado en años recientes, permitiendo que la infección sea identificada en campo sin la necesidad de tener laboratorios tan sofisticados. La falta de disponibilidad de una vacuna que proteja contra todos los serovares de leptospiras hace que la prevención hasta ahora dependa de la implantación de medidas de saneamiento. En esta revisión se brinda información sobre aspectos relacionados a la bacteria, epidemiología, reservorios, transmisión, patogenia, clínica, diagnóstico y manejo de la leptospirosis.
Palabras clave: Leptospira; Leptospirosis; Salud Pública; Revisión (fuente DeCS BIREME).
ABSTRACT
Leptospirosis is a public health problem all over the world, particularly in tropical and subtropical areas, as well as in developing countries. The high prevalence of this disease is attributed to weather and environmental conditions, but it also occurs because of contact with contaminated environments, particularly in relation to agricultural, farming, mining, recreational, and sport activities, as well as unhealthy conditions in households. Leptospirosis is a potentially lethal but treatable disease; its clinical spectrum goes from an asymptomatic disease or a condition with minimal symptoms resembling common cold, viral hepatitis, or classic dengue fever, to a severe disease with the same presentation as that of hemorrhagic viral fevers and meningitis. Since leptospirosis is frequent in tropical areas where other infectious diseases, such as dengue fever, its clinical manifestations tend to overlap with those of other conditions, and it is frequently misdiagnosed; however, recent studies have shown that leptospirosis is an important public health problem. New and easy-to-use diagnostic methods have been developed in recent years, so that the infection is now identified in the field without the need for sophisticated laboratory equipment. Since no vaccine is available, prevention depends upon appropriate sanitation measures. In this review we present information with respect to the causative microorganism, as well as considering epidemiology, reservoirs, transmission, pathophysiology, clinical features, diagnosis, and management of leptospirosis.
Key words: Leptospira; Leptospirosis; Public Health; Review (source: DeCS BIREME). Rev Perú Med Exp Salud Publica
INTRODUCCIÓN
La leptospirosis es una enfermedad zoonótica de importancia global y distribución mundial, pero es más frecuente en las áreas tropicales dónde las condiciones para su transmisión son particularmente favorables1. Los últimos brotes han permitido que aumente el interés como problema de salud pública, debido a que estos han producido formas letales y presentaciones clínicas poco frecuentes, como los casos de hemorragia pulmonar grave2-4.
Es reconocida ahora en muchas regiones del mundo como una causa frecuente de síndromes febriles indiferenciados, confundiéndola muchas veces con enfermedades endémicas de cada región5; se creía que la leptospirosis se circunscribía sólo en áreas tropicales, pero actualmente se reportan casos en ciudades con más frecuencia6.
Se ha considerado siempre a la leptospirosis como una enfermedad asociada con la ocupación de las personas, sobre todo cuando la persona está en contacto directo o indirecto con orina de animales infectados5. Sin embargo, el fenómeno de globalización, los cambios climáticos, y las migraciones de animales y personas hacia nuevas zonas, han propiciado que la leptospirosis sea considerada en la actualidad como un problema latente para cualquier población7.
MICROBIOLOGÍA Y TAXONOMÍA
TAXONOMÍA
El género Leptospira (Gr. Lepto = fino y espira = espiral) pertenece a la familia Leptospiraceae y al orden Spirochaetales, las cuales se diversificaron tempranamente en la evolución de las bacterias.
Tradicionalmente han sido clasificadas tomando como base a sus determinantes antigénicos en dos especies, la mayoría de leptospiras patógenas se agruparon dentro del «complejo interrogans» (después L. interrogans sensu lato), las otras se pusieron en el «complejo biflexa» (después L. biflexa sensu lato) que agrupa a las saprofitas principalmente.
La unidad taxonómica en Leptospira es el serovar, ambos complejos (L. interrogans y L. biflexa) han sido dividido en numerosos serovares por la prueba de aglutinación cruzada (CAAT), muchos serovares dentro de un serogrupo son representados por una sola cepa de referencia5,7. Los serovares homólogos antigénicamente han sido agrupados en serogrupos. Existe mas de 60 serovares de L. biflexa sensu lato y más de 240 serovares agrupados en 24 serogrupos dentro de L. interrogans.
Actualmente, la clasificación del género Leptospira está basado en la homología del ADN y está dividido en 17 especies; definido en 70% de homología y 5% de divergencia en el ADN (Tabla 1)5,7,8; el avance en la biología molecular ha permitido también secuenciar su genoma que consiste de dos cromosomas circulares9,10.
No obstante, esta clasificación coexiste con la clasificación serológica antigua; debido a problema en la clasificación los nuevos aislamientos de Leptospira deben caracterizarse por pruebas moleculares y serológicas5,7,11.
MICROBIOLOGÍA
Esta bacteria fue aislada en 1915 por Inada et al. en el Japón y la identificaron como el agente causal del síndrome de Weil (Inada et al., 1916). La Leptospira es de forma helicoidal, aeróbico obligatorio, presenta en uno o ambos extremos una curvatura en forma de gancho, tiene una gran movilidad que le viene dada por un axostilo, el cual está formado por dos filamentos axiales insertados en un disco o protuberancia al final del cuerpo citoplasmático y cuyo extremo libre está unido a la región media de la bacteria estas características se observan en microscopio electrónico. Tiene un diámetro aproximado de ~0,25µm y una longitud variable entre 6-25µm y puede pasar por membranas de filtración de poro 0,22µm, ésta característica hace que la Leptospira sea observable únicamente en un microscopio de campo oscuro o de contraste de fase, y además que no se pueda colorear con anilinas5,10.
La Leptospira se cultiva en medios artificiales, las cuales podrían contener 10% de suero de conejo ó 1% de suero albúmina bovina y tween 80, a un pH 6,8 - 7,4; el crecimiento óptimo es entre 28 y 30 oC. Para evitar la contaminación del medio se puede adicionar antibióticos o intercalantes como el 5-fluorouracil y sulfato de neomicina para hacerlo selectivo. Los medios comúnmente usados son el Ellinghausen- McCullough-Johnson-Harris medium (EMJH) el cual contiene 1% BSA y Tween 80; Korthoffs y Fletchers5.
EPIDEMIOLOGÍA
La leptospirosis es una zoonosis de distribución mundial, con mayor incidencia en las zonas tropicales que en las regiones con climas cálidos como la costa; actualmente su transmisión ocurre con mayor frecuencia en zonas donde hay expansión poblacional, especialmente en países en vías de desarrollo.
Se desconoce su real incidencia, debido a la falta de conocimiento de la enfermedad, a la gran proporción de infección subclínica que puede pasar desapercibida, y que los métodos diagnósticos no están disponibles en las áreas endémicas12,13. En estudios desarrollados en la selva del Perú (regiones de Loreto y Madre de Dios), se halló una proporción muy alta (20-30%) con evidencia serológica de leptospirosis aguda en pacientes con síndrome febril indiferenciado14,15.
RESERVORIOS
Los reservorios de las Leptospiras son animales que mantienen una relación de comensales con las bacterias y no sufren o sufren muy levemente la enfermedad; transfieren las Leptospiras a sus crías en útero o el periodo neonatal, favoreciendo la cadena de transmisión. Los portadores son aquellos animales que mantienen las Leptospiras viables y con capacidad de multiplicarse en sus riñones, excretándolas intermitentemente por la orina; muchos de estos pueden tener serología negativa 5.
Los reservorios más importantes son mamíferos pequeños que pueden transmitir la infección a los animales domésticos y a los humanos. La transmisión depende de muchos factores como el clima, la densidad y el grado de contacto entre el reservorio y los hospederos accidentales. Los roedores pueden ser reservorios de diferentes serovares, pero las ratas generalmente son reservorios de serovares como lcterohaemorrhagiae y Ballum, y los ratones son reservorios para el serogrupo Ballum5,11.
Recientes estudios muestran que algunos mamíferos y marsupiales presentan serovares inusuales como el caso de serovar Bim en Mus musculus de Barbados16. Sin embargo, se conoce que una sola especie podría ser reservorio de serovares diferentes en áreas geográficas diferentes, como por ejemplo el pequeño mongoose (Herpestes auropunctatus), el cual mantiene el serovar Sejroe e Icterohaemorrhagiae en Hawaii7, serovar Icterohaemorrhagiae y Djatzi en Puerto Rico17, serovar Icterohaemorrhagiae en Jules en Jamaica18, serovar Icterohaemorrhagiae y Brasiliensis en Granada19, y serovar Canicola en Trinidad20.
Los animales domésticos también son reservorios accidentales; los cerdos albergan a los serovares Pomona, Tarassovi y Bratislava; las ovejas, Hardjo y Pomona; los perros, Canicola21; y el ganado vacuno puede albergar serovares como Grippotyphosa, Pomona y Hardjo (Tabla 2).
El serovar Hardjo causa infección en el ganado vacuno en todo el mundo, y produce brotes de mastitis y aborto; también se puede encontrar en fetos abortados y en terneros prematuros22. Además, se ha aislado en fetos sanos, descarga vaginal y en el tracto genital, urinario y en semen de toros23.
Las distintas variaciones en los reservorios accidentales y sus serovares ocurren a lo largo del mundo. Un conocimiento de los serovares prevalentes y sus reservorios accidentales es esencial para entender la epidemiología de la enfermedad en cualquier región5.
Se han aislado serovares patógenos de fuentes de agua en las regiones tropicales y en los Estados Unidos se han aislado los serovares Icterohaemorrhagiae, Dakota, Ballum, Pomona, y Grippotyphosa24. La supervivencia de Leptospiras patógenas en el ambiente depende de varios factores, como el pH, temperatura, y la presencia de compuestos inhibitorios.
Las Leptospiras en el agua, a temperatura ambiente, permanecen viables durante varios meses con un pH de 7,2 a 8,0 bajo las condiciones del laboratorio25; la supervivencia en agua de río es más corta pero es prolongada a bajas temperaturas24. En aguas servidas domésticas disminuye el tiempo de supervivencia a pocas horas; en tierra ácida (pH 6,2) sobreviven por siete semanas, y en lodo de tierra por lo menos tres semanas7. También se piensa que los rezagos de detergentes han reducido la sobrevivencia de la Leptospira en los desagües, pues se inhiben a concentraciones bajas de detergente5. Cuando la tierra se contamina con la orina de ratas infectadas la Leptospira sobrevive durante aproximadamente dos semanas25.
TRANSMISIÓN Y GRUPOS DE RIESGO
La infección humana es el resultado de la exposición a la orina infectada de mamíferos portadores, ya sea directamente o vía la contaminación de tierra o agua. Las puertas usuales de entrada de la Leptospira son las abrasiones, cortes en la piel y por vía conjuntivar; la infección también puede darse después de la inmersión prolongada en el agua. La transmisión en el agua se ha documentado en muchos brotes de leptospirosis26-28. Se ha reportado también que por la inhalación de agua o por aerosoles y el ingreso hacia las vías respiratorias se puede producir la infección. Raramente la infección puede darse por mordeduras de animales29. La transmisión directa entre los humanos ocasionalmente se ha demostrado porque el pH bajo de la orina limita la sobrevivencia de la Leptospira después de la excreción. También se ha reportado la transmisión por relaciones sexuales11.
Las infecciones humanas pueden adquirirse a través actividades profesionales, recreativas, o exposiciones involuntarias. La ocupación es un factor de riesgo importante para los humanos30. El contacto directo con las orina de los animales infectados puede causar infecciones en granjeros, veterinarios, matarifes31, trabajadores que realizan el control de roedores32, y otras ocupaciones en el que se tiene acercamiento con animales33. El contacto indirecto es importante para los obreros de desagüe, mineros, militares34, los limpiadores de tanque sépticos, criadores de peces35, guardabosques, obreros de canales12, agricultores que se dedican al cultivo de arroz, plátanos, caña de azúcar y otros5.
Los mineros fueron el primer grupo de riesgo en ser conocido5,11. La ocurrencia de la enfermedad de Weil se detectó primero en obreros de desagües en los años treinta, el serovar comprometido fue el Icterohaemorrhagiae, que se aisló mediante inoculación con muestras de los pacientes a cobayos y también de las ratas atrapadas en los desagües5. El reconocimiento de esta actividad como un riesgo, llevó a la adopción, en el programa de control de roedores, del uso de ropa de protección lo que repercutió en la reducción de casos.
Los pescadores son otro grupo de riesgo para contraer leptospirosis. Recientemente se ha demostrado casos en pescadores contagiados, presumiblemente, por el contacto con orina de ratas35, en este caso la infección fue con serovares del serogrupo Icterohaemorrhagiae, el cual se asocia por su alta mortalidad36.
Los ganaderos son un grupo ocupacional de riesgo importante a lo largo del mundo, principalmente asociado a la enfermedad del ganado(mastitis)31, la presencia del serovar Hardjo y el ordeñamiento23.
En los últimos años se han incrementado los casos asociados con actividades recreacionales, particularmente en deportes de agua como natación37, canotaje38, balseo en agua dulce39 y pesca en agua dulce; también se ha producido un gran número de casos cuando la exposición ocurre durante eventos deportivos en áreas tropicales40,41.
Se han reportado varios brotes de leptospirosis asociadas a fuentes de agua26-28, aumentando el riesgo en casos de inundación42,43.
Los casos de leptospirosis en las regiones tropicales son debido a exposiciones accidentales adquiridas durante actividades de la vida diaria44. Muchas infecciones se han atribuido al caminar descalzo en suelos húmedos o cultivando un huerto o jardín con las manos desnudas45.
Los perros son una fuente importante para la infección humana en muchos países tropicales y puede ser una fuente importante para el inicio de brotes46 (Figura 1). Nosotros hemos encontrado dos brotes asociados a cerdos y perros en la selva y costa del Perú (Figura 2).
Las variaciones en los ecosistemas, ya sea por el clima, las migraciones, invasión de selvas vírgenes o las actividades socioculturales de la población, cambian las interacciones entre los seres vivos y modifican las condiciones medioambientales, lo cual afecta notablemente a las poblaciones de reservorios y modifican la transmisión de la leptospirosis.
En el estudio de la ecología de la transmisión de la leptospirosis en la amazonía peruana se ha obtenido una gran variedad de aislamientos provenientes de mamíferos silvestres y animales domésticos, estos aislamientos incluyeron serovares ya conocidos como Icterohaemorrhagiae y cuatro nuevos serovares, todos ellos obtenidos a través de la electroforesis de campo pulsado. Estos aislamientos se obtuvieron de roedores (Rattus norvegicus, Rattus, Proechimys brevicauda), y de zarigüeyas (Didelphis marsupialis, Philander andersoni y Philander opossum).
Para entender mejor la transmisión de la leptospirosis, Faine et al. propone tres modelos epidemiológicos5; el primero ocurre en climas templados donde son pocos los serovares que están involucrados en la infección humana y generalmente es por contacto directo con ganado y cerdos. El control se realiza por inmunización de animales o humanos.
El segundo ocurre en áreas tropicales donde hay muchos serovares que infectan a humanos y animales, además hay un gran número de reservorios como los roedores, animales de granja y perros. La exposición humana no está limitada a la ocupación sino a la contaminación medioambiental, en especial durante la época de lluvias. El control se realiza en roedores, mejorando el saneamiento en estas áreas y higiene profesional para prevenir los casos de leptospirosis humana. Posiblemente son áreas donde ocurran los
grandes brotes después de diluvios, huracanes u otros desastres42.
El tercer modelo se da cuando la infección en los roedores es llevada al ambiente urbano. Es un caso importante cuando la infraestructura urbana se rompe debido a la guerra o por catástrofes naturales. Este tipo de infección es rara en países desarrollados, pero se observó un brote de leptospirosis urbano en Baltimore47 luego de una inundación; también ocurren en barrios pobres de los países en desarrollo48.
PATOGENIA
El periodo de incubación es de 7 a 26 días, con un promedio de 12 días. El microorganismo penetra a través de la piel reblandecida por el agua, por excoriaciones o por mucosas y alcanza rápidamente el torrente sanguíneo, diseminándose a todos los órganos, incluyendo líquido cefalorraquídeo (LCR) y humor acuoso; su movimiento en tirabuzón y la producción de hialuranidasa, pueden explicar la penetración a estos sitios49,50.
En la primera semana, la Leptospira se puede encontrar en sangre y LCR, sin ocasionar síntomas neurológicos. Los órganos más frecuentemente afectados incluyen al hígado, riñón, cerebro y músculos. Dentro de las complicaciones está la disfunción hepática que se manifiesta por la disminución de la excreción de la bilirrubina como alteración más frecuente, disminución de los niveles de albúmina sérica, incremento de los niveles de inmunoglobulinas y disminución en la producción de los factores dependientes de la vitamina K5,10,51.
La insuficiencia renal aguda por necrosis tubular aguda, es causada por efecto directo de la Leptospira sobre el tejido renal, la hipoxia o el depósito de complejos antígeno-anticuerpo-complemento en los glomérulos. La afección vascular, se debe a vasculitis grave con daño endotelial, produciendo lesión en los capilares. En los músculos, las alteraciones varían desde inclusiones vacuolares en las miofibrillas e infiltrado discreto de polimorfonucleares en el tejido muscular, acompañado de elevación importante de la enzima creatinfosfoquinasa (CPK)5,51.
Después de la primera semana, aparecen los anticuerpos en sangre y coinciden con el desarrollo de meningitis, no encontrándose Leptospira en el LCR, lo cual sugiere daño inmunológico. La Leptospira puede persistir por semanas en el humor acuoso y ocasionalmente causa uveítis crónica o recurrente. Los elevados niveles de factor de necrosis tumoral alfa (FNTá) encontrados en pacientes con leptospirosis mortal, contrasta con el buen pronóstico de los niveles normales de esta citoquina, sugiriendo el papel del FNTá en el pronóstico de la enfermedad5.
MANIFESTACIONES CLÍNICAS
La expresión clínica de la infección por Leptospira varía ampliamente en el ser humano, con oscilaciones que van desde procesos totalmente asintomático, que son los más frecuentes, pasando por las formas de evolución generalmente benignas, hasta el desarrollo de cuadros graves ictero-hemorrágicos con colapso vascular y serio compromiso de funcionamiento hepático-renal, que pude ser de evolución fatal (enfermedad de Weil). De las formas clínicas sintomáticas de la enfermedad, el 80-90% evoluciona en una forma anictérica benigna y 10-20% como leptospirosis grave con ictericia e insuficiencia renal (figura 3)5,7,17.
LEPTOSPIROSIS ASINTOMÁTICA
La existencia de formas subclínicas se hace evidente cuando se realizan encuestas seroepidemiológicas, donde el 16-40% de personas expuestas a la fuente de infección presentan títulos serológicos de anticuerpos específicos detectables; sin embargo, no recuerdan haber tenido manifestaciones clínicas sugestivas de la enfermedad5,7.
LEPTOSPIROSIS SINTOMÁTICA
La leptospirosis es típicamente una enfermedad bifásica, presentándose una fase inicial o de leptospiremia con una duración de cuatro a siete días, caracterizada por la presencia de las Leptospira en sangre y una segunda fase inmune o leptospiruria con una duración de 8 a 30 días donde se puede detectar anticuerpos específicos en circulación. Ambas fases son comunes a las dos formas clínicas de presentación: anictérica e ictérica.
Leptospirosis anictérica. Comienza de forma abrupta, con cefalea intensa y persistente, mialgias en la región lumbar y gemelar, inyección conjuntival, escalofríos y dolor abdominal que puede llegar a confundirse con abdomen agudo quirúrgico. Se presentan nauseas, vómitos y un acentuado malestar general con postración. La fiebre es de carácter remitente alcanzando 40 ºC o más. Con cierta frecuencia se observa un exantema macular de pocas horas de duración, en el tronco. Se puede presentar confusión mental, tos, dolor toráxico o hemoptisis y exantema petequial en el paladar. La evolución de estos casos es usualmente satisfactoria en un periodo de cuatro a diez días.
Son muy pocos los pacientes que pasan a la segunda fase (fase inmune), donde sólo hay fiebre ligera, la cefalea es intensa, señal de meningitis sin signos neurológicos, y con dolor retro-ocular. Hay mialgias acentuadas en los músculos de las pantorrillas, en los paravertebrales y el cuello, por lo cual existe la posibilidad de confusión con una meningitis viral. Raramente se desarrollan signos neurológicos focales o de encefalitis. A partir de la segunda semana puede desarrollarse uveítis en uno o ambos ojos, que puede seguir un curso crónico o recurrente. Se han descrito compromisos pulmonares graves como hemoptisis franca, hipoxemia e insuficiencia respiratoria aguda2,3,48,52-54.
Leptospirosis ictérica (Síndrome de Weil). Es la forma más grave de la enfermedad, se caracteriza por las alteraciones de la función hepática y renal, desarrollo de hemorragias, colapso vascular, alteraciones graves de la conciencia y una mortalidad aproximadamente de 5 - 40%10,48,52,55.
El inicio de la enfermedad es similar a la forma anictérica, pero al cabo de tres a seis días de evolución, los síntomas alcanzan su máxima intensidad. La ictericia es una manifestación constante y está asociada con daño hepatocelular, con predominancia de la bilirrubina directa.
Con la instalación de la insuficiencia renal, puede desarrollarse delirio y convulsiones, junto con la aparición de manifestaciones hemorrágicas diversas y acentuación de la ictericia. Puede aparecer esplenomegalia acompañada de una hepatomegalia dolorosa. Algunos de los pacientes pueden desarrollar frotes pericárdicos sin evidencia de derrames, y en los casos graves, puede desarrollarse insuficiencia cardiaca congestiva y shock cardiogénico55.
En los niños, se han descrito manifestaciones no encontradas usualmente en los adultos tales como colecistitis acalculosa, pancreatitis56, dolor abdominal, hipertensión arterial, exantema maculopapular con descamación periférica asociada a gangrena y paro respiratorio. Las manifestaciones radiológicas pulmonares consisten en exudados alveolares en ambos campos pulmonares2,48,52. Son comunes las alteraciones electroradiográficas bajo la forma de bloqueos A-V primer grado, así como cambios sugestivos de pericarditis. En algunos pacientes es posible detectar anormalidades electrocardiográficas tales como aleteo auricular, fibrilación auricular, taquicardia ventricular y extrasístoles.
PRUEBAS GENERALES DE LABORATORIO
Debido a que las manifestaciones clínicas de la leptospirosis varían en tipo y gravedad tanto en los hombres como en animales, es difícil su diagnóstico clínico, haciéndose necesaria la confirmación de los casos mediante pruebas de laboratorio; existen pruebas que sin ser específicas para la enfermedad pueden orientar al clínico hacia el diagnóstico de leptospirosis.
Es frecuente hallar la velocidad de sedimentación globular elevada, leucocitosis o en rango normal (a diferencia del dengue en que tienden a la leucopenia)43,una elevación ligera en transaminasas, fosfatasa
alcalina y bilirrubina en ausencia de ictericia (fase anicterica).
En el análisis de la orina puede encontrarse una proteinuria, piuria y hematuria5. Las proteínas del LCR pueden ser normales o ligeramente elevadas, y la glucosa del LCR es generalmente normal. El examen inicial del LCR puede revelar el predominio de polimorfos o de linfocitos que es seguido por preponderancia de los linfocitos5.
En la leptospirosis grave, hay leucocitosis periférica con desviación a la izquierda, puede presentarse cuadros con trombocitopenia marcada57; la función renal se deteriora evidenciando niveles elevados de creatinina en plasma. En la leptospirosis ictérica hay un incremento marcado de bilirrubina total y directa, transaminasas y fosfatasa alcalina57, además de un incremento de la creatinfosfoquinasa y la amilasa sérica48,57.
La clínica con los hallazgos de laboratorio mencionados pueden sugerir un caso probable de leptospirosis pero no es específico, por lo que es necesario la confirmación del caso por pruebas microbiológicas, serológicas o moleculares específicas.
DEMOSTRACIÓN MICROSCÓPICA
La Leptospira se puede observar en muestras clínicas como sangre, orina, LCR y fluidos dializados, en microscopía de campo oscuro e inmunofluorecencia directa; pero su sensibilidad es muy baja, debido a que sólo se la puede detectar cuando la concentración de leptospiras está entre 100-200/mL58. La microscopía en muestras de sangre es válida sólo en los primeros días (fase leptospirémica), además se agrega la dificultad para la confusión con fibras o proteínas que puede mostrar movimiento browniano58.
Se ha desarrollado otros métodos para mejorar la pruebas microscópicas como la inmunoperoxidasa, que se ha aplicado en muestras de agua59, suelo59, sangre60 y orina60,61. Una variedad de pruebas histopatológicas se han aplicado para la detección de Leptospira en tejidos, destacando la coloración con plata, la coloración de Warthin-Starry y los métodos immunohistoquímicos2,62.
CULTIVO
La prueba de diagnóstico definitiva es la demostración de Leptospira en diferentes muestras clínicas por cultivo, pero lamentablemente es poco sensible y tardía. La Leptospira se pueden aislar de sangre en los primeros 7 a 10 días de enfermedad, para ello se debe agregar dos gotas de sangre en 10 mL de medio semisólido que contiene 5-fluorouracil58.
Otras muestras de la cuales se puede aislar, son el LCR durante los primeros diez días de enfermedad y de la orina a partir de la segunda a cuarta semana de enfermedad5. La supervivencia de la Leptospira en la orina humana es limitada, por tanto esta se debe procesar inmediatamente61.
Cuando no se cuenta inmediatamente con los medios de cultivo, las muestras de sangre deben tomarse con tubos que contengan oxalato, heparina o EDTA; no se debe usar citrato de sodio como anticoagulante ya que esta tiene propiedades inhibitorias.
Todos los cultivos deben ser incubados entre 28 y 30 ºC y por varias semanas puesto que esta bacteria crece lentamente y los cultivos se pueden reportar como negativos solamente después de un mínimo de diez semanas o a veces después de tres meses de observación5.
IDENTIFICACIÓN DE LEPTOSPIRAS
La Leptospira aislada es identificada por métodos serológicos o por técnicas moleculares. Tradicionalmente se usó la absorción cruzada, posteriormente se usó anticuerpos monoclonales63, lo que ha permitido identificar mediante la prueba de aglutinación microscópica rápidamente los aislamientos; en la actualidad los métodos moleculares son los más usados64,65.
DETECCIÓN DE ANTÍGENO
Se han desarrollado muchos métodos para detectar el antígeno en muestras clínicas y cuya especificidad es mayor que la microscopía en campo oscuro. El radioinmunoensayo (RIA) puede detectar 104 a 105 leptospiras/mL y un método de ELISA 105 leptospiras/ mL. En la actualidad se están usando otros métodos como la quimioluminicencia en sangre y orina66. Recientemente se ha desarrollado métodos para la captura de antígeno con partículas inmunomagnéticas que son más sensibles que las anteriores67.
SEROLOGÍA
La serología aplicada en casos de leptospirosis nos da aproximación para el diagnóstico; por mucho tiempo se ha usado la prueba de aglutinación microscópica (MAT) la cual tiene alta sensibilidad y especificidad y es la prueba estándar de referencia para la diagnóstico serológico de leptospirosis.
El MAT tiene ciertas dificultades, por ello se han trabajado pruebas género-específicas que tienen la ventaja de proporcionar resultados rápidos y de no requerir el cultivo o MAT, destacándose las que detectan el IgM68.
Los anticuerpos IgM contra Leptospira llegan a ser perceptibles durante la primera semana de enfermedad. La mayoría de los análisis usan antígenos crudos de la célula entera, pero en la actualidad se han desarrollado antígenos recombinantes de la lipoproteína de la superficie de la célula. Varios métodos están comercialmente disponibles; la principal ventaja de tales análisis es que llegan a ser a menudo positivos antes del MAT69,70.
PRUEBA DE AGLUTINACIÓN MICROSCÓPICA (MAT)
Es el método de referencia para el diagnóstico serológico de la leptospirosis debido a su alta sensibilidad y especificidad, además puede identificar el serovar o serogrupo de Leptospira comprometida en la infección.
La MAT detecta los anticuerpos aglutinantes en suero, para ella se incuban los sueros de los pacientes con el antígeno de los serovares de Leptospira, luego las mezclas del suero-antígeno se examinan en microscopio de campo oscuro para observar la aglutinación y luego se determina el título de la muestra71.
La MAT es una prueba compleja y de difícil realización e interpretación, por lo que requiere de personal con experiencia; cultivos vivos de todos los serovares requeridos para su uso como antígeno, los cuales deben ser mantenidos semanalmente, además es peligrosa para el personal de laboratorio por la continua manipulación de bacterias vivas.
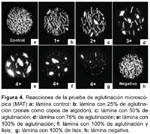
Otras desventajas incluyen el riesgo continuo de contaminación cruzada de las cepas, haciendo necesario la verificación periódica de cada serovar con sus antisueros homólogos. Los antígenos usados deben incluir un representante de cada serogrupo y también se debe tener serovares aislados localmente, e incluir dentro de la batería a uno de los serovares de L biflexa5,11,72. También hay que tener en cuenta que los títulos de anticuerpos a los aislamientos locales son a menudo más altos que títulos a las cepas referenciales (Figura 4).
La interpretación del MAT es complicada por el alto grado de reacción cruzada entre diversos serogrupos, especialmente de las muestras en fase aguda, que se puede explicar por la presencia de varios antígenos comunes entre leptospiras5,11,72; a menudo, no es posible distinguir un serogrupo predominante hasta meses después de la infección, pues los títulos cruzados declinan en diversas maneras73; además se ha demostrado que la serología por MAT en muestras con muy pocos días de enfermedad a veces puede salir negativa74.
Algunos pacientes tienen evidencia serología de infecciones anteriores con diversos serogrupos de Leptospira. En estos casos, el diagnóstico serológico es complicado, la primera subida del título del anticuerpo generalmente se da contra el serovar anterior que produjo la infección, solamente es posible identificar al serovar o al serogrupo responsable de la infección actual tardíamente ya que se incrementa el título de anticuerpos específicos contra el serovar causante.
Debido a estas limitaciones es necesario tener muestras de suero pareadas para confirmar el diagnóstico con certeza, por lo que para considerar un caso positivo se necesita un incremento de cuatro veces el título en los sueros pareados sin importar el intervalo entre las muestras; o una conversión del seronegativo a un título de 1/100.
Si los síntomas de leptospirosis están presentes, un intervalo de tres a cinco días puede ser adecuado para detectar el incremento del título de anticuerpos; sin embargo, si el paciente presentó anteriormente la enfermedad o si la fecha de inicio no es clara, entonces un intervalo de 10 a 14 días entre las muestras es la
más apropiada.
En muchas de las regiones el problema es que se cuenta con una sola muestra, entonces la determinación de la infección aguda es a veces sugerida por un solo título elevado. Pero la magnitud de tal título es dependiente de la exposición de la población y la prevalencia de la enfermedad.
El CDC, estableció un título de 1/200 para definir un caso probable de leptospirosis75; sin embargo, sólo es apropiado para poblaciones donde la exposición a es infrecuente, por lo que en áreas endémicas se usan títulos más altos como 1/800 en pacientes sintomáticos5, aunque incluso recomiendan títulos hasta 1/1600. Los títulos que siguen después de la infección aguda generalmente son extremadamente altos (1/25600).
La MAT es también la prueba más apropiada para estudios de prevalencia, puesto que puede ser aplicada a sueros de cualquier especie de animal y la gama de los antígenos usados se puede ampliar o disminuir según lo requerido. Generalmente utiliza un título de 1/100 como evidencia de la última exposición. Sin embargo, las conclusiones sobre que serovares están circulando se determina con los aislamientos.
OTRAS PRUEBAS SEROLÓGICAS
Debido a la complejidad del MAT, se han desarrollado diversas pruebas para detectar anticuerpos contra Leptospira en una infección aguda. La fijación de complemento (CF) fue usada extensamente. Posteriormente, se ha desarrollado la hemoaglutinación indirecta76, la aglutinación en lámina77, la inmunofluorescencia78, la contrainmunoelectroforesis79 y la aglutinación microcápsula80; todos estos métodos han tenido sus dificultades ya sea por su baja sensibilidad y especificidad además que muchos no eran reproducibles o requerían de reactivos y equipamiento muy sofisticado.
Todas estas pruebas han sido sustituidas generalmente por el método de ELISA69,81, que detecta los anticuerpos IgM durante la primera semana de la enfermedad69,81, permitiendo que el diagnóstico rápido y y un tratamiento oportuno.
La detección de IgM en suero por ELISA, es más sensible que el MAT cuando la primera muestra se toma en la fase aguda de la enfermedad69. Los anticuerpos IgM han sido detectados por ELISA en LCR en 15% de pacientes con meningitis sin una etiología probada82.También las IgM se han detectado en la saliva83.
En el ámbito comercial se ha producido un dot-ELISA IgM, que ha demostrado ser tan sensible como un ELISA convencional, además de haber sido usado para detectar también IgA e IgG84. Otros sistemas de detección de anticuerpos es mediante el dipstick IgM, que se ha evaluado extensamente en varias poblaciones70.
Los sistemas de ELISA también se han aplicado al diagnóstico de leptospirosis en animales con un eficiente resultado68. Nosotros hemos desarrollado un sistema de ELISA IgM con un pool de seis serovares patogénico, lo cual nos ha permitido determinar que es más sensible que el MAT y algunos ELISA comerciales81.
MÉTODOS MOLECULARES
Son métodos que puede sustituir el cultivo para la demostración directa de Leptospira en muestras humanas o de animales. Los primeros estudios en biología molecular realizados para detectar ADN fueron el dot blotting e hibridación in situ85. Posteriormente se desarrollaron sondas específicas para detectar algunos serovares como el serovar hardjobovis86 y estas fueron aplicadas para la detección de Leptospira en muestras de orina de vacunos. Sin embargo, la sensibilidad de esta pruebas marcadas con fósforo 32 bordeaba la detección en más de 100 leptospiras86, pero comparándolo con el PCR su sensibilidad era mucho más baja.
Cuando el PCR se introdujo para el diagnóstico de patógenos, se comenzaron a desarrollar varios primer para amplificar el ADN de la Leptospira, los primeros fueron dirigidos a genes específicos, pero con más frecuencia al 16S o 23S rRNA cuyos genes son más conservados en general en todas las bacterias87 a elementos repetititivos88, mientras que otros se han construido a partir de bibliotecas genómicas89.
Sin embargo, pocos han demostrado su utilidad para amplificar el ADN de Leptospira en humanos90 o en animales91 a partir de muestras clínicas; de éstos, sólo dos métodos han sido evaluados con la parte clínica y de laboratorio92. Se demostró que usando ambos pares de primers, el PCR era más sensible que el cultivo.
Uno de los primers más usados fue el descrito por Merien et al.87 que amplifica el fragmento 331-bp del gene de los rrs (rRNA 16S) de Leptospira patógena y no patógena, mientras que las primers G1 y G2 descritas por Gravekamp et al. amplifican serovares patógenos excepto Leptospira kirschneri91.
A pesar de estas limitantes, han sido usados extensamente en estudios clínicos. Estos ha sido aplicados a ADN obtenido a partir de muestras de suero, de orina, de humor acuoso, de LCR y tejidos obtenidos después de la autopsia93,94.
Asimismo, se han desarrollado pruebas basadas en las secuencia de inserción IS153395, estos permitieron la detección y la identificación directa de serovares a partir de las muestras de orina. Otros PCR fueron desarrollados y aplicados a muestras de orina de vacunos y cerdos91.
Una limitación del diagnóstico por PCR de la leptospirosis es la incapacidad de la mayoría de los análisis de PCR para identificar el serovar. Esto no es significativo para el tratamiento de paciente, pero tiene un gran valor en la epidemiología y la salud pública.
Entre las estrategias para superar estos obstáculos se ha incluido a la digestión con enzimas de restricción de los amplificados por PCR, el secuenciamiento directo de amplificados y el análisis de la conformación de una sola cadena (SSCP). Para diferenciar entre genomoespecies después del PCR se usa geles de polyacrylamide, seguido de la tinción con plata; otros trabajos se dirigieron hacia los amplificados del PCR no purificado, desnaturalizándolos para distinguir serovares patógenos y no patógenos65.
En la actualidad, se ha descrito un PCR cuantitativo en tiempo real, con alta sensibilidad, que permite detectar a la Leptospira distinguiendo entre especies patógenas y no patógenas en muestras clínicas y ambientales, permitiendo un diagnóstico rápido, que puede servir incluso cuando el paciente ya ha comenzado su tratamiento antibiótico96.
TIPIFICACIÓN MOLECULAR
Debido a las dificultades asociadas con la identificación serológica de aislamientos, hubo un gran interés de introducir los métodos moleculares para la identificación y subtipificacion. Los primeros métodos empleados han incluido la digestión del ADN cromosómico con enzimas de restricción (REA), el polimorfismo de fragmentos de restricción (RFLP), ribotipificacion, PFGE y un sin número de PCR. El REA se ha estudiado ampliamente65,86. Con ellos se demostró distintos genotipos dentro del serovar hardjo86.
Las diferencias entre los serovares Copenhageni e Icterohaemorrhagiae también fueron demostradas97. Algunos trabajos han documentado una correlación con la clasificación filogenética de Leptospira de 11 genomospecies usando la ribotipificación, para ello se usó la enzima de restricción EcoRI para la digestión del 16S y 23 S rRNA a partir de ella se ha construido una base de datos que se encuentra en la pagina web del Instituto Pasteur. Numerosos serovares dieron perfiles únicos, pero a pesar de ello, muchos no pueden ser distinguidos entre uno y otro por la ribotipificacion, particularmente los muy cercanos como los serovares Icterohaemorrhagiae y Copenhageni. Se usó una gama de sondas para generar RFLPs65.
El PFGE es unos de los métodos más útiles para caracterizar los serovares de Leptospira; puesto que ha demostrado que los genomas de estos serovares se han conservado a través del tiempo y el área geográfica. La enzima de restricción más usada en PFGE es la enzima NotI, pero no todos los serovares dieron patrones únicos de PFGE. Los serovares de Leptospira interrogans como Bratislava, Lora, Jalna y Muenchen dieron patrones idénticos digeridos con NotI pero fueron diferentes cuando estás fueron digeridos con SgrAI. Otros serovares difíciles de distinguir fueron los de Leptospira borgpetersenii Arborea y Castellonis; también los serovares Copenhageni e Icterohaemorrhagiae de Leptospira interrogans. Un factor limitante en los métodos que analizan ADN cromosómico es que requieren de grandes cantidades de bacterias y por tanto de ADN purificado98.
Consecuentemente, varios métodos se han desarrollado para el análisis a partir de los productos amplificados por PCR. La variación en la secuencia de los amplificados por los primer G1 y G2 de 285-bp91 se analizó por electroforesis en gel de poliacrilamida y teñido con plata. Esto permitió diferenciar entre los serovares de L. interrogans y L. noguchii. También se encontró variación usando el método SSCP; esto se observó para diferenciar los serovares L. interrogans y L. borgpetersenii a partir de amplificaciones del 16S rRNA y G1y G2. Asimismo, se ha investigado la presencia de secuencias múltiples de inserción para la identificación de serovares99. Se ha limitado el uso de los métodos basados en IS1533 debido a la ausencia de esta secuencia en L. interrogans y L. noguchii.
El RFLP de los amplificados por PCR de los genes del 16S y 23S permitió agrupar 48 serovares en 16 perfiles de polimorfismo. Este mismo método se usó para diferenciar dentro del serovar Hardjo los genotipos hardjobovis y hardjoprajitmo. El método fue simplificado para rendir solamente cinco perfiles usando una
sola enzima de la restricción. Una de las ventajas potenciales de este del RFLP es la capacidad de amplificar el ADN de Leptospira a partir de muestras clínicas e identificar la infección serovar o genomospecies rápidamente65.
El DNA fingerprinting usando primers arbitrarios se ha estudiado extensivamente con diversos primers y condiciones100. La limitación de estos métodos es la reproducibilidad, también los perfiles son afectados dependiendo de los primer usados, la cantidad y la calidad de ADN101, y las condiciones del electroforesis. Pero el método es valioso porque su capacidad de distinguir en los aislamientos cuando la cantidad de serovares en una zona es limitada, permitiendo rápidamente la identificación cepas aisladas101. Este ha sido usado para generar sondas e identificar L. interrogans, L. borgpetersenii y L. kirschneri.
Recientemente se han desarrollado otros métodos como i-rep1 PCR para diferenciar cepas aisladas en Brasil. Otro método reciente es el PCR de baja astringencia aplicada a muestras clínica usando los primer G1 y G2 lo cual permitió diferenciar leptospiras101,102.
DIAGNÓSTICO DIFERENCIAL
Esta debe realizarse de acuerdo con la presentación clínica de la enfermedad. En las formas anictéricas el diagnóstico diferencial debe establecerse con enfermedades febriles tales como: influenza, dengue, hepatitis virales, neumonía, meningitis virales, mononucleosis, Brucelosis, borreliosis, toxoplasmosis. En la forma ictérica (síndrome de Weil), el diagnóstico diferencial debe hacerse con: hepatitis virales, dengue hemorrágico, malaria, fiebre tifoidea, fiebre amarilla, rickettsiosis, fiebre hemorrágica venezolana e infecciones debidas a antivirus, pielonefritis e intoxicaciones103.
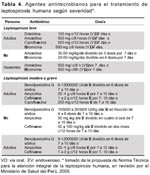
TRATAMIENTO
El tratamiento se basa principalmente en la terapia de soporte, corrección del desequilibrio electrolítico y ácido básico. La antibioticoterapia se debe iniciar lo más temprano posible para evitar las lesiones en los tejidos. El manejo y el tratamiento de leptospirosis de moderado a grave debe ser en forma hospitalaria48,52,104,105. Todo paciente con diagnóstico presuntivo de leptospirosis debe ser hospitalizado si es que se presenta los siguientes signos de alarma:
· Fiebre elevada que no cede a antipiréticos (39 ºC)
· Vómitos persistentes.
· Dolor abdominal intenso que puede llegar al abdomen agudo.
· Ictericia.
· Manifestaciones hemorrágicas (gingivorragia, hemoptisis,melena, petequias generalizadas).
· Dificultad respiratoria.
· Trastornos hemodinámicos (shock).
· Oliguria.
· Signos meníngeos.
Para grupos de personas que ingresen a zonas endémicas en forma temporal (personal militar, practicantes de deportes de aventura, brigadistas y otros) se recomienda aplicar, en adultos, doxiciclina 200 mg VO una vez por semana o amoxicilina 500 mg VO una vez por semana; en niños amoxicilina 250 mg VO una vez por semana. El tratamiento quimioprofiláctico está recomendado mientras dure la estadía.
Las medidas terapéuticas de soporte constituyen aspectos importantes y deben ser iniciadas rápidamente, evitando complicaciones como principalmente las renales. La hidratación, de preferencia endovenosa, es la terapia más importante en las formas graves de la enfermedad, ya que los pacientes presentan deshidratación debido a la fiebre, vómitos, diarrea, anorexia y lesiones vasculares.
En casos graves con oliguria, se debe tener cuidado con la reposición hídrica excesiva, que puede empeorar la insuficiencia respiratoria, pudiendo llegar hasta insuficiencia cardiaca. Si a pesar de las medidas adoptadas, no mejora la insuficiencia renal se debe indicar precozmente la diálisis peritoneal o derivación a un establecimiento de salud que cuente con unidad de cuidados intensivos (UCI).
CONCLUSIONES
Los conocimientos de esta enfermedad en países desarrollados han conducido al desarrollo de estrategias preventivas eficaces; sin embargo, en nuestra región, la leptospirosis ha sido hasta hace pocos años desconocida en los aspectos etiológicos, epidemiológicos y clínicos.
En la actualidad, es un problema latente y esto debido a cambios en el clima y la actividad humana especialmente en los países en vías de desarrollo. Los últimos brotes que se han presentado, pusieron en alerta a los sistemas de salud debido al amplio espectro de manifestaciones clínicas que puede presentar y a la confusión que puede generar debido a que clínicamente se pueden parecer con otras enfermedades regionales.
Por ello la importancia de establecer los métodos de diagnóstico en las zonas donde se producen los casos, esto en gran parte serviría para que el tratamiento se inicie rápidamente en los pacientes. Sin embargo, es necesario mencionar que el diagnóstico y tratamiento deberán ser sostenibles en el tiempo para que sea accesible a las poblaciones más deprimidas que sufren el problema.
El conocimiento de la patogenia de la enfermedad continúa siendo pobre; pero se están desarrollando cada vez más investigaciones, apoyadas en el avance de las técnicas moleculares y usando el conocimiento genético de la bacteria, permitirá entender la biología de esta bacteria y contribuir en un futuro a generar una vacuna contra la leptospirosis.
REFERENCIAS BIBLIOGRÁFICAS
1. Vinetz JM. Leptospirosis. Curr Opin Infect Dis 2001; 14(5): 527-38. [ Links ]
2. Trevejo RT, Rigau-Pérez JG, Ashford DA, McClure EM, Jarquin-González C, Amador JJ, et al. Epidemic leptospirosis associated with pulmonary hemorrhage-Nicaragua, 1995. J Infect Dis 1998; 178(5):1457-63.
3. ONeil KM, Rickman LS, Lazarus AA. Pulmonary manifestations of leptospirosis. Rev Infect Dis 1991; 13(4): 705-9.
4. Monsuez JJ, Kidouche R, Le Gueno B, Postic D. Leptospirosis presenting as haemorrhagic fever in visitor to Africa. Lancet 1997; 349(9047): 254-55.
5. Faine S, Adler B, Bolin C, Perolat P. Leptospira and leptospirosis. 2nd ed. Melbourne, Australia: Medisci; 1999.
6. Sasaki DM, Pang L, Minette HP, Wakida CK, Fujimoto WJ, Manea SJ, et al. Active surveillance and risk factors for leptospirosis in Hawaii. Am J Trop Med Hyg 1993; 48(1): 35-43.
7. Bharti AR, Nally JE, Ricaldi JN, - Matthias MA, Diaz MM, Lovett MA, et al. Leptospirosis: a zoonotic disease of global importance. Lancet Infect Dis 2003; 3(12): 75771.
8. Brenner DJ, Kaufmann AF, Sulzer KR, Steigerwalt AG, Rogers FC, Weyant RS. Further determination of DNA relatedness between serogroups and serovars in the family Leptospiraceae with a proposal for Leptospira alexanderi sp. nov. and four new leptospira genomospecies. Int J Syst Bacteriol 1999; 49 (Pt 2): 839-58.
9. Nascimento AL, Ko AI, Martins EA, Monteiro-Vitorello CB, Ho PL, Haake DA, et al. Comparative genomics of two Leptospira interrogans serovars reveals novel insights into physiology and pathogenesis. J Bacteriol 2004; 186(7): 2164-72.
10. Ren SX, Fu G, Jiang XG, Zeng R, Miao YG, Xu H, et al. Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing. Nature 2003; 422(6934): 888-93.
11. Levett PN. Leptospirosis. Clin Microbiol Rev 2001; 14(2): 296-326.
12. Bovet P, Yersin C, Merien F, Davis CE, Perolat P.Factors associated with clinical leptospirosis: a population-based case-control study in the Seychelles (Indian Ocean). int. J Epidemiol 1999; 28(3): 583-90.
13. Ashford DA, Kaiser RM, Spiegel RA, Perkins BA, Weyant RS, Bragg SL, et al. Asymptomatic infection and risk factors for leptospirosis in Nicaragua. Am J Trop Med Hyg 2000; 63(5-6): 249-54
14. Ganoza CA, Segura ER, Swancutt MA, Gotuzzo E, Vinetz JM. Mild, self-resolving acute leptospirosis in an HIV-infected patient in the Peruvian Amazon. Am J Trop Med Hyg 2005; 73(1): 67-8.
15. Cespedes M, Ormaeche M, Condori P, Balda L, Glenny M. Prevalencia de leptospirosis y factores de riesgo en personas con antecedentes de fiebre en la provincia de Manu, Madre de Dios, Perú. Rev Perú Med Exp Salud Publica 2003; 20(4):180-85.
16. Matthias MA, Levett PN. Leptospiral carriage by mice and mongooses on the island of Barbados. West Indian Med J 2002; 51(1): 10-13.
17. Alexander AD, Benenson AS, Byrne RJ, Diaz-Rivera RS, Evans LB, Gochenour WS, et al. Leptospirosis in Puerto Rico. Zoonoses Res 1963; 2(3): 152-227.
18. Sulzer C. Leptospiral serotype distribution lists according to host and geographic area July 1966 to July 1973. Atlanta: U.S. Department of Health, Education, and Welfare; 1975.
19. Everard CO, Sulzer CR, Bhagwandin LJ, Fraser- Chanpong GM, James AC. Pathogenic leptospira isolates from the Caribbean Islands of Trinidad, Grenada and St. Vincent. Int J Zoonoses 1980; 7(2): 90-100.
20. Everard CO, Green AE, Glosser JW. Leptospirosis in Trinidad and Grenada, with special reference to the mongoose. Trans R Soc Trop Med Hyg 1976; 70(1): 57-61.
21. Hartskeerl RA, Terpstra WJ. Leptospirosis in wild animals. Vet Q 1996; 18 (Suppl 3): S149-50.
22. Ellis WA, OBrien JJ, Cassells J. Role of cattle in the maintenance of Leptospira interrogans serotype hardjo infection in Northern Ireland. Vet Rec 1981; 108(26): 555-57.
23. Ellis WA, OBrien JJ, Cassells JA, Neill SD, Hanna J. Excretion of Leptospira interrogans serovar hardjo following calving or abortion. Res Vet Sci 1985; 39(3): 296-98.
24. Crawford RP, Heinemann JM, McCulloch WF, Diesch SL. Human infections associated with waterborne leptospires, and survival studies on serotype pomona. J Am Vet Med Assoc 1971; 159(11): 1477-84.
25. Karaseva EV, Chernukha Yu G, Sakhartseva TF. Results of the investigation of soil for contamination with pathogenic leptospires. Folia Parasitol (Praha) 1977; 24(4): 301-4.
26. Cacciapuoti B, Ciceroni L, Maffei C, Di Stanislao F, Strusi P, Calegari L, et al. A waterborne outbreak of leptospirosis. Am J Epidemiol 1987; 126(3): 535-45.
27. Corwin A, Ryan A, Bloys W, Thomas R, Deniega B, Watts D. A waterborne outbreak of leptospirosis among United States military personnel in Okinawa, Japan. Int J Epidemiol 1990; 19(3): 743-48.
28. Jackson LA, Kaufmann AF, Adams WG, Phelps MB, Andreasen C, Langkop CW, et al. Outbreak of leptospirosis associated with swimming. Pediatr Infect Dis J 1993; 12(1): 48-54.
29. Barkin RM, Guckian JC, Glosser JW. Infection by Leptospira ballum: a laboratory-associated case. South Med J 1974; 67(2): 155.
30. Waitkins SA. Leptospirosis as an occupational disease. Br J Ind Med 1986; 43(11): 721-25.
31. Campagnolo ER, Warwick MC, Marx HL, Jr., Cowart RP, Donnell HD, Jr., Bajani MD, et al. Analysis of the 1998 outbreak of leptospirosis in Missouri in humans exposed to infected swine. J Am Vet Med Assoc 2000; 216(5): 676-82.
32. Demers RY, Frank R, Demers P, Clay M. Leptospiral exposure in Detroit rodent control workers. Am J Public Health 1985; 75(9): 1090-91.
33. Anderson DC, Geistfeld JG, Maetz HM, Patton CM, Kaufmann AF. Leptospirosis in zoo workers associated with bears. Am J Trop Med Hyg 1978; 27(1 Pt 1): 210-11.
34. Russell KL, Montiel Gonzalez MA, Watts DM, Lagos- Figueroa RC, Chauca G, Ore M, et al. An outbreak of leptospirosis among Peruvian military recruits. Am J Trop Med Hyg 2003; 69(1): 53-57.
35. Robertson MH, Clarke IR, Coghlan JD, Gill ON. Leptospirosis in trout farmers. Lancet 1981; 2(8247): 626-27.
36. Gill N, Waitkins SA, Calder IM. Further update on leptospirosis: continuing risk in fish farmers. Br Med J (Clin Res Ed) 1985; 290(6486): 1988.
37. Mumford CJ. Leptospirosis and water sports. Br J Hosp Med 1989; 41(6): 519.
38. Shaw RD. Kayaking as a risk factor for leptospirosis. Mo Med 1992; 89(6): 354-57.
39. van Crevel R, Speelman P, Gravekamp C, Terpstra WJ. Leptospirosis in travelers. Clin Infect Dis 1994; 19(1): 132-34.
40. From the Centers for Disease Control and Prevention. Outbreak of acute febrile illness among athletes participating in triathlonsWisconsin and Illinois, 1998. JAMA 1998; 280(17): 1473-74.
41. Sejvar J, Bancroft E, Winthrop K, Bettinger J, Bajani M, Bragg S, et al. Leptospirosis in «Eco-Challenge» athletes, Malaysian Borneo, 2000. Emerg Infect Dis 2003; 9(6): 702-7.
42. Vanasco NB, Fusco S, Zanuttini JC, Manattini S, Dalla Fontana ML, Prez J, et al. Outbreak of human Leptospirosis after a flood in Reconquista, Santa Fe, 1998. Rev Argent Microbiol 2002; 34(3): 124-31.
43. Karande S, Gandhi D, Kulkarni M, Bharadwaj R, Pol S, Thakare J, et al. Concurrent outbreak of leptospirosis and dengue in Mumbai, India, 2002. J Trop Pediatr 2005; 51(3): 174-81.
44. Everard CO, Bennett S, Edwards CN, Nicholson GD, Hassell TA, Carrington DG, et al. An investigation of some risk factors for severe leptospirosis on Barbados. J Trop Med Hyg 1992; 95(1): 13-22.
45. Douglin CP, Jordan C, Rock R, Hurley A, Levett PN. Risk factors for severe leptospirosis in the parish of St. Andrew, Barbados. Emerg Infect Dis 1997; 3(1): 78-80.
46. Feigin RD, Lobes LA, Jr., Anderson D, Pickering L. Human leptospirosis from immunized dogs. Ann Intern Med 1973; 79(6): 777-85.
47. Vinetz JM, Glass GE, Flexner CE, Mueller P, Kaslow DC. Sporadic urban leptospirosis. Ann Intern Med 1996; 125(10): 794-98.
48. Ko AI, Galvao Reis M, Ribeiro Dourado CM, Johnson WD, Jr., Riley LW. Urban epidemic of severe leptospirosis in Brazil. Salvador Leptospirosis Study Group. Lancet 1999; 354(9181): 820-25.
49. Lee SH, Kim KA, Park YG, Seong IW, Kim MJ, Lee YJ. Identification and partial characterization of a novel hemolysin from Leptospira interrogans serovar lai. Gene 2000; 254(1-2): 19-28.
50. Hauk P, Negrotto S, Romero EC, Vasconcellos SA, Genovez ME, Ward RJ, et al. Expression and characterization of HlyX hemolysin from Leptospira interrogans serovar Copenhageni: potentiation of hemolytic activity by LipL32. Biochem Biophys Res Commun 2005; 333(4): 1341-47.
51. Lux R, Moter A, Shi W. Chemotaxis in pathogenic spirochetes direct movement toward targeting tissues. J Mol Microbiol Biotechnol 2000; 2(4): 355-64.
52. Segura ER, Ganoza CA, Campos K, Ricaldi JN, Torres S, Silva H, et al. Clinical spectrum of pulmonary involvement in leptospirosis in a region of endemicity,with quantification of leptospiral burden. Clin Infect Dis 2005; 40(3): 343-51.
53. Heron LG, Reiss-Levy EA, Jacques TC, Dickeson DJ, Smythe LD, Sorrell TC. Leptospirosis presenting as a haemorrhagic fever in a traveller from Africa. Med J Aust 1997; 167(9): 477-79.
54. Antoniadis A, Alexiou-Daniel S, Fidani L, Bautz EF. Comparison of the clinical and serologic diagnosis of haemorrhagic fever with renal syndrome (HFRS) and leptospirosis. Eur J Epidemiol 1995; 11(1): 91-92.
55. Dupont H, Dupont-Perdrizet D, Perie JL, Zehne r-Hansen S, Jarrige B, Daijardin JB. Leptospirosis: prognostic factors associated with mortality. Clin Infect Dis 1997; 25(3): 720-24.
56. Monno S, Mizushima Y. Leptospirosis with acute acalculous cholecystitis and pancreatitis. J Clin Gastroenterol 1993; 16(1): 52-54.
57. Edwards CN, Nicholson GD, Hassell TA, Everard CO, Callender J. Thrombocytopenia in leptospirosis: the absence of evidence for disseminated intravascular coagulation. Am J Trop Med Hyg 1986; 35(2): 352-54.
58. Turner LH. Leptospirosis 3. Maintenance, isolation and demonstration of leptospires. Trans R Soc Trop Med Hyg 1970; 64(4): 623-46.
59. Litvin V, Karaseva EV, Karulin BE. [Leptospira distribution in the soil of a natural focus of the infection (an attempt at the radioisotopic labelling of infected voles)]. Zh Mikrobiol Epidemiol Immunobiol 1979; (6):74-79. Russian.
60. Terpstra WJ, Jabboury-Postema J, Korver H. Immunoperoxidase staining of leptospires in blood and urine. Zentralbl Bakteriol Mikrobiol Hyg [A] 1983; 254(4): 534-39.
61. Bolin CA, Zuerner RL, Trueba G. Comparison of three techniques to detect Leptospira interrogans serovar hardjo type hardjo-bovis in bovine urine. Am J Vet Res 1989; 50(7): 1001-3.
62. Uip DE, Amato Neto V, Duarte MS. [The early diagnosis of leptospirosis by demonstrating antigens via an immunohistochemical exam of the hamstring muscle]. Rev Inst Med Trop Sao Paulo 1992; 34(5): 375-81. Portuguese.
63. Kobayashi Y, Tamai T, Sada E. Serological analysis of serogroup icterohaemorrhagiae using monoclonal antibodies. Microbiol Immunol 1985; 29(12): 1229-35.
64. Herrmann JL, Baril C, Bellenger E, Perolat P, Baranton G, Saint Girons I. Genome conservation in isolates of Leptospira interrogans. J Bacteriol 1991; 173(23): 7582-88.
65. Perolat P, Merien F, Ellis WA, Baranton G. Characterization of Leptospira isolates from serovar hardjo by ribotyping, arbitrarily primed PCR, and mapped restriction site polymorphisms. J Clin Microbiol 1994; 32(8): 1949-57.
66. Palmer M, Hookey J. The chemiluminescent detection of leptospiral antigen. Zentralbl Bakteriol 1992; 277(3): 300-8.
67. Yan KT, Ellis WA, Montgomery JM, Taylor MJ, Mackie DP, McDowell SW. Development of an immunomagnetic antigen capture system for detecting leptospires in bovine urine. Res Vet Sci 1998; 64(2): 119-24.
68. Cousins DV, Robertson GM, Parkinson J, Richards RB. Use of the enzyme linked immunosorbent assay (ELISA) to detect the IgM and IgG antibody response to Leptospira interrogans serovar hardjo in pregnant ewes. Zentralbl Bakteriol 1991; 275(3): 335-42.
69. Winslow WE, Merry DJ, Pirc ML, Devine PL. Evaluation of a commercial enzyme-linked immunosorbent assay for detection of immunoglobulin M antibody in diagnosis of human leptospiral infection. J Clin Microbiol 1997; 35(8): 1938-42.
70. Smits HL, Hartskeerl RA, Terpstra WJ. International multi-centre evaluation of a dipstick assay for human leptospirosis. Trop Med Int Health 2000; 5(2):124-8.
71. Turner LH. Leptospirosis. II. Serology. Trans R Soc Trop Med Hyg 1968; 62(6): 880-99.
72. Hergt R. [Meaning of serotype Patoc (biflexa complex) for the diagnosis of leptospirosis by microscopic agglutination test]. Zentralbl Bakteriol [Orig A] 1976; 235(4): 506-11. [german]
73. Lupidi R, Cinco M, Balanzin D, Delprete E, Varaldo PE. Serological follow-up of patients involved in a localized outbreak of leptospirosis. J Clin Microbiol 1991; 29(4): 805-9.
74. Cumberland P, Everard CO, Levett PN. Assessment of the efficacy of an IgM-ELISA and microscopic agglutination test (MAT) in the diagnosis of acute leptospirosis. Am J Trop Med Hyg 1999; 61(5): 731-34.
75. World Health Organization. Case definitions. Leptospirosis. Epidemiol Bull 2000; 21(2): 15-16.
76. Sulzer CR, Jones WL. Evaluation of a hemagglutination test for human leptospirosis. Appl Microbiol 1973; 26(5): 655-57.
77. Galton MM, Powers DK, Hall A, Cornell RG. A rapid microscopic-slide screening test for the serodiagnosis of leptospirosis. Am J Vet Res 1958; 19(71): 505-12.
78. Torten M, Shenberg E, Van der Hoeden J. The use of immunofluorescence in the diagnosis of human leptospirosis by a genus-specific antigen. J Infect Dis 1966; 116(5): 537-43.
79. Myers DM. Serodiagnosis of human leptospirosis by counterimmunoelectrophoresis. J Clin Microbiol 1987; 25(5): 897-99.
80. Arimitsu Y, Kobayashi S, Akama K, Matuhasi T. Development of a simple serological method for diagnosing leptospirosis: a microcapsule agglutination test. J Clin Microbiol 1982; 15(5): 835-41.
81. Céspedes M, Glenny M, Felices V, Balda L, Suárez V. Prueba de ELISA indirecta para la deteccion de anticuerpos IgM para el diagnóstico de leptospirosis humana. Rev Perú Med Exp Salud Publica 2002; 19(1): 24-27.
82. Silva MV, Camargo ED, Batista L, Vaz AJ, Ferreira AW, Barbosa PR. Application of anti-leptospira ELISAIgM for the etiologic elucidation of meningitis. Rev Inst Med Trop Sao Paulo 1996; 38(2): 153-56.
83. da Silva MV, Díaz Camargo E, Vaz AJ, Batista L. Immunodiagnosis of human leptospirosis using saliva. Trans R Soc Trop Med Hyg 1992; 86(5): 560-1.
84. Levett PN, Branch SL, Whittington CU, Edwards CN, Paxton H. Two methods for rapid serological diagnosis of acute leptospirosis. Clin Diagn Lab Immunol 2001; 8(2): 349-51.
85. McCormick BM, Millar BD, Monckton RP, Jones RT, Chappel RJ, Adler B. Detection of leptospires in pig kidney using DNA hybridisation. Res Vet Sci 1989; 47(1):134-35.
86. Zuerner RL, Bolin CA. Repetitive sequence element cloned from Leptospira interrogans serovar hardjo type hardjobovis provides a sensitive diagnostic probe for bovine leptospirosis. J Clin Microbiol 1988; 26(12): 2495-500.
87. Merien F, Amouriaux P, Perolat P, Baranton G, Saint Girons I. Polymerase chain reaction for detection of Leptospira spp. in clinical samples. J Clin Microbiol 1992; 30(9): 2219-24.
88. Van Eys GJ, Gravekamp C, Gerritsen MJ, Quint W, Cornelissen MT, Schegget JT, et al. Detection of leptospires in urine by polymerase chain reaction. J Clin Microbiol 1989; 27(10): 2258-62.
89. Wagenaar J, Zuerner RL, Alt D, Bolin CA. Comparison of polymerase chain reaction assays with bacteriologic culture, immunofluorescence, and nucleic acid hybridization for detection of Leptospira borgpetersenii serovar hardjo in urine of cattle. Am J Vet Res 2000; 61(3): 316-20.
90. Brown PD, Gravekamp C, Carrington DG, van de Kemp H, Hartskeerl RA, Edwards CN, et al. Evaluation of the polymerase chain reaction for early diagnosis of Leptospirosis. J Med Microbiol 1995; 43(2): 110-14.
91. Gravekamp C, Van de Kemp H, Franzen M, Carrington D, Schoone GJ, Van Eys GJ, et al. Detection of seven species of pathogenic leptospires by PCR using two sets of primers. J Gen Microbiol 1993; 139(8): 1691-700.
92. Merien F, Baranton G, Perolat P. Comparison of polymerase chain reaction with microagglutination test and culture for diagnosis of leptospirosis. J Infect Dis 1995; 172(1): 281-85.
93. Levett PN, Morey RE, Galloway RL, Turner DE, Steigerwalt AG, Mayer LW. Detection of pathogenic leptospires by real-time quantitative PCR. J Med Microbiol 2005; 54(Pt 1): 45-49.
94. Oliveira MA, Caballero OL, Díaz Neto E, Koury MC, Romanha AJ, Carvalho J, et al. Use of nondenaturing silver-stained polyacrylamide gel analysis of polymerase chain reaction amplification products for the differential diagnosis of Leptospira interrogans infection. Diagn Microbiol Infect Dis 1995; 22(4): 343-48.
95. Zuerner RL, Alt D, Bolin CA. IS1533-based PCR assay for identification of Leptospira interrogans sensu lato serovars. J Clin Microbiol 1995; 33(12): 3284-49.
96. Smythe LD, Smith IL, Smith GA, Dohnt MF, Symonds ML, Barnett LJ, et al. A quantitative PCR (TaqMan) assay for pathogenic Leptospira spp. BMC Infect Dis 2002; 2: 13.
97. Pacciarini ML, Savio ML, Donini G, Tagliabue S. The search for improved methods for diagnosing leptospirosis: the approach of a laboratory in Brescia, Italy. Rev Sci Tech 1993; 12(2): 647-63.
98. Herrmann JL, Bellenger E, Perolat P, Baranton G, Saint Girons I. Pulsed-field gel electrophoresis of NotI digests of leptospiral DNA: a new rapid method of serovar identification. J Clin Microbiol 1992; 30(7): 1696-702.
99. Masri SA, Nguyen PT, Gale SP, Howard CJ, Jung SC. A polymerase chain reaction assay for the detection of Leptospira spp. in bovine semen. Can J Vet Res 1997; 61(1): 15-20.
100. Oliveira MA, Caballero OL, Vago AR, Harskeerl RA, Romanha AJ, Pena SD, et al. Low-stringency single specific primer PCR for identification of leptospira. J Med Microbiol 2003; 52(Pt 2): 127-35
101. Ooteman MC, Vago AR, Koury MC. Potential application of low-stringency single specific primer-PCR in the identification of Leptospira in the serum of patients with suspected leptospirosis. Can J Microbiol 2004; 50(12): 1073-79.
102. Barocchi MA, Ko AI, Ferrer SR, Faria MT, Reis MG, Riley LW. Identification of new repetitive element in Leptospira interrogans serovar copenhageni and its application to PCR-based differentiation of leptospira serogroups. J Clin Microbiol 2001; 39(1): 191-95.
103.Céspedes M, Mostorino R, Suárez M. Enfoque sindrómico para el diagnóstico de laboratorio durante brotes. Lima: Instituto Nacional de Salud; 2005. Serie de Normas Técnicas Nº 42.
104. Edwards CN, Nicholson GD, Hassell TA, Everard CO, Callender J. Penicillin therapy in icteric leptospirosis. Am J Trop Med Hyg 1988; 39(4): 388-90.
105. Panaphut T, Domrongkitchaiporn S, Vibhagool A, Thinkamrop B, Susaengrat W. Ceftriaxone compared with sodium penicillin g for treatment of severe leptospirosis. Clin Infect Dis 2003; 36(12): 1507-13.
Correspondencia: Blgo. Manuel Céspedes Zambrano. Centro Nacional de Salud Pública, Instituto Nacional de Salud.
Lima, Perú.
Dirección: Cápac Yupanqui 1400, Lima 11.
Teléfono: (511) 471-9920
Correo electrónico: mcespedes@ins.gob.pe