Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.23 n.2 Lima abr. 2006
TRABAJO ORIGINAL
Hiperendemicidad de Hepatitis viral B y Delta en pueblos indìgenas de la Amazonía Peruana
César Cabezas S1; Magna Suárez J1; Giovana Romero C1; Carlos Carrillo P1; María P. García1; Juan Reátegui S2; Félix Vallenas G2; Luis Torres T2
1 Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
2 Programa de Salud Indígena, Asociación Interétnica de Desarrollo de la Selva Peruana (AIDESEP). Lima, Perú.
Este estudio contó con el apoyo financiero de la Cooperación Española y la Cooperación Amazónica, en el marco del Convenio entre AIDESEP y el INS para el desarrollo y promoción de investigaciones aplicadas a la salud de los pueblos indígenas.
RESUMEN
Objetivos: Determinar la prevalencia de marcadores serológicos de hepatitis viral B y delta en pueblos indígenas de la Amazonía, así como su distribución en las diferentes cuencas y cuales son los factores de riesgo asociados. Materiales y métodos: Se realizó un estudio transversal en 870 pobladores de 37 comunidades nativas distribuidas en 12 cuencas de la Amazonía peruana. Se obtuvieron datos epidemiológicos en relación a hepatitis viral B y delta y una muestra de sangre venosa para determinar la presencia de HBsAg, HBeAg, anticuerpos totales anti-HBcAg, IgM Anti-HBcAg, Anti-HBeAg y anti delta usando la técnica de ELISA. Resultados: La edad promedio fue de 22,7 años (1-94 a), 50,7% (441/870) fueron varones. Se determinó infección previa por HVB en 519 (59,7%) e infección reciente en 16 (1,8%). Se encontraron 82 portadores de HBsAg (9,4%) de estos 18 (21,9%) tenían HBeAg positivo, y 15 (83,3%) eran varones. 44,2% de los menores de diez años tenían antecedente de infección. 39%(32/82) de los portadores de HBsAg tenía infección por HVD. Fue mayor la prevalencia de HVB en nativos (64,3%) que en mestizos (50,6%); así como en las cuencas de la selva norte (73%) que en las de centro y sur (42%). La infección por HVB se encontró asociada con el consumo de masato (OR: 4,9; IC95%: 3,4-7,4) y al antecedente de mordedura por murciélago (OR: 1,7; IC95%: 1,2-2,4). No se encontró diferencias significativas con relación al sexo. Conclusiones: La población indígena y mestiza de las diferentes cuencas de la Amazonía peruana es hiperendémica para la infección por hepatitis viral B y delta.
Palabras clave: Prevalencia; Hepatitis B; Hepatitis Delta; Indígenas; Amazonía (fuente: DeCS BIREME).
ABSTRACT
Objective: To determine the prevalence of serological markers for viral hepatitis B and delta in indigenous communities in the Peruvian Amazon jungle, as well as their distribution in the different river basins and what are the associated risk factors. Materials and methods: A cross-sectional study was performed in 837 inhabitants from 37 native communities distributed alongside 12 river basins in the Peruvian Amazon jungle. Epidemiological data were obtained with respect to the presence of viral hepatitis B and delta, and a venous blood sample was taken in order to determine HBsAg, HBeAg, total anti-HBcAg anti-HBcAg IgM, and anti-delta antibodies using an ELISA technique. Results: Average age in the studied population was 22,7 years (range 1–94 years), and 50,/% were male. Previous infection caused by hepatitis B virus was determined in 519 (59,7%) subjects, and a recent infection was detected in 16 (1,8%) subjects. 82 HBsAg carriers were found (9,4%); of them, 18 (21,9%) were positive for HBeAg, and 15 (3,3%) were male. 44,2% of subjects less than ten years old had past history of infection. 39% (32/82) of HBsAg carriers had also hepatitis delta virus infection. The prevalence of HBV was higher in natives (64,3) compared to that in mestizos (50,6%); as well in northern jungle river basins (73%) compared to findings in central and southern areas (42%). HBV infection was associated with masato (liquor made of yucca) use (OR: 4,9; 95% CI: 3,4 – 7,4) and with history of being bitten by bats (OR: 1,7; 95% IC: 1,2 – 2,4). There were no significant differences with respect to sex distribution. Conclusions: Viral hepatitis B and delta is hyperendemic in indigenous and mestizo populations in different river basins in Peruvian Amazon jungle.
Key words: Prevalence; Hepatitis B; Hepatitis Delta; Indigenous; Amazon region (source: DeCS BIREME).
INTRODUCCIÓN
La hepatitis viral es una de las causas importantes de enfermedad aguda, crónica y de mortalidad en todo el mundo1. Se estima que globalmente más de dos billones de habitantes han sido infectados por virus de la hepatitis B (HVB), de los cuales 350 millones son portadores crónicos del antígeno de superficie (HBsAg). Tres cuartas partes de la población mundial viven en zonas con significativos niveles de infección. Un millón de muertes en un año están relacionadas directamente con infección por HVB, estando los portadores del virus en elevado riesgo de fallecer por hepatitis crónica activa, cirrosis o hepatocarcinoma2.
La hepatitis viral delta (HVD), esta asociada con HVB y cumple un papel importante en la enfermedad crónica, así, 82% de portadores del antígeno de superficie (HBsAg) y hepatitis crónica activa, y 52% con cirrosis tienen antígeno delta, comparado con aquellos portadores de HBsAg sin enfermedad hepática donde no se detecta antígeno delta3-5. El virus delta puede ser adquirido como una coinfección primaria junto con la HVB, o como una superinfección en un portador del virus de la HVB6, ambos pueden estar asociados con hepatitis fulminante, además de su mayor predisposición para hacer las formas crónicas de la enfermedad6,7.
En Latinoamérica es reconocida la importancia de la HVB, por la elevada tasa de portadores del HBsAg, especialmente en zonas tropicales, particularmente en la cuenca Amazónica8,9. El Perú, un país con aproximadamente 27 millones de habitantes, tiene un promedio de prevalencia para el HBsAg entre 1 - 2% y de 20 - 30% para anticuerpos contra HBsAg. Sin embargo, debido a su variada geografía, hábitats y grupos poblacionales, presenta zonas hiperendémicas en diez departamentos que cuentan con selva alta y áreas rurales de la selva baja10,11; y en algunos valles de la vertiente oriental de la cordillera de los Andes, como Abancay y Huanta12,13.
El Perú es un país pluricultural y multilingüe, lo cual se expresa en la coexistencia de 72 etnias, siete ubicadas en los andes y 65 en el área amazónica, denominadas comunidades nativas. Actualmente comparten el espacio que tradicionalmente era de ellos, con los emigrantes o colonos14. Estudios previos realizados en comunidades nativas de la selva muestran la elevada prevalencia de hepatitis B y delta, en tres de los ocho pueblos idiomáticos mas importantes de la selva, Jívaros (Nordeste), Pano (Ucayali) y Arawak (centro y Sudeste) áreas donde 82,9% de los indígenas estudiados presentan marcadores serológicos para HVB, y 17,1% es considerado comoportador asintomático de la HVB. Igualmente, en 6,1% se encuentra anticuerpos contra HVD15.
Existiendo evidencias de este problema, era importante confirmar los hallazgos, contemporizarlos y proyectarlos para orientar las medidas de control, mas aun conociendo el éxito de los programas de vacunación en zonas hiperendémicas16-19.
MATERIALES MÉTODOS
POBLACIÓN Y MUESTRA
Se realizó un estudio transversal prospectivo entre julio a octubre de 1996, en 12 cuencas de los principales ríos de la selva peruana, se incluyeron en el estudio a los habitantes de las 37 comunidades indígenas de la Amazonía del Perú seleccionadas y a los grupos de mestizos que viven con ellos.
El marco muestral se construyó según el censo e información del Instituto Nacional de Estadística e Informática (INEI)20, así como los registros de la población en las diferentes comunidades indígenas para ser incluidas en la programación inicial. Se calculó el tamaño muestral según el número de habitantes de cada una de las comunidades elegidas en las diferentes cuencas hidrográficas de la selva peruana, usando el programa EPI-INFO 6.0. Este cálculo se hizo considerando una prevalencia esperada de 5 a 10% de portadores de HBsAg con un nivel de confianza de 95%.
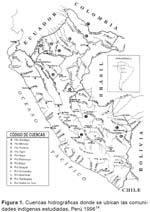
Se eligieron cuencas de los ríos del norte, centro y sur de la selva, que corresponden a los principales ríos de la Amazonía Peruana (Amazonas, Marañón, Ucayali) o a sus principales afluentes; seleccionada la cuenca, se eligieron aleatoriamente las comunidades con más de 100 habitantes, que se encuentren ubicadas al inicio de la cuenca, en la mitad de ella y en su unión con otro afluyente mayor o su desembocadura (Figura 1). El cálculo inicial realizado en gabinete, fue reajustado de acuerdo con la población real encontrada en las comunidades estudiadas, se seleccionaron aleatoriamente las viviendas y dentro de ellas a sus integrantes; en comunidades pequeñas se incluyeron a todos sus integrantes.
RECOLECCIÓN DE INFORMACIÓN
Procedimientos de campo. Se obtuvo información de los registros del censo por comunidades y por cuencas, luego se contactó con las organizaciones de las comunidades indígenas (AIDESEP), las autoridades comunales,las autoridades de salud y educación de las diferentes comunidades. Se capacitó al personal médico, enfermeras y técnicos de salud de las comunidades antes de proceder a la obtención de la información. Para la obtención de los datos se contó con la colaboración de los dirigentes, cuando el caso requería de traducción.
Cuestionario. Previa validación, se usó una ficha epidemiológica relacionada a hepatitis virales, donde se recogió información demográfica (edad, sexo, lugar de nacimiento, lugar de procedencia), posibles factores de riesgo (fuentes de obtención de agua para consumo, antecedente de vacunación, uso de inyectables, tatuajes, hospitalizaciones, acupuntura, extracción o curación dental, picadura por mosquitos, relaciones sexuales, consumo de masato, mordedura por murciélagos), así como el antecedente de hepatitis en el encuestado, en sus familiares y contactos.
Procedimientos de laboratorio. Previo consentimiento, se extrajo 5 mL de sangre venosa usando tubos al vacío, el suero obtenido por sedimentación se depositó en crioviales que fueron transportados en termos con hielo, desde las diferentes cuencas hasta las capitales de departamento, y luego por vía aérea al Laboratorio de Hepatitis Virales del Centro Nacional de Laboratorios de Salud Pública del Instituto Nacional de Salud en Lima. Se determinó la presencia antígeno de superficie de HVB (HBsAg), anticuerpos totales anticore (anti HBcAg), anticuerpos anticore (antiHBc) IgM, anticuerpos totales antidelta (anti-HVD), antígeno e de HVB (HBeAg), Anticuerpos anti HBeAg (anti-HBeAg) usando la técnica de ELISA (kits Laboratorios Abbott®)21.
DEFINICIONES OPERACIONALES
Antecedente de hepatitis. Presencia de signos de ictericia (respuesta positiva a la pregunta se pusieron los ojos amarillos).
Antecedentes de cirrosis o cáncer de hígado. Si se tenía estos diagnósticos dados por un servicio de salud.
Uso de inyectables. Si el sujeto recibió inyectables intramuscular o endovenoso por lo menos una vez, aplicado en el centro de salud, hospital o por un empírico.
Extracción o curación dental. Si tuvo extracciones o curaciones dentales por lo menos una vez, realizadas por un odontólogo o por un empírico.
Hospitalización o cirugía. Si fue hospitalizado por lo menos una vez o sometido a algún procedimiento quirúrgico.
Tatuajes. Si alguna vez en su vida se hizo tatuajes y compartió el instrumento usado para tal fin.
Picadura por mosquitos. Si fue muy frecuente (más de diez veces diarias).
Mordedura por murciélagos. Si le sucedió por lo menos una vez por semana.
Infección aguda por HVB. Sujetos con anticuerpos IgM anti-HBcAg positivo.
Infección previa por HVB. Sujeto con anticuerpos totales anti-HBcAg positivo.
Portador crónico de HVB. Sujeto con HBsAg positivo e IgM anti HBcAg negativo.
Infección activa de HVB. Portador crónico de HBsAg y HBeAg positivo.
Infección por HVD. Sujeto con anticuerpos totales anti- HVD positivo.
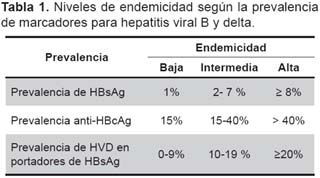
Niveles de endemicidad. Ver tabla 1.
ASPECTOS ÉTICOS
El personal asignado a cada cuenca difundió entre la población los pormenores de la actividad por realizarse, también se realizó una sensibilización sobre la trascendencia de la HVB, HVD y de cuales eran las finalidades del estudio tales como la futura aplicación de programas de vacunación; esta actividad contó con el apoyo de los dirigentes locales como traductores. Antes de la realización del estudio se obtuvo el consentimiento verbal de los dirigentes de la comunidad y de los jefes de familia. Finalmente, se brindó atención médica a todos los integrantes de la comunidad y de acuerdo al diagnóstico se les entregó los medicamentos que cada caso requería, además de las recomendaciones médicas necesarias. En la época en que se realizó el presente estudio no existía un Comité de Ética en el Instituto Nacional de Salud.
ANÁLISIS DE DATOS
La información obtenida, se ingresó a una base de datos en el programa FOXPRO 2,5, a partir de la cual fue procesada mediante el programa EPI-INFO 6,0. Se calcularon las prevalencias con su intervalo de confianza al 95%. Se determinó la presencia y magnitud de la asociación entrelos posibles factores de riesgo y la presencia de infección, calculando el OR con su IC95%, se usó la prueba exacta de Fisher o Chi cuadrado cuando fue necesario, considerando un p<0,05 como significativo.
RESULTADOS
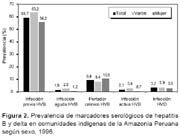
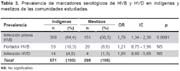
Se evaluaron 870 muestras correspondientes a 12 cuencas hidrográficas de la selva y 37 comunidades indígenas, 441 (50,7%) correspondieron al sexo masculino y 429 (49,3%) al sexo femenino. La edad promedio fue de 22,7 años (1 - 94 años). Se determinó infección previa por HVB en 519 (59,7%) e infección reciente en 16(1,8%). La tasa de portadores de HBsAg fue de 9,4%, de éstos 18 (21,9%) presentaron HBeAg. En 32 de los 82 portadores de HBsAg (39%) se encontró infección por HVD (Figura 2). De un total de 82 portadores crónicos de HBsAg se encontraron 32 (39%) con infección por hepatitis delta.
Con relación a la distribución por sexo, se encontró una mayor tasa de infección activa con presencia de HBeAg en varones en comparación a las mujeres (OR: 5,0; IC95%: 1,44-17,40; p=0,007). Para los otros marcadores no se encontró diferencia significativa con relación al sexo.
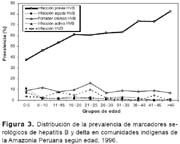
La tasa de infección por HVB fue creciendo progresivamente con la edad llegando hasta 82,5% en los mayores de 45 años. Se observa una mayor presencia de estado de portador de HBsAg, así como de HBeAg, si se considera el total del grupo menor de cinco años; sin embargo, si observamos a este grupo por cada año, la tasa de infección es igualmente ascendente dentro de dicho grupo de edad (Figura 3).
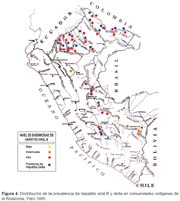
La prevalencia de infección, tanto para HVB y HVD, en promedio, es mayor en las cuencas de la selva norte (73%), cuando se compara con las del centro y del sur (32%). La distribución de la prevalencia de infección por cuencas y comunidades, la podemos observar en la tabla 2 y figura 4.
En las comunidades, la población esta constituida por indígenas/nativos y mestizos, encontrándose una mayor prevalencia de infección previa por HVB (p<0,05) y HVD (p>0,05) en indígenas nativos en comparación a los mestizos; sin embargo, en ambos grupos los niveles de prevalencia son elevados (Tabla 3).
Cuando se evaluó la probable asociación entre factores de riesgo para infección por HVB, con el estado de infección real, se encontró como asociaciones significativas (p= 0,001), el consumo de masato (OR= 4,98; IC95%= 3,37 - 7,36) y la mordedura por murciélago (OR=1,69; IC95%= 1,21 - 2,35). Los clásicos mecanismos de transmisión como cirugía previa, transfusión de sangre, tatuajes, curación y extracción dental, no fueron asociaciones significativas (Tabla 4).
DISCUSIÓN
Los resultados encontrados en el presente estudio, con- firman la hiperendemicidad de la infección por los virus de hepatitis virales B y delta en la comunidades indígenas y grupos de mestizos de la selva peruana, lo cual es un problema de salud compartido por otras comunidades ubicadas en la cuenca Amazónica del país y de los países vecinos, como lo muestran estudios realizados en el Perú, Brasil, Colombia, Ecuador y Venezuela9,15,22-24.
Estudios previos muestran tasas de 82,9% para infección previa por HVB y 17,1% de portadores de HBsAg en comunidades indígenas15, la prevalencia en promedio encontrada en nuestro estudio de 59% para infección previa por HVB y 9,8% de portadores de HBsAg, están en el rango de hiperendemicidad. Estas diferencias pueden deberse al diseño de los estudios para la elección de la población a ser estudiada. Las variaciones de la prevalencia, entre las comunidades de las cuencas del norte y sur, son también coincidentes tanto para HVB como para HVD, siendo mayor en las comunidades ubicadas en las cuencas del norte en comparación a las del sur. Estas variaciones entre las cuencas pudieran obedecer a diferencias inmunológicas en las diferentes etnias y su mayor susceptibilidad a la infección y mayor predisposición a quedar como portadores crónicos, teniendo por tanto mayor proporción de reservorios humanos que perennizen la infección o algunas costumbres más arraigadas, como el consumo de masato.
Es importante destacar que el estudio muestra también una elevada tasa de infección en grupos de mestizos, que conviven en las comunidades con los nativos, por lo que se puede deducir que estos grupos tienen similar susceptibilidad a la infección. Estas observaciones, también se han hecho en zonas como Belice donde se muestran diferencias significativas de infección por HVB entre las diferentes etnias, variando de 5% en grupos de mestizos, a 9% en indígenas mayas, elevándose significativamente entre Creoles y Garifuna a 30 y 56% respectivamente25.
Cuando la infección por HVB ocurre en edades tempranas de la vida, como en las zonas hiperendémicas, existe mayor riesgo que los infectados queden como portadores crónicos del virus y posteriormente desarrollen formas crónicas de hepatitis, cirrosis o hepatocarcinoma; así, si la infección ocurre en los menores de un año la probabilidad de quedar como portador es de 70 a 90%, si ocurre entre los dos a tres años, esa probabilidad es de 40 a 70%, y si ocurre entre los cuatro a seis años es de 10 a 40%25,26. La elevada prevalencia de infección por HVB y de portadores en la población infantil de indígenas estudiados evidencian el riesgo de desarrollar las formas crónicas de infección, teniendo en cuenta, que 37,5% de los menores de cinco años y 44,2 % de los menores de diez años, tienen antecedente de infección por HVB, y 14% de los menores de cinco años son portadores crónicos del HBsAg.
Diversos estudios han mostrado que el ser varón es un factor de riesgo para quedar coma portador de HBsAg y tener por tanto secuelas de la infección por HVB35, sin embargo, existen también otros estudios que no muestran dicho riesgo con relación al sexo25. En la población estudiada no encontramos diferencia significativa en cuanto al sexo e infección previa y estado de portador, pero sí cuando se compara la presencia del HBeAg.
El hallazgo de que 40% de los portadores crónicos varones tengan el antígeno (HBeAg), comparado con su presencia en sólo 6% en las mujeres portadoras de HBsAg, es coincidente con otros estudios en Latinoamérica donde la presencia del HBeAg, que es un marcador de actividad viral, se encuentra en baja proporción en las mujeres, si se compara con lo que ocurre en la región asiática29. Esta observación conlleva a pensar que no teniendo las mujeres portadoras del HBsAg presencia significativa del HBeAg, la transmisión vertical o perinatal, no constituirían las formas preponderantes de infección, lo cual es también respaldado por la forma ascendente de la curva de infección relacionada a la edad observada en el presente estudio (Figura 3). Esta observación también se hizo en Huanta (Perú), al evaluar gestantes portadoras de HBsAg en las que de 9% de portadoras del HbsAg, ninguna tenía HBeAg y todas tenían anticuerposanti-HBeAg, que explicaría la baja tasa de portadores en recién nacidos y menores de un año, observándose también un progresivo incremento de infección de acuerdo con el grupo de edad13,30.
Dos hallazgos que llaman la atención son la significativa asociación de infección por HVB con el consumo de masato, que es una bebida hecha de yuca, utilizando la saliva como fermento; y la mordedura por murciélagos, estas observaciones, sin embargo, son preliminares, y no se ha encontrado estudios que respalden esta asociación por lo que debería realizarse estudios prospectivos y experimentales para su confirmación como probables mecanismos de transmisión, al igual que la participación de vectores biológicos31.
Si bien se conoce que la mordedura por murciélagos es frecuente entre los habitantes de las comunidades indígenas, casi siempre se asoció la presencia de estas mordeduras con la aparición de brotes epidémicos de rabia silvestre32, lo cual fue confirmado en varias ocasiones, siendo la primera vez que se encuentra una probable asociación entre la mordedura por estos mamíferos hematófagos a infección por HVB, HVD. De ser real la asociación se consideraría a estos agentes como vectores mecánicos en poblaciones con elevadas tasas de viremia de HVB, y la otra opción a ser evaluada sería que puedan constituir reservorios animales en la selva, hecho que no ha sido reportado en este tipo de animales.
Por otro lado, existen múltiples evidencias de transmisión intrafamiliar de HVB11, principalmente antes de los seis años, debido a las condiciones en que viven algunas comunidades, donde hay infectados agudos o portadores crónicos del virus. Si bien el mecanismo de transmisión no está bien definido, se asocia con la intima relación entre los sujetos infectados y los sujetos susceptibles, en los que se produciría contacto con lesiones de piel o una transferencia inadvertida de secreciones. Se ha descrito la presencia del HBsAg en la saliva, y se plantea que este sea un vehículo en la transmisión horizontal33, es más, se ha identificado el caso de una persona que contrajo la enfermedad por mordedura humana34; es importante evaluar si la preparación del masato, en el que se usa saliva, puede constituir un riesgo real de infección en los susceptibles, dado que son frecuentes las lesiones dentales y de la mucosa oral en los que preparan la bebida.
Cronológicamente la endemia de HVD es un antiguo problema, por la observación de que el virus delta esté implicado en muchos de los brotes epidémicos devastadores de enfermedad íctero-hemorrágica que ocurren encomunidades del norte de Sur América, comprendiendo la hoya Amazónica de Venezuela, Colombia, Brasil y Perú35. Así, muchas veces se diagnostica fiebre amarilla en brotes de hepatitis delta, como las ocurridas en Santa Marta o en Labrea y en la selva alta peruana. La aparición de nuevas técnicas de diagnóstico como la inmunoperoxidasa han permitido aclarar el diagnóstico de hepatitis delta en fallecidos que habían sido diagnosticados previamente con fiebre amarilla35. El presente estudio confirmó la hiperendemicidad de la hepatitis viral B y delta en los pueblos indígenas de la Amazonía Peruana en 1996 lo que los pone en riesgo de extinción; basado en esta realidad se recomendó la vacunación contra la hepatitis B como parte del programa ampliado de inmunizaciones, tal como se hizo en otras áreas hiperendémicas del Perú16, ahora es necesario realizar un estudio que permita evaluar el impacto de esta intervención sanitaria.
AGRADECIMIENTOS
A las comunidades indígenas de la Amazonía peruana y sus dirigentes por su incondicional apoyo, a la Cooperación Española y el COAM por el valioso auspicio al estudio de los problemas de salud de las comunidades indígenas, al personal de las subregiones de salud del MINSA por el apoyo y las facilidades brindadas. En particular a Isolina Valdez, Jenny Ramírez, Miguel Farfán y Roxana Lescano por su apoyo en la ejecución de la investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. World Health Organization. Prevention and control of hepatitis B in the community. Communicable Diseases Series WHO 1996; 1: 17-26. Nº 1. [ Links ]
2. Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures. J Viral Hepat 2004; 11(2): 97-107. [ Links ]
3. Colombo M. Cambieri R, Rumi MG, Ronchi G, Del Ninno E, de Francis R. Long term delta super infection in hepatitis B surface antigen carriers and its relationship to the course of chronic hepatitis. Gastroenterology 1983; 85(2): 235-39. [ Links ]
4. Rizzeto M, Verne G, Recchia S, Borino F, Farci P, Arico S, et al. Chronic hepatitis in carriers of hepatitis B surface antigen, with intrahepatic expression of the delta antigen. An active and progressing disease unresponsive to immunosupressive treatment. Ann Intern Med 1983; 98(4): 437-41. [ Links ]
5. Grigorescu M, Pascu O, Acalovschi M, Radu C. What is the real prevalence of the D virus infection in chronic hepatitis and liver cirrhosis in Romania? Rom J Gastroenterol 2003; 12(3): 179-82. [ Links ]
6. Flodgren E, Bengtsson S, Knutsson M, Strebkova EA, Kidd AH, Alexeyev OA, et al. Recent high incident of fulminant hepatitis in Samara, Russia: molecular analysis of prevailing hepatitis B and D virus strains. J Clin Microbiol 2000; 38(9): 3311-16. [ Links ]
7. Govindarajan S, Chin KP, Redeker AG, Peters RL. Fulminant viral B hepatitis: role of delta agent. Gastroenterology 1984; 86(6): 1417-20. [ Links ]
8. Echevarría JM, Leon P. Epidemiology of viruses causing chronic hepatitis among population from the Amazon Basin and related ecosystems. Cad Saude Publica 2003; 19(6): 1583-91. [ Links ]
9. Viana S, Parana R, Moreira RC, Compri AP, Macedo V. High prevalence of hepatitis B virus and hepatitis D virus in the western Brazilian Amazon. Am J Trop Med Hyg 2005; 73(4): 808-14. [ Links ]
10. Cabezas C. Hepatitis virales B y delta: epidemiología y prevención en el Perú. Rev Peru Med exp Salud Publica 2002; 19(3): 150-61. [ Links ]
11. Segovia G, Galván K, García V, Huamaní L, Gotuzzo E. Prevalencia de marcadores serológicos para hepatitis B y delta e infección intrafamiliar en el valee del río Pampas, Perú. Rev Peru Med Exp Salud Publica 2002; 19(2): 57-62. [ Links ]
12. Indacochea S, Gotuzzo E, de la Fuente J, Philips I, Whignal S. Elevada prevalencia de hepatitis B y delta en el valle interandino de Abancay. Rev Med Hered 1991; 2(4):168-71. [ Links ]
13. Cabezas C, Gotuzzo E, Escamilla J, Philips I. Prevalencia de marcadores serológicos de hepatitis virales A, B y delta en escolares aparentemente sanos de Huanta. Rev Gastroenterol Peru 1994; 14(2): 123-34. [ Links ]
14. Instituto Indigenista Peruano. Mapa etnolingüístico oficial del Perú. Lima: Ministerio de Agricultura; 1994. [ Links ]
15. Colichon a. Distribución seroepidemiológica de la hepatitis B y delta en diferentes comunidades indígenas de la selva peruana. [Tesis Doctoral]. Lima: Facultad de Medicina, Universidad Peruana Cayetano Heredia; 1989. [ Links ]
16. Cabezas C, Echevarria C, Gomez G, Gotuzzo E. Programa piloto de inmunización contra hepatitis viral B, integrado al Programa Ampliado de Inmunizaciones en Abancay (Perú). Rev Gastroenterol Peru 1995; 15(3): 215-22. [ Links ]
17. Cabezas C, Ramos F, Vega M, Suarez M, Romero G, Carrillo C, et al. Impacto del programa de vacunación contra la hepatitis B (HVB) integrado al programa ampliado de inmunizaciones (PAI) en Huanta (Perú), 1994-1997. Rev Gastroenterol Peru 1985; 20(3): 201-12. [ Links ]
18. Murhekar MV, Murhekar KM, Sehgal SC. Hepatitis B vaccination in a hyper-endemic tribal community from India: assessment after three years. Vaccine 2004; 23(3): 399-403. [ Links ]
19. Ni YH, Chang MH, Huang LM, Chen HL, Hsu HY, Chiu tY, et al. Hepatitis B virus infection in children and adolescents in a hyperendemic area: 15 years after mass hepatitis B vaccination. Ann Intern Med 2001; 135(9): 796-800. [ Links ]
20. Perú, Instituto Nacional de Estadística e Informática. IX Censo Nacional de Población y IV de Vivienda. Lima: INEI; 1993 [ Links ]
21. Sjogren MH. Serologic diagnosis of viral hepatitis. Med Clin North Am 1996; 80(5): 929-56. [ Links ]
22. Juliao RO. Prevalencia de antígeno de superficie de hepatitis B en Colombia. Biornédica 1991; 11: 56-60. [ Links ]
23. Manock SR, Kelley PM, Hyams KC, Douce R, Smalligan RD, Watts DM, et al. An outbreak of fulminant hepatitis delta in the Waorani, an indigenous people of the Amazon basin of Ecuador. Am J Trop Med Hyg 2000; 63(3-4): 209-13. [ Links ]
24. Hadler SC, Alcala de Monzon M, Rivero D, Perez M, Bracho A, Fields H. Epidemiology and long-term consequences of hepatitis delta virus infection in the Yucpa Indians of Venezuela. Am J Epidemiol 1992; 136(12): 1507-16. [ Links ]
25. Craig PG, bryan JP, Miller RE, Reyes L, Hakre S, Jaramillo R, et al. The prevalence of hepatitis A, B and C infection among different ethnic groups in Belize. Am J Trop Hyg 1993; 49(4): 430-34. [ Links ]
26. Shapiro CN. Epidemiology of hepatitis B. Pediatr Infect Dis J 1993; 12(5): 433-37. [ Links ]
27. Van Damme P, Vorsters A. Hepatitis B control in Europe by universal vaccination programmes: the situation in 2001. J Med Virl 2002: 67(3): 433-39. [ Links ]
28. Beasley PR, Hwang LY. Overview on the epidemiology of hepatocellular carcinoma. En: Hollinger FB, Lemon SM, Margolis HS. Viral Hepatitis and Liver Disease. Baltimore USA: Williams & Wilkins; 1991. p. 532-35. [ Links ]
29. Machado IV, Carvajal J, Mondolfi A. Seroepidemiological differences of HBV infection between urban areas and Amerindian population in Venezuela. En: Zuckerman AJ (ed). Viral Hepatitis and Liver Disease. New York: Alan R. Liss Inc; 1988. p. 174. [ Links ]
30. Vasquez S, Cabezas C, García B, Torres R, Larrabure G, Suarez M, et al. Prevalencia de portadoras de HBsAG y anti HBs en gestantes residentes den areas de diferente endemimcidad de HVB en departamentos del centro y sur del Perú. Rev Gastroenterol Peru 1999; 19(2): 110-15. [ Links ]
31. Ghoda MK, Shah RA. A prospective epidemiological study to see if mosquito bite could be responsible for spread of hepatitis B virus infection. Trop Gastroenterol 2005; 26(1): 29-30. [ Links ]
32. Lopez A, Miranda P, Tejada E, Fishbein DB. Outbreak of human rabies in Peruvian jungle. Lancet 1992; 339(8790): 408-11. [ Links ]
33. Villarejos VM, Visona KA, Gutierrez A, Rodriguez A. Role of saliva, urine and feces in the transmission of type B hepatitis. N Engl J Med 1974; 291(26): 1375-78. [ Links ]
34. Huy AY, Hung LC, Tse PC, Leung WK, Chan PK, Chan HL. Transmission of hepatitis B by human bite-confirmation by detection of virus in saliva and full genome sequencing. J Clin Virol 2005; 33(3): 254-56. [ Links ]
35. Torres JR, Machado IV. Special aspects of hepatitis B virus and delta virus infection in Latin America. Inf Dis Clinics North Am 1994; 8(1): 13-27. [ Links ]
Correspondencia: César Cabezas Sánchez. Instituto Nacional de Salud. Lima, Perú.
Dirección: Cápac Yupanqui 1400, Lima 11.
Teléfono: (511) 471 9920
Correo electrónico: ccabezas@ins.gob.pe