Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.23 n.3 Lima jul.-set. 2006
ARTÍCULO ORIGINAL
Expresión y sororreactividad de la lipoproteína recombinante de 43-kda de Bartonella bacilliformis.
Carlos Padilla R1; Karen Gallegos V1; Adolfo Marcelo Ñ2; Stella Chenet C1; Christian Baldeviano V1
1 Laboratorio de Biotecnología y Biología Molecular, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
2 Universidad Peruana Cayetano Heredia. Lima, Perú.
Esta investigación es parte del proyecto Desarrollo y evaluación de una prueba rápida para el diagnóstico de la Bartonelosis basada en proteínas recombinantes (Código OGITT 2-01-05-02-110), la cual ha sido financiada por el Instituto Nacional de Salud.
RESUMEN
Objetivo: La lipoproteína de 43-kDa de Bartonella bacilliformis fue obtenida en su forma recombinante (rBbLppB) y purificada para evaluar su serorreactividad mediante ELISA. Materiales y métodos: Los niveles de anticuerpos IgG e IgM humanos en los sueros de pacientes con Bartonelosis confirmada y sueros de otras enfermedades (salmonelosis, Brucelosis y leptospirosis) frente a rBbLppB fueron evaluados por ELISA, se utilizó sueros de personas sanas como controles. Resultados: La sensibilidad y la especificidad del ELISA IgG fueron 70,4% y 90% respectivamente. Asimismo, la sensibilidad y especificidad de ELISA IgM fueron 85,2% y 90% respectivamente. Conclusiones: Estos resultados demuestran que el ELISA usando rBbLppB tiene una buena sensibilidad y especificidad y puede ser considerada como un buen antígeno para el diagnóstico de Bartonelosis causada por B. bacilliformis.
Palabras clave: Bartonella bacilliformis; Diagnóstico; Test de ELISA; Proteínas Recombinantes, Enfermedad de Carrión (fuente: DeCS BIREME).
ABSTRACT
Objective: The Bartonella bacilliformis 43-kDa lipoprotein was obtained from its recombinant form (rBbLppB) and then, purified to evaluate sero-reactivity through ELISA. Material and methods: IgG and IgM humanantibodies levels in the sera of patients with confirmed Bartonellosis and sera of patients with other diseases (salmonellosis, Brucellosis and Leptospirosis), when contrasted with rBbLppB were evaluated by ELISA. Sera from some healthy people were used for controls. Results: Sensitivity and specificity of the IgG ELISA were 70,4% and 90% respectively. Also, sensitivity and specificity of the IgM ELISA were 85,2% and 90%, respectively. Conclusions: These results show that ELISA using rBbLppB is highly sensitive and specific and may be considered a good antigen for the diagnosis of Bartonellosis caused by B. bacilliformis.
Key words: Bartonella bacilliformis; Diagnosis; Enzime-Lynked Immunosorbent Assay; Recombinant proteins, Carrions diseases (source: DeCS BIREME).
INTRODUCCIÓN
La Bartonelosis causada por B. bacilliformis es una enfermedad endémica en diversas localidades de nuestro país1. Esta enfermedad presenta generalmente dos fases, la primera es conocida como la fase anémica, siendo ésta la más crítica, mientras que la segunda fase o etapa crónica se caracteriza por la presencia de verrugas2. El diagnóstico de esta enfermedad presenta varias limitaciones, el frotis (método ampliamente difundido) presenta baja sensibilidad, mientras que el cultivo in vitro toma mucho tiempo (15 a 45 días)3. Una alternativa a este problema es la implementación del diagnóstico serológico mediante el uso de antígenos específicos, por ello, es importante caracterizar la serorreactividad de antígenos de B. bacilliformis.
MATERIALES Y METODOS
CEPAS, INICIADORES Y PLÁSMIDOS
ADN genómico de la cepa JB584 de B. bacilliformis (Dr. Michael Minnick, Universidad de Montana, USA). cepa de E. coli XL1-Blue (Stratagene Corp, La Jolla, CA, USA), genotipo: recA1, endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac[F´proABlacIqZDM15Tn(Tetr)]c. El medio de cultivo usado durante todo el proceso de clonación fue Luria Bertani (1g de triptona, 0,5g de extracto de levadura y 1g de NaCl csp 100 mL). El plasmido de expresion pQE-30 fue adquirido comercialmente de QIAGEN (QIAGEN Inc., Valencia, CA, USA).
Se utilizo un juego de oligonucleotidos disenados por el programa Primer Select version 4.05 de DNASTAR. Los oligonucleotidos usados fueron adquiridos de la compania IDT (Integrated DNA Technologies Inc., Coralville, IA, USA). La secuencia para el diseno de oligonucleotidos se obtuvo del GenBank numero de acceso AF157831 reportado por Padmalayan et al. en el 20004, el analisis de esta secuencia indico que el gen para BbLppB se encuentra en el ORF 401. El juego de nucleotidos utilizado fue KpnI 5´- GAT GGT ACC TAT GAG GGA GAA G - 3´ y Pstl 5´- AAA CTG CAG AAA CCG AGT CAG - 3´.
AMPLIFICACION DE LA SECUENCIA QUE CODIFICA LA LIPOPROTEINA DE B. Bacilliformis (BbLppB) POR REACCION EN CADENA DE LA POLIMERASA (PCR)
Las reacciones de PCR se realizaron en tubos para PCR de polipropileno de 200 µL de capacidad. El volumen de reaccion fue de 50 µL conteniendo: 50 ng de ADN genomico, 5 µL de buffer de amplificacion (500 mM KCl; 100 mM TrisCl pH 8,3; 1% gelatina), oligonucleotidos a una concentracion de 1 µM, 1 U por tubo de reaccion de AmpliTaq Gold® DNA polimerasa (Perkin Elmer, PE Applied Biosystems, Forter City, CA, USA), 0,2 mM de mezcla de nucleotidos trifosfatos (dNTPs) (Perkin Elmer, PE Applied Biosystems, USA), MgCl2 a una concentracion final de 2,5 mM y agua para PCR (libre de ADNasas y ARNasas). El PCR se llevo a cabo usando un termociclador Perkin Elmer modelo 9700. Las condiciones de amplificacion fueron: 95 ºC por 10 minutos para activar la enzima, 30 ciclos de amplificacion de 95 ºC por 30 segundos, 51 ºC por 30 segundos, 72 ºC por 1 minuto 30 segundos y una extension final de 72 ºC por 10 minutos.
Los productos de amplificacion fueron verificados realizando una electroforesis en gel de agarosa ultra pura (Biorad) al 1% en buffer de corrida TAE 1X diluido a partir de buffer TAE 50X (24,2g de Tris base disueltos en 50 mL de agua esteril, agregando luego 5,71 mL de acido acetico glacial y 10 mL de EDTA 0,5M pH 8,0. Se completo hasta un volumen de 100 mL con agua esteril.) a 100 voltios por 40 minutos. El gel fue tenido con una solucion de bromuro de etidio y la visualizacion se hizo en un transiluminador de luz ultravioleta.
Los productos de PCR obtenidos de la amplificacion fueron purificados a partir de geles de agarosa de bajo punto de fusion (Bio-Rad Laboratories, Inc., Hercules, CA, USA) al 1%. El producto de amplificacion de interes fue cortado del gel y colocado en un tubo nuevo esteril de 1,5 mL (Eppendorf AG, Hamburg, Germany). El fragmento fue purificado del gel usando el kit comercial Wizard PCR Preps DNA Purification Systems (Promega).
CUANTIFICACION DE ADN POR COMPARACION DE INTENSIDAD DE BANDAS
La muestra de ADN proveniente de los productos de PCR purificados fue cuantificada mediante la comparacion de la intensidad de bandas con un marcador de peso molecular comercial. Para tal efecto, un volumen de 5µL de ADN purificado fue resuelto en gel de agarosa al 1%, junto con diferentes concentraciones del marcador comercial ΦX174 cortado con HaeIII, donde cada una de las bandas represento un valor de concentracion de ADN en ng. La concentracion de ADN obtenida fue de 10ng/µL.
REACCION DE LIGACION Y TRANSFORMACION DE CELULAS DE E. coli XL1-Blue
Luego de la cuantificacion se procedio a digerir los productos purificados y el plasmido con las enzimas de restricccion KpnI y PstI. Los productos de amplificacion de PCR fueron ligados en marco de lectura al vector ya digerido pQE-30 KpnI/Pstl. La reaccion de ligacion se llevo a cabo en un volumen final de 10 µL, considerando los siguientes componentes: 1X de buffer de ligacion (50 mM Tris-HCl pH 7,5, 7 mM de MgCl2 y 1 mM DTT), 1 µL rATP, 3,5 µL pQE KpnI/PstI, 3,5 µL de LppB KpnI/ PstI y 2 U de ligasa T4 a 4 ºC toda la noche.
Para la transformacion de celulas de E. coli XL-1 Blue se utilizo un volumen de 10 µL de la reaccion de ligacion y se mezclo con un volumen de 100 µL de bacterias competentes. La transformacion se llevo a cabo por el metodo de cloruro de calcio.
Para la identificacion de clonas recombinantes se realizo un mapeo con enzimas de restriccion, secuenciamiento y expresion de la proteina recombinante.
EXPRESION Y PURIFICACION DE LA LIPOPROTEINA RECOMBINANTE DE B. bacilliformis (rBbLppB) EN E. coli
Las condiciones de expresion de la rBbLppB fueron optimizadas a pequena escala tomando en cuenta: la OD600 del cultivo bacteriano, la concentracion de IPTG y el tiempo de induccion a los cuales se obtuvo una mayor cantidad de proteina.
Se utilizaron las condiciones optimas de expresion a pequena escala para iniciar la produccion a gran escala y se utilizo el protocolo "Batch purification of 6xHis-tagged proteins from E. coli under native conditions" del manual QIAexpressionist para la posterior purificacion. Para ello, se inocularon 50 mL de cultivo bacteriano crecido durante toda la noche en 500 mL de LB con ampicilina. El cultivo fue incubado por una hora y media a 37 ºC hasta alcanzar un OD600 = 0,6. La expresion de la proteina recombinante fue inducida anadiendo 1 mM de IPTG por dos horas. Luego, las celulas fueron recuperadas por centrifugacion, el sobrenadante fue descartado y el pellet fue resupendido en 10 mL de buffer de lisis (50 mM NaH2PO4, 300 mM NaCl, 10 mM imidazol a un pH de 8). El cultivo fue lisado por tres ciclos de frio y calor (30 min a 80 oC por 15 min a 37 oC).
Luego, se centrifugo a 4400 rpm. por 15 minutos y se recupero el sobrenadante. Se agrego 2,5 mL de resina y se incubo por una hora a 4 ºC con movimiento constante. La mezcla del lisado con la resina Ni-NTA agarosa se paso por una columna cromatografica y se lavo dos veces con 10 mL de buffer de lavado (50 mM NaH2PO4, 300 mM NaCl, 10 mM imidazol a un pH de 8). Posteriormente, se eluyo la proteina cuatro veces con 500 µL de buffer de elucion y se analizo en geles de poliacrilamida al 12%. Finalmente se procedio a la cuantificacion de la proteina por el metodo de Bradford obteniendose una cantidad entre 0,32 a 0,4 mg por litro.
EVALUACION DE LA SERORREACTIVIDAD DE rBbLppB
Para la evaluacion de la serorreactividad se realizo un ELISA (ensayo de inmunoabsorcion ligado a enzima) indirecto para la deteccion de anticuerpos IgG e IgM contra rBbLppB evaluando tres clases de sueros obtenidos de la seroteca del Instituto Nacional de Salud:
* Cuarenta sueros de personas sanas, las cuales no tienen historia de Bartonelosis, no viven, ni han viajado a zonas endemicas.
* Veintisiete sueros de pacientes con Bartonelosis aguda o cronica confirmada mediante PCR, frotis positivo o cultivo microbiologico. Estos pacientes provienen de zonas endemicas y no presentan complicaciones infecciosas asociadas.
* Diez sueros de pacientes con otras infecciones (salmonelosis, leptospirosis, Brucelosis).
La estandarizacion del ELISA se llevo a cabo usando dos sueros positivos y dos sueros negativos. Se encontro que las condiciones optimas para el ensayo fueron: 100 ng del antigeno por pocillo, dilucion de suero 1/200 y dilucion de conjugado 1/1000 y 1/500, para anti-IgG y anti-IgM respectivamente.
Se estableció el punto de corte tanto para IgG como IgM usando el promedio de los títulos obtenidos de los 41 sueros de personas sanas más tres veces la desviación estándar, tomando en cuenta este valor, se consideró a los sueros de los pacientes como positivos o negativos. Luego se calculó la sensibilidad y la especificidad con un intervalo de confianza de 95% con el paquete estadístico Epidat v.3,1.
RESULTADOS
AMPLIFICACIÓN EXPRESIÓN Y PURIFICACIÓN DE rBbLppB
Los oligonucleótidos amplificaron sólo la porción que codifica a la proteína madura correspondiente a 1099 pb. Se efectuó una selección de las colonias mediante aislamiento del ADN plasmídico según el procedimiento usado por Sambrook et al., 1989 con algunas modificaciones.
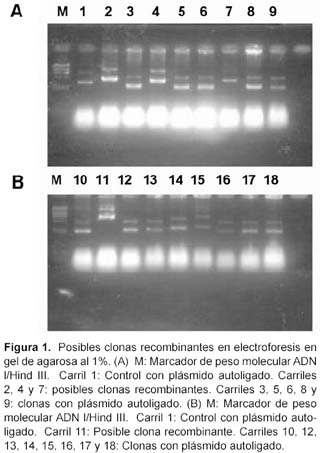
En la figura 1 se muestran los plásmidos aislados de los cuales en los carriles 2, 4, 7, y 11 se observan plásmidos de mayor tamaño comparados con los autoligados y coinciden con el tamaño esperado de 4,4 kb. Las posibles clonas recombinantes fueron luego evaluadas con cortes con las enzimas de restricción respectivas, de las cuales sólo una liberó el inserto. El posterior secuenciamiento de esta clona corroboró la secuencia que coincide con la reportada por Padmalayan4.
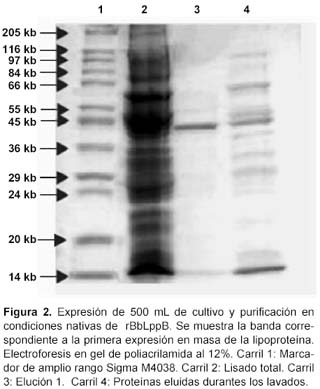
De los cultivos a escala de 500 mL se obtuvo una banda de 43 kDa, la cual corresponde al peso de rBbLppB. En la figura 2, en el carril 3 se observa la rBbLppB purificada bajo condiciones nativas con un peso de 43 kDa.
SERORREACTIVIDAD FRENTE A rBbLppB
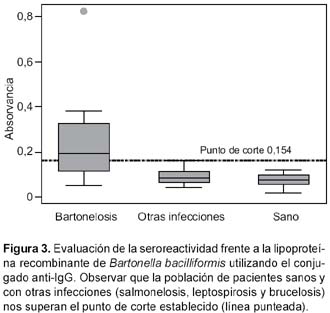
Los títulos de anticuerpos IgG de los individuos normales (control negativo) variaron entre 0,018 y 0,117; mientras que para individuos bartonelósicos variaron entre 0,0435 y 0,824. Se estableció el punto de corte en 0,154 (Figura 3). La sensibilidad fue de 70,4% (IC95%: 51,3-89,5) y la especificidad fue de 100% (IC95%: 98,5- 100%).
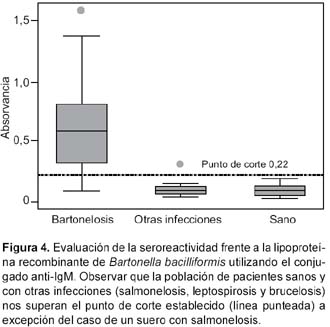
Los títulos de anticuerpos IgM de los individuos normales (control negativo) variaron entre 0,033 y 0,185; mientras que para individuos bartonelósicos variaron entre 0,095 y 1,587. Se obtuvo el valor de la línea de corte utilizando el promedio de los títulos de los 40 sueros negativos más tres veces la desviación estándar, siendo este valor igual a 0,22. Con los títulos obtenidos se calculó la sensibilidad y la especificidad de la prueba. El valor de sensibilidad fue de 85,2% (IC96: 69,9-100%) y el de especificidad fue de 100% (IC95%: 98,5-100%) (Figura 4).
DISCUSIÓN
Los problemas existentes en el diagnóstico de la Bartonelosis acarrean una detección subóptima de pacientes en fase aguda o crónica, lo cual genera una demora en el tratamiento de casos, especialmente en fase aguda, e incrementa el riesgo de mortalidad y tasa de transmisión de esta enfermedad.
La identificación de antígenos inmunogénicos podría ser útil para el desarrollo de herramientas de diagnóstico para la Bartonelosis4. Debido a esto se clonó, expresó, purificó y evaluó la serorreactividad del antígeno de 43-KDa de Bartonella bacilliformis (rBbLppB) frente a sueros de pacientes con Bartonelosis y otras enfermedades en el formato ELISA.
Ensayos de inmunoabsorción ligado a enzima (ELISA) que usan proteínas recombinantes para diagnóstico de otras enfermedades infecciosas ya han sido descritos. Muchos de estos ensayos con proteínas recombinantes se desarrollan con altos niveles de sensibilidad y especificidad o funcionan mucho mejor que inmunoensayos que utilizan antígeno total5. Las proteínas recombinantes pueden ser ventajosas en ELISA bacterianos porque son antígenos definidos que contienen potencialmente menos epítopes que preparaciones de antígenos totales y por lo tanto la reacción cruzada es menor6.
La evaluación de los sueros en formato ELISA utilizando rBbLppB dio como resultado un valor de sensibilidad de 70,4 % para IgG y de 85,2% para IgM, lo cual resulta coherente con lo reportado por Patrucco, quien demostró que en las cuatro primeras semanas de la fase aguda de la Bartonelosis los niveles de anticuerpos IgM se elevan, mientras que los niveles de IgG e IgA se mantienen normales. Los niveles de IgG se elevan aproximadamente luego de la cuarta semana. En la fase eruptiva existe un incremento significativo pero no muy marcado de los niveles de IgA, IgG e IgM7. Esto concuerda con los resultados obtenidos, ya que de los 27 sueros positivos evaluados 23 pertenecen a fase aguda y presentan títulos más altos al evaluarlos con conjugado anti-IgM, que con anti-IgG. Sin embargo, los tres sueros de pacientes crónicos presentaron títulos elevados de IgM, lo cual nos indica que el ELISA IgM rBbLppB no discrimina entre las dos fases de la enfermedad.
También, se ha evaluado la reactividad serológica de la flagelina recombinante (rFlaA) de Bartonella bacilliformis por ELISA y Western-Blot obteniendo resultados satisfactorios. La reactividad encontrada para IgG en ELISA nos indica que podría ser un antígeno sensible identificando 11/20 (70%) sueros de pacientes. Se ha observado también que al evaluar la rFlaA en formato ELISA existe reactividad cruzada con sueros de pacientes con Salmonella y Brucella8. Sin embargo, los resultados de sensibilidad y especificidad obtenidos con la rBbLppB fueron mejores, esto debido a que la flagelina de B. bacilliformis posee mucha similaridad con otras flagelinas y es posible que comparta epítopes con otras bacterias.
Los datos reportados en la literatura indican reacciones cruzadas entre sueros de pacientes con B. bacilliformis y sueros de pacientes con C. psittaci y C. burnettii9. También se ha detectado reacción cruzada con sueros de Brucella10. Sin embargo, en los ensayos realizados con rBbLppB no se encontró reacción cruzada con sueros de Brucella, pero sí con un suero de Salmonella.
El diagnóstico por inmunoblot, utilizando antígenos preparados por sonicación (bandas proteicas de 17 y 18 kDa) tiene 70% de sensibilidad frente a casos agudos de Bartonelosis y 94% de sensibilidad frente a casos crónicos11. Bb65, por su parte, presenta 100% de sensibilidad a anticuerpos IgG con sueros de pacientes agudos y 70% de sensibilidad con sueros de pacientes en fase verrucosa12. Por otro lado, la prueba de anticuerpos fluorescentes (IFA) para B. bacilliformis tiene 82% de sensibilidad con muestras de pacientes confirmados en fase aguda13. Estos reportes nos indican que la evaluación realizada con rBbLppB en formato ELISA tiene una muy buena sensibilidad, incluso mayor a la obtenida por IFA y por tanto podría también ser utilizada como una herramienta de diagnóstico para B. bacilliformis.
Cabe resaltar, que el estudio realizado es un estudio preliminar por lo que debido a los datos obtenidos resultaría necesario evaluar un mayor número de casos para la posterior validación de la prueba utilizando rBbLppB, incluyendo pacientes en la fase aguda, fase verrucosa y en portadores crónicos de B. bacilliformis. Sin embargo, de ser considerado éste un buen método serológico de detección podría ser útil para dar un diagnóstico presuntivo en menos tiempo del que usualmente se requiere, claro que éste sólo serviría como complemento de uno de los métodos ya validados para la enfermedad.
AGRADECIMIENTOS
Los autores agradecen a la Tec. Lab. Sra. Juana Choque Portilla por el apoyo brindado en estudio. Asimismo agradecemos a la Blga. Karina Jaramillo por proporcionarnos parte de los sueros utilizados en este estudio y al Dr. Michael Minnick de la Universidad de Montana, USA por la donación del ADN genómico de la cepa JB584 de B. bacilliformis.
La proteína recombinante lipoproteína de Bartonella bacilliformis de 43 KDa (rBbLppB) desarrollada en este estudio es propiedad de Instituto Nacional de Salud.
REFERENCIAS BIBLIOGRAFICAS
1. Pachas P. Epidemiología de la bartonelosis en el Perú. Lima: Oficina General de Epidemiología/Instituto Nacional de Salud; 2001. Módulos técnicos. Serie de documentos monográficos Nº 13. [ Links ]
2. Maguiña C, Gotuzzo E. Bartonellosis: new and old. Infect Dis Clin North Am 2000, 14(1): 1-22. [ Links ]
3. Anderson BE, neuman MA. Bartonella spp as emerging human pathogens. Clin Microbiol Rev 1997; 10(2): 203-19. [ Links ]
4. Padmalayam I, Kelly T, Baumstark B, Massung R. Molecular cloning, sequencing, expression and characterization of an immunogenic 43-kilodalton lipoprotein of Bartonella bacilliformis that has homology to NlpD/LppB. Infec Immun 2000; 68(9): 4972-79. [ Links ]
5. Kaltenboeck B, Heard D, DeGraves FJ, Schmeer N. Use of synthetic antigens improves detection by enzymelinked immunosorbent assay of antibodies against abortigenic Chlamydia psittaci in ruminants. J Clin Microbiol 1997; 35(9): 2293-98. [ Links ]
6. Livingston RS, Riley LK, Hook RR, Besch-Williford CL, Franklin CL. Cloning and expression of an immunogenic membrane-associated protein of Helicobacter hepaticus for use in an enzyme-linked immunosorbent assay. Clin Diagn Lab Immunol 1999; 6(5): 745–750. [ Links ]
7. Patrucco R. Estudio de los parámetros inmunológicos en pacientes portadores de la enfermedad de Carrión. Diagnóstico 1983; 12(4): 138-44. [ Links ]
8. Gallegos K, Baldeviano C, Marcelo A, Padilla C. Clonamiento, expresión y seroreactividad del antígeno recombinante flagelina de Bartonella bacilliformis. Rev Peru Med Exp Salud Publica 2005; 22(1): 39-46. [ Links ]
9. Knobloch J, Bialek R, Muller G, Asmus P. Common surface epitope for Bartonella bacilliformis and Chlamydia psittaci. Am J Trop Med Hyg 1988; 39(5): 427-33. [ Links ]
10. Mallqui V, Speelmon EC, Verastegui M, Maguiña-Vargas C, Pinell-Salles P, Lavarello R, et al. Sonicated diagnostic immunoblot for bartonellosis. Clin Diagn Lab Immunol 2000, 7(1):1-5. [ Links ]
11. Knobloch J. Analysis and preparation of Bartonella bacilliformis antigens. Am J Trop Med Hyg 1988; 39(2):173-78. [ Links ]
12. Knobloch J, Schreiber M. Bb65, a major immunoreactive protein of Bartonella bacilliformis. Am J Trop Med Hyg 1990; 43(4): 373-79. [ Links ]
13. Chamberlin J, Laughlin L, Gordon S, Romero S, Solorzano N, Regnery RL. Serodiagnosis of Bartonella bacilliformis infection by indirect fluorescence antibody assay: test development and application to a population in an area of bartonellosis endemicity. J Clin Microbiol 2000; 38(11): 4269-71. [ Links ]
Correspondencia: Blgo. Carlos P. Padilla Rojas. Laboratorio de Biotecnología y Biología Molecular. Centro Nacional de Salud Pública. Instituto Nacional de Salud. Lima, Perú.
Dirección: Calle Cápac Yupanqui 1400, Jesús Maria, Lima.
Teléfono: (511) 4719920 anexo 129.
Correo electrónico: cpadilla@ins.gob.pe; cpadillar@hotmail.com















