Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.23 n.4 Lima oct./dic. 2006
ARTÍCULO ORIGINAL
Determinación de la resistencia a insecticidas en Aedes aegypti, Anopheles albimanus y Lutzomyia peruensis procedentes del Norte Peruano
Determination of resistance to insecticides in Aedes aegypti, Anopheles albimanus y Lutzomyia peruensis in Northern Peru
Franklin Vargas V1; Ofelia Córdova P2; Arturo Alvarado A3
1 Instituto de Investigación en Microbiología y Parasitología Tropical, Universidad Nacional de Trujillo. Trujillo, Perú.
2 Universidad Privada Antenor Orrego. Trujillo, Perú.
3 Centro de Investigación y Capacitación Epidemiológica (CICE) Sullana. Piura, Perú.
RESUMEN
Objetivo: Determinar los niveles de resistencia a temephos y deltametrina en cinco poblaciones naturales de Aedes aegypti del norte de Perú (La Libertad y Piura), dos cepas de Anopheles albimanus (Sullana y Tambogrande) y una cepa de Lutzomyía spp (Santiago de Chuco, La Libertad). Materiales y métodos: Se realizaron bioensayos en larvas y adultos siguiendo la metodología de la Organización Mundial de la Salud. La visualización de bandas de B-esterasas se hizo por electroforesis en gel de poliacrilamida en larvas de cuarto estadio. Resultados: Las poblaciones de Ae. aegypti de Sullana y Tambogrande (Piura) presentaron factores de resistencia (FR) a temephos de 6,84 con un KDT50 = 160,42 minutos y 70% de mortalidad a las 24 horas; en tanto en la población de Tambogrande se observó un FR de 5,60, KDT50 = 107,20 y 80% de mortalidad, a diferencia de las cepas de La Esperanza, El Porvenir y Florencia de Mora (La Libertad) que fueron susceptibles. Se identificó resistencia en las poblaciones de Ae. aegypti y A. albimanus procedentes de Piura (Tambogrande y Sullana) para deltametrina, a diferencia de las poblaciones de Ae.aegypti y Lutzomyia spp de La Libertad que fueron susceptibles. Se identificó la esterasa B2 con un Rf de 0,23 en la población de Ae. aegypti de Sullana. Conclusiones: Dada la susceptibilidad de la población de La Libertad al insecticida temephos, puede seguir siendo usado en el control vectorial de Aedes aegypti; por lo contrario, dada la resistencia observada en poblaciones de Anopheles en Sullana y Tambogrande se debe evaluar el uso de la deltametrina en estas poblaciones. Finalmente, la población de Lutzomyia spp. no presentó resistencia a deltametrina.
Palabras clave: Aedes aegypti; Anopheles albimanus; Lutzomyia peruensis; Control vectorial; Resistencia a insecticidas; Perú.
ABSTRACT
Objective: To determine resistance levels to temephos and deltamethrin in native populations of the following insects: Aedes aegypti (La Libertad and Piura), Anopheles albimanus strains (Sullana and Tambogrande), and Lutzomyia spp. (Santiago de Chuco) in Northern Peru. Materials and methods: Bioassays in larvae and adults were performed following the methodology designed by the World Health Organization. B-estearase band visualization in fourth-stage larvae was performed using electrophoresis in a polyacrylamide gel. Results: A. aegypti from Sullana had a 6,84 resistance factor (RF) to temephos, a KDT50 = 107,20 minutes and 70% mortality rate at 24 hours; while the Tambogrande mosquito population had a 5,50 RF, a KDT50 = 98,35, and 80% mortality rate at 24 hours. These results were different from what was found in La Esperanza, El Porvenir, and Tambo de Mora mosquito strains, which were reported as susceptible to temephos. Deltamethrin resistance was reported in A. aegypti and A. albimanus from Piura (Tambogrande and Sullana), differently from La Libertad A. aegypti and Lutzomyia mosquito populations, which were reported as susceptible. B2 estearase was identified with a 0,23 RF in A. aegypti from Sullana. Conclusions: Given that mosquitoes from La Libertad are susceptible to temephos, this agent may still be used for Aedes aegypti vector control; on the contrary, considering observed resistance in Anopheles populations in Sullana and Tambogrande, the use of deltamethrin must be assessed in these areas. Finally, Lutzomyia spp. populations did not show deltamethrin resistance.
Key words: Aedes aegypti; Anopheles albimanus; Lutzomyia peruensis; Vector control; Insecticide resistance; Peru.
INTRODUCCIÓN
Las enfermedades metaxénicas constituyen uno de los principales problemas de salud en el Perú, que afectan a grandes sectores de la población, generalmente las más pobres y de menos acceso a los servicios de salud. Dentro de estas enfermedades se destacan la malaria, el dengue, la fiebre amarilla, la Bartonelosis, la Leishmaniosis, entre otras, las cuales generan un gran impacto sobre la salud pública nacional así como una gran pérdida económica1-4.
Aunque las opciones para el control de estas infecciones están disponibles, los problemas de resistencia a drogas (por ejemplo en la malaria5) la falta de disponibilidad o el costo de una vacuna (por ejemplo en el dengue6), hacen del control vectorial una opción importante2. Sin embargo, la habilidad de los insectos en desarrollar resistencia a los insecticidas ha sido hoy en día el mayor obstáculo para su control7.
En 1955 la Organización Mundial de Salud (OMS) propuso la erradicación global de la malaria, una de las enfermedades más prevalentes transmitidas por vectores, haciendo uso de rociados residuales intradomiciliarios de Dicloro-Difenil-Tricloroetano (DDT), pero los problemas de resistencia continuaron aun con la rotación hacia nuevos insecticidas como los organofosforados, carbamatos y piretroides8.
La resistencia a los insecticidas tuvo mayor incremento e impacto en los últimos 60 años, luego del descubrimiento y uso extensivo de los insecticidas orgánicos sintéticos. Actualmente, la resistencia se explica sobre la base de los factores multidimensionales dependientes de la ecología, fisiología, bioquímica y genética de los vectores, que varía con la especie, las poblaciones y la localización geográfica7.
Dentro del gran número de especies de mosquitos resistentes a la acción de los insecticidas se encuentran el Aedes aegypti, Anopheles albimanus y Lutzomyia peruensis que desempeñan un importante papel en la transmisión de enfermedades vírales, parasitarias y bacteriana, respectivamente2,3,8. En los últimos 15 a 20 años se han utilizado insecticidas organofosforados, incluido el temephos granulado para su uso en recipientes de agua doméstica. Actualmente, los insecticidas piretroides son los más utilizados para el control de adultos de Aedes aegypti, sobre todo en casos de emergencia.
La resistencia se ha desarrollado en cada uno de los grupos de insecticidas, también en el control biológico de vectores mediante microbios y en los reguladores del desarrollo de los insectos. Se espera que en donde la resistencia no ha contribuido a la emergencia de enfermedades, se amenace el control de la enfermedad9. Sin embargo, un cuidadoso análisis de la información acerca de resistencia de vectores (por ejemplo la base de datos de la OMS y los registros de los programas de enfermedades) muestran que el efecto de la resistencia en los esfuerzos del control son aún desconocidos.
La importancia creciente del problema de la resistencia fisiológica a los insecticidas hace recomendable que se realicen cuidadosas mediciones de la susceptibilidad antes de iniciar su aplicación en gran escala, y periódicamente después y durante todo el desarrollo del programa de control vectorial, por lo que el estudio de la resistencia no debe considerarse solamente como una inquietud científica, sino como un problema operacional10.
Muchos reportes sobre resistencia de vectores, están basados en un punto geográfico de un país, además de ser información no actualizada por años o décadas. Por otra parte, el desconocimiento que se tiene en nuestro país referente al comportamiento de la susceptibilidad de las poblaciones de insectos vectores, pone en riesgo los programas de intervención que aún dependen del uso de insecticidas, facilitando con su uso indiscriminado que se manifieste prontamente el desarrollo de la resistencia contra los insecticidas que aún son empleados7.
En la actualidad las investigaciones se están orientando hacia el estudio de los mecanismos moleculares y bioquímicos de la resistencia y su manejo racional, con la visión de controlar el desarrollo y la diseminación de poblaciones de vectores resistentes10.
Para el control del Ae. aegypti, el Ministerio de Salud del Perú ha hecho uso del larvicida organofosforado temephos6. La reducción de los criaderos y los programas de saneamiento ambiental son importantes dentro de las estrategias trazadas2; sin embargo, no han sido suficientes para el control de las poblaciones de este vector y en el año 2000 este insecticida fue usado con alta intensidad cuando se presentaron los primeros casos de dengue en los distritos de la provincia de Trujillo, con un índice aédico de 23%12.
La resistencia del Ae. aegypti al temephos y al malatión se ha difundido por todo el Caribe y en algunos países de América Central y América del Sur, además de la resistencia a fenitrotión desarrollada en otros países13. Las localidades seleccionadas para esta investigación están registradas como zonas de altos índices de infestación por Aedes aegypti, Anopheles albimanus y Lutzomyía peruensis y presencia de casos de enfermos.
La reducción de los criaderos y los programas de saneamiento ambiental son importantes dentro de las estrategias trazadas, sin embargo, no han sido suficientes para el control de las poblaciones de estos vectores. Debido a esto y a la importancia del uso de insecticidas en los programas de control de estos importantes vectores, este trabajo se propone determinar los niveles de resistencia al temephos como larvicida y deltametrina como adulticida, ampliamente utilizados en estas zonas como parte de un control efectivo de estas especies en el Perú14.
MATERIALES Y MÉTODOS
POBLACIÓN DE ESTUDIO
Se usaron cinco cepas de A. aegypti procedentes de Sullana, Tambogrande (Piura), La Esperanza, El Porvenir y Florencia de Mora (La Libertad) y una cepa Rockefeller (cepa de referencia de A. aegypti susceptible suministrada por el Instituto Pedro Kouri-La Habana-Cuba); cepas de Anopheles albimanus proveniente de Sullana y Tambogrande (Piura) y la cepa de Lutzomyia peruensis proveniente de Santiago de Chuco (La Libertad).
Las colonias de Aedes, Anopheles y Lutzomyia se establecieron y mantuvieron en el insectario del Instituto de Investigación en Microbiología y Parasitología Tropical de la UNT (La Libertad, Perú), con temperatura de 26 ± 2 ºC y humedad relativa de 65 ± 5%.
INSECTICIDAS
Se emplearon las dosis recomendadas por la OMS: temephos 0,02 ppm (mg/L) y deltametrina 0,025%. Los papeles impregnados con deltametrina al 0,025% procedían del Centro de Investigación de Paludismo, Tapachula, Chiapas-México proporcionados por el Dr. Américo Rodríguez.
BIOENSAYOS DE LARVAS
Los bioensayos se realizaron siguiendo la metodología de la OMS15. Se utilizaron larvas de tercer o cuarto estadio temprano de cada población de insecto vector incluyendo la cepa susceptible de Rockefeller Se emplearon cinco réplicas de cada concentración del insecticida (à de 20 larvas por réplica). Todas las soluciones de insecticidas se ajustaron a un volumen final de 1 mL con acetona, concentración de acetona que no causó mortalidad en los controles. La lectura de la mortalidad se realizó a las 24 horas y los resultados se procesaron en el laboratorio de parasitología del Instituto de Investigación en Microbiología y Parasitología Tropical de la Universidad Nacional de Trujillo, mediante el programa probit-log para obtener la CL50 y CL95.
BIOENSAYOS DE ADULTOS
Las hembras de los insectos vectores en estudio fueron expuestas a papeles impregnados con los insecticidas temephos 0,02 ppm (mg/L) y deltametrina 0,025%. Los papeles fueron impregnados con deltametrina al 0,025%, a dosis diagnósticas sugeridas por la OMS15, y evaluados a través de cinco réplicas. Los papeles impregnados se colocaron en los cilindros plásticos de exposición (kits de la OMS) a 23+/-2 ºC y 70% de humedad relativa, durante 60 minutos, el número de mosquitos derribados fue registrado a los 10, 20, 30, 50 y 60 minutos, la lectura de mortalidad se realizó a las 24 horas. Se consideró de 100 a 98% de mortalidad como indicador de susceptibilidad, de 97 a 80% indica que se debe realizar confirmación de resistencia, menos de 80% de mortalidad señala resistencia15. Se realizaron cinco réplicas (17-26 mosquitos/ réplica) para cada población. Los controles fueron papeles impregnados con silicona. Los resultados fueron analizados mediante el programa Probit - log16 para obtener las dosis letales media y de 95 (KDT50 y KDT95) cuyos valores indican el tiempo en que son derribados el 50 y 95% del número de mosquitos expuestos al insecticida deltametrina en base a los criterios de resistencia a insecticidas según la OMS15.
Para la determinación del factor de resistencia (FR) se utiliza la fórmula de Bisset et al.17 FR= CL50 cepa a evaluar / CL50 cepa susceptible de referencia; FR< 5 susceptible; FR > 5 resistente.
ELECTROFORESIS EN GEL DE POLIACRILAMIDA (PAGE)
Se determinó la actividad de esterasas en larvas de tercer estadio o cuarto temprano, en geles de poliacrilamida (PAGE) de acuerdo con el método estandarizado para Ae. aegypti. y Anopheles por Rodríguez et al.18, Previo a la corrida electroforética se determinó la actividad enzimática de las esterasas y se seleccionaron las muestras con mayor actividad17. Las enzimas fueron identificadas por sus valores de Rf7. Un estimado de la frecuencia de los mecanismos de esterasas fue calculado a partir del número de individuos susceptibles para cada ensayo, asumiendo que la población se encontraba en equilibrio de Hardy-Weinberg18.
RESULTADOS
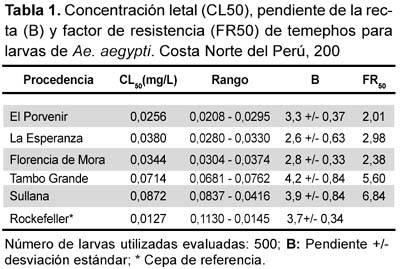
En la tabla 1 se muestran los rangos de las concentraciones letales (CL50), la pendiente de la línea de regresión probit-log, y el factor de resistencia (FR50) para el insecticida con larvas de poblaciones naturales de Ae. aegypti, colectadas en los distritos El Porvenir, La Esperanza, Florencia de Mora, Sullana y Tambogrande, y la cepa susceptible de referencia de Ae. aegypti (Rockefeller). Según la determinación de la susceptibilidad o resistencia al insecticida organofosforado temephos, resultaron susceptibles (FR50 < 5) las cepas del El Porvenir, La Esperanza, Florencia de Mora y Tambogrande. Los individuos de la población de Sullana mostraron moderados niveles de resistencia a temephos.
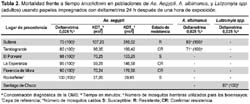
Los bioensayos de resistencia en adultos se observan en la tabla 2. Asimismo, se muestra que la población de Sullana presentó el mayor KDT50 (107,20 minutos) en tanto que la población de Tambogrande presentó el menor KDT50 (98,35 minutos). Los porcentajes de mortalidad indican resistencia para las poblaciones de Sullana y Tambogrande, y susceptibilidad para las poblaciones de Florencia de Mora, El Porvenir y La Esperanza, con porcentajes de mortalidad de 90, 98 y 95%; respectivamente, a una concentración de deltametrina de 0,025%.
Según la tabla 2, los porcentajes de mortalidad hallados nos indican resistencia para la población de Anopheles de Sullana con 71%, mediana resistencia para la población de Tambogrande con una mortalidad de 83%, y susceptibilidad para la población de L. peruensis de Santiago de Chuco con 97%.
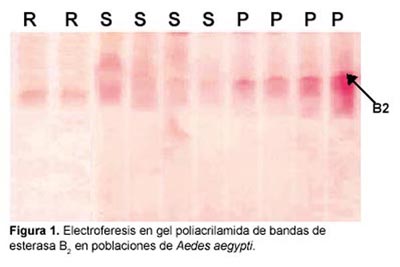
En la figura 1 se muestra la formación de bandas de esterasas en un corrido electroforético en geles de poliacrilamida (PAGE) de las poblaciones de A. aegypti de las diferentes área de estudio. Tal como se puede observar la población de El Porvenir, presenta una bandas electroforéticas identificadas como esterasa B2 con un Rf de 0,23 y relacionada con la resistencia a los organosfosforados.
DISCUSIÓN
En el presente trabajo se determinaron los niveles de resistencia a temephos en tres distritos de la provincia de Trujillo (La Esperanza, El Porvenir y Florencia de Mora) y uno de Piura (Sullana). El nivel de susceptibilidad o resistencia se demostró a través de los valores del FR50 que presentaron las poblaciones estudiadas.
Durante los últimos años el control del vector Aedes aegypti se ha estado realizando con el insecticida organofosforado temephos, larvicida utilizado por el Ministerio de Salud en la provincia de Trujillo12 y Lima19. El uso constante de este insecticida sugiere la aparición de poblaciones resistentes, tal como se reporta en Cuba, Venezuela y Brasil, que presentan factores de resistencia 89,9, 11,1 y 15,5 respectivamente18,20.
Los resultados obtenidos en los bioensayos en larvas (Tabla 1) indican valores de factores de resistencia de 2,01, 2,98, 2,38, 6,84 y 5,60 para las poblaciones de El Porvenir, La Esperanza, Florencia de Mora, Tambogrande y Sullana; estos resultados son similares al hallado previamente en estas zonas 1,9321. La explicación de estos altos niveles de resistencia a temephos en poblaciones de Venezuela y Cuba con un FR50 de 11,1 y FR50 de 5,9, respectivamente; o de Brasil en un FR50 de 6,3 X, es que a partir de 1977-1980 apareció la epidemia del dengue 1 en el Caribe y en 1981 la gran epidemia de la fiebre del dengue en Cuba, propiciando a la realización de campañas de erradicación del vector con insecticidas, y por consiguiente a los primeros casos de resistencia13,22.
Este mismo fenómeno se estaría observando en el Perú, desde 1990 en que aparece el primer caso de dengue 1 en Loreto, hasta 1999 - 2000 con grandes número de casos de dengue en Tumbes, Piura y posteriormente La Libertad, en donde también se está utilizando el temephos para el control de A aegypti2,12. La susceptibilidad de poblaciones de La Libertad asociada con la baja presión de selección ejercida en esa región y el extensivo uso de temephos en las poblaciones de Sullana conllevaría a la resistencia observada en países como Cuba18.
El KDT50 encontrado para Ae. aegypti de las poblaciones de Sullana y Tambogrande (107,20 min y 160,42 min respectivamente) nos indicarían la evolución de la resistencia a deltametrina (Tabla 2), que comparado con otras especies fue superior, como en Anopheles gambiae (Giles) de Kao Koffikro (Africa) con KDT50 de 78,7 min para este insecticida23 y Aedes albopictus (Skuse) con KDT50 de 53,66 min frente al piretroide cipermetrina con mortalidad de 97,124, semejante a los encontrados en La Esperanza, El Porvenir y Florencia de Mora (La Libertad) con porcentajes de mortalidad de 95%, 98% y 90%, siendo necesario confirmar estos dos últimos resultados.
La resistencia a deltametrina presentada en las poblaciones de Sullana y Tambogrande y los por confirmar de La Esperanza y Florencia de Mora, serían el resultado de la presión de selección por el empleo de aspersiones de deltametrina en viviendas, siendo causa probable la presencia de resistencia de Ae. aegypti por los insecticidas empleados para el control de A. albimanus, principal vector de la malaria en el norte del Perú (Sullana), ya que las viviendas se encuentran muy cercanas a los campos de cultivos, presentando esta especie resistencia a alfacipermetrina, lambdacialotrina, ciflutrina y deltametrina.
La banda que se distingue en la figura 1 en el gel de poliacrilamida (PAGE) perteneciente a la población de El Porvenir, con un Rf de 0,23 aproximadamente, concuerda con lo señalado en trabajos previos para esta población14,21. El resultado obtenido difiere con el tipo de esterasas detectadas en poblaciones de Cuba y Venezuela en donde 98% de las poblaciones de Ae. aegypti estudiadas predomina la esterasa A4 con una movilidad relativa de 0,779 la cual estaría produciendo resistencia a organofosfarados en estas regiones25.
Las poblaciones de Venezuela mostraron la presencia de otra esterasa denominada A6 con una movilidad relativa de 0,61. También ha sido demostrada la correlación existente entre la actividad de esterasas y la resistencia a insecticidas organofosforados25.
La probable intervención de esterasas en la resistencia cruzada a piretroides ha sido señalada en Culex quinquefasciatus (Say) a través de estudios con sinergistas detectándose juntos a la esterasas B1A6 y B6, ya habiéndose registrado previamente también en áfidos17. Otro mecanismo de resistencia a piretroides es la aparición del gen kdr, y la presencia de oxidasas del citocromo P-450. El primero se debe al producirse un simple cambio de algún aminoácido en el sitio de anclaje del insecticida en el canal de sodio y el segundo es un mecanismo de detoxificación mediante oxidaciones e hidroxilaciones23. Se ha indicado que, en poblaciones de Brasil y Vietnam, la causa de resistencia a piretroides y DDT es la presencia del gen kdr26, de lo cual se infiere que éste podría ser el mecanismo probable que estuviera interviniendo en la resistencia del Ae. aegypti a la deltametrina en la población de Sullana y Tambogrande.
Con relación al A. albimanus, todo esto indica que las cepas de Sullana ya son resistentes, y las de Tambogrande han iniciado un proceso de resistencia a deltametrina, demostrando una resistencia en el norte de Perú (Sullana, Tambogrande) que irá aumentando progresivamente y en un determinado momento la dosis 0,025% no será la adecuada en el control vectorial como sucede en otros países23; para el caso de Lutzomyia es aún susceptible.
Finalmente los resultados obtenidos en el presente trabajo indican que el insecticida temephos puede seguir siendo utilizado en los programas de control vectorial del Ae. aegypti. A la vez se hace necesario realizar vigilancia continua de los niveles de resistencia en poblaciones naturales, pues el Ae. aegypti podría convertirse en una seria amenaza para las operaciones de control químico adecuado.
REFERENCIAS BIBLIOGRÁFICAS
1. Perú, Ministerio de Salud. El impacto económico de la malaria en el Perú. Lima: Proyecto Vigia-MINSA/USAID; 1999. [ Links ]
2. Cabezas C. Dengue en el Perú: aportes para su diagnóstico y control. Rev Peru Med Exp Salud Publica 2005; 22(3): 212-28. [ Links ]
3. Pachas P. Epidemiología de la Bartonelosis en el Perú. Lima: Oficina General de Epidemiología/Instituto Nacional de Salud; 2001. Módulos técnicos. Serie de documentos monográficos Nº 13. [ Links ]
4. Perfil etiológico del síndrome febril en áreas de alto riesgo de transmisión de enfermedades infecciosas de impacto en salud pública en el Perú, 2000-2001. Rev Peru Med Exp Salud Publica 2005; 22(3): 165-74. [ Links ]
5. Ruebush TK 2nd, Zegarra J, Cairo J, Andersen EM, Green M, Pillai DR, et al. Cloroquine-resistant Plasmodium vivax malaria in Peru. Am J Trop Med Hyg 2003; 69(5): 548-52. [ Links ]
6. Stephenson JR. Understanding dengue pathogenesis: implications for vaccine design. Bull World Health Organ 2005; 83(4): 308-14. [ Links ]
7. Brown AW. Insecticide resistance in mosquitoes: a pragmatic review. J Am Mosq Control Assoc 1986; 2(2): 123-40. [ Links ]
8. Palacios Fraire S. Analysis of the principal problems impeding normal development of malaria eradication programs. Bull Pan Am Health Organ 1975; 9(4): 283-94. [ Links ]
9. Zaim M, Guillet P. Alternative insecticides: an urgent need. Trends Parasitol 2002; 8(4): 161-63. [ Links ]
10. Hemingway J, Ranson H. Insecticide resistance in insect vectors of human disease Annv Rev Entomol 2000; 45: 371-391. [ Links ]
11. Polo JL. Vigilancia entomológica, epidemiológica y control vectorial del dengue en el sector Santo Toribio del distrito de Florencia de Mora, departamento La Libertad, abril junio [Tesis para obtener el Título Profesional de Biólogo]. Trujillo: Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo; 2000.
12. Chávez J, Córdova O, Vargas F. Niveles de susceptibilidad a temefos en el vector transmisor del dengue en Trujillo, Perú. An Fac Med 2005; 66(1): 53-56. [ Links ]
13. Organización Panamericana de la Salud. Dengue y dengue hemorrágico en las Américas. Washington D.C.: OPS; 1995. Publicación Científica Nº 548. [ Links ]
14. Chávez J, Vargas F. Niveles de resistencia a dos insecticidas en poblaciones de Aedes aegypti (Díptera:Culicidae) del Perú. Rev Colomb Entomol 2005; 31(1):75-78. [ Links ]
15. World Health Organization. Instructions for determining the susceptibility or resistance of adult mosquitoes to organochlorine, organophosphorous and carbamate insecticides; 1981. Unpublished document. WHO/ VBC.81.806. [ Links ]
16. Raymond M. Presentation d´une programme d´analyse log-probit pour microordinateur. Cahiers Orstrom. Serie Entomol Med Parasitol 1985; 23: 117-121. [ Links ]
17. Bisset JA, Rodríguez l, Rodríguez M, Dõaz C, Gonzalez T, Vásquez R. Tres combinaciones de esterasas y su relación con la resistencia a insecticidas organofosforados, carbamatos y piretroides en Culex quinquefasciatus Say, 1823 (Diptera: Culicidae) de Cuba. Rev Cuba Med Trop 1996; 48(1): 150-55. [ Links ]
18. Rodríguez MM, Bisset JA, Molina DF, Lauzan L, Soca A. Detection of insecticide resistance in Aedes aegypti from Cuba and Venezuela. J Med Entomol 2001; 38(5): 623-28. [ Links ]
19. Palomino M, Solari L, León W, Vega R, Vergaray M, Cubillas L, et al. Evaluación del efecto residual del temephos en larvas de Aedes aegypti en Lima, Perú. Rev Peru Med Exp Salud Publica 2006; 23(3): 158-62. [ Links ]
20. Campos J, Andrade C. Suscetibilidade larval de duas populacoes de Aedes aegypti a inseticidas quÌmicos. Rev Saude Publica 2001; 35(3): 232-36. [ Links ]
21. Vargas VF, Roldán J, Vergara C, Córdova O, Bisset J, Rodríguez M. Detección de los niveles de resistencia de Aedes aegypti al temefos y evaluación de la efectividad biolarvicida de Bacillus thuringiensis H-14 var. israelensis, Trujillo- La Libertad. Universidad Nacional de Trujillo. Informe al CONCYTEC; 2003. [ Links ]
22. Schneider J, Droll D. A timeline for dengue in the Americas to December 31, 2000 and noted first occurrences. Washington D.C.: PAHO. Division of diseases prevention and control; 2001. [ Links ]
23. Chandre F, Darrier F, Manga L, Akogbeto M, Faye O, Mouchet J, et al. Status of pyrethroid resistance in Anopheles gambiae sensu lato. Bull World Health Organ 1999; 77(3): 230-34. [ Links ]
24. Sulaiman S, Pawanchee ZA, Othman HF, Shaari N, Yahaya S, Wahab A, et al. Field evaluation of cypermetrhrin and cyfluthrin against dengue vectors in a house state in Malaysia. J Vector Ecol 2002; 27(2): 230-34. [ Links ]
25. Bisset JA, Rodríguez MM, Molina D, Díaz C, Soca LA. Esterasas elevadas como mecanismo de resistencia a insecticidas organofosforados en cepas de Aedes aegypti. Rev Cub Med Trop 2001; 53(1): 37-43. [ Links ]
26. Brengues C, Hawkes N, Chandre F, McCarroll L, Duchon S, Guillet P, et al. Pyrethroid and DDT cross-resistance in Aedes aegypti is correlated with novel mutations in the voltage-gated sodium channel gene. Med Veter Entomol 2003; 17(1): 87-94. [ Links ]
Correspondencia:
Franklin Vargas Vásquez.
Instituto de Investigación en Microbiología y Parasitología Tropical. Universidad Nacional de Trujillo. Trujillo, Perú.
Dirección: Apartado Postal 315.
Telefax: (051) 044-222331.
Correo electrónico: frvargasv@yahoo.es
Esta investigación contó con el apoyo técnico - financiero del proyecto "Enfrentado las amenazas de las enfermedades infecciosas emergentes y reemergentes" Vigía (MINSA / USAID) en el marco del IV Concurso para Proyectos de Investigación en Enfermedades Infecciosas Emergentes y Reemergentes - año 2003.