Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.23 n.4 Lima oct./dic. 2006
ARTÍCULO ORIGINAL
Efecto citotóxico selectivo in vitro de muricin H (acetogenina de Annona muricata) en cultivos celulares de cáncer de pulmón
Selective in vitro cytotoxic effect of muricin H (Annona muricata acetogenenin) in lung cancer cell cultures
Angel Quispe M1; David Zavala C1; José Rojas C1; Margarita Posso R1; Abraham Vaisberg W2
1 Sociedad Científica de San Fernando, Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Laboratorio de Virología, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia. Lima, Perú.
RESUMEN
Objetivos: Determinar la actividad citotóxica selectiva de muricin H en la línea celular H460 (cáncer de pulmón de células grandes). Materiales y métodos: Las líneas H460 y 3T3 (fibroblastos normales de ratón), fueron expuestas a seis concentraciones de muricin H (62,5, 15,6, 3,9, 0,98, 0,24, 0,06 µg/mL), e iguales concentraciones de 5-fluorouracilo (5-FU) usado como control positivo. Se hallaron los porcentajes de crecimiento en 48 horas, luego se determinó la concentración inhibitoria de crecimiento 50 (CI50) mediante análisis de regresión linear y se obtuvieron los coeficientes de correlación de Pearson. Finalmente se calculó el índice de selectividad de cada muestra. Resultados: Los CI50 en µg/mL de muricin H fueron <0,06 (r = -0,96; p<0,005) para H460; y 6,16 (r = -0,96; p<0,025) para 3T3. Los CI50 de 5-fluorouracilo fueron 0,46 (r = -0,95; p<0,005) para H460 y 0,29 (r = -0,88; p =0,01) para 3T3. Los índices de selectividad para muricin H y 5-FU fueron: >102,6 y 0,63 respectivamente. Conclusiones: Se demostró la acción citotóxica selectiva in vitro del muricin H, porque tuvo mayor efecto citotóxico para la línea H460, y menor para la línea 3T3 en relación con el 5-fluorouracilo.
Palabras clave: Plantas medicinales; Fitoterapia; Citotoxicidad; Agentes antineoplásicos; Cultivo celular; Cáncer pulmonar.
ABSTRACT
Objectives: To determine the selective cytotoxic activity of muricin H on a H460 cell line (non-small cell lung cancer). Materials and methods: H460 and 3T3 cell lines (normal murine fibroblasts) were exposed to six concentrations of muricin H (62,5; 15,6; 3,9; 0,98; 0,24; 0,06 µg/mL) and to equal concentrations of 5-fluorouracil (5-FU) used as a positive control. Growth percentages at 48 hours were measured, and then the half-maximal inhibitory concentration (IC50) was determined using linear regression analysis, and Pearson correlation coefficients were calculated. Finally, the selectivity index for each sample was calculated. Results: IC50 values for muricin H, expressed in µg/mL were as follows: <0,06 (r= -0,96; p<0,05) for the H5460 cell line, and 6,16 (r= -0,96; p<0,025) for the 3T3 cell line. IC50 with 5-FU were 0,46 (r= 0,95; p<0,005) for H460, and 0,29 (r= -0,88 P= 0,01) for 3T3. Selectivity indexes for muricin H and 5-FU were <102,6 and 0,63, respectively. Conclusions: In vitro selective cytotoxic activity of muricin H was proven, since it had a greater cytotoxic effect for H460 cell line, and lesser effect upon the 3T3 cell line when compared to 5-FU.
Key words: Medicinal plants; Phytotherapy; Cytotoxicity; Antineoplastic agents; Cell culture; Lung cancer.
INTRODUCCIÓN
Las plantas son consideradas fuente valiosa para la obtención de nuevas drogas antineoplásicas, como la vinblastina y el paclitaxel que derivan de los principios activos de Catharanthus roseus y Taxus brevifolia, respectvamente1. La Annona muricata, también conocida en nuestro medio como guanábana es un pequeño árbol perteneciente a la familia Annonaceae, género Annona. Es originaria de las Antillas y de las regiones tropicales de América del Sur, que incluye el Amazonas. En el Perú los centros de producción se encuentran en Chanchamayo (Junín), Bagua y Jaén2.
Los primeros estudios químicos se llevaron a cabo en las décadas del 70 y 80, los cuales condujeron al aislamiento de alcaloides isoquinolínicos en diversos órganos de la planta. Se ha reportado que Annona muricata posee más de 50 acetogeninas con diferentes actividades biológicas encontradas en frutos, corteza y hojas. Otros estudios han reportado el aislamiento de 21 acetogeninas citotóxicas en las hojas de esta planta3.
Las acetogeninas son miembros de una clase de derivados policétidos que se caracterizan por poseer una larga cadena alifática con uno a tres anillos de tetrahidrofurano (THF) los que algunas veces son reemplazados por anillos de epóxido o dobles enlaces, y con un anillo de ã-lactona insaturado metil sustituido como grupo terminal2.
Desde la primera acetogenina, uvaricina, reportada en 1982, la investigación en estos compuestos ha tenido una gran expansión debido a sus diversas actividades biológicas, incluida la antitumoral in vitro, citotóxica4, como pesticida, antiparasitaria y de efecto inmunosupresor. Estas diversas actividades biológicas son probablemente explicadas por la inhibición de la enzima NADH ubiquinona oxidoreductasa o complejo I de la cadena respiratoria mitocondrial5.
En el año 2002, se publicó el aislamiento de tres nuevas acetogeninas de Annona muricata: muricin H, muricin I y Cis-annomontacin las cuales mostraron actividad antitumoral significativa contra dos líneas celulares de hepatoma humano: la línea HepG2 y Hep2,2,156. Desde entonces muricin H no ha sido evaluada en otras líneas celulares, por ello, nuestro objetivo fue determinar la actividad citotóxica selectiva de muricin H en cultivo de la línea celular H460.
MATERIALES Y MÉTODOS
Estudio experimental realizado en los laboratorios del Departamento de Farmacología de la Universidad Nacional Mayor de San Marcos (UNMSM) y de la Facultad de Ciencias y Filosofía de la Universidad Peruana Cayetano Heredia (UPCH).
Se usaron las líneas celulares de la American Type Culture Collection (ATCC): H460 (carcinoma; large cell lung cancer) y 3T3 (Embryonic Albino Swiss Mouse Fibroblast Cells) proporcionadas por el Laboratorio de Virología de la Facultad de Ciencias y Filosofía de la UPCH (Lima, Perú), y el muricin H (acetogenina de Annona muricata), proporcionado por el Graduate Institute of Natural Products, Kaohsiung Medical University, Kaohsiung 807, Taiwan, Republic of China.
Las líneas celulares H460 y 3T3 fueron cultivadas y mantenidas en crecimiento logarítmico en los medios de cultivo MEM y DMEM (Dulbecco Modified Eagle Medium) respectivamente, suplementados con 10 % de suero fetal bovino y 50 µg/mL de gentamicina. Las dos líneas fueron mantenidas a una temperatura de 37 ºC, en un ambiente húmedo con 95% de aire y 5% de CO2.
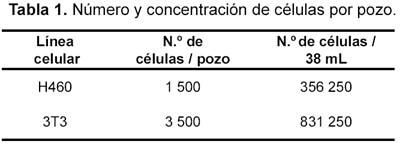
Para resuspender cada línea celular se lavó la mono capa de células con 3x4 mL de la solución de HANKS sin Ca-Mg, luego se agregó 1 mL de la solución de tripsina-EDTA que después de diez segundos fue eliminada. Se incubó el frasco invertido por ocho minutos a 37 ºC, al término de los cuales los cultivos fueron resuspendidos en 2 mL de cada medio de cultivo. Las células fueron contadas usando un hemocitómetro. Finalmente cada pozo de una placa de 96 pozos recibió 160 µL de medio conteniendo el número de células que se especifica en la tabla 1.
ENSAYO DE LA ACTIVIDAD CITOTÓXICA
Se utilizó una placa 0 (control) asignándose seis pozos para cada línea celular y una placa 1 (experimental) con 12 pozos para cada línea celular. En cada pozo de ambas placas se colocaron 160 µL de medio de cultivo conteniendo las células. Se incubó a 37 ºC en una atmósfera húmeda con 5% de CO2 y 95% de aire por 24 horas. A la placa 0 se le añadió acido tricloroacético (TCA) para fijar las células y luego cuantificarlas en el tiempo cero. A la placa 1 se le agregaron las diferentes diluciones de muricin H y de 5-fluorouracilo (5-FU) que se muestra en la tabla 2.
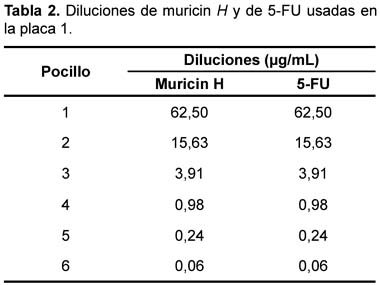
Diluciones de muricin H. El stock de muricin H fue diluido en ETOH es: 1,375 mg/ 50 µL. Para una concentración inicial de 62,5 µg/mL se usó 7,72 µL de stock con 680 µL de medio. Luego se hicieron diluciones sucesivas de 1:4, obteniéndose así una concentración inicial de 62,5 µg/mL y una concentración final de 0,06 µg/mL.
Diluciones de 5 fluorouracilo. La concentración inicial fue de 62,5 µg/mL y luego se hicieron diluciones sucesivas de 1:4.
La placa 1 fue incubada por 48 h adicionales. Luego a cada pozo se le agregó TCA frío y se incubó a 4 ºC por una hora. Para determinar el número de células se empleó el método del bioensayo de citotoxicidad con sulforodamina B (SRB)7.
Para la línea H460 y 3T3 se hallaron los porcentajes de crecimiento en 48 horas en función a las seis diluciones (Tabla 2). La concentración inhibitoria de crecimiento 50 (CI50) se halló mediante el análisis de regresión linear (ecuación de la recta: y=a+bx). Luego se determinaron los coeficientes de correlación de Pearson (r) que nos indican la relación dosis-respuesta entre las concentraciones y el porcentaje de crecimiento.
Para determinar la selectividad citotóxica de las sustancias evaluadas, se calculó el índice de selectividad, según la fórmula:
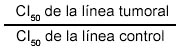
Si el valor es >1, indica que la sustancia es más citotóxica para las células tumorales que para las células normales, si es <1, lo contrario. Se usó Microsoft Office Excel 2003 para crear la base de datos y efectuar los cálculos estadísticos. Fueron respetadas las medidas de bioseguridad de trabajo con material biológico.
RESULTADOS
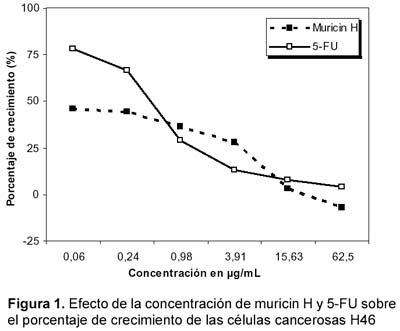
El porcentaje de crecimiento de las células tumorales H460 fue menor cuando se usó muricin H en relación con las dosis iguales de 5-FU, tanto en la concentración más baja (0,06 µg/mL) como en la más alta (62,5 µg/ mL); así mismo, se observa que se inhibe el crecimiento de células tumorales a menos dosis de las ensayadas con muricin H (Figura 1).
Para el caso de células normales 3T3, se observó que a bajas concentraciones el 5-FU es más citotóxico que muricin H; sin embargo, las mayores concentraciones de muricin H tienden a igualar o incluso superar la citotoxicidad del 5-FU (Figura 2).
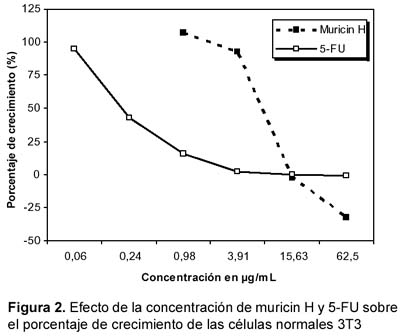
El grado de correlación entre concentración de la sustancia y crecimiento celular varió entre los valores varían de la r de Pearson de -0,88 hasta -0,96, en todos los casos p < 0,05.
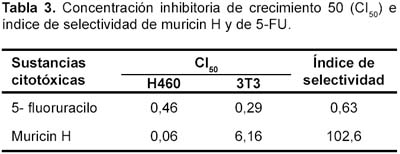
Muricin H mostró un CI50 menor que del 5-FU para la línea tumoral H460. De otro lado el CI50 de muricin H fue mayor que el CI50 del 5-FU para la línea 3T3. El índice de selectividad de muricin H supera ampliamente el valor de 1 obteniéndose un valor de 102,6 (más citotóxico para células tumorales), a diferencia del 5-FU que sólo alcanza un valor de 0,63 (más citotóxico para células normales) (Tabla 3).
DISCUSIÓN
El bioensayo muestra que muricin H tiene una potente actividad citotóxica frente a la línea tumoral H460 llegando superar al 5-FU. Además la citotoxicidad en las células normales (3T3) fue mucho menor comparado con el 5- FU, demostrando su efecto citotóxico selectivo in vitro.
El CI50 que hallamos para la línea H460 (<0,06 µg/mL) con muricin H, resulta similar a los resultados de Liaw et al.6, que obtuvieron valores de 0,095 y 0,012µg/mL con muricin H, para las líneas HepG2 y Hep2,2,156 respectivamente.
Se ha evaluado la actividad antitumoral de varias acetogeninas de Annona muricata contra diversas líneas celulares tumorales in vitro, por ejemplo, contra células de carcinoma pancreático y prostático (PACA-2 y PC-3)3,8,9, carcinoma pulmonar (A-549)10-12, carcinoma de mama (MCF-7)12,13, carcinoma epidermoide (KB)6, células HepG2 (células de hepatoma humano)14,15 y células Hep2,2,15 (hepatoma celular causado por hepatitis B)6,14; con este hallazgo se corrobora el efecto citotóxico de las acetogeninas de Annona muricata pero sobre una nueva línea celular.
Esto es importante, puesto que en la actualidad la quimioterapia para el cáncer de pulmón de células grandes (non-small cell lung cancer) se basa aún en el cisplatino16. Por este motivo es incesante la búsqueda de nuevos compuestos activos en las plantas que puedan demostrar efectividad, como el muricin H; sin embargo, los resultados aún son in vitro, por lo que es necesario evaluar gradualmente su utilidad en modelos animales17, así como su seguridad y toxicidad; antes de pensar en su recomendación a pacientes18.
Se ha encontrado que el consumo de Annona muricata y Annona squamosa puede estar relacionado a la presencia de un parkinsonismo atípico que se evidenció en la población de Isla Guadalupe en el Caribe19, se han identificado posibles sustancias como la annonacin que puede ocasionar neurodegeneración en ratas y estar relacionadas a este hallazgo20, que ligado al conocido efecto de sus derivados sobre la toxicidad mitocondrial21, hacen riesgoso la recomendación del consumo de concentrados sin purificar.
En conclusión, en las condiciones experimentales se ha demostrado que existe una mayor actividad citotóxica concentración dependiente de muricin H sobre la línea tumoral H460, en relación con el 5-fluoruracilo. Finalmente se resalta el alto índice de selectividad superior a 100 en muricin H, contrario al bajo índice en el caso del 5-FU.
AGRADECIMIENTOS
Al Graduate Institute of Natural Products, Kaohsiung Medical University, Kaohsiung 807, Taiwan, Republic of China, por haber donado la acetogenina de Annona muricata: muricin H. Al Dr. Rolig Aliaga Chavez, Jefe del servicio de Oncología Médica del Hospital Nacional Arzobispo Loayza por la donación del fármaco 5-fluorouracilo.
REFERENCIAS BIBLIOGRÁFICAS
1. Laza D, Rodríguez I, Sardiña G. Descubrimiento y desarrollo de agentes cancerígenos derivados de plantas medicinales. Rev Cubana Plant Med 2003; 8(3): e12. [ Links ]
2. Lock O, Rojas R. Química y farmacología de Annona Muricata Linn. Rev Quim (Lima) 2003; 7(2): 23-28. [ Links ]
3. Kim GS, Zeng L, Alali F, Rogers LL, Wu FE, Sastrodihardjo S, et al. Muricoreacin and murihexocin C, monotetrahydrofuran acetogenins, from the leaves of Annona muricata. Phytochemistry 1998; 49(2): 565-71. [ Links ]
4. Arroyo J, Prashad M, Vasquez Y, Li E, Tomás G. Actividad citotóxica in vitro de la mezcla de Annona muricata y Krameria lappacea sobre células cancerosas de glándula mamaria, pulmón y sistema nervioso central. Rev Peru Med Exp Salud Publica 2005; 22(4): 247-57. [ Links ]
5. Tormo JR, Gonzalez MC, Cortes D, Estornell E. Kinetic characterization of mitochondrial complex I inhibitors using annonaceous acetogenins. Arch Biochem Biophys 1999; 369(1): 119-26. [ Links ]
6. Liaw CC, Chang FR, Lin CY, Chou CJ, Chiu HF, Wu MJ, et al. New cytotoxic monotetrahydrofuran annonaceous acetogenins from Annona muricata. J Nat Prod 2002; 65(4): 470-75. [ Links ]
7. Skehan P, Storeng R, Scudiero D, Monks A, McMahon J, Vistica D, et al. New colorimetric cytotoxicity assay for anticancer-drug screening. J Natl Cancer Inst 1990; 82(13): 1107-12. [ Links ]
8. Hopp DC, Zeng L, Gu ZM, Kozlowski JF, McLaughlin JL. Novel mono-tetrahydrofuran ring acetogenins, from the bark of Annona squamosa, showing cytotoxic selectivities for the human pancreatic carcinoma cell line, PACA-2. J Nat Prod 1997; 60(6): 581-86. [ Links ]
9. Hopp DC, Zeng L, Gu Z, McLaughlin JL. Squamotacin: an annonaceous acetogenin with cytotoxic selectivity for the human prostate tumor cell line (PC-3). J Nat Prod 1996; 59(2): 97-99. [ Links ]
10. Wu FE, Zeng L, Gu ZM, Zhao GX, Zhang Y, Schwedler JT, et al. New bioactive monotetrahydrofuran Annonaceous acetogenins, annomuricin C and muricatocin C, from the leaves of Annona muricata. J Nat Prod 1995; 58(6): 909-15. [ Links ]
11. Wu FE, Zhao GX, Zeng L, Schwedler JT, McLaughlin JL, Sastrodihardjo S. Additional bioactive acetogenins, annomutacin and (2,4-trans and cis)-10R-annonacin-Aones, from the leaves of Annona muricata. J Nat Prod 1995; 58(9): 1430-37. [ Links ]
12. Wu FE, Zeng L, Gu ZM, Zhao GX, Zhang Y, Schwedler JT, et al. Muricatocins A and B, two new bioactive monotetrahydrofuran Annonaceous acetogenins from the leaves of Annona muricata. J Nat Prod 1995; 58(6): 902-8. [ Links ]
13. Oberlies NH, Chang CJ, McLaughlin JL. Structureactivity relationships of diverse Annonaceous acetogenins against multidrug resistant human mammary adenocarcinoma (MCF-7/Adr) cells. J Med Chem 1997; 40(13): 2102-6. [ Links ]
14. Chang FR, Wu YC. Novel cytotoxic annonaceous acetogenins from Annona muricata. J Nat Prod 2001; 64(7): 925-31. [ Links ]
15. Chang FR, Liaw CC, Lin CY, Chou CJ, Chiu HF, Wu YC. New adjacent Bis-tetrahydrofuran Annonaceous acetogenins from Annona muricata. Planta Med 2003; 69(3): 241-46. [ Links ]
16. Non-small Cell Lung Cancer Collaborative Group. Chemotherapy in non-small cell lung cancer: a metaanalysis using updated data on individual patients from 52 randomised clinical trials. BMJ 1995; 311: 899-909. [ Links ]
17. Bermejo A, Figadere B, Zafra-Polo MC, Barrachina I, Estornell E, Cortes D. Acetogenins from Annonaceae: recent progress in isolation, synthesis and mechanisms of action. Nat Prod Rep 2005; 22(2): 269-303. [ Links ]
18. Vickers AJ. How to design a phase I trial of an anticancer botanical. J Soc Integr Oncol 2006; 4(1): 46-51. [ Links ]
19. Caparros-Lefebvre D, Elbaz A. Posible relation of atypical parkinsonism in the French West Indies with consumption of tropical plants: a case-control study. Caribbean Parkinsonism Study Group. Lancet 1999; 354(9175): 281-86. [ Links ]
20. Champy P, Hoglinger GU, Feger J, Gleye C, Hocquemiller R, Laurens A, et al. Annonacin, a lipophilic inhibitor of mitochondrial complex I, induces nigral and striatal neurodegeneration in rats: possible relevance for atypical parkinsonism in Guadeloupe. J Neruochem 2004; 88(1): 63-69. [ Links ]
21. Lannuzel A, Hoglinger GU, Champú P, Michel PP, Hirsch EC, Ruberg M. Is atypical parkinsonism in the Caribbean caused by the consumption of Annonacae? J Nerual Transm Suppl 2006; (70): 153-57. [ Links ]
Correspondencia:
Ángel Quispe M.
Sociedad Científica de San Fernando, Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
Dirección: Av. Colectora Mz C Lote 1 Urb. Los Olivos de Ate, Ate. Lima, Perú.
Teléfono: (511) 794-5576; (511) 9211-4224
Correo electrónico: 0110857@unmsm.edu.pe














