Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.24 n.1 Lima ene./mar. 2007
ARTÍCULO ORIGINAL
Estandarización y validación de una prueba de PCR para el diagnóstico precoz de Leptospirosis humana
Standardization and validation of the polymerase chain reaction for early diagnosis of human Leptospirosis
Manuel Céspedes Z1a ; Rafael Tapia L1a ; Lourdes Balda J1b ; Dana Gonzalez Q1a ; Carlos Peralta2a ; Patricia Condori2a
1 Laboratorio Referencia Nacional de Leptospirosis - Zoonosis Bacteriana, Centro Nacional de Salud Publica, Instituto Nacional de Salud. Lima, Perú.
2 Dirección de Salud de Madre de Dios. Madre de Dios, Perú.
a Biólogo.
b Técnico de Laboratorio.
RESUMEN
Objetivos: Estandarizar y optimizar la prueba de PCR dirigida al gen rrs (16S) de Leptospira spp., para luego validar su uso en muestras de pacientes con síndrome febril captados en zonas endémicas del Perú. Material y métodos: Se estandarizó y validó una prueba de PCR para el diagnostico rápido de leptospirosis en muestras de sangre y orina. Se optimizó la prueba con muestras de ADN de Leptospira de diferentes especies, y se determinó en 180 muestras clínicas de pacientes con sospecha de leptospirosis su sensibilidad y especificidad en comparación con la prueba de aglutinación microscópica (MAT) y ELISA IgM. Resultados: El PCR estandarizado amplificó el ADN de 25 serovares de seis especies de Leptospira spp. No amplificó las muestras de ADN de otros microorganismos patógenos. La sensibilidad y especificidad del método fue 100% in vitro. Su sensibilidad fue de 100% (IC95: 97,9 - 100%) en muestras de sangre antes de los ocho primeros días de enfermedad y de 30% (IC95: 16,3 - 43-,7) cuando el tiempo de enfermedad fue mayor. El PCR en orina tiene una baja sensibilidad. Conclusiones: El PCR estandarizado es más sensible que las pruebas serológicas en los primeros días de enfermedad y es poco sensible cuando la carga bacteriana es baja en sangre.
Palabras clave: Leptospira; Leptospirosis; Anticuerpos; Reacción en cadena de la polimerasa, Diagnóstico precoz (fuente: DeCS BIREME).
ABSTRACT
Objectives: To standardize and optimize a PCR assay to detect rrs gene (rRNA 16S) from Leptospira spp. to use it with samples of suspected patients of febrile syndrome, in endemic areas from Peru. Methods: We standardized and validated a PCR assay for rapid diagnostic of leptospirosis from blood and urine samples. The PCR assay was optimized with DNA samples from different species of Leptospira. Sensitivity and specificity was determined in comparison with serological test: MAT and IgM ELISA in 180 clinical samples of patients with suspect of leptopirosis. Results: The PCR assay amplified DNA of twenty five serovars of six pathogenic species of Leptospira spp. No amplification was detected with DNA from other pathogens. Sensitivity and specificity was 100% in vitro (culture samples). In blood samples, sensitivity was 100% (95CI: 97,9 - 100) in patients on the first 8 days of disease; and 30% (95CI: 16,3 - 43,7) when the time of disease was greater. In urine samples the PCR assay showed a low sensitivity. Conclusions: The standardized PCR assay for Leptospira was more sensitive than serological tests in the first days of disease. On the other hand, it has low sensitivity when bacterial population is poor.
Key words: Leptospira; Leptospirosis; Polymerase chain reaction; Early diagnosis (source: DeCS BIREME).
INTRODUCCIÓN
La leptospirosis es una enfermedad zoonótica de distribución mundial, causada por diversos serovares de Leptospira spp. patógenas; se adquiere cuando el hombre está en contacto directo o indirecto con orina contaminada1-3. En el Perú, está distribuida ampliamente, pero no se conoce la real proporción de febriles atribuidas a esta infección, porque no es considerada usualmente como una enfermedad de notificación y tampoco es incluida dentro del diagnóstico diferencial4-8; sin embargo, algunos estudios de vigilancia demuestran que es una causa muy frecuente de síndrome febril incluso mayor que el dengue en áreas endémicas9,10.
La enfermedad puede variar desde una infección subclínica hasta una enfermedad grave con falla multiorgánica11, debido a la gran variedad de signos y síntomas clínicos, la leptospirosis esta siendo confundida con otras enfermedades febriles como malaria, influenza, hepatitis, dengue, fiebre amarilla, enfermedad de Carrión, entre otras7-8.
La presencia de Leptospira spp. puede demostrarse mediante observación en microscopía de campo oscuro o por cultivo; pero el proceso es laborioso e incluso podría tardar hasta tres meses7. Los métodos de diagnóstico más usados están basados en la respuesta inmune del paciente frente a las leptospiras, como la prueba de microaglutinación (MAT) 12 y el ELISA IgM 13, que detectan anticuerpos contra Leptospira spp. en líquido cefalorraquídeo (LCR) y suero, pero estas técnicas son poco sensibles en los primeros seis días de enfermedad y por tanto pueden ser inoportunas para el inicio de tratamiento7.
El diagnóstico precoz en leptospirosis es necesario, sobretodo en las formas graves de la enfermedad11; esto ha motivado el desarrollo de técnicas de PCR que han demostrado que pueden ser útiles en los periodos agudos de la infección14,15; sin embargo, no se encuentran disponibles para el diagnóstico clínico en el Perú.
El propósito del estudio fue estandarizar y optimizar la prueba de PCR dirigida al gen rrs (16S) de Leptospira spp.14, para luego validar su uso en muestras de pacientes con síndrome febril captados en zonas endémicas y comparar estos resultados con el cultivo, MAT y el ELISA IgM.
MATERIALES Y MÉTODOS
ADAPTACIÓN IN VITRO
Bacterias y condiciones de crecimiento
Las cepas de Leptospira usadas para la estandarización in vitro fueron especies de leptospiras patógenas y no patógenas, pertenecientes a los serovares Andamana, Bratislava, Autumnalis, Ballum, Bataviae, Canicola, Celledoni, Pomona, Hebdomadis, Cynopteri, Djasiman, Georgia, Grippotyphosa, Icterohaemorrhagiae, Javanica, Pyrogenes, Sejroe y Tarassovi; las cuales pertenecen a seis especies Leptospira biflexa, L. borgepetersenii, L. interrogans, L. kischneri, L. santarosai y L. weilii. Las cepas fueron fueron obtenidas del Laboratorio de Leptospiras del Instituto Nacional de Salud (INS) y reactivadas en medio de cultivo en medio EMJH, por cinco días a 28 ºC.
Las cepas de Brucella melitensis y Salmonella typhi fueron cultivados en BHI (Difco), Borrelia burdorgferi fue cultivado en medio BSK-H medium (Sigma), Treponema pallidum fue extraído de un antígeno FTA-Absorvent (Difco), el ADN de Plasmodium falciparum y Rickettsia spp. fueron proporcionados por los Laboratorios de Referencia Nacional de Malaria y Rickettsiosis del INS.
Aislamiento de ADN
Las leptospiras fueron cultivadas por cinco días y centrifugadas a 2000 g durante diez minutos. El sedimento fue resuspendido en buffer TE/sodio (50 mM Tris, 50 mM EDTA, 100 mM NaCl, pH 8,0), y luego se adicionó 30 ìL de SDS al 10% y 3 ìL de proteinasa K, para incubarlo a 37 ºC durante una hora. La suspensión de las células lisadas se trataron con fenol: cloroformo: alcohol isoamílico (25:24:1) y los ácidos nucleicos fueron precipitados con dos volúmenes de etanol frío y luego resuspendidos en agua de PCR estéril.
Para la optimización del PCR se trabajó con 25 muestras de ADN de leptospiras patógenas y no patógenas y a partir de éstas se evaluó la sensibilidad. Posteriormente seis cepas fueron mezcladas individualmente con muestras de sangre y estas se extrajeron con diferentes métodos: M1: DNAzol (GIBCO), M2: DNAzol y extracción orgánica, M3: DNAzol modificado, M4: esferas de CHELEX 100 (SIGMA), M5: método convencional, M6: método convencional modificado, M7: método de precipitación. Además se diluyeron de 107 hasta 102 leptospiras en muestras de sangre y se extrajeron con kits de extracción de ADN los cuales fueron Perfect DNA Blood (Eppendorf), Ready Amp Genomic (Promega), Qiamp DNA Blood (Quiagen), Chelex 100 (Sigma) y DNA zol modified (Gibco). Para orina se probaron cuatro métodos (método convencional-lisis buffer, Chelex 100, DNAzol modificado y Boiling 16).
Reacción en cadena de la polimerasa (PCR)
Se realizó la optimización de todos los parámetros del PCR como primer, cloruro de magnesio, dNTPS, taq polimerasa, buffer y ADN. Para los estudios de especificidad de la prueba de PCR se probaron con tres muestras de ADN de los siguientes patógenos (Brucella mellitensis, Salmonella typhi, Treponema pallidum, Borrelia burdorgferi, Rickettsia typhi y Plasmodium falciparum).
VALIDACIÓN CON MUESTRAS CLÍNICAS (IN VIVO)
Lugar de estudio
Para la validación en campo se enrolaron pacientes con sospecha clínica de leptospirosis que acudieron a cinco establecimientos de salud de la Dirección de Salud de Madre de Dios (Hospital Santa Rosa y Iberia, Centro de Salud Jorge Chávez, Nuevo Milenio y Laberinto), adicionalmente se captaron muestras de pacientes febriles en un brote de leptospirosis al sur de Lima en San Vicente de Cañete.
Se incluyeron aquellos pacientes febriles que residían en el área de estudio un mínimo de dos meses, con una edad comprendida entre los 5 y 65 años, que presentaron un tiempo de enfermedad menor de diez días, con temperatura oral mayor o igual a 38 ºC, con malestar general, cefalea repentina y asociada a uno o más signos y síntomas como escalofrío, mareo, mialgia, artralgia, tos, disnea, diarrea, náuseas o vómitos, hemorragia conjuntival, fenómenos hemorrágicos, ictericia y oliguria.
Muestra biológicas
Las muestras biológicas se tomaron en el primer contacto con el establecimiento de salud, se obtuvo 5 mL de sangre total en tubo al vacío con anticoagulante EDTA, otro tubo de 5 mL de sangre sin anticoagulante y además se obtuvo 15 mL de orina, previo consentimiento informado. Posteriormente, entre los 7 a 21 días después de tomado la primera muestra se tomó la muestra pareada de sangre sin anticoagulante. De la muestra de sangre con anticoagulante se realizó el PCR y cultivo, la muestra de sangre total fue centrifugada y se separó el suero, a partir del cual se realizaron las pruebas de ELISA IgM y MAT. El estudio fue aprobado por el Comité de Ética del Instituto Nacional de Salud, Lima, Perú.
Exámenes de laboratorio
El cultivo se realizó en dos tubos con medio EMJH, a estos se agregó 2 a 3 gotas de sangre anticoagulada por medio, luego se incubaron a 28 a 30 ºC, los tubos se observaron semanalmente por un lapso de tres meses, después se descartaron.
El ELISA IgM se realizó usando un kit de ELISA que usa como antígeno un pool de serovares patogénicos, preparado en el Instituto Nacional de Salud-Perú; en una evaluación previa mostró una sensibilidad y especificidad mayor al 95%13.
Asimismo, se realizó la prueba de aglutinación microscópica (MAT). El MAT se realizó utilizando los siguientes serovares: Andamana, Bratislava, Autumnalis, Ballum, Bataviae, Canicola, Celledoni, Pomona, Hebdomadis, Cynopteri, Djasiman, Georgia, Grippotyphosa, Icterohaemorrhagiae, Javanica, Pyrogenes, Sejroe, Tarassovi y un nuevo serovar Varillal12.
La extracción de muestras ADN de sangre se realizó con el kit Qiagen, y para las muestras de orina se utilizó un método que se basa en el uso de la resina Chelex 100.
Criterios de confirmación
Se consideró como caso positivo cuando hubo seroconversión en muestras pareadas (de serología negativa a positiva o aumento de anticuerpos en dos o más títulos), cuando se tuvo en una sola muestra ELISA IgM positiva y MAT positiva con título mayor a 1/400, o cuando se tuvo cultivo positivo7.
ANALISIS DE DATOS
Se calculó la sensibilidad y especificidad con su respectivo intervalo de confianza al 95%(IC95) del PCR optimizado, en muestras de sangre y orina usando el sofware estadístico Epidat 3,1.
RESULTADOS
ESTANDARIZACIÓN DEL PCR
Para el PCR se uso el primer ribosomal correspondiente al gene rrs 16SRNA Lep A: 5´GGCGGCGCGTCTTAAACATG3´ y Lep B: 5´TTCCCCCCATTGAGCAAGATT3´. Las condiciones de la mezcla que se estandarizó fue 100 pmol de cada primer, 1,5 mM MgCl2 (Perkin Elmer), 1X PCR Buffer II (Perkin Elmer), 200 ìM dNTPs y 1 U de AmpliTaq DNA polimerasa (Perkin Elmer) en un volumen final de 50 µL.
Las condiciones se ciclaje fueron: desnaturación inicial de 95 °C por cinco minutos, 95 °C por 30 segundos, 59 °C por 1 minuto, 72 °C por 30 segundos, este ciclo se repitió 30 veces. Una vez terminado se hizo una extensión final a 72 °C por siete minutos en un termociclador Amplitron II (Thermolyne).
SENSIBILIDAD Y ESPECIFICIDAD IN VITRO
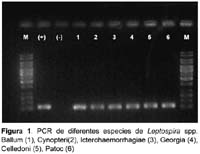
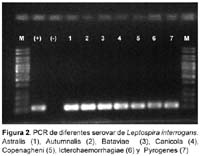
Los primer usados durante la estandarización del PCR amplificaron los 25 serovares de leptospiras que están agrupados en seis especies, estos serovares son usados en el MAT y son de L. biflexa (2), L. borgepetersenii(4), L. interrogans(14), L. kischneri(1), L. santarosai(3) y L. weilii(1). En las amplificaciones realizadas se muestran bandas bien marcadas (Figura 1 y 2).
De las muestras de ADN de otros agentes patógenos (Brucella mellitensis, Salmonella typhi, T.pallidum, Borrelia burdorgferi, Rickettsia typhi y P.falciparum) no se amplificó ninguno de ellos usando este primer. Para este número de cepas y con estas bacterias podemos afirmar que la sensibilidad in vitro del método es de 100% y su especificidad es también de 100%.
EVALUACIÓN DE LA EXTRACCIÓN DE ADN CON MUESTRAS DE SANGRE Y ORINA
De ocho serovares evaluados por siete métodos, sólo se amplificó adecuadamente y se observó una banda con los métodos M3, M4, M5, M6 y M7 (Tabla 1). Los kits que detectaron leptospiras en las muestras diluidas fueron Quiamp DNA Blood, Perfect DNA Blood y Chelex 100 (Tabla 2). Para orina se encontró que la resina Chelex 100 fue el método más adecuado para los procesos de extracción de ADN y posterior PCR (Tabla 3).
VALIDACIÓN DE LA PRUEBA EN CAMPO
Se recolectaron 194 muestras, pero se excluyeron 14 debido a que no tenían muestras de sangre anticoagulada. Para determinar la sensibilidad y especificidad, se evaluaron 153 procedentes de Madre de Dios y 27 de San Vicente de Cañete.
La sensibilidad del PCR en sangre, antes de los ocho primeros días de enfermedad es de 100% (IC95: 97,9 - 100%) y detecta más casos que la MAT o ELISA evaluados en forma individual o conjunta (Tabla 4), sin embargo, su sensibilidad disminuye al 30% (IC95: 16,3 - 43-,7) cuando se evalúan muestras de ocho o más dias de enfermedad. Su especificidad es muy buena independientemente del tiempo de enfermedad del paciente.
El PCR en orina es poco sensible, aunque en combinación con el PCR en sangre ayudó a encontrar seis casos más (Tabla 4).
DISCUSIÓN
Se logró desarrollar un PCR sensible y específico en base a los primers publicados por Merien et al.14 para la detección precoz de la infección por Leptospira spp. El método desarrollado es capaz de detectar el ADN de leptospiras patógenas y no patógenas, pero no puede diferenciar los serovares entre los serogrupos de leptospiras. La inhabilidad de poder diferenciar entre leptospiras patógenas y no patógenas puede ser una dificultad en estudios ambientales donde se quiera diferenciar entre los distintos serovares; sin embargo, no tiene importancia en el aspecto clínico, pues no se aísla Leptospira biflexa en muestras humanas 17,18. El PCR desarrollado no tuvo reacciones cruzadas con muestras de patógenos causantes de infecciones que clínicamente pueden ser similares a las ocasionadas por las leptospiras en zonas endémicas del Perú (Brucelosis, fiebre tifoidea, sífilis, borreliosis, tifus y malaria), similares resultados se obtuvieron por otros investigadores 15,19.
Los experimentos realizados con el DNA purificado indican que pequeñas cantidades de bacteria pueden ser detectadas por el PCR, tanto en muestras de sangre como de orina. Sin embargo, se obtuvo pocos aislamientos en las muestras clínicas que se trabajaron, debido a diferentes problemas intrínsecos de la propia bacteria1.
Esta prueba es de utilidad en los primeros días de enfermedad, donde tiene una sensibilidad del 100% en muestras de sangre, detecta más casos en momentos precoces de la enfermedad a diferencia del MAT y el ELISA (Tabla 4) y permite obtener los resultados en el mismo día (a diferencia del cultivo que puede demorar entre una a ocho semanas para tener el resultado)7. Por ello, el PCR es una técnica que podría reemplazar al cultivo debido a su alta sensibilidad demostrada en el estudio18.
Esta alta sensibilidad y su superioridad a los resultados obtenidos por MAT y ELISA en momentos precoces de la enfermedad, ha sido confirmado recientemente por otros estudios20,21, demostrando que el PCR en sangre es de particular ayuda en aquellos casos sospechosos no confirmados por las técnicas serológicas20, o que en combinación con ellas se aumenta la sensibilidad de las pruebas de laboratorio hasta 96% en casos sospechosos de leptospirosis21.
Son pocos los estudios que usan las muestras de orina para la detección de Leptospira spp. con PCR, la mayoría de ellos han sido realizados en animales22- 24; en los experimentos in vitro se pudo demostrar su capacidad para lograr la identificación de Leptospira spp., sin embargo, en muestras clínicas no fue mejor ni significó un mayor aporte al diagnóstico que ofrece el PCR en sangre, por lo que se recomienda sólo el uso del PCR en sangre para el diagnóstico precoz de leptospirosis.
En conclusión, el PCR estandarizado es mucho más sensible que las pruebas serológicas en los primeros días de enfermedad y baja su detección de leptospiras en sangre cuando va bajando su carga a partir del octavo día.
AGRADECIMIENTOS
A los profesionales y técnicos de los establecimientos de salud participantes de la DIRESA Madre de Dios y en especial a Teresa Huamán Meza por el apoyo en la elaboración del manuscrito.
REFERENCIAS BIBLIOGRÁFICAS
1. Faine S, Adler B, Bolin C, Perolat P. Leptospira and Leptospirosis. 2nd ed. ed. Melbourne, Australia: Medisci; 1999. [ Links ]
2. Bharti AR, Nally JE, Ricaldi JN, Matthias MA, Diaz MM, Lovett MA, et al. Leptospirosis: a zoonotic disease of global importance. Lancet Infect Dis 2003; 3(12): 757-71.
3. Levett PN. Leptospirosis. Clin Microbiol Rev 2001; 14(2): 296-326.
4. Johnson MA, Smith H, Joseph P, Gilman RH, Bautista CT, Campos KJ, et al. Environmental exposure and leptospirosis, Peru. Emerg Infect Dis 2004;10(6): 1016- 22.
5. Céspedes M, Fernández R, Rimarachín R, Taipe H, Cenepo J, Mori M, et al. Leptospirosis: Una enfermedad zoonótica hiperendémica en la provincia de Coronel Portillo. Ucayali, Perú. Rev Peru Med Exp Salud Publica 2004; 21(2): 62-70.
6. Céspedes M, Ormaeche M, Condori P, Balda L, Glenny M. Prevalencia de leptospirosis y factores de riesgo en personas con antecedentes de fiebre en la provincia de Manu, Madre de Dios, Perú. Rev Peru Med Exp Salud Publica 2003; 20 (4): 180-85.
7. Céspedes M. Leptospirosis: enfermedad zoonótica reemergente. Rev Peru Med Exp Salud Publica 2005; 22(4): 290-307.
8. Céspedes M, Balda L, González D, Tapia R. Situación de la leptospirosis en el Perú: 1994-2004. Rev Peru Med Exp Salud Publica 2006; 23(1): 52-62.
9. Troyes L, fuentes L, Troyes M, Canelo L, García M, anaya e, et al. Etiología del síndrome febril agudo en la provincia de Jaén, Perú 2004-2005. Rev Peru Med Exp Salud Publica 2006; 23(1): 5-11.
10. Perfil etiológico del síndrome febril en áreas de alto riesgo de transmisión de enfermedades infecciosas de alto impacto en salud pública en el Perú, 2000-2001. Rev Peru Med Exp Salud Publica 2005; 22(3):165-74.
11. Segura ER, Ganoza CA, Campos K, Ricaldi JN, Torres S, Silva H, et al. Clinical spectrum of pulmonary involvement in leptospirosis in a region of endemicity, with quantification of leptospiral burden. Clin Infect Dis 2005; 40(3): 343-51.
12. Cole JR, Sulzer CR, Pursell AR. Improved microtechnique for the leptospiral microscopic agglutination test. Appl Microbiol 1973; 25(6): 976-80.
13. Céspedes M, Glenny M, Felices V, Balda L, Suárez V. Prueba de ELISA indirecta para la detección de anticuerpos IgM para el diagnóstico de leptospirosis humana. Rev Peru Med Exp Salud Publica 2002; 19(1): 24-27.
14. Merien f, Amouriaux P, Perolat P, Baranton G, Saint Girons I. Polymerase chain reaction for detection of Leptospira spp. in clinical samples. J Clin Microbiol 1992; 30(9): 2219-24.
15. Brown PD, Gravekamp C, Carrington DG, Van de Kemp H, Hartskeerl RA, Edwards CN, et al. Evaluation of the polymerase chain reaction for early diagnosis of leptospirosis. J Med Microbiol 1995; 43(2): 110-14.
16. Corney BG, Colley J, Djordjevic SP, Whittington R, Graham GC. Rapid identification of some Leptospira isolates from cattle by random amplified polymorphic DNA fingerprinting. J Clin Microbiol 1993; 11(3): 2927-32.
17. Romero EC, Billerbeck AE, Lando VS, Camargo ED, Souza CC, Yasuda PH. Detection of Leptospira DNA in patients with aseptic meningitis by PCR. J Clin Microbiol 1998; 36(5): 1453-55.
18. Merien F, Baranton G, Perolat P. Comparison of polymerase chain reaction with microagglutination test and culture for diagnosis of leptospirosis. J Infect Dis 1995; 172(1): 281-85.
19. Gravekamp C, Van de Kemp H, Franzen M, Carrington D, Schoone GJ, Van Eys GJ, et al. Detection of seven species of pathogenic leptospires by PCR using two sets of primers. J Gen Microbiol 1993; 139(8): 1691-700.
20. Ooteman MC, Vago AR, Koury MC. Evaluation of MAT, IgM ELISA and PCR methods for the diagnosis of human leptospirosis. J Microbiol Methods 2006; 65(2): 247-57.
21. De Abreu Fonseca C, Teixeira de Freitas VL, Caló Romero E, Spinosa C, Arroyo Sanches MC, da Silva MV, et al. Polymerase chain reaction in comparison with serological test for early diagnosis of human leptospirosis. Trop Med Int Health 2006; 11(11): 1699-707.
22. Bal AE, Gravekamp C, Hartskeerl RA, De Meza-Brewster J, Korver h, Terpstra WJ. Detection of leptospires in urine by PCR for early diagnosis of leptospirosis. J Clin Microbiol 1994; 32(8): 1894-98.
23. Van Eys GJ, Gravekamp C, Gerritsen MJ, Quint W, Cornelissen MT, Schegget JT, et al. Detection of leptospires in urine by polymerase chain reaction. J Clin Microbiol 1989; 27(10): 2258-62.
24. Wagenaar J, Zuerner RL, Alt D, Bolin CA. Comparison of polymerase chain reaction assays with bacteriologic culture, immunofluorescence, and nucleic acid hybridization for detection of Leptospira borgpetersenii serovar hardjo in urine of cattle. Am J Vet Res 2000; 61(3): 316-20.
Correspondencia:
Manuel Céspedes Zambrano.
Laboratorio de Referencia Nacional de Leptospirosis – Zoonosis Bacteriana, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
Dirección: Av. Defensores del Morro 2268, Chorrillos, Lima.
Teléfono: (511) 251-6151 / Fax: (511) 251-6151
Correo electrónico: mcespedes@ins.gob.pe