Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.24 no.1 Lima Jan./mar. 2007
ARTÍCULO ORIGINAL
Distribución vertical de Haemagogus janthinomys (dyar) (diptera: culicidae) en bosques de la amazonía peruana
Vertical distribution of the mosquito Haemagogus jantinomys (dyar) (diptera: culicidae) in forests of the peruvian amazon
John E. Ramírez P1a ; Stephen P. Yanoviak2,3a ; L. Philip Lounibos3a ; Scott C. Weaver2a
1 Facultad de Ciencia Biológicas, Universidad Nacional de la Amazonía Peruana. Loreto, Perú.
2 Department of Pathology, University of Texas Medical Branch. Texas, EE.UU.
3 Florida Medical Entomology Laboratory, University of Florida. Florida, EE.UU.
a Biólogo Entomólogo.
RESUMEN
Objetivos: Determinar si la abundancia del mosquito Haemagogus janthinomys está relacionada con la temperatura y la humedad relativa, y si varía entre el dosel y el sotobosque en tres tipos de bosques de la selva Amazónica, medido por cebo humano. Materiales y métodos: Se colectó Hg. janthinomys al mismo tiempo en dos estratos de tres sitios en tres tipos de bosques -bosque que se desarrolla sobre suelo arcilloso, sobre arena blanca (varillal), y bosques inundables (bajiales) cerca de Iquitos, Perú. Se midió la temperatura y la humedad relativa cada 15 minutos durante el tiempo de colecta. Resultados: No se encontró Hg. janthinomys en los bajiales mostrados. Su abundancia fue igual en el monte alto que en los varillales (Z = 1, 48; p = 0,14), pero fue mayor en el dosel (2,9; ± 0,89) que en el sotobosque (0,4; ± 0.23) (Z = 2,80; p = 0,005). No se encontró una relación entre la abundancia de Hg. janthinomys y la temperatura y la humedad relativa (F1, 14 < 0,33; p > 0057; r2 < 0,03). Conclusiones: Estos resultados preliminares indican que alrededor de Iquitos, como en otras regiones, Hg. janthinomys es más abundante en el dosel. También, los resultados sugieren que la probabilidad de encontrar Hg. janthinomys puede depender del tipo de bosque en la selva amazónica peruana, pero no depende en la variación de la temperatura ni la humedad relativa que es típica para los bosques tropicales.
Palabras clave: Culicidae / Crecimiento & Desarrollo; Picaduras; Perú (fuente: DeCS BIREME).
ABSTRACT
Objectives: Our goals were to determine if the abundance of the mosquito Haemagogus janthinomys is correlated with environmental variables, and if it differs between the canopy and understory in three different Amazonian forest types. Materials and methods: Adult Hg. janthinomys mosquitoes were collected via human landings simultaneously in the canopy and understory of three replicate high forest, white sand forest, and seasonally flooded forest sites near Iquitos, Peru. Temperature and relative humidity were recorded every 15 min. during the collection periods. Results: No Hg. janthinomys were collected in seasonally flooded forest. Their abundance was similar between high forest and white sand forest (Z = 1, 48; p = 0,14), but more individuals were encountered in the canopy (2.9; ± 0.89) than in the understory (0,4; ± 0.23) (Z = 2.80; p = 0,005). Hg. janthinomys abundance was not correlated with temperature or humidity (F1, 14 < 0.33; p > 0057; r2 < 0.03). Conclusions: These preliminary results show that around Iquitos as in other regions, Hg. janthinomys are most abundant in the forest canopy. They also suggest that the probability of encountering Hg. janthinomys it can depends both on forest type and height of sampling within forests, but is not a function of temperature and humidity within the ranges commonly encountered in tropical forests.
Key words: Culicidae / Growth & Development; Biting; Peru (source: DeCS BIREME).
INTRODUCCIÓN
Las enfermedades causadas por los arbovirus (virus transmitidos por artrópodos) se presentan con alta frecuencia en la cuenca amazónica y causan la muerte de varias personas cada año1,2. Entre ellos, los virus causantes de la fiebre amarilla selvática y el Mayaro son transmitidos por los mosquitos del género Haemagogus3-5.
Es escasa la información sobre la ecología o comportamiento de los Haemagogus en la Amazonía peruana, se ha notificado dos especies de estos en la región Loreto, Hg. janthinomys es la más común6.
Haemagogus spp. se distribuyen en los bosques de América Central y del Sur, su fase larvaria la desarrolla en huecos de árboles y de bambú3,7; sin embargo, se les puede encontrar también en recipientes artificiales8. Los adultos de Haemagogus spp. son de costumbres diurnas y antropofílicos, se encuentran en los bosques y zonas rurales, en particular al medio día donde realizan su máxima actividad9.
Galindo et al. investigaron la distribución de Haemagogus spp. en los bosques de Panamá10,11, descubriendo que los adultos de algunas especies se encuentran mayormente en el dosel (las copas de los árboles). Esta preferencia también se ha sido notificado para otras especies, como Sabethes chloropterus12.
En los bosques tropicales, las condiciones climatológicas (luz, temperatura, humedad) varían dramáticamente entre el dosel y el sotobosque (la zona sombrada desde el suelo hasta aproximadamente cuatro metros de altura)13, específicamente, en el dosel se encuentra menos humedad y temperaturas más altas que en el sotobosque. Esta variación abiótica influye en la distribución vertical de varias especies de plantas y animales14,15.
El objetivo del estudio fue medir la abundancia de adultos de Hg. janthinomys en dos estratos (dosel y sotobosque) de tres tipos de bosques de la Amazonía peruana, y su relación con la variación de parámetros climatológicos (temperatura y humedad relativa).
MATERIALES Y MÉTODOS
Este estudio se realizó en los bosques de los alrededores de la ciudad de Iquitos, departamento de Loreto, Perú (3,86°S, 73,34°O, elevación 120 msnm), región que recibe aprox. 2500 mm de lluvia por año.
Los bosques se clasifican según su posibilidad de inundación estacional, en bajiales o tahuampas si son inundados, y de tierra firme si no lo son, éstos últimos pueden desarrollarse sobre suelo arcilloso (monte alto) o sobre arena blanca (varillales)16,17. Descripción más detallada sobre estos ecosistemas se puede encontrar en otros textos16-19.
Se seleccionó tres sitios para cada uno de los tres tipos de bosques (N = 9, n=3: 3 varillales, 3 bajiales, y 3 de suelos arcillosos) cerca de la ciudad de Iquitos (Figura 1). En cada sitio se escogió un árbol de 30-40 m de altura y se ascendió en ellos según la técnica de soga fija, los mosquitos se colectaron al mismo tiempo en los dos estratos [sotobosque (1,5 m) y dosel (20-30 m)] mediante la técnica de cebo humano21.
La colecta fue realizada en el transcurso de la mañana (08.00 hasta 10.00 h), durante una hora por sitio, entre el 20 de enero y el 20 de agosto de 2005.
Se tomaron datos de temperatura (°C) y humedad relativa (HR) con un medidor digital (Forestry Suppliers #76255) al principio y cada 15 minutos durante cada sesión de colecta (N = 5 medidas por sesión). Los especímenes colectados fueron trasladados al laboratorio para su identificación.
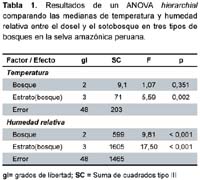
Se utilizó el análisis de varianza (ANOVA) hierarchical para diferenciar la variación en temperatura y HR por tipos de bosque y estratos (dosel y sotobosque) dentro de los bosques, y se usó la prueba de comparación múltiple de Tukey para determinar diferencias entre los factores22. Los datos de HR fueron normalizados por la transformación angular antes de ser analizados22. Todos los datos fueron probados por normalidad con la prueba Kolmogorov-Smirnov23. Ninguna transformación normalizó los datos de abundancia de Hg. janthinomys, por lo tanto, las diferencias entre tipos de bosque y estratos fueron analizados por la prueba no-paramétrica Wilcoxon. Se usaron α = 0,025 (Bonferroni-ajustada) para determinar diferencias significativas en estos análisis, se utilizó el SAS 2002 para realizar los respectivos análisis.23
RESULTADOS
Tras 54 horas de colecta (sin tomar en cuenta el tiempo usado para preparar el equipo y subir a los árboles), se colectaron 53 adultos de Haemagogus janthinomys en el dosel, y 8 individuos en el sotobosque. El mínimo colectado por sitio fue cero y el máximo fue 13. No se encontró Hg. janthinomys en el bosque tipo bajial, por lo que esta clase de bosque no fue incluido en el análisis estadístico de abundancia.
La abundancia de Hg. janthinomys en los bosques sobre suelo arcilloso (promedio; ± 1 error estándar = 2,6; ± 0,90) fue mayor que en los varillales (0,8; ± 0,35), pero la diferencia no fue significativa (Z = 1,48; p = 0,14). Sin embargo, en los estratos de estos dos tipos de bosques de tierra firme la abundancia de Hg. janthinomys fue más alta en el dosel (2,9; ± 0,89) que en el sotobosque (0,4; ± 0,23) (Z = 2,80; p = 0,005).
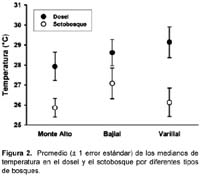
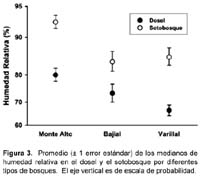
La temperatura (ºC) entre los tres tipos de bosques no varió significativamente; sin embargo, la temperatura fue mayor en el dosel que en el sotobosque (Tabla 1, Figura 2). La humedad relativa (HR) fue diferente entre los tres tipos de bosques y entre los estratos dentro de los bosques (Tabla 1, Figura 3). Específicamente, el promedio de las medianas de la HR (calculados por los dos estratos juntos) fue mayor en los bosques sobre suelo arcillosos que en los varillales y bajiales, y fue menor en el sotobosque que el dosel de cada bosque (Figura 3).
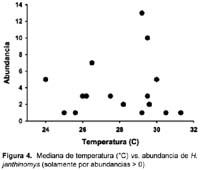
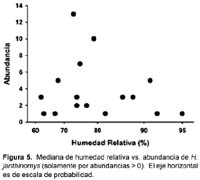
No hubo diferencias en los promedios (Z < 1,74; p > 0,08; Tabla 2) de temperatura o HR en los sitios según la presencia o ausencia de Hg. janthinomys. En los casos donde fue colectado Hg. janthinomys, su abundancia no estuvo relacionado con la HR ni con la temperatura (regresión linear: F1,14 < 0,33; p > 0,57, r2 < 0,03; Figuras 4 y 5).
DISCUSIÓN
Las características ambientales como la humedad relativa (HR) y la temperatura, varían entre el dosel y el sotobosque en los bosques tropicales 13. Estos factores pueden estar influenciados, por ejemplo, por la estructura del bosque, y la abundancia y duración de las lluvias18, pero frecuentemente la temperatura es mayor y la HR menor en el dosel que en el sotobosque. En este sentido, los resultados del presente estudio guardan relación con los de otros sitios tropicales.
La variación en las características abióticas entre el dosel y el sotobosque 30 m abajo puede influir en la distribución vertical de varias plantas y animales14,15, incluyendo los mosquitos24. No se encontró una relación entre la abundancia de Hg. janthinomys y la temperatura ni la HR en este estudio, pero es posible que otros factores no medidos afecten la distribución de estas especies. Por ejemplo, las características de la luz cambian mucho entre el dosel y el sotobosque en bosques tropicales25-27, y esta variación puede influir las actividades de los mosquitos.
La baja abundancia de Hg. janthinomys que se encontró probablemente fue, en parte, una consecuencia de la hora de colecta, ya que los Hg. janthinomys son más abundantes por la mitad del día 9. Por razones logísticas, las colecciones fueron hechas mayormente antes del mediodía. Por eso, se recomienda que otros proyectos que siguen esta investigación realicen colectas por más tiempo cada día o que empiecen más tarde, como a las 11.00 de la mañana.
Haemagogus janthinomys es una especie con hábitos arborícolas3. La distribución de esta especie entre diferentes tipos de bosques puede estar asociada con la abundancia de microhábitats de oviposición presentes. Los Hg. janthinomys mayormente ponen sus huevos en huecos de los árboles que contienen agua, la presencia de éstos huecos está en relación con la edad y el tipo del bosque28,29. También, áreas recién deforestadas pueden presentar muchos huecos en los troncos de los árboles caídos30. La ausencia de Hg. janthinomys en los bajiales de esta investigación puede ser por la menor abundancia de huecos de sus árboles.
Estudios que nos permitan conocer más sobre la ecología y comportamiento de los vectores de la fiebre amarilla selvática y Mayaro, nos da la oportunidad de buscar formas naturales de controlar su distribución y amplificación. También, pueden ayudar a predecir los efectos de alteraciones antropogénicas (como la deforestación) en los ciclos de transmisión de las enfermedades.
En resumen, los resultados de esta investigación confirman la preferencia del Haemagogus spp. en el dosel y en claros recién formados11; adicionalmente, brindan información sobre el posible mecanismo por esta preferencia aparente, ya que no está relacionado con la temperatura ni la HR, lo que nos insta a buscar otros factores como la intensidad de la luz o la densidad de sitios de oviposición.
Se recomienda continuar esta línea de investigación incluyendo un aumento en la cantidad de replicaciones en cada tipo de bosque, repetir el muestreo varias veces al año para ver cambios temporales, y determinar si la distribución y abundancia de otras especies (p.e., Sabethes spp.) están relacionadas con los mismos factores que los de Hg. janthinomys, dada la importancia de éste vector como transmisor de la fiebre amarilla selvática.
AGRADECIMIENTOS
Agradecemos al Blgo. Edwin Requena y al Tco. Calyder Valderrama quienes apoyaron en el trabajo de campo, al INRENA por proveer los permisos de colecta y exportación de los mosquitos, y a Úrsula Portocarrero por sus sugerencias que mejoraron el manuscrito. Este proyecto fue apoyado por la beca AI049725 del Instituto Nacional de Salud de los Estados Unidos a SCW.
REFERENCIAS BIBLIOGRÁFICAS
1. Vasconcelos PF, Rodrigues SG, Degallier N, Moraes MA, da Rosa JF, da Rosa ES, et al. An epidemic of sylvatic yellow fever in the southeast region of Maranhao State, Brazil, 1993-1994: epidemiologic and entomologic findings. Am J Trop Med Hyg 1997; 57(2):132-37. [ Links ]
2. Vasconcelos PF, Rosa AP, Rodrigues SG, Rosa ES, Monteiro HA, Cruz AC, et al. Yellow fever in Pará State, Amazon region of Brazil, 1998-1999: entomologic and epidemiologic findings. Emerg Infect Dis 2001; 7(3 Suppl): 565-69.
3. Arnell JH. Mosquito studies (Diptera, Culicidae) XXXII. A revision of the genus Haemagogus. Contrib Am Entomol Inst 1973; 10(2):1-174.
4. Hoch AL, Peterson NE, LeDuc JW, Pinheiro FP. An outbreak of Mayaro virus disease in Belterra, Brazil. III. Entomological and ecological studies. Am J Trop Med Hyg 1981; 30(3): 689-98.
5. Mondet B, Vasconcelos PF, Travassos da Rosa AP, Travassos da Rosa eS, Rodrigues SG, Travassos Rosa Jf, et al. Isolation of yellow fever virus from nulliparous Haemagogus (Haemagogus) janthinomys in eastern Amazonia. Vector Borne Zoonotic Dis 2002; 2(1): 47-50.
6. Jones JW, Turell MJ, Sardelis MR, Watts DM, Coleman RE, fernandez R, et al. Seasonal distribution, biology, and human attraction patterns of culicine mosquitoes (Diptera: Culicidae) in a forest near Puerto Almendras, Iquitos, Peru. J Med Entomol 2004; 41(3): 349-60.
7. Navarro JC. Fauna de mosquitos (Diptera: Culicidae) del Parque Nacional Cerro El Copey y nuevos registros para la Isla de Margarita, Venezuela. Bol Entomol Venez 1998; 13(2):187-194.
8. Lopes J. Ecologia de mosquitos (Diptera: Culicidae) em criadouros naturais e artificiais de área rural do Norte do Estado do Paraná, Brasil. V. Coleta de larvas em recipientes artificiais instalados em mata ciliar. Rev Saúde Publica 1997; 31(4): 370-77.
9. Chadee DD, Tikasingh ES, Ganesh R. Seasonality, biting cycle and parity of the yellow fever vector mosquito Haemagogus janthinomys in Trinidad. Med Vet Entomol 1992; 6(2):143-48.
10. Galindo P, Carpenter SJ, Trapido H. A contribution to the ecology and biology of tree hole breeding mosquitoes of Panama. Ann Entomol Soc Am 1955; 48:158-164.
11. Trapido H, Galindo P, Carpenter SJ. A survey of forest mosquitoes in relation to sylvan yellow fever in the Panama isthmian area. Am J Trop Med Hyg 1955; 4(3): 525-42.
12. Navarro JC, Machado-Allison CE. Aspectos ecológicos de Sabethes chloropterus (Diptera: Culicidae) en un bosque húmedo del Edo. Miranda, Venezuela. Bol Entomol Venez 1995; 10:91-104.
13. Parker GG. Structure and microclimate of forest canopies. En: Lowman MD, Nadkarni NM (eds). Forest canopies. San Diego: Academic Press; 1995. p. 73-106.
14. Allee WC. Measurement of environmental factors in the tropical rain-forest of Panama. Ecology 1926; 7(3):273-302.
15. Hosokawa T, Odani N, Tagawa H. Causality of the distribution of corticolous species in forests with special reference to the physio-ecological approach. Bryologist 1964; 67(4): 396-411.
16. Vásquez Martinez R. Flórula de las reservas biológicas de Iquitos, Perú. St. Louis: Missouri Botanical Garden; 1997. Monographs in systematic botany, vol. 63.
17. Villacorta RG, Reátegui MA, Zumaeta MO. Clasificación de bosques sobre arena blanca de la Zona Reservada Allpahuayo-Mishana. Folia Amaz 2002; 14(1):17-33.
18. Madigosky SR, Vatnick I. Microclimatic characteristics of a primary tropical Amazonian rain forest, ACEER, Iquitos, Peru. Selbyana 2000; 21:165-72.
19. Mäki S, Kalliola R, Vuorinen K. Road construction in the Peruvian Amazon: process, causes and consequences. Environ Conserv 2001; 28(3):199-214.
20. Perry DR. A method of access into the crowns of emergent and canopy trees. Biotropica 1978; 10(2): 155-57.
21. Service MW. A critical review of procedures for sampling populations of adult mosquitoes. Bull Entomol Res 1977; 67: 343-82.
22. Sokal RR, Rohlf FJ. Biometry: the principles and practice of statistics in biological research, 3rd ed. New York: W. H. Freeman & Company; 1995.
23. SAS Institute. SAS OnlineDoc® 9. Cary, North Carolina: SAS Institute Inc.
24. Pittendrigh CS. The bromeliad-Anopheles-malaria complex in Trinidad. I-The bromeliad flora. Evolution 1948; 2(1): 58-89.
25. Chazdon RL, Fetcher N. Photosynthetic light environments in a lowland tropical rain forest in Costa Rica. J Ecol 1984; 72(2): 553-64.
26. Endler JA. The color of light in forests and its implications. Ecol Monogr 1993; 63(1): 1-27.
27. Shashar N, Cronin TW, Wolf LB, Condon MA. The polarization of light in a tropical rain forest. Biotropica 1998; 30(2): 275-85.
28. Kitching RL. Food webs and container habitats–the natural history and ecology of phytotelmata. Cambridge: Cambridge University Press; 2000.
29. Yanoviak SP, Lounibos LP, Weaver SC. Land use affects macroinvertebrate community composition in phytotelmata in the Peruvian Amazon. Ann Entomol Soc Am 2006; 99(6): 1172-81.
30. Yanoviak SP, Ramírez JE, Lounibos LP, Weaver SC. Deforestation alters mosquito habitat availability and production in the Peruvian Amazon. Ecol Applic 2006; 16(5):1854-64.
Correspondencia:
Stephen P. Yanoviak.
Florida Medical Entomology Laboratory, University of Florida, EE.UU.
Dirección: 200 9th Street SE, Vero Beach, FL 32962, EE.UU.
Teléfono: 772-778-7200; FAX: 772-778-7205.
Correo electrónico: syanoviak@yahoo.com