Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.24 no.3 Lima July/set 2007
COMUNICACIONES CORTAS
Conjuntivitis folicular por Chlamydia trachomatis: frecuencia y pruebas diagnósticas
Follicular conjunctivitis caused by Chlamydia trachomatis: frequency and diagnosis test
María E. Muñoz Z1a, Patricia Caballero Ñ1b, Carlos Ayllón A2c, Sonia Medina A1a
1 Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
2 Laboratorio de Microbiología Ocular, Instituto Nacional de Oftalmología. Lima, Perú.
a Tecnóloga médica; b Médico infectóloga; c Biólogo.
RESUMEN
La Chlamydia trachomatis es la principal causa infecciosa de ceguera en el mundo, que empieza como conjuntivitis folicular. En el Perú se han realizado pocos estudios, debido a su dificultad diagnóstica. Se realizó un estudio en 55 pacientes de 18 a 68 años con diagnóstico de conjuntivitis folicular atendidos en el Instituto Nacional de Oftalmología (Lima, Perú) durante los años 2005 y 2006, con el objetivo de determinar la frecuencia de infección por Chlamydia trachomatis y evaluar la utilidad de la tinción de Giemsa y la inmunofluorescencia directa (IFD) para el diagnóstico de C. trachomatis en relación con el cultivo celular. La frecuencia de C. trachomatis en muestras de secreciones de conjuntivitis folicular fue de 13% (7/55) por cultivo celular, 20% (11/55) por IFD y de 9%(5/55) por Giemsa; los signos y síntomas más frecuentes fueron la presencia de secreciones y fotofobia. Todos los casos fueron varones y manifestaron no tener antecendentes de infecciones de transmisión sexual previas. Se encontró una sensibilidad de 42,9 y 85,7 % y una especificidad de 98,8 y 89,6% para la tinción Giemsa e IFD respectivamente.
Palabras clave: Infecciones por Chlamydia; Tracoma; Conjuntivitis de inclusión; Perú (fuente: DeCS BIREME).
ABSTRACT
Chlamydia trachomatis is the principal infectious cause of blindness in the world, which begins as follicular conjunctivitis. In Peru few studies was realized by its difficulty to diagnose. A study was conducted in 55 patients 18 to 68 years with follicular conjunctivitis treated at the Instituto Nacional de Oftalmología (Lima, Peru) during the years 2005 and 2006, with the objective of determining the prevalence of Chlamydia trachomatis and evaluated the usefulness of Giemsa and direct immunofluorescence (DIF) for the diagnosis of C. trachomatis in relation to cell culture. The frequency of C. trachomatis in samples of eyes secretions was 13% (7/55) for cell culture, 20% (11/55) for DIF and 9% (5/55) for Giemsa; the signs and symptoms more frequents were the presence of secretions and photophobia. All cases were males and reported not having had prior sexually transmitted infections. We found a sensitivity of 42,9 and 85,7%, and a specificity of 98,8 and 89,6% for Giemsa and DIF respectively.
Key words: Chlamydia infections; Trachoma; Conjunctivitis, Inclusion; Peru (source: DeCS BIREME).
INTRODUCCIÓN
La Chlamydia trachomatis es el principal agente infeccioso causante de ceguera a nivel mundial, se estima que existen seis millones de personas irreversiblemente ciegas por tracoma (estadio avanzado de la infección que empieza como conjuntivitis folicular)1; por ello la Organización Mundial de la Salud se ha propuesto erradicar el tracoma en el año 20202, que afecta principalmente a zonas pobres de África y el sudeste asiático2.
La conjuntivitis folicular por C. trachomatis se transmite por contacto directo o indirecto con secreciones genitales infectadas3-5, puede afectar a una o ambas conjuntivas tarsales. En el recién nacido se manifiesta como una conjuntivitis aguda mucopurulenta con hiperemia intensa, quemosis y formación de pseudomembranas; se distingue de la oftalmia neonatorum gonocócica porque se presenta en forma más tardía al parto (5 a 12 días postparto)6,7.
En el adulto produce una conjuntivitis folicular crónica caracterizada por cuadros recurrentes de hiperemia ocular, secreción mucopurulenta, fotofobia y ocasionalmente edema palpebral. Clínicamente se observa infiltración inflamatoria y engrosamiento de la conjuntiva tarsal superior, folículos y se asocia a queratitis puntiforme superior; puede cursar con infiltrados subepiteliales corneales y en etapas crónicas se manifiesta un micropannus (vascularización superficial de la córnea) superior1.
Existen pocos reportes en Latinoamérica sobre la frecuencia de C. trachomatis en pacientes con conjuntivitis, tanto pediátricos7,8, como adultos9. En el Perú, se hizo un estudio en población shipiba donde se encontró 74% de su población con conjuntivitis folicular, causada en 94% de los casos por C. trachomatis. No se han encontrado más referencias que documenten su frecuencia en el Perú, particularmente en población adulta, esto principalmente por su dificultad diagnóstica, llevando a la falta de documentación de la enfermedad y a un tratamiento inadecuado de muchos pacientes, con el riesgo de ceguera o daño visual a largo plazo.
Por ello, el propósito del estudio fue determinar la frecuencia de infección por C. trachomatis en pacientes ambulatorios del Instituto Nacional de Oftalmología (INO) con diagnóstico de conjuntivitis folicular, mediante cultivo celular, inmunofluorescencia directa y tinción de Giemsa, y evaluar la sensibilidad y especificidad de estas pruebas para el diagnóstico de Chlamydia trachomatis.
EL ESTUDIO
Se realizó un estudio transversal con los pacientes que tuvieron diagnóstico clínico de conjuntivitis folicular en los consultorios externos del Instituto Nacional de Oftalmología (Centro Nacional de Referencia ubicado en Lima, Perú) durante los años 2006 y 2007. Estos pacientes fueron derivados al Laboratorio de Microbiología del INO, donde se les tomó muestras de hisopados conjuntivales por triplicado para el diagnóstico de Chlamydia trachomatis por cultivo, inmunofluorescencia directa (IFD) y coloración Giemsa. Se les tomó datos sobre la evolución de la enfermedad y se solicitó su consentimiento informado para la realización del estudio.
Para el cultivo celular, se procesó uno de los hisopados en línea celular Mc Coy identificando las inclusiones de glucógeno teñidas con lugol en las muestras positivas; para la IFD se consideró como muestra positiva las inclusiones de diferente forma de C. trachomatis de color verde manzana sobre un fondo rojizo, ambos procedimientos se realizaron sobre un control positivo y uno negativo para validar el ensayo9,11,12. Para el caso de las muestras coloreadas con Giemsa, se consideraron positivas con la presencia de cuerpos elementales –cuerpos de inclusión- en 4 ó 5 campos por muestra.
Se tomaron en total 55 muestras de conjuntiva superior e inferior para diagnóstico de Chlamydia, se detectó 11 (20%) casos positivos por IFD, 7 (13%) por cultivo celular y 5 (9%) por Giemsa. Las edades de los pacientes atendidos fueron de 22 a 66 con un promedio de 39 años, todos fueron varones. La presencia de secreciones se dio en 10(91%) casos (Tabla 1), que fueron de característica mucoide (7), mucopurulenta (1) y sanguinolenta en uno (1).
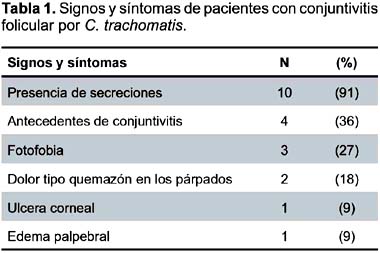
Sólo un caso manifestó tener más de una pareja sexual, un caso tuvo adenopatías cervicales, ninguno informó antecedente de infecciones de transmisión sexual (ITS) previas, o tener sintomatología relacionada en el momento de la muestra. No se tomaron muestras para descartar presencias de ITS.
Usando al cultivo celular como patrón de oro (Tabla 2), se calculó la sensibilidad, especificidad y valores predictivos de la IFD para el diagnóstico de C. trachomatis en pacientes con conjuntivitis folicular. La sensibilidad fue de 85,7% (IC95%: 52,7-100), la especificidad de 89,6% (IC95%: 79,9-99,3), el valor predictivo positivo de 54,6% (IC95%: 20,6-88,5) y el valor predictivo negativo de 97,7% (IC95%: 92,2 -100) y un kappa de 0,61 (IC95%: 0,32-0,89).
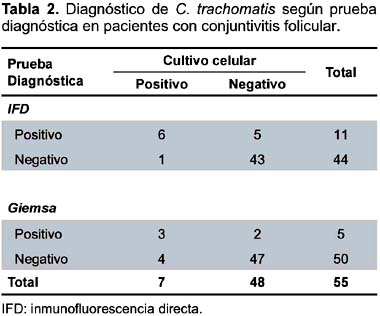
Para el caso de la tinción Giemsa, la sensibilidad fue de 42,9% (IC95%: 0-86,7), la especificidad de 95,8% (IC95%: 89,1-100), el valor predictivo positivo de 60,0% (IC95%: 7,1-100) y el valor predictivo negativo de 92,0% (IC95%: 83,5 -100) y un Kappa de 0,44 (IC95%: 0,07- 0,81). La concordancia entre el IFD y Giemsa fue de 0,57 (IC95%: 0,28 -0,86).
DISCUSION
La frecuencia hallada de C. trachomatis en pacientes con conjuntivis folicular es similar a lo reportado por Milano (15%) en Italia13, pero menor a lo encontrado por Basualdo (65%) en Buenos Aires9 usando el cultivo celular debido posiblemente a que la población que incluyó en su estudio tenían tratamiento fallido y estudios para patógenos tradicionales negativos. La presencia de Chlamydia como agente causal de conjuntivitis varía según la población de estudio siendo más frecuente en neonatos7,14.
Llama la atención la cantidad de falsos positivos con IFD en relación al cultivo celular (Tabla 2), esto probablemente se debió a que algunas muestras fueron mantenidas por un periodo largo (tres meses) antes de realizar el cultivo y hayan perdido la capacidad de reproducirse, así mismo es conocida la dificultad que existe para el aislamiento de Chlamydias por cultivo, por lo que se han desarrollado técnicas moleculares que permiten resultados más rápidos y con mayor sensibilidad como el PCR14,15 que no son de uso común en el diagnóstico en países en desarrollo como el Perú.
Otro factor que puede explicar estos falsos positivos, es la subjetividad asociada a la lectura e interpretación del IFD; sin embargo, el uso de controles positivos y negativos nos permite alejar esta posibilidad.
En relación a los resultados con Giemsa, es conocido que si bien es más económico y fácil de utilizar, su sensibilidad es baja11, como lo muestran nuestros resultados, pero es la herramienta que más se usa para el diagnóstico de C. trachomatis en los hospitales del Perú. Esto podría explicar el poco reporte de casos y consecuente interés por esta infección, ya que para que los resultados sean satisfactorios la toma de muestra se debe realizar en condiciones adecuadas y los medios de cultivo, soluciones de lavado así como equipos (estufas, microscopios, cámara húmeda) se encuentren en condiciones óptimas.
Llama la atención que ninguno de los pacientes que fueron tuvieron infección por C. trachomatis refieran sintomatología o antecedentes de infecciones de transmisión sexual; sin embargo, existen algunos estudios que reportan situaciones similares16.
Esta primera aproximación, nos permite demostrar la importancia de C. trachomatis como agente causal de conjuntivitis folicular en adultos atendidos en el centro de referencia nacional de oftalmología en el Perú, por lo que deben implementarse las técnicas diagnósticas adecuadas, por lo menos inmunofluorescencia directa. Futuros estudios con técnicas moleculares o en población infantil permitirían conocer el espectro de la enfermedad en el país.
REFERENCIAS BIBLIOGRÁFICAS
1. Kasi PM, Gilani AI, Ahmad K, Janjua NZ. Blinding trachoma: a disease of poverty. Plos Med. 2004; 1(2): e4.
2. Mariotti SP, Pararajasegaram R, Resnikoff S. Trachoma: looking forward to global elimination of trachoma by 2020 (GET 2020). Am J Trop Med Hyg. 2003; 69 (Suppl 5): 33- 35.
3. Postema EJ, Remeijer L, van der Meijden WI. Epidemiology of genital chlamydial infections in patients with chlamydial conjunctivitis; a retrospective study. Genitourin Med. 1996; 7283): 203-5.
4. Garland SM, Malatt A, Tabrizi S, Grando D, Lees MI, Andrew JH, et al. Chlamydia trachomatis conjunctivitis. Prevalence and association with genital tract infection. Med J Aust. 1995; 162(7): 363-66.
5. Rackstraw S, Viswalingam ND, Goh BT. Can chlamydial conjunctivitis result from direct ejaculation into the eye?. Int J STD AIDS. 2006; 17(9): 639-41.
6. Mohile M, Deorari AK, Satpathy G, Sharma A, Singh M. Microbiological study of neonatal conjunctivitis with special reference to Chlamydia trachomatis. Indian J Ophthalmol. 2002; 50(4): 295-99.
7. Valencia C, Prado V, Rios M, Cruz MA, Pilorget JJ. Prevalencia de Chlamydia trachomatis en conjuntivitis neonatal determinada mediante las técnicas de inmunofluorescencia y amplificación génica. Rev Med Chile. 2000; 128(7): 758-65.
8. Goldschmidt P, Vanzzini Zago V, Diaz Vargas L, Espinoza García L, Morales Montoya C, Peralta B, et al. Chlamydia trachomatis in the conjunctiva of children living in three rural areas in Mexico. Rev Panam Salud Publica. 2007; 22(1): 29-34.
9. Basualdo JA, Huarte L, Bautista E, Niedfeld G, Alfonso G, Rosso N, et al. Conjuntivitis folicular debida a Chlamydia trachomatis. Medicina (Bs Aires). 2001; 61(4): 397-400.
10. Wong C, Nava A, Calderón M, Guerra L, Chea C, Pongo L, et al. Hallazgos oftalmológicos en la comunidad Shipiba de Santa Teresita: tracoma, demostración citológica. Rev Peru Oftalmol. 1986; 12(1): 14-16.
11. Solomon AW, Peeling RW, Foster A, Mabey DC. Diagnosis and assessment of trachoma. Clin Microbiol Rev. 2004; 17(4): 982-1011.
12. E lnifro EM, Cooper RJ, Klapper PE, Bailey AS, Tullo AB. Diagnosis of viral and chlamydial keratoconjunctivitis: wich laboratory test? Br J Ophthalomol. 1999; 83: 622-27.
13. Milano F, Gorini G, Olliaro P, Astori M, Furiosi G, Trimarchi F. Evaluation of diagnosis procedures in chlamydial eye infection. Ophthalmologica. 1991; 203: 114-7.
14. Javaloy J, Ferrer C, Vidal MT, Alió JL. Follicular conjunctivitis caused by Chlamydia trachomatis in an infant Saharan population: molecular and clinical diagnosis. Br J Ophthalmol. 2003; 87: 142-46.
15. Solomon AW, Holland MJ, Burton MJ, West SK, Alexander ND, Aguirre A, et al. Strategies for control of trachoma: observational study with quantitative PCR. Lancet. 2003; 362: 198-204.
16. Stenberg K, Mardh PA. Genital infection with Chlamydia trachomatis in patients with chlamydial conjunctivitis: unexplained results. Sex Transm Dis. 1991; 18(1): 1-4.
Correspondencia:
María Elena Muñoz Zambrano
Laboratorio de Bacterias de Transmisión Sexual, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
Dirección: Calle Cápac Yupanqui 1400, Lima 11 – Perú. Apartado postal 471.
Teléfonos: (511) 4719920 anexo 165
Correo electrónico: mmunoz@ins.gob.pe














