Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.24 no.4 Lima Oct./dic. 2007
ARTÍCULO ORIGINAL
Factores de riesgo asociados a infección aguda por hepatitis B en población militar destacada al departamento de Amazonas, Perú
Risk factors associated to acute hepatitis B infection in Peruvian military personnel deployed in Amazonas, Perú
César Cabezas1,2,a; J. Jaime Miranda3,4,b; Giovana Romero1,c; Magna Suárez1,c; Frine Samalvides3,4,a; Juan Echevarría3,4,a; Juan D. Valdivia3,d; Walter A. Valdivia3,d
1 Instituto Nacional de Salud. Lima, Perú.
2 Instituto de Medicina Tropical Daniel A Carrión, Universidad Nacional Mayor de San Marcos. Lima, Perú.
3 Facultad de Medicina Alberto Hurtado, Universidad Peruana Cayetano Heredia. Lima, Perú.
4 Wellcome Trust Research Training Fellow, London School of Hygiene and Tropical Medicine. London, UK (Afiliación actual).
5 Instituto de Medicina Tropical Alexander von Humboldt, Universidad Peruana Cayetano Heredia. Lima, Perú.
a Médico infectólogo, b Médico epidemiológo, c Bióloga, d Médico cirujano
RESUMEN
El Perú es considerado un país de endemicidad intermedia-alta para el virus de hepatitis B (VHB), con variaciones entre diferentes regiones. Existen pocos reportes del problema de infección por el VHB en personal militar. Objetivos. Determinar los factores de riesgo asociados con el desarrollo de infección por el VHB en un brote epidémico en personal militar destacado en Ampama, Amazonas, Perú. Material y métodos. Estudio caso-control en personal militar destacado al puesto de Ampama y a la base El Milagro, departamento de Amazonas. Fueron evaluados HBsAg y posibles factores de riesgo asociados a un incremento de riesgo de adquirir el VHB. Resultados. Se estudió a 123 personas, repartidos en 41 sujetos en cada uno de los grupos (casos, control 1 y control 2). 73,2% de los casos tuvo confirmación de infección aguda por el VHB (IgM anti HBc positivo) y anti Delta fue positivo en 1/37 (2,7%) caso. Ninguno de los factores de riesgo evaluados mostró una asociación significativa con hepatitis B. Algunos factores de riesgo con posible asociación fueron contacto con personal con hepatitis B (OR 2,3; IC95% 0,9 – 5,7) y mordedura de murciélago (OR 1,6; IC95% 0,6 – 4,4). Conclusiones. Los factores de riesgo clásicos asociados con la transmisión del virus de la hepatitis B no fueron significativos. El personal militar es un grupo en riesgo para infectarse con el VHB.
Palabras clave: Hepatitis B; Hepatitis Delta; Personal Militar; Estudios de casos y controles; Amazonía; Perú (fuente: DeCS BIREME).
ABSTRACT
Peru is considered a mid-high endemic country for viral hepatitis B virus (HBV) and its prevalence varies between regions. There is limited reported data of the problem of HBV infection in rural areas and military personnel. Objective. We evaluated risk factors associated with an increased risk of HBV infection in an outbreak among military personnel deployed in the rainforest region of Ampama, Amazonas, Peru. Material and methods. Case-control study amongst soldiers placed in Ampama post and El Milagro base. HBsAg and potential family, personal, hygiene and sanitation and specific risk factors for the area were evaluated. Results. A total of 123 male military personnel, 41 in each group (cases, control group 1 and control group 2) were included in the study. 73.2% of cases had confirmed HBV acute infection (IgM anti-HBc positive) and delta antibody was positive in 1/37 (2.7%) of the cases. None of the traditional risk factors showed a significant association with hepatitis B. Some risk factors with borderline association were contact with someone sick due to hepatitis B (OR 2.3, 95%IC 0.9 – 5.7) and bat bites (OR 1.6, 95%CI 0.6 – 4.4). Conclusions. The outbreak described was due to HBV and classical risk factors did not show an association with hepatitis B in this study. Military personnel are a risk group to develop HBV infection and HBV continues to be an important problem in these areas.
Key words: Hepatitis B, Hepatitis Delta; Military personnel; Case-control studies; Amazonian; Peru (source: DeCS BIREME).
INTRODUCCIÓN
La infección por el virus de la hepatitis B (VHB) se constituye como un problema global1-3. De acuerdo con la Organización Mundial de la Salud, 30% de la población mundial, cerca de 2000 millones de personas, muestran signos serológicos de infección por el VHB. De estas, 350 millones están infectadas crónicamente por el VHB, y cada año aproximadamente un millón de ellas muere a causa del hepatitis crónica activa, cirrosis o cáncer hepático3.
Más allá de sus efectos en la persona, sus efectos en la salud pública son también importantes, si consideramos que tres cuartas partes de la población mundial viven en áreas donde la prevalencia de la infección crónica por el VHB es del 2% o mayor4. El Perú está considerado entre los países de endemicidad intermedia-alta para el VHB, de acuerdo con la prevalencia del antígeno de superficie (HBsAg) y anticuerpos anti HbsAg4-6. Dentro del país, estas prevalencias varían significativamente entre las diferentes regiones, y aún más dentro de ellas7,8.
La infección por el VHB suele presentarse muchas veces como brotes epidémicos, particularmente en personas susceptibles y es particularmente reconocida entre el personal militar en otros entornos9-14, especialmente en los Estados Unidos12,15-17. Tradicionalmente, en la mayoría de brotes en personal militar, se asocia al VHB con un mecanismo de contagio predominantemente parenteral15, sea por exposición a sangre contaminada15,18, uso de drogas inyectables16,19,20 y conducta sexual de riesgo15,16,21,22. Sin embargo, cuando este mismo grupo poblacional es asignado a zonas de mayor endemicidad, se plantean otros factores asociados, los que están relacionados principalmente con la transmisión no parenteral u horizontal23-26. Más aún, se propone la posibilidad de que algunos vectores, por ejemplo mosquitos, pudieran estar relacionados con dicha transmisión24.
El presente estudio describe un brote de hepatitis B en personal militar asignado a un área hiperendémica de la selva peruana8,27,28. El objetivo del presente estudio fue determinar los factores de riesgo asociados con el desarrollo de infección por el VHB en un brote epidémico en personal militar destacado en Ampama, Amazonas.
MATERIALES Y MÉTODOS
DESCRIPCIÓN DEL BROTE
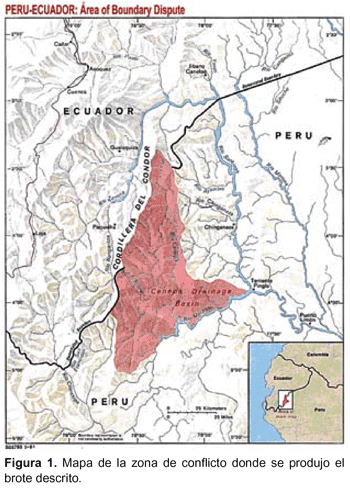
En 1996 se produjo un conflicto armado entre Perú y Ecuador en la localidad del Cenepa (Figura 1) estando en disputa un área limítrofe no demarcada. Efectivos militares fueron movilizados hacia esa zona, la cual corresponde a un área de selva tropical perteneciente al departamento de Amazonas. Una de las bases establecidas fue la llamada El Milagro, ubicada en las proximidades de Bagua, capital de la provincia de Bagua, Amazonas. Ampama es un campamento, cercano al cual estaban los frentes de combate, y en este campamento, localizado a cuatro horas por helicóptero de la base El Milagro, es que se atendían a los soldados que enfermaban.
El personal del Instituto Nacional de Salud (INS) en Lima, fue comunicado de la aparición de un brote –definido como tal por la aparición de un número elevado de casos en población previamente sana– de una enfermedad caracterizada por ictericia, en el personal destacado al puesto de Ampama, entre enero y agosto de 1996. Dicho brote no fue reportado en otros puestos ni en la base El Milagro. El ingreso del personal militar a la zona, aparentemente sanos y en buena condición, fue entre cuatro a cinco meses antes del reporte del brote.
Un equipo de intervención rápida acudió a la zona de conflicto a fin de evaluar el brote epidémico y tomar medidas de control. Por las condiciones de conflicto, no se pudo contar con información detallada del brote, tales como identificación de caso índice, ni fuente de origen del brote, y se puso especial énfasis en identificar la patología del brote.
Se aplicó una ficha de recolección de datos y evaluación rápida de brotes infecciosos, usualmente utilizada por el equipo del INS en el estudio de brotes epidémicos de enfermedades infecciosas, a fin de evaluar los factores asociados a la aparición de este brote.
Por tratarse de una evaluación rápida en el contexto de un brote epidémico y, por los costos involucrados, todos los sueros de los sujetos evaluados fueron estudiados inicialmente para el HBsAg. Tal marcador ha sido sugerido en otros trabajos para la definición de casos de hepatitis aguda29,30. Por otro lado, un estudio extenso de los marcadores serológicos no es costo efectivo en un paciente con hepatitis aguda31.
En algunos casos se pudo evaluar los IgM anti HBc (anticuerpo IgM contra la sección central del virus), anti HBc totales y antígeno delta. Sin embargo, dado que la mayoría de controles eran sujetos aparentemente sanos, no se hizo un estudio completo de todos los marcadores en estos grupos. Se usó la prueba estándar EIA (Enzyme Immunoassay, Laboratorios Abbott).
Las muestras fueron colectadas y manejadas por el equipo de intervención rápida del INS, siendo transportadas en cadena de frío, según los estándares de laboratorio, para su estudio en la capital a cargo del Laboratorio de Virología del INS.
DISEÑO
Estudio caso-control en personal militar asignado a la zona de Ampama, relación 1:2. El grupo de casos correspondió a los que desarrollaron infección aguda por el VHB en la base de Ampama.
Los controles correspondieron a: 1) personal militar que ingresó a la misma zona pero que no desarrolló infección, y 2) personal militar asignado a otra zona de la selva, que no ingresó a la zona del brote y que no desarrolló infección.
POBLACIÓN DE ESTUDIO
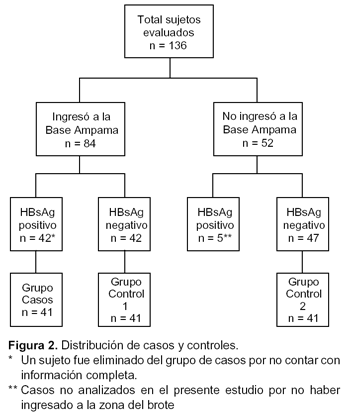
Fueron destacadas 136 personas a la Base El Milagro, Puesto Ampama, Departamento de Amazonas, Perú (Figura 1), 84 de ellos ingresaron a la zona de Ampama donde se produjo el brote epidémico, y los 52 restantes permanecieron en la Base El Milagro (Figura 2). En el grupo de militares que ingresaron a la zona de Ampama, 42/84 (50%) fueron HBsAg positivo. En contraste, entre aquellos que permanecieron en la Base El Milagro, 5/52 (9,6%) fueron HBsAg positivo.
La hepatitis B aguda fue definida como la presencia de HBsAg positivo en presencia de ictericia28. Los criterios de inclusión para cada uno de los grupos de estudio fueron:
Casos. Presencia de ictericia clínica al momento del estudio, antígeno de superficie (HBsAg) positivo29,30 y haber sido destacado al Puesto de Ampama.
Grupo control 1. Ausencia de ictericia clínica al momento del estudio, HBsAg negativo, y haber sido destacado al Puesto de Ampama.
Grupo control 2. Ausencia de ictericia clínica al momento del estudio, HBsAg negativo, y no haber sido destacado al Puesto de Ampama.
Para todos los grupos definidos, se consideró como único criterio de exclusión el no cumplir simultáneamente con todos los criterios de inclusión.
TAMAÑO MUESTRAL Y GRUPOS DE ESTUDIO
Tomando en cuenta las prevalencias de HBsAg entre los grupos que ingresaron (50%) y los que no ingresaron (9,6%) a la zona de Ampama (Figura 2), se requeriría un tamaño muestral de 14 sujetos por cada grupo para encontrar una diferencia de 40%, con un poder de 90% y un error alfa de 0,05.
De 42 casos elegibles, uno fue descartado por presentar información incompleta, quedando el grupo de casos conformado por 41 sujetos. En el caso de los grupos control, se contó con 42 sujetos para el grupo 1 y 47 para el grupo 2, de los cuales se seleccionaron en forma aleatoria 41 sujetos para cada grupo control (Figura 2).
Los grupos quedaron conformados de la siguiente manera: i) Casos: 41 pacientes con diagnóstico de hepatitis viral B en Ampama; ii) Grupo control 1: 41 sujetos sanos en Ampama; iii) Grupo control 2: 41 sujetos sanos en El Milagro.
Un cálculo retrospectivo tomando en cuenta el tamaño muestral alcanzado en cada grupo (n=41) y las cifras de prevalencia antes reportadas, se logra un poder (1-ß) para el presente estudio de 99%.
VARIABLES DE ESTUDIO
El HBsAg estuvo disponible en todos los sujetos estudiados. Sólo el grupo de casos tuvo estudio completo adicional con marcadores IgM anti HBc y anti Delta. Se evaluó una serie de factores de riesgo, tanto en el ámbito individual (antecedentes de cirugías, tatuajes, transfusiones, extracciones dentales, relaciones sexuales con trabajadoras sexuales), familiar (antecedente familiar de hepatitis o cáncer hepático), antecedentes de salubridad (presencia de ratas, acceso a desagüe, lugar de alimentación) y antecedentes específicos para la zona de estudio (contacto con personas con ictericia o hepatitis B, uso de mosquitero y mordedura por murciélago).
ANÁLISIS ESTADÍSTICO
Los datos obtenidos se almacenaron y procesaron en el paquete estadístico SPSS versión 9.0. Se calculó frecuencias y porcentajes para las variables discretas. Para las variables continuas se calculó la media y desviación estándar (DS).
Se realizó análisis bivariados entre casos y grupos controles. Se aplicó las pruebas estadísticas Chicuadrado y test exacto de Fisher según correspondía. Se tomó como significativo un p<0,05. Para conocer el grado de asociación como factor de riesgo se calculó el odds ratio (OR) y el intervalo de confianza al 95% (IC 95%).
Estos análisis se hicieron independientemente entre casos–grupo control 1 y casos–grupo control 2. Este tipo de análisis permite corroborar potenciales asociaciones usando distintos grupos de comparación, lo que resulta más informativo y permite deslindar posibles asociaciones espurias. En tal sentido, la primera comparación entre casos y controles 2, que no entraron a la zona, permitiría identificar posibles asociaciones entre hepatitis B aguda con un factor de riesgo en particular. La comparación entre casos y controles 1, aquellos que entraron a la zona y no desarrollaron hepatitis aguda, permitirá corroborar tal asociación descrita inicialmente.
RESULTADOS
Todas las personas estudiadas fueron personal militar de sexo masculino, movilizados hacia el puesto de Ampama y la Base El Milagro, en el departamento de Amazonas. El total de sujetos evaluados en cada uno de los grupos cumplieron con los criterios de inclusión especificados para cada uno de ellos, de manera que en la muestra estudiada no se cuenta con ningún caso que haya tenido HBsAg sin ictericia, o viceversa.
Las edades promedio (± DS) de los participantes en el grupo de casos, control 1 y control 2 fueron 20,1 (2,28), 19,98 (3,62) y 18,98 (3,31) años, respectivamente.
Del total de casos, 30/41(73,2%) fueron positivos para anticuerpos IgM anti HBc y, por otro lado, el antígeno Delta estuvo presente en 1/37 casos evaluados (2,7%), y en ninguno de los evaluados de los grupos control.
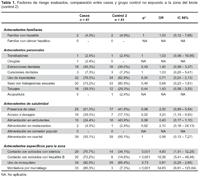
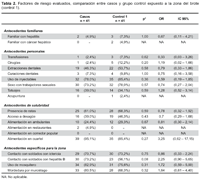
Los resultados del análisis bivariado de factores de riesgo que pudieran estar relacionados con el desarrollo de hepatitis B entre el grupo de casos y grupos controles se muestran en las tabla 1 y tabla 2.
En los análisis de casos con cada uno de los grupos control no se encontró diferencia significativa entre los antecedentes familiares, en donde se evaluó el antecedente de tener un familiar con cáncer hepático o con hepatitis.
Entre los antecedentes personales, no se encontró una diferencia estadísticamente significativa entre los casos y controles para los antecedentes de transfusiones, cirugías, extracciones o curaciones dentales, uso de inyectables, relaciones sexuales con trabajadoras sexuales, tatuajes y acupuntura; aunque esta última fue más frecuente entre los grupos controles. En el caso de antecedentes de salubridad, hubo diferencia en el acceso a desagüe como factor de riesgo para adquirir la infección entre casos y grupo control 2, con un OR 3,2 [IC 1,15 – 8,93] (Tabla 1). Esta asociación no fue significativa cuando se compararon casos y controles expuestos a la misma zona del brote (Tabla 2).
En cuanto a los factores específicos para la zona, al comparar los casos con los controles no expuestos a la zona (Tabla 1), se nota que hubo diferencia significativa en los siguientes factores: contacto con personal con ictericia (OR 4,83 [IC 1,91 – 12,25]), contacto con personal con hepatitis B (OR 16,36 [IC 5,41 – 49,48]) y antecedente de mordedura por murciélago (OR 34,83 [IC 9,82 – 123,64]). Al hacer la comparación entre los grupos de casos y controles expuestos a la zona del brote (Tabla 2), no se observan diferencias estadísticamente significativas para ninguno de estos factores.
DISCUSIÓN
El presente estudio confirma la existencia de un brote de hepatitis aguda ocasionada por el virus de hepatitis B. La zona ha sido descrita previamente como una zona endémica para hepatitis viral de tipo B y Delta28. El antígeno Delta se estudió en 37 casos (90,2%), siendo solamente un caso (2,7%) positivo para este marcador.
Dado que los controles eran sujetos clínicamente sanos y con antígeno de superficie negativo, no se realizó las pruebas para este marcador en dichos grupos, pues se sabe que el virus de la hepatitis Delta se presenta usualmente como una coinfección junto con el VHB. Este hallazgo difiere a los reportes de Casey et al.32 y Ruiz et al.28, por lo que la hepatitis por el virus delta no se constituye en un agente importante en el presente brote.
Si bien en la comparación entre casos y grupo control 2 (no expuestos), se encontró inicialmente una asociación significativa entre algunos factores de riesgo y hepatitis B, éstas no fueron confirmadas en el análisis entre casos y grupo control 1 (expuestos).
En cuanto a los factores de riesgo evaluados, se sabe que los factores de riesgo para adquirir la infección por el VHB en epidemias no son necesariamente los mismos que en una endemia. En este estudio, ninguno de los clásicos factores de riesgo asociados con infección por el VHB en personal militar -y población generaltales como uso de inyectables, relaciones sexuales, cirugías y transfusiones, tuvo una diferencia significativa en el presente estudio. Los factores familiares que se evaluaron tampoco mostraron diferencias entre los sujetos evaluados.
La búsqueda de factores de riesgo vinculados a la infección por VHB resulta difícil. Estados Unidos, país de baja endemicidad para el VHB, reporta que entre 30 a 40% de la población no describe factor de riesgo alguno para la adquisición de la infección por el VHB mediante estudios por centros centinelas29.
Las diferencias observadas para los factores contacto con personal con hepatitis B y antecedente de mordedura por murciélago, son significativas inicialmente entre casos y grupo control 2, sin embargo, la magnitud de la asociación decrece cuando se comparan con el grupo control 1 (OR 2,3, IC95% 0,9 – 5,7 para contacto con personal con hepatitis B y OR 1,6, IC95% 0,6 – 4,4 para mordedura de murciélago). Tratándose de un estudio exploratorio, valdría la pena evaluar el papel de estos potenciales factores de riesgo en futuros estudios. En el caso de la mordedura por murciélago, ha sido previamente asociado con la infección por hepatitis B en comunidades indígenas peruanas33.
Una de las lecciones más importantes que debe aportar este estudio es que este brote era un evento totalmente predecible y prevenible. Conociendo que la zona ha sido descrita varios años atrás como endémica para el VHB28 y sabiendo que existe una vacuna disponible y efectiva34,35, se pudo haber protegido a estas personas, de sufrir la enfermedad en etapa aguda, de progresar (algunos de ellos) hacia formas crónicas, y de la posibilidad de que transmitan la infección a otras personas. El Perú empezó a incorporar la vacunación contra la hepatitis B en 1996 en ciertos grupos poblacionales36,37, pero no consideraron al personal militar.
LIMITACIONES
Dado que el estudio trata sobre hepatitis aguda por VHB, se esperaría que todos los casos tuvieran IgM anti HBc. El hecho de que sólo 73,2% (30/41) del total de casos hayan sido positivos para el marcador IgM anti HBc llama la atención. El marcador IgM anti HBc es considerado como el mejor marcador serológico para el diagnóstico de hepatitis aguda38-40. Alrededor de 10% de pacientes (descrito desde 5 hasta 20%) negativizan el HBsAg antes del desarrollo de síntomas o durante la presentación de la enfermedad34,41-47 siendo diagnosticados por la presencia del IgM anti HBc. Dado que el diseño del estudio no busca medir la magnitud del brote en términos de prevalencia, sino por el contrario busca los factores de riesgo presentes en el brote descrito, esta dificultad con el HBsAg como marcador no está presente ya que todos los sujetos estudiados como casos fueron HBsAg positivos. Adicionalmente, ha sido descrito que en pacientes sintomáticos evaluados dentro de las dos primeras semanas de instalación de los síntomas, las pruebas para HBsAg son más sensibles que el IgM anti HBc en la detección de infección aguda por el VHB48.
Otra limitación del presente estudio es que este se desarrolla dentro de una evaluación rápida de brotes y no se pudo identificar el caso índice ni confirmar la fuente de origen del brote. Especial énfasis fue puesto en identificar la patología del brote, que coincidió con hepatitis B. Lamentablemente por las condiciones del estudio no se cuenta con información basal de los participantes. El estudio fue realizado en una época prevacunación masiva contra hepatitis B y no se descarta la posibilidad de que algunos pocos hayan tenido HBsAg antes del brote. Sin embargo, los factores de riesgo reportados en este artículo resultan útiles para entender los posibles factores de riesgo asociados con la enfermedad del brote y el diseño elegido es el más adecuado para tal evaluación en las condiciones presentadas.
AGRADECIMIENTOS
No hubo financiamiento específico para este estudio. Actualmente JJM es financiado por un Wellcome Trust Research Training Fellowship (GR074833MA).
REFERENCIAS BIBLIOGRÁFICAS
1. Ganem D, Prince AM. Hepatitis B virus infection--natural history and clinical consequences. N Engl J Med. 2004; 350(11): 1118-29.
2. Lai CL, Ratziu V, Yuen MF, Poynard T. Viral hepatitis B. Lancet 2003; 362: 2089-94.
3. Shepard CW, Simard EP, Finelli L, Fiore AE, Bell BP. Hepatitis B virus infection: epidemiology and vaccination. Epidemiol Rev. 2006; 28: 112-25.
4. World Health Organization. Hepatitis B vaccines. WHO position paper. Wkly Epidemiol Rec. 2004; 79(28): 255-63.
5. Torres JR. Hepatitis B and hepatitis delta virus infection in South America. Gut. 1996; 38 Suppl 2: S48-55.
6. Torres JR, Machado IV. Special aspects of hepatitis B virus and delta virus infection in Latin America. Infect Dis Clin North Am. 1994; 8(1): 13-27.
7. Cabezas C. Epidemiología de las hepatitis virales B y delta en el Perú. Rev Med Exp.1997; 14(1): 57-62.
8. Cabezas C. Hepatitis virales B y delta: Epidemiología y prevención en el Perú. Rev Peru Med Exp Salud Publica 2002; 19(3): 150-61.
9. Emiroglu HH, Altunay H, Oguz S. Prevalence of hepatitis B virus carriers among soldiers and civilians in Turkey. J Clin Gastroenterol. 2004; 38(7): 614-15.
10. German V, Giannakos G, Kopterides P, Liaskonis K, Falagas ME. Serologic indices of hepatitis B virus infection in military recruits in Greece (2004-2005). BMC Infect Dis. 2006; 6:163.
11. Kupcinskas L, Petrauskas D, Petrenkiene V, Saulius K. Prevalence of hepatitis B virus chronic carriers and risk factors for hepatitis B virus infection among Lithuanian army soldiers. Mil Med. 2007; 172(6): 625-27.
12. Scott PT, Niebuhr DW, McGready JB, Gaydos JC. Hepatitis B immunity in United States military recruits. J Infect Dis. 2005; 191(11): 1835-41.
13. Shi MD, Lee SY, Lee YB. Increased risk of viral hepatitis in Taiwanese male conscriptees with tattoos. Mil Med. 2007; 172(5): 539-40.
14. Ogarkov PI, Malyshev VV, Tokmakov VS, Smirnov AV. Epidemiological features of virus hepatitis in the Russian Army. Minerva Gastroenterol Dietol. 2004; 50(2): 165-69.
15. Bancroft WH, Kelley PW, Takafuji ET. The military and hepatitis B. Vaccine. 1990; 8 Suppl: S33-36.
16. Hyams KC, Palinkas LA, Burr RG. Viral hepatitis in the US Navy, 1975-1984. Am J Epidemiol. 1989; 130(2): 319-26.
17. Parkinson MD, Stout RW, Mahon DR, Clardy WF, Warner RW, Weston ME, et al. Viral hepatitis in the US Air Force. Vaccine. 1993; 11(5): 516-17.
18. Goob TC, Yamada SM, Newman RE, Cashman TM. Bloodborne exposures at a United States Army Medical Center. Appl Occup Environ Hyg. 1999; 14(1): 20-25.
19. Cates W Jr, Warren JW. Hepatitis B in Nuremberg, Germany. Epidemiology of a drug-associated epidemic. Among US Army soldiers. JAMA. 1975; 234(9): 930-34.
20. Prier RE, Cowan DN. Risk factors for hepatitis B virus infection in US Army soldiers in Europe. J Epidemiol Community Health. 1987; 41(3): 229-32.
21. Aronson NE, Palmer BF. Acute viral hepatitis in American soldiers in Korea. South Med J. 1988; 81(8): 949-51.
22. Hyams KC, Krogwold RA, Brock S, Wignall FS, Cross E, Hayes C. Heterosexual transmission of viral hepatitis and cytomegalovirus infection among United States military personnel stationed in the western Pacific. Sex Transm Dis. 1993; 20(1): 36-40.
23. Brewer TG, Oetgen WJ, Dunn MA, Johnson LF. Hepatitis B in United States soldiers in Korea. South Med J. 1980; 73(12): 1568-69.
24. Gill GV, Bell DR, Vandervelde EM. Horizontal transmission of hepatitis B virus amongst British 2nd World War soldiers in South-East Asia. Postgrad Med J. 1991; 67(783): 39-41.
25. Gill GV, Bell DR, Vandervelde EM. Horizontal transmission of hepatitis B virus. Lancet. 1991; 337(8735): 247-8.
26. Green AD, Harbour SJ. Horizontal transmission of hepatitis B virus. Lancet. 1991; 337(8742): 676.
27. Perú, Ministerio de Salud, Oficina General de Epidemiología. Sistema Nacional de Vigilancia Epidemiológica. Anuario 2002. Lima: MINSA, OGE; 2003. Disponible en http://www.oge.sld.pe/publicaciones/pub_anuario/anuario_2002.pdf
28. Ruiz RA, Jaimes A, Guibert J, Hinostroza-Sjogren M. Marcadores serológicos de hepatitis viral en la región amazónica del Perú: Estudio de una población representativa. Diagnóstico (Perú). 1989; 24(1/2): 5-9.
29. Alter MJ, Hadler SC, Margolis HS, Alexander WJ, Hu PY, Judson FN, et al. The changing epidemiology of hepatitis B in the United States. Need for alternative vaccination strategies. JAMA. 1990; 263(9): 1218-22.
30. Hoofnagle JH, Di Bisceglie AM. Serologic diagnosis of acute and chronic viral hepatitis. Semin Liver Dis. 1991; 11(2): 73-83.
31. Ahmed A, Keeffe EB. Cost-effective evaluation of acute viral hepatitis. West J Med. 2000; 172(1): 29-32.
32. Casey JL, Niro GA, Engle RE, Vega A, Gomez H, McCarthy M, et al. Hepatitis B virus (HBV)/hepatitis D virus (HDV) coinfection in outbreaks of acute hepatitis in the Peruvian Amazon basin: the roles of HDV genotype III and HBV genotype F. J Infect Dis. 1996; 174(5): 920-26.
33. Cabezas C, Suárez M, Romero G, Carrillo C, Garcia MP, Reátegui J, et al. Hiperendemicidad de hepatitis viral B y delta en pueblos indígenas de la Amazonía peruana. Rev Peru Med Exp Salud Publica. 2006; 23(2): 114-22.
34. Lemon SM, Thomas DL. Vaccines to prevent viral hepatitis. N Engl J Med. 1997; 336(3): 196-204.
35. Robinson WS. Hepatitis B virus and hepatitis D virus. In: Mandel GL, Bennett JE, Dolin R, editors. Mandel, Douglas and Bennetts Principles and Practice of Infectious Diseases. 5th ed. New York: Churchill Livingstone; 2000. p. 1652-85.
36. Cabezas C, Ramos F, Vega M, Suarez M, Romero G, Carrillo C, et al. Impacto del programa de vacunación contra la hepatitis B (HVB) integrado al programa de inmunizaciones (PAI) en Huanta (Perú), 1994-1997. Rev Gastroenterol Peru. 2000; 20(3): 201-12.
37. Kane MA. Status of hepatitis B immunization programmes in 1998. Vaccine. 1998; 16 Suppl: S104-8.
38. Kryger P. Significance of anti-HBc IgM in the differential diagnosis of viral hepatitis. J Virol Methods. 1985; 10(4): 283-89.
39. Lemon SM. What is the role of testing for IgM antibody to core antigen of hepatitis B virus? Mayo Clin Proc. 1988; 63(2): 201-4.
40. Papaevangelou G, Roumeliotou-Karayannis A, Tassopoulos N, Stathopoulou P. Diagnostic value of anti- HBc IgM in high HBV prevalence areas. J Med Virol. 1984; 13(4): 393-99.
41. Gitnick G. Immunoglobulin M hepatitis B core antibody: to titer or not to titer? to use or not to use? Gastroenterology. 1983; 84(3): 653-55.
42. Hoofnagle JH. Serodiagnosis of acute viral hepatitis. Hepatology. 1983; 3(2): 267-68.
43. Hoofnagle JH, Ponzetto A, Mathiesen LR, Waggoner JG, Bales ZB, Seeff LB. Serological diagnosis of acute viral hepatitis. Dig Dis Sci. 1985; 30(11): 1022-27.
44. Hoofnagle JH, Seeff LB, Bales ZB, Gerety RH, Tanor E. Serologic responses in hepatitis B. In: Vyas GN, Cohen SN, Schmid R, editors. Viral hepatitis. Philadelphia: Franklin Institute Press; 1978. p. 219-42.
45. Kryger P, Aldershvile J, Mathiesen LR, Nielsen JO. Acute type B hepatitis among HBsAg negative patients detected by anti-HBc IgM. Hepatology. 1982; 2(1): 50-53.
46. Lemon SM, Gates NL, Simms TE, Bancroft WH. IgM antibody to hepatitis B core antigen as a diagnostic parameter of acute infection with hepatitis B virus. J Infect Dis. 1981; 143(6): 803-9.
47. Sjogren MH. Serologic diagnosis of viral hepatitis. Med Clin North Am. 1996; 80(5): 929-56.
48. Lindsay KL, Nizze JA, Koretz R, Gitnick G. Diagnostic usefulness of testing for anti-HBc IgM in acute hepatitis B. Hepatology 1986; 6(6): 1325-28.
Correspondencia: César Cabezas Sánchez, Instituto Nacional de Salud, Lima, Perú.
Dirección: Cápac Yupanqui 1400, Lima 11, Perú
Teléfono: (511) 471 9920 Fax: (511) 471 7443
Correo electrónico: ccabezas@ins.gob.pe