Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.24 no.4 Lima Oct./dic. 2007
ARTÍCULOS DE REVISIÓN
Manejo de la coinfección por virus de la hepatitis B y VIH en el Perú
Hepatitis B virus and HIV coinfection management in Perú
Vivian Levy1,a, Robert M. Grant1,a, César Cabezas2,3,a
1 Gladstone Institute of Virology and Immunology, University of California. San Francisco, USA.
2 Instituto Nacional de Salud. Lima, Perú.
3 Instituto de Medicina Tropical Daniel A. Carrión. Universidad Nacional Mayor de San Marcos. Lima, Perú.
a Médico infectólogo.
Resumen
En el Perú, los hombres que tienen sexo con hombres (HSH) deben ser incorporados a los grupos de riesgo para la infección por virus de hepatitis B (HBV), los cuales también incluye a personas provenientes de áreas endémicas de HBV, trabajadores de atención en salud y trabajadores/as sexuales, que potencialmente puedan estar infectadas por el VIH. Debido a que en estos grupos comparten riesgos para la transmisión sexual, la coinfección con HBV y VIH, es común particularmente en HSH y en heterosexuales de alto riesgo. Se debe tener mucho cuidado en el tratamiento para la infección crónica por el HBV en pacientes que tienen, además, coinfección con el VIH. Los principales objetivos del tratamiento de la infección con HBV son suprimir la replicación del virus, mejorar las funciones hepáticas y minimizar la emergencia de resistencia medicamentosa al HBV y al VIH. En el presente artículo se revisa la epidemiología del HBV en el Perú, la historia natural de la coinfección con HBV-VIH y se describe las opciones actuales de tratamiento en el contexto peruano.
Palabras clave: Hepatitis B/ terapia; VIH/SIDA / terapia; Perú (fuente: DeCS BIREME).
Abstract
In Peru, men who have sex with men (MSM) should be added to the groups at risk for hepatitis B (HBV) infection which include persons from endemic areas, health care workers and commercial sex workers. Given the shared sexual risk factors for transmission, co-infection with HBV and HIV is common in MSM and high risk heterosexuals. The treatment of chronic HBV infection needs to be carefully coordinated with HIV management in HBV-HIV co-infected patients. The main treatment goals for HBV infection are to suppress HBV replication, improve liver function, and minimize the emergence of HBV and HIV drug resistance. In this article, we review the epidemiology of HBV in Peru, the natural history of HBV-HIV co-infection, and describe current treatment options in the Peruvian context.
Key words: Hepatitis B/ therapy; HIV/AIDS / therapy; Peru (source: DeCS BIREME).
ENMARCANDO EL PROBLEMA DE LA INFECCIÓN POR HBV EN EL PERÚ
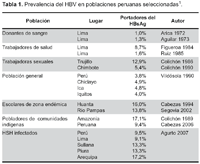
El Perú es un país con prevalencia intermedia para la infección por el virus de la hepatitis B (HBV), que comparte áreas de alta, mediana y baja endemicidad, con un incremento de la prevalencia en poblaciones de riesgo como el personal de salud, trabajadores sexuales, hombres que tienen sexo con hombres (HSH) y personas provenientes de áreas endémicas (Tabla 1)1-4. La prevalencia reportada de infección crónica del HBV en HSH peruanos infectados con el VIH es de de 9,5%4, resultado consistente con los estudios realizados en los Estados Unidos, donde se reporta una prevalencia de 10% en antígeno de superficie de la hepatitis B (HBsAg) en HSH infectados con el VIH5.
El VIH-1 en el Perú es una epidemia concentrada. Este virus se transmite de manera predominante por la vía sexual (97%), y afecta principalmente a adultos jóvenes entre 20 y 39 años de edad en grandes centros urbanos, con una tasa de 73% de casos de SIDA a nivel nacional entre el 1983 y el 2006 en Lima-Callao6. Los HSH son el grupo de riesgo más perjudicado por la infección por VIH 398-404. revisión en el Perú, con una prevalencia general reportada del 13,9% en el 2002 (rango de 5,7% en Pucallpa a 22,3% en Lima) 6. Los HSH son, asimismo, una población puente hacia las mujeres, dada la bisexualidad de muchos de ellos7. La proporción de hombre/mujer de casos de SIDA reportados ha disminuido de 14:1 en 1990 a 3:1 en los últimos años 6.
El genotipo A del HBV es el predominante en los Estados Unidos, mientras que en el Perú, el genotipo principalmente corresponde al genotipo F8. Algunos estudios relacionan una mayor gravedad de la enfermedad en pacientes infectados con el VIH o una mayor letalidad aun con la monoinfección por este genotipo y el genotipo F de HBV9,10. Una implicancia de la infección por el genotipo F puede ser una potencial falta de respuesta a las vacunas contra HBV que son elaboradas en base a los genotipos A y D, aunque no hay sólidas evidencias aún de ello 11. De otro lado, la mutación responsable de la formación del HBsAg, puede afectar en el reconocimiento para un correcto diagnóstico con los kits comerciales12.
No hay aún estudios en gran escala sobre la respuesta al tratamiento y los niveles de resistencia del genotipo F de HBV en el Perú.
Se ha reportado, adicionalmente, coinfección del HBV con el virus de la hepatitis Delta (D) en 17-40% de personas infectadas de manera crónica con el HBV, provenientes de áreas endémicas del Perú2,3. El virus de la hepatitis D, un patógeno que requiere del virus de la hepatitis B para replicarse, continua siendo causa importante de hepatitis fulminante y puede acelerar el curso clínico de la infección crónica por HBV hasta llegar a la cirrosis o la falla hepática13.
Las personas coinfectadas con HBV-VIH presentan tasas más altas de mortalidad relacionadas con enfermedades del hígado, que personas con una sola de las dos infecciones. En una cohorte multicéntrica de 5 293 hombres con SIDA, se encontró que los coinfectados tuvieron mayor riesgo de fallecer por falla hepática que los que estaban infectados solamente con el VIH (RR: 8.3; IC95%: 4,8-14,3) y de morir por falla hepática, que los infectados solamente con el HBV (RR: 18,7; IC95%: 3,1-76,1). La tasa de mortalidad atribuible a la enfermedad hepática fue más alta en hombres con un conteo de células CD4 < 100 células/mm3 y para los que acusen un alto uso de alcohol 14.
El uso de alcohol (proporcional en cuanto al alcance y duración del uso) y la infección por HBV producen un efecto aditivo en términos de la progresión hacia la falla hepática y al carcinoma hepatocelular15. El riesgo incrementado de toxicidad por alcohol en las personas infectadas con HBV-VIH puede ser mediado por la esteatosis hepática asociada con el alcohol o por algunos antirretrovirales que producen toxicidad mitocondrial. La influencia de estos cofactores puede reducirse mediante la consejería dirigida a reducir el uso de alcohol y emplear terapias antirretrovirales menos hepatotóxicas. La recolección de datos sobre eventos adversos de medicamentos anti-VIH (D:A:D), que evaluó de manera prospectiva 76 893 personas-años de seguimiento en 23 441 personas infectadas con el VIH, encontró más decesos relacionados con falla hepática en pacientes con CD4 < 50 cel/mL (RR: 16,1) en comparación con aquellos relacionados a SIDA que tenían CD4 > 500cel/mL, por otro lado, los pacientes que murieron por causa hepática tuvieron CD4 más altos que los decesos relacionados a SIDA (CD4: 196 vs 19 cel/mL respectivamente)16.
EFECTO DEL VIH EN LA HISTORIA NATURAL DEL HBV
La infección por el VIH incrementa el riesgo de tener una infección crónica por HBV, los pacientes coinfectados tienen una prevalencia de 23% de infección crónica por HBV en adultos, comparada con 4% en personas que sólo presentan la infección por HBV17. Se observa niveles elevados y sostenidos de ADN del HBV (carga viral del HBV) en pacientes coinfectados con HBV-VIH, que están asociados con el desarrollo de carcinoma hepatocelular y cirrosis.
Un estudio prospectivo basado en la población realizado en 3 653 personas HBsAg positivas no infectadas con el VIH en Taiwán, encontró que la incidencia de carcinoma hepatocelular se incrementaba en forma lineal, con el nivel del ADN del HBV en el suero al ingresar al estudio, independientemente del estado serológico de HBeAg, nivel de aminotransferasa de suero y de la presencia de cirrosis18. Se demostró una relación similar de dependencia de los niveles de ADN del HBV y la cirrosis en 3 582 pacientes de HBV con una sola infección19.
La seroconversión espontánea de HBsAg y HBeAg (la pérdida de HBsAg con el desarrollo de anti-HBsAg y la pérdida de HBeAg con el desarrollo de anti-HBeAg, respectivamente) es menos probable con la coinfección20. A pesar de que las elevaciones de enzimas hepáticas en los pacientes coinfectados a menudo son más leves en comparación con los pacientes de una sola infección, la fibrosis avanza a una mayor rapidez en los coinfectados que en la infección sola por HBV. Este incremento del avance de la enfermedad hepática en pacientes infectados por VIH enfatiza la importancia de evaluar a personas para el tratamiento de la hepatitis B.
VACUNA CONTRA EL HBV Y PERSONAS INFECTADAS POR EL VIH
En los últimos años, se ha incrementado los esfuerzos para vacunar a HSH y adultos en alto riesgo contra el HBV. Todas las personas infectadas deben ser tamizadas buscando marcadores de HBV al poco tiempo del diagnóstico con VIH. La vacuna contra el HBV se indica para todas las personas infectadas por VIH, sin evidencia de infección o inmunidad previa. En centros de salud ambulatorios para VIH en los Estados Unidos, sólo 32% de pacientes elegibles para la vacuna contra la hepatitis B habían recibido por lo menos una dosis21.
Se debe identificar a los contactos familiares, sexuales y de intercambio de agujas de personas positivas a HBsAg, analizar sus muestras buscando susceptibilidad a la infección por HBV y aplicar la primera dosis de la vacuna contra el HBV una vez obtenida la muestra para el análisis serológico. Las parejas sexuales de personas positivas a HBsAg deben recibir consejería en cuanto al uso de condones, a menos que sean inmunes o hayan tenido una infección previa22.
Las personas infectadas por el VIH, especialmente las que tienen inmunosupresión avanzada, presentan respuestas más débiles de anticuerpos a la vacuna contra el HBV y pierden anticuerpos protectores después de la vacuna más rápidamente. Después de concluir la serie de tres dosis de vacuna contra el HBV15, la respuesta adecuada del anticuerpo (definida como mayor a 10 IU/mL) es 87% en pacientes con CD4 > 500 cel/mL, mayores al 33% en personas con CD4 entre 200 y 500 cel/mL.
Un estudio cohortes retrospectiva que predecía el éxito de la vacuna contra el HBV en personas infectadas sólo con el VIH, encontró que el ARN indetectable de VIH en el plasma en el momento de la vacunación estuvo asociada con una respuesta protectora de los anticuerpos23.
Se recomienda un seguimiento de los niveles de anticuerpos después de la vacuna (1-3 meses después de concluir la serie) y luego en forma periódica en el caso de pacientes vacunados que están infectados con el VIH. Se deben intentar dosis adicionales de vacuna o una serie nueva con el doble de la dosis convencional en pacientes que no desarrollan niveles adecuados de anticuerpos.
OBJETIVOS DEL TRATAMIENTO CONTRA EL HBV E INDICACIONES PARA EL TRATAMIENTO
Los objetivos del tratamiento de la terapia del HBV son detener el avance de la inflamación del hígado y la fibrosis a través de la supresión sostenida de la replicación viral del HBV. La supresión del ADN del HBV se correlaciona con una mejora histológica en pacientes que están recibiendo terapia con el HBV, con niveles < 102 copias/mL se obtiene una emergencia reducida de la resistencia antirretroviral (ARV) y del carcinoma hepatocelular24,25. Además de la supresión viral, la seroconversión del HBeAg es un objetivo del tratamiento para pacientes positivos a HBeAg. La seroconversión del HBsAg es un objetivo ideal pero poco probable del tratamiento.
Es importante reconocer que la infección por HBV probablemente nunca se cure, pero puede controlarse con agentes antirretrovirales. El ADN viral se encuentra en una forma circular cerrada y covalente del ADN (cccADN) solamente en el núcleo de los hepatocitos infectados. El cccADN es una plantilla transcripcional principal del virus y sirve como reservorio para la reactivación viral cuando se retira la terapia antiviral del nucleótido26.
Debe ofrecerse tratamiento a personas en riesgo elevado de desarrollar cirrosis o carcinoma hepatocelular. Los criterios para el inicio del tratamiento con HBV incluye lo siguiente: ADN del HBV > 104 copias/mL18,19, niveles de ALT por lo menos dos veces mas del borde superior del rango normal o evidencia de fibrosis en la biopsia del hígado. Si se toma la decisión de postergar la terapia para HBV, se debe hacer seguimiento a los niveles de ALT y ADN del HBV cada cuatro a seis meses.
CONSIDERACIONES DEL TRATAMIENTO: POTENCIA Y RESISTENCIA
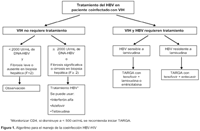
Lo primero a tener en cuenta sobre el tratamiento en el paciente coinfectado, es decidir si sólo un virus o los dos virus necesitan tratamiento, ya que varios ARV nucleótidos análogos (lamivudina, emtricitabina, tenofovir y entecavir) son activos contra los dos virus y su mal uso puede generar resistencia.
Tratamiento para VIH y HBV
Cuando ambos virus necesitan tratamiento, cualquiera de los siguientes antivirales son potentes contra ambos virus: tenofovir (TDF), lamivudina (3TC) o emtricitabina (FTC) como parte de un régimen combinado de antirretrovirales, el cual incluye un inhibidor no nucleósido de la transcriptasa reversa o un inhibidor de la proteasa. Si ambos virus necesitan tratamiento y el paciente presenta HBV resistente a la lamivudina, se recomienda tratamiento con TDF y FTC como parte del tratamiento antirretroviral como régimen combinado. Los datos de resistencia a adefovir no muestran ninguna resistencia a lamivudina en curso27 (Figura 1).
El TDF es un medicamento potente contra el VIH, el cual ha sido empleado también para tratar el HBV en pacientes coinfectados con el VIH. Diversos estudios apoyan una eficacia superior del TDF contra el HBV en relación con la del adefovir28,29. En un estudio prospectivo, randomizado y controlado que compara al TDF con adefovir en 52 pacientes coinfectados que estaban recibiendo TARGA, la disminución promedio en el nivel de ADN del HBV en el suero a las 48 semanas de tratamiento fue de 4,44 log10copias/mL con TDF y 3,21 log10copias/mL con adefovir. No se observó diferencias en la toxicidad, incluyendo la nefrotoxicidad entre los dos grupos29.
Otra opción potencial cuando ambos virus necesitan tratamiento es el uso de entecavir en el TARGA. El entecavir, que tiene alguna protección contra el VIH y cuenta con el potencial de seleccionar rtM184V30, no debe ser empleado en pacientes infectados con VIH que no estén recibiendo TARGA.
Tratamiento sólo para HBV
Cuando es solamente el virus de HBV que necesita tratamiento en casos de infección de VIH, las opciones son adefovir, telbivudina o interferón alfa 2a pegilado.
El adefovir es activo, tanto contra el HBV resistente a la lamivudina como contra el tipo silvestre. La limitación del adefovir es que es el medicamento menos potente disponible y podría no controlar la replicación del HBV. En personas infectadas por VIH-HBV, cuando se agregó adefovir al TARGA que incluía lamivudina, se alcanzó niveles no detectables de ADN del HBV sólo en 25% de los participantes y el 45% de los participantes alcanzaron niveles de ADN del HBV < 1000 copias/mL30,31.
Aunque el adefovir tiene el riesgo teórico de desarrollar la mutación al VIH K65R, que disminuiría la susceptibilidad al TDF, estudios pequeños realizados hasta la fecha, no han encontrado dichas mutaciones en la transcriptasa reversa del VIH32. La resistencia del HBV al adefovir ocurre con menos frecuencia que la resistencia a lamivudina, con una prevalencia del 2% después de dos años y 30% después de cinco años33.
El interferón no presenta riesgo de resistencia pero tiene baja potencia, poca eficacia establecida en la coinfección por VIH-HBV y grave toxicidad. Un estudio encontró que pacientes de VIH-HBV coinfectados con conteos más bajos de células CD4 tenían una pobre respuesta al interferón y tasas más altas de reactivación de la infección por HBV34.
Tratamiento sólo para VIH
Si sólo el VIH necesita tratamiento en un paciente coinfectado, es importante no usar lamivudina sola (de los medicamentos activos contra HBV) en el régimen ARV porque la resistencia del HBV a lamivudina es de 55% en terapias de lamivudina sola y 85% después de cinco años35. Aunque la lamivudina es potente contra el HBV, su utilidad como terapia única está limitada debido a la rapidez con la cual se desarrolla la resistencia en comparación con otros nucleótidos (mayor de 70% después de 48 meses de tratamiento en pacientes con infección única de HBV)36. Se ha identificado cinco patrones comunes de resistencia 3TC: 1) rtM204I 2) rtL180M + rtM204V 3) rtL180M + rtM204I 4) rtV173L + rtL180M + rtM204V y 5) rtL80V/I +/- rtL180M + rtM204I. El dominio de fenotipos particulares esta influenciado por el genotipo de HBV37.
VIGILANDO LA RESPUESTA VIRAL
En pacientes que no cumplen los criterios de tratamiento de VIH o HBV, se debe realizar un control de los dos virus por lo menos cada seis meses. (Para el HBV, el control incluye ALT, idealmente ADN del HBV, alfa-feto proteína y ecografía).
Si un paciente esta recibiendo tratamiento para el HBV, el control incluye el examen anteriormente mencionado y HBeAg (si es positivo al inicio de la terapia) cada cuatro meses.
Si el nivel de ADN de HBV sugiere resistencia al medicamento antiviral (la resistencia al medicamento antiviral de HBV se define como un incremento de la carga viral de ≥1 log10 comparado con el valor nadir durante la terapia)38,39, debe obtenerse una repetición del ADN del HBV, otras causas como el no cumplimiento evaluado y consideraciones en cuanto al cambio de régimen.
En un paciente positivo a HBeAg, si desarrolla anti-HBe, se le debería hacer seguimiento anti-HBs cada 6 a12 meses. En un paciente negativo a HBeAg, es adecuado realizarle un seguimiento anti-HB cada año.
INCREMENTO SÚBITO DE ENZIMAS HEPÁTICAS
Las elevaciones en enzimas hepáticas de personas coinfectadas tienen diversas causas, que es importante considerar. La infección crónica por HBV se asocia con incrementos súbitos de las enzimas hepáticas en pacientes que han iniciado terapia antirretroviral40. Estos incrementos súbitos que se inician en los primeros tres meses de haber comenzado el TARGA pueden ser el resultado de un síndrome de reconstitución inmune y no necesariamente de hepatotoxicidad antirretroviral directa41. Los incrementos súbitos por reconstitución inmune deben ser seguidos de niveles de normalización de ALT y disipación del ADN del HBV. Una vigilancia estrecha de los pacientes con incrementos súbitos debidos a reconstitución inmune podrá permitir la continuación de la terapia, ya que las anormalidades en los niveles de enzimas hepáticas mejoran de manera progresiva mientras que el paciente continúa con la terapia antirretroviral.
En pacientes con infección crónica por HBV, se ha reportado incrementos súbitos con la discontinuación de análogos nucleótidos o nucleótidos42 y con la emergencia de las cepas resistentes a lamivudina o emtricitabina15. En el Perú, una causa de incremento súbito de enzimas hepáticas puede ser la coinfección con hepatitis D, por lo que debería ser investigada. Causas menos probables son la seroconversión a HBeAg o HBsAg.
CONCLUSIONES
Debe valorarse los esquemas antes del tratamiento del HBV y del VIH en un paciente coinfectado, para maximizar la potencia y minimizar la resistencia. Debe evitarse la terapia única con lamivudina tanto en los pacientes infectados sólo con HBV, como en los coinfectados debido a su baja barrera a la resistencia a HBV y VIH. Las investigaciones futuras deben evaluar aspectos clínicos singulares del HBV genotipo F en relación a la respuesta al tratamiento y el efecto del genotipo S en patrones de resistencia en el Perú, así como la influencia de la coinfección por el virus Delta en la respuesta al tratamiento. Considerando la magnitud del problema en el país, de infectados crónicos por HBV con y sin coinfección con HIV, se requiere contar con un programa que haga factible el acceso al tratamiento integral en estos pacientes.
REFERENCIAS BIBLIOGRÁFICAS
1. Cabezas C. Hepatitis virales B y delta: epidemiología y prevención en el Perú. Rev Peru Med Exp Salud Publica. 2002; 19(3): 150-61.
2. Segovia G, Galván K, García V, Huamaní L, Gotuzzo E. Prevalencia de marcadores serologicos para hepatitis B y delta y infección intrafamiliar en el valle del río Pampas, Perú. Rev Peru Med Exp Salud Publica. 2002; 19(2):57- 62.
3. Cabezas C, Suarez M, Romero G, Carrillo C, García MP, Reátegui J, et al. Hiperendemicidad de hepatitis viral B y delta en pueblos indigenas de la Amazonia Peruana. Rev Peru Med Exp Salud Publica. 2006; 23(2): 114-22.
4. Agurto H, Lama J, Suarez L, Montano S, Chauca G, Sanchez JL, et al. Epidemiología y factores de riesgo asociado para HBsAg entre hombres que tienen sexo con hombres en el Perú. En: X Congreso Peruano de Enfermedades Infecciosas y Tropicales. Lima: Sociedad Peruana de Enfermedades Infecciosas y Tropicales; 2007.
5. Kellerman SE, Hanson D, McNaghten A, Fleming P. Prevalence of chronic hepatitis B and incidence of acute hepatitis B infection in human immunodeficiency virusinfected subjects. J Infect Dis. 2003; 188(4):571-57.
6. Mesones J, Caballero P, Sanchez J, Grant R, Podesta JE. A step forward in the fight against AIDS: the first two years of universal access to antiretroivral treatment in Peru. Lima: Ministry of Health; 2006.
7. Miller GA, Mendoza W, Krone MR, Meza R, Caceres CF, Coates TJ, et al. Clients of female sex workers in Lima, Peru: a bridge population for sexually transmitted disease/ HIV transmission? Sex Trans Dis. 2004; 31(6): 337-42.
8. H ijar G, Suárez M, Padilla C, Cabezas C. Genotipificación del virus de la hepatitis B en pacientes de áreas endémicas del Perú. Rev Peru Med Exp Salud Publica. 2007; 24(4): 427-30.
9. Gomes SA, de Castro L, Niel C, Santos EA. Uncommon mutation pattern of a hepatitis B virus isolate from genotype F infecting a patient with AIDS. J Infect. 2004; 48(1): 102-8.
10. Campos RH, Mbayed VA, Pineiro Y Leone FG. Molecular epidemiology of hepatitis B virus in Latin America. J Clin Virol. 2005; 34(Suppl 2): S8-13.
11. Tacke F, Amini-Bavil-Olyaee S, Heim A, Luedde T, Manns MP, Trautwein C. Acute hepatitis B virus infection by genotype F despite successful vaccination in an immunecompetent German patient. J Clin Virol. 2007; 38(4): 353- 57.
12. Gutiérrez C, Devesa M, Loureiro CL, León G, Liprandi F, Pujol FH. Molecular and serological evaluation of surface antigen negative hepatitis B virus infection in blood donors from Venezuela. J Med Virol. 2004; 73(2): 200-7.
13. B alik I, Onul M, Tekeli E, Caredda F. Epidemiology and clinical outcome of hepatitis D virus infection in Turkey. Eur J Epidemiol. 1991; 7(1): 48-54.
14. Thio C, Seaberg E, Skolasky R, Phair J, Visscher B, Muñoz A, et al. HIV-1, hepatitis B virus, and risk of liverrelated mortality in the Multicenter Cohort Study (MACS). Lancet. 2002; 360: 1921-26.
15. Soriano V, Puoti M, Bonacini M, Brook G, Cargnel A, Rockstroh J, et al. Care of patients with chronic hepatitis B and HIV co-infection: recommendations from an HIV-HBV international panel. AIDS. 2005; 19(3): 221-40.
16. Weber R, Sabin CA, Friis-Moller N, Reiss P, El-Sadr WM, Kirk O, et al. Liver-related deaths in persons infected with the human immunodeficiency virus: the D:A:D study. Arch Intern Med. 2006; 166(15): 1632-41.
17. B odsworth NJ, Cooper D, Donovan B. The influence of human immunodeficiency virus type 1 infection on the development of the hepatitis B virus carrier state. J Infect Dis. 1991; 163(5): 1138-40.
18. Chen CJ, Yang HI, Su J, Jen CL, You SL, Lu SN, et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA. 2006; 295(1): 65-73.
19. Iloeje UH, Yang HI, Su J, Jen CL, You SL, Chen CJ, et al. Predicting cirrhosis risk based on the level of circulating hepatitis B viral load. Gastroenterology. 2006; 130(3): 678- 86. 398-404. Manejo de coinfección VHB-VIH Rev Peru Med Exp Salud Publica. 2007; 24(4): 404
20. Gilson RJ, Hawkins AE, Beecham MR, Ross E, Waite J, Briggs M, et al. nteractions between HIV and hepatitis B virus in homosexual men: effects on the natural history of infection. AIDS. 1997; 11(5): 597-606.
21. Tedaldi EM, Baker RK, Moorman AC, Wood KC, Fuhrer J, McCabe RE, et al. Hepatitis A and B vaccination practices for ambulatory patients infected with HIV. Clin Infect Dis. 2004; 38(10): 1478-84.
22. Mast EE, Weinbaum CM, Fiore AE, Alter MJ, Bell BP, Finelli L, et al. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Inmunization Practices (ACIP) Part II: immunization of adults. MMWR Recomm Rep. 2006; 55(RR-16): 1-33.
23. O verton ET, Sungkanuparph S, Powderly WG, Seyfried W, Groger RK, Aberg JA. Undetectable plasma HIV RNA load predicts success after hepatitis B vaccination in HIVinfected persons. Clin Infect Dis. 2005; 41(7): 1045-48.
24. Nuñez M, Soriano V. Management of patients co-infected with hepatitis B virus and HIV. Lancet Infect Dis. 2005; 5(6): 374-82.
25. Mommeja-Marin H, Mondou E, Blum MR, Rousseau F. Serum HBV DNA as a marker of efficacy during therapy for chronic HBV infection: analysis and review of the literature. Hepatology. 2003; 37(6): 1309-19.
26. Thio CL, Locarnini S. Treatment of HIV/HBV coinfection: clinical and virologic issues. AIDS Rev. 2007; 9(1): 40-53.
27. Delaney W. Progress in the treatment of chronic hepatitis B: long term experience with adefovir dipivoxil. J Antimicrob Chemother. 2007; 59(5): 827-32.
28. van Bommel F, Wünsche T, Mauss S, Reinke P, Bergk A, Schürmann D, et al. Comparison of adefovir and tenofovir in the treatment of lamivudine resistant hepatitis B virus infection. Hepatology. 2004; 40(6): 1421-25.
29. Peters MG, Andersen J, Lynch P, Liu T, Alston-Smith B, Brosgart CL, et al. Randomized controlled study of tenofovir and adefovir in chronic hepatitis B virus and HIV infection: ACTG A5127. Hepatology. 2006; 44(5): 1110-16.
30. McMahon MA, Jilek BL, Brennan TP, Shen L, Zhou Y, Wind-Rotolo M, et al. The HBV drug Entecavir- Effects on HIV-1 replication and resistance. N Eng J Med. 2007; 356(25): 2614-21.
31. B enhamou Y, Thibault V, Vig P, Calvez V, Marcelin AG, Fievet MH, et al. Safety and efficacy of adefovir dipivoxil in patients infected with lamivudine resistant hepatitis B and HIV-1. J Hepatol. 2006; 44(1): 62-67.
32. Marcelin P, Chang TT, Lim SG, Tong MJ, Sievert W, Shiffman ML, et al. Adefovir dipivoxil for the treatment of hepatitis B e antigen-positive chronic hepatitis B. N Eng J Med. 2003; 348(9): 808-16.
33. H adziyannis SJ, Tassopoulos NC, Heathcote EJ, Chang TT, Kitis G, Rizzetto M, et al. Long-term therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B. N Engl J Med. 2005; 352(26): 2673-81.
34. Di Martino V, Thevenot T, Colin JF, Boyer N, Martinot M, Degos F, et al. Influence of HIV infection on the response to interferon therapy and the long-term outcome of chronic hepatitis B. Gastroenterology. 2002; 123(6): 1812-22.
35. Liaw YF, Leung NW, Chang TT, Guan R, Tai DI, Ng KY, et al. Effects of extended lamivudine therapy in Asian patients with chronic hepatitis B. Asia Hepatitis Lamivudine Study Group. Gastroenterology. 2000; 119(1): 172-80.
36. Lai CL, Dienstag J, Schiff E, Leung NW, Atkins M, Hunt C, et al. Prevalence and clinical correlates of YMDD variants during lamivudine therapy for patients with chronic hepatitis. Clin Infect Dis. 2003; 36(6): 687-96.
37. Zöllner B, Petersen J, Puchhammer-Stöckl E, Kletzmayr J, Sterneck M, Fischer L, et al. Viral features of lamivudine resistant hepatitis B genotypes A and D. Hepatology. 2004; 39(1): 42-50.
38. Alberti A, Clumeck N, Collins S, Gerlich W, Lundgren J, Palú G, et al. Short statement of the first European Consensus Conference on the treatment of chronic hepatitis B and C in HIV-coinfected patients. J Hepatol. 2005; 42(5): 615-24.
39. Locarnini S, Hatzakis A, Heathcote J, Keeffe EB, Liang TJ, Mutimer D, et al. Management of antiviral resistance in patients with chronic hepatitis B. Antivir Ther. 2004; 9(5): 679-93.
40. Sulkowski MS, Thomas DL, Chaisson RE, Moore RD. Hepatotoxicity associated with antiretroviral therapy in adults infected with human immunodeficiency virus and the role of hepatitis C or B virus infection. JAMA. 2000; 283(1): 74-80.
41. Carr A, Cooper DA. Restoration of immunity to chronic hepatitis B infection in HIV-infected patient on protease inhibitor. Lancet. 1997; 349: 995-96.
42. B essesen M, Ives D, Condreay L, Lawrence S, Sherman K. Chronic active hepatitis B exacerbations in human immunodeficiency virus-infected patients following development of resistance to or withdrawal of lamivudine. Clin Infect Dis. 1999; 28(5): 1032-35.
Correspondencia. Dr. César Cabezas Sánchez. Instituto Nacional de Salud. Lima, Perú.
Dirección: Cápac Yupanqui 1400, Lima 11.
Teléfono: (511) 4719920
Correo electrónico: ccabezas@ins.gob.pe