Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.25 n.1 Lima ene./mar. 2008
ARTÍCULOS ORIGINALES
Características morfométricas, genéticas, alimenticias y vectoriales de Panstrongylus herreri procedentes de Jaén (Cajamarca) y Cajaruro (Amazonas), Perú
Morphometric, genetic, FEEDING and vectorial characteristics of Panstrongylus herreri from Jaén (Cajamarca) and Cajaruro (Amazonas), Perú
Jenny Ancca1,a, Jesús Pinto1,a, Silvia Vega1,a, Abraham G. Cáceres2,a, Cesar Náquira1,b
1 Laboratorio de Leishmaniasis y Chagas, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
2 Laboratorio de Entomología, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
a Biólogo; b Médico parasitólogo
RESUMEN
Objetivo. Comparar las características morfológicas, alimenticias y genéticas de dos poblaciones de Panstrongylus herreri, de los distritos de Jaén (Cajamarca) y Cajaruro (Amazonas). Materiales y métodos. Se colectó especímenes adultos de P. herreri, 42 (Jaén) y 68 (Cajaruro). Se utilizó la morfometría geométrica para evaluar el dimorfismo sexual de tamaño y conformación. El perfil genómico se realizó por amplificación del espaciador interno transcrito del ADNr (ITS-2). La amplificación del espaciador intergénico del gen mini-exón, permitió la caracterización molecular de los trypanosomas aislados. Se utilizó la prueba de precipitina para conocer las fuentes de alimentación de los vectores y así poder asociarlos a posibles reservorios del parásito. Resultados. El análisis morfométrico demostró que el dimorfismo sexual de tamaño fue similar (p>0,05); no ocurrió lo mismo con el dimorfismo de la conformación; asimismo no se encontró diferencias de tamaño al comparar por separado hembras y machos de Jaén y Cajaruro. Por ITS-2, se evaluó cinco especímenes de cada distrito, en ellos se observó una banda de 960 pb aproximadamente. Sólo en Cajaruro se encontraron triatominos parasitados, que fue caracterizado como Trypanosoma cruzi TCI (350 pb). Se identificó al cobayo como la fuente de alimento más frecuente. Conclusiones. Ambas poblaciones de P. herreri por morfometría geométrica e ITS-2, no evidenció diferencias, indicando que se trataría de una misma población y por consiguiente de la misma procedencia. La sangre de cobayo fue la más frecuente fuente de alimento, pudiendo ser el principal reservorio para la enfermedad de Chagas en esta zona del Perú.
Palabras clave: Panstrongylus; Triatominae; Trypanosoma cruzi; Genética; Perú (fuente: DeCS BIREME).
ABSTRACT
Objective. To compare the morphology, feeding and the genetic profile of specimens of Panstrongylus herreri from districts of Jaen (Cajamarca) and Cajaruro (Amazonas). Material and methods. Adult specimens of P. herreri were collected, 42 from Jaen and 68 from Cajaruro. Geometric morphometrics was used to evaluate the sexual differences in size and form. The genetic profile was done using the PCR amplification, second internal transcribed spacer (ITS-2) of the ribosomal ADN. The molecular characterization of the isolated trypanosomes was made by the amplification the parasite. We used the precipitin test for identification the feeding sources and thus be able to associate them with the potential reservoir of the parasite. Results. The morphometric analyses showed no difference (p<0,05) in sex between the insects from both departments, but there was difference in the form between females. The genetic profile showed by ITS-2 similar bands of 960 pb in both groups (five insects) from Jaen and Cajaruro. The trypanosoma isolated from P. herreri (only in Cajaruro) was identify as Trypanosoma cruzi TCI (350 pb). Guinea pig blood was the main source of food for the insects. Conclusions. P. herreri from both localities no showed important differences under geometric morphometry and genetic studies. These results indicate the same population with similar origin. The guinea pig blood was the main source of food of P. herrei, may be the principal reservoir for the Chagas disease from this Peruvian area.
Key words: Panstrongylus; Triatominae; Trypanosoma cruzi; Genetics; Peru (source: DeCS BIREME).
INTRODUCCIÓN
La trypanosomiosis americana o enfermedad de Chagas es considerada como un importante problema de salud pública, con un alto impacto socioeconómico en América Latina, se estima que cerca de 100 millones de personas están en riesgo de adquirir la infección con alrededor de 20 millones de personas infectadas y más de 50 000 muertes ocurren cada año debido a esta enfermedad (1). En el Perú se estima que la seroprevalencia varía entre 0,14 a 16% en las diferentes áreas endémicas, sin embargo existe un subregistro de casos (2).
La enfermedad de Chagas es causada por el protozoo flagelado Trypanosoma cruzi y transmitida por insectos de la subfamilia Triatominae. Actualmente se reconoce un total de 137 especies que están agrupadas en 18 géneros y conformando cinco tribus (3). En el norte y nororiente del Perú se ha reportado, hasta el momento, 16 especies de triatominos, cuatro de ellas tienen un papel relevante en la transmisión de la enfermedad de Chagas por cohabitar con el hombre: Rhodnius ecuadoriensis (domiciliario), Panstrongylus herreri (domiciliario), Panstrongylus chinai, y Triatoma carrioni (peridomiciliados) y constituirían el blanco de medidas de control vectorial (4,5).
Panstrongylus herreri (Wygodzinsky, 1948), está presente principalmente en localidades de los departamentos de Piura, Cajamarca, San Martín y Amazonas ubicados en la región norte y nororiental del país (6). En Amazonas se ha reportado al P. herreri infectado por Trypanosoma sp en las provincias de Bagua (7) y Utcubamba (8). Esta especie también ha sido reportada en Ecuador (9,10).
La identificación taxonómica de los triatominos basada en las características morfológicas ha avanzado sustancialmente en los últimos años con la aplicación de diversas herramientas genéticas, principalmente técnicas de ADN; así el ITS-2 del ADNr es considerado como un buen marcador molecular para poblaciones, especies y relaciones filogenéticas en los triatominos (11-13).
Además de los estudios genéticos, la morfometría se ha aplicado exitosamente en diversas especies de triatominos, para resolver el origen territorial de individuos en casos de reinfestaciones, estudios de fenómenos de especiación y en las variaciones a nivel intraespecífico (14).
Estas observaciones son de utilidad en la planificación de medidas de control vectorial con insecticidas de acción residual, es por ello la necesidad de realizar estudios comparativos de morfometría y biología molecular para caracterizar las poblaciones de triatominos presentes, antes y después de la aplicación de químicos insecticidas, sobre todo en áreas aledañas a las aplicaciones de medidas de control (15).
Por otro lado, la colonización de la vivienda humana por los triatominos, podría estar relacionada a la accesibilidad de éstos, a fuentes de alimento (sangre), por lo que el conocer sus fuentes de alimentación nos ayudará a diferenciar sus hábitats (doméstico, peridomestico o silvestre), así como la selección de hospederos y la correlación entre la fuente hemática y la infección por Trypanosomatideos (16).
En esta investigación se compara dos poblaciones de Panstrongylus herreri, principal vector domiciliario de la enfermedad de Chagas en las provincias de Jaén y Cajaruro de los departamentos de Cajamarca y Amazonas, utilizando la morfometría geométrica, amplificación del espaciador interno trascrito del ADNr (ITS-2), la determinación de sus fuentes de alimentación; así como la caracterización genética de los tripanosomas que los parasitan.
MATERIALES Y MÉTODOS
TIPO Y ÁREA DE ESTUDIO
Se realizó un estudio descriptivo de las características morfométricas, genéticas y alimenticias de P. herreri en el distrito de Jaén, provincia de Jaén, departamento de Cajamarca y en el distrito de Cajaruro, provincia de Utcubamba, departamento de Amazonas.
La provincia de Jaén está ubicada al norte del departamento de Cajamarca, entre los 5º15 y los 6º4 de latitud sur; y entre los 78º33 y los 79º38 de longitud occidental, cuenta con una extensión territorial de 5 232,57 km2, que representa el 15,4% del total departamental. Su relieve es bastante variado y accidentado, por el acentuado contraste entre sus cordilleras, valles y pampas; está atravesada por el ramal interior de la cordillera occidental de los Andes, que en esta zona se llama Andes del Chamaya, por Weberbauer (17). El ramal exterior de dicha cordillera está ubicado al oeste del río Huancabamba y la cordillera oriental de los Andes, está ubicada al este del río Marañón. Presenta un clima tropical y húmedo, con una temperatura media de 26 °C y con lluvias de octubre a abril, cuyas precipitaciones no llegan a los 1200 mm anuales. El distrito de Jaén se encuentra a 729 msnm, y corresponde a la región Rupa Rupa o selva alta (18).
La provincia de Utcubamba, tiene una extensión de 3 859,93 km2 que representan el 9,8% del territorio de la región Amazonas y se ubica entre las coordenadas 77º5172 y 78º4212 longitud oeste y 5º2325 y 6º1053 de latitud sur; cuenta con un clima cálido, templado y húmedo, la temperatura oscila entre 25 °C y 35 °C, con humedad de 70% a 80% y la precipitación fluvial es de 1200 a 1800 mm anuales (18). En Utcubamba se observan extensiones de terrenos con características ecológicas semiexofíticas. La mayoría de las viviendas tienen piso de tierra y de dos a tres ambientes: dormitorio, cocinacomedor- cuyero a la vez y otro ambiente que sirve de depósito.
COLECTA E IDENTIFICACIÓN DE TRIATOMINOS
Se colectó 110 especímenes de P. herreri adultos (machos y hembras), 42 del distrito de Jaén (localidades: Cruz Grande, Las Naranjas, Santa Fe, Tierra Blanca, Quillabamba y Tumbillan) y 68 del distrito de Cajaruro (localidades: El Ron y Hebrón). La información sobre la presencia de triatominos en las viviendas de estas localidades fue proporcionada por los Laboratorios de la Subregión de Salud, Jaén y Bagua y orientaron su búsqueda. La captura se realizó manualmente por búsqueda activa (una hora/hombre) en el intra y peridomicilio. Todos los triatominos capturados fueron colocados en frascos de plástico que contenían en su interior papel plegado, y trasladados al laboratorio para su identificación taxonómica y procesamiento. Para su identificación taxonómica se utilizó las claves dicotómicas de Lent H y Wygodzinsky (1979) (19).
DETERMINACIÓN DE LA INFECCIÓN NATURAL POR TRYPANOSOMAS
El espécimen fue sujetado con una pinza en posición dorsoventral, sobre una lámina portaobjetos limpia, se presionó el extremo final del abdomen hasta la expulsión de las heces, luego se añadió una gota de suero fisiológico, se homogeneizó la muestra y se cubrió con una laminilla, luego se observó al microscopio a 40X en busca de formas móviles de trypanosomas.
MORFOMETRÍA GEOMÉTRICA
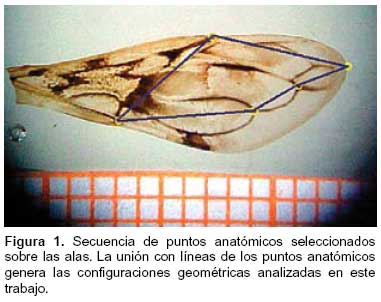
El análisis morfométrico comprendió el montaje de las alas de todos los P. herreri (hembras y machos) recolectados. Las alas fueron removidas del cuerpo de los insectos, luego montadas sobre portaobjetos y fijadas en una inclusión de Entellan MERCK ®. Las imágenes de las alas fueron digitalizadas, utilizando una cámara digital Sony ® MVC-FD75, zoom óptico 10X conectada a un estéreomicroscopio Bausch&Lomb ®.
Se seleccionó cinco puntos de referencia sobre las alas derechas: cuatro puntos tipo I y un punto tipo II (Figura 1) cuyas conexiones dan información sobre el tamaño y conformación. Mediante el análisis generalizado de procrustes (AGP) (20-23), los puntos anatómicos de referencia seleccionados, se convirtieron en matrices de coordenadas bidimensionales. Cada punto de referencia tiene dos variables correspondientes a las coordenadas sobre la ordenada y la abscisa, por esto se requiere cuatro veces más individuos que los puntos de referencia. Se utilizó 40 alas de hembras y 40 de machos de P. herreri. El conjunto de puntos de referencia tomados sobre una estructura biológica corresponde a la configuración geométrica de tal objeto (24).
EXTRACCIÓN Y AMPLIFICACIÓN DEL ADN RIBOSOMAL ITS-2 POR PCR DE TRIATOMINOS
Se examinó cinco especímenes de cada distrito (Jaén y Cajaruro). La extracción del ADN se realizó a partir de las seis patas de cada triatomino; se utilizó el kit DNeasy Tissue Handbook de QUIAGEN®, de acuerdo con las indicaciones descritas por el fabricante.
Para la amplificación del ADN Ribosomal por PCR (ITS- 2), se utilizó los iniciadores 5.8T (5-CAT AGC GGT GGA TCA CTC GG) y 28T (5-GCA CTAT CAA GC A ACA CGA CTC) (12). La concentración final de la reacción de PCR fue de 1X para el buffer de reacción de Taq polimerasa, 3,5 mM de ClMg2 (Invitrogen ®), 200 μM para los dNTPs, 1 μM para cada uno de los primers y 0,5 U de Platinum ® Taq DNA Polymerase High Fidelity (Invitrogen ®). Se utilizó el perfil térmico touchdown (25). Los productos fueron visualizados en geles de poliacrilamida al 6% y teñidos con nitrato de plata (26), utilizándose el marcador de peso molecular 50 pb.
FUENTES DE ALIMENTACIÓN
Para determinar la fuente de alimentación de los triatominos se empleó la prueba de precipitina (27). La muestra, constituida por el contenido intestinal de cada triatomino, fue colectado sobre papel filtro (Watman N.º 4) y conservado en bolsas plásticas herméticas a –20°C (28).
Los papeles impregnados con el contenido intestinal fueron recortados (1 cm2) y sumergidos en un tubo de prueba con 1,5 mL de solución salina 0,85%, dejándose a 4 ºC durante toda la noche; al día siguiente los tubos fueron centrifugados durante cinco minutos a 2000 rpm para separar el sobrenadante.
La identificación de las fuentes de alimentación se realizó enfrentando los eluídos del material impregnado en papel filtro (sobrenadante) contra los antisueros específicos para humano, perro, gato, cobayo y pollo, producidos en conejos Nueva Zelanda de 2,5 kg de peso (16). La prueba se ejecutó en tubos de vidrio (2,1 mm diámetro interno x 40 mm de alto), incubados a 37 ºC durante una hora, siendo positiva la prueba cuando se observó la formación de un anillo blanco en el medio del tubo.
La preparación de los antisueros, titulación y determinación de la especificidad se realizó de acuerdo a Siqueira (27). Los títulos de los antisueros fueron: antihumano (1: 25 000), anti-perro (1: 15 000), anti-gato (1:10 000), anti-cobayo (1:10 000) y anti-pollo (1:15 000).
AISLAMIENTO Y EXTRACCIÓN DE ADN A PARTIR DE TRYPANOSOMATIDEOS
Trypomastigotes metacíclicos del contenido intestinal de P. herreri procedentes de Cajaruro (Amazonas), fueron inoculados intraperitonealmente en ratones Balb/C. A los 30 días se realizó el aislamiento del parásito por hemocultivo de una muestra de sangre del ratón infectado que contenía trypomastigotes de Trypanosoma. El ADN genómico fue extraído a partir de los parásitos aislados y mantenidos en medio de cultivo axénico, utilizando el kit DNeasy Tissue Handbook de QUIAGEN®.
AMPLIFICACIÓN POR PCR DEL ESPACIADOR ÍNTERGÉNICO DEL GEN MINI EXÓN
Se usó las siguientes condiciones de reacción: 1X de buffer de reacción de Taq polimerasa, 0,5 unidades de Taq polimerasa, 2,5 mM de MgCl2, (Invitrogen®), 200 μM de mezcla de dNTPs, y 50 μM de los iniciadores: TCC (5´ CCC CCC TCC CAG GCC ACA CTG 3´); TC1 (5´GTG TCC GCC ACC TCC TTC GGG CC 3´) y TC2 (5´ CCT GCA GGC ACA CGT GTG TGT G 3´) (29). Se utilizó el perfil térmico descrito por Brisse et al. (30). Los productos amplificados fueron visualizados en geles de poliacrilamida al 6% y teñidos con nitrato de plata (28), utilizando un marcador de peso molecular de 50 pb.
ANÁLISIS ESTADÍSTICO
Las variables de la conformación derivadas del AGP se utilizaron para comparar los sexos y hábitat de los P. herreri de Jaén y Cajaruro, mediante análisis de componentes principales y análisis discriminantes. Se incluyó el análisis multivariado de varianza (MANOVA) para asociar niveles de significancia estadística a la variación interespecies, para ello se usó los programas MOG, PAD, BAC (31) y PAST (32) de libre acceso en Internet.
RESULTADOS
MORFOMETRÍA GEOMÉTRICA
Dimorfismo sexual. Las comparaciones del tamaño en las alas de hembras y machos mostraron que no hay diferencias significativas según sexo (p> 0,05) en el análisis univariado. Las comparaciones multivariadas utilizando el análisis discriminante evidenció que el dimorfismo sexual en la conformación de las alas es significativo (Lamba de Wilks: 0,543, p< 0,001); la reclasificación de alas para machos fue de un 75% (30/40) y para las hembras de un 82% (33/40) y la distancia de Mahalanobis fue de 1,81, la cual demostró ser significativa después de un análisis de permutaciones (0/1000). Al obtener estos resultados se analizó por separado los grupos de hembras y machos de Jaén y Cajaruro.
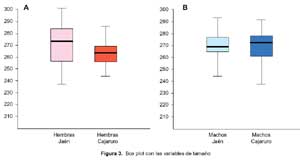
El análisis de relative warps, no muestra dimorfismo sexual de la conformación entre hembras y machos; pero hay mayor variación en la conformación alar en las hembras que en los machos (A). Caso contrario ocurre en la conformación alar de hembras procedentes de Jaén y Cajaruro (B) y machos del mismo lugar (C), en el que se observa diferencias en la conformación (Figura 2).
Al efectuar el análisis univariado entre el tamaño alar según procedencia (Jaén y Cajaruro) no se encontró diferencias significativas en hembras (Figura 3A, p=0,173) ni en machos (Figura 3B, p=0,763). Con respecto a la conformación, en el análisis discriminante se encontró diferencias en la conformación alar de los triatominos de Jaén y Cajaruro, tanto en las hembras (Lamba de Wilks: 0,473, distancia Mahalanobis: 2,06, p<0,001) como en los machos (Lamba de Wilks: 0,623, distancia Mahalanobis: 1,52, p=0,011).
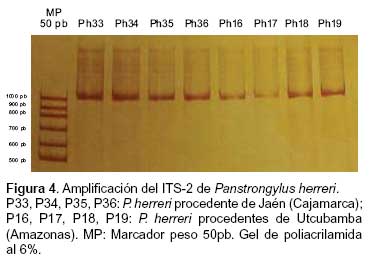
CARACTERIZACIÓN MOLECULAR POR AMPLIFICACIÓN DE ADN RIBOSOMAL POR PCR (ITS-2)
Todas las muestras pudieron ser visualizados en el gel de poliacrilamida al 6%, observándose una banda de aproximadamente 960 pb, evidenciando la ausencia de polimorfismo de longitud en el ITS-2 de los individuos evaluados (Figura 4).
FUENTES DE ALIMENTACIÓN Y SU RELACIÓN CON LA INFECIÓN POR TRYPANOSOMA
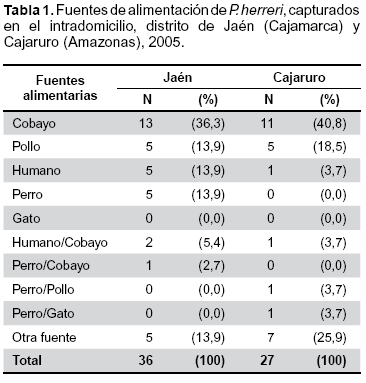
Se procesaron un total de 63 triatominos, 36 procedentes de Jaén y 27 de Cajaruro, la principal fuente de alimentación fue el cobayo en ambas localidades (36,3 y 40,8% respectivamente), el hombre fue la tercera fuente más frecuente, aproximadamente en uno de cada cinco casos no se logró identificar la fuente de alimentación (Tabla 1).
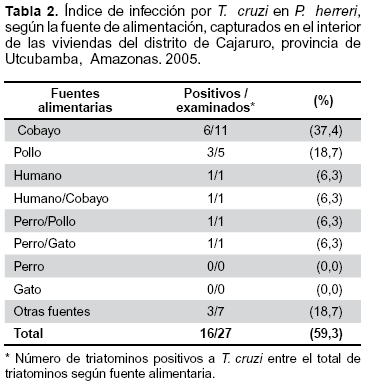
La infección por Trypanosoma en los P. herreri se evidencio sólo en ejemplares provenientes de Cajaruro donde se encontró una tasa de infección de 59,3% (16/27), la principal fuente alimenticia en los ejemplares positivos fue el cobayo, seguido por el pollo y humano, es importante señalar que 3 (18,7%) tuvieron preferencia alimenticia por otras fuentes no identificadas (Tabla 2).
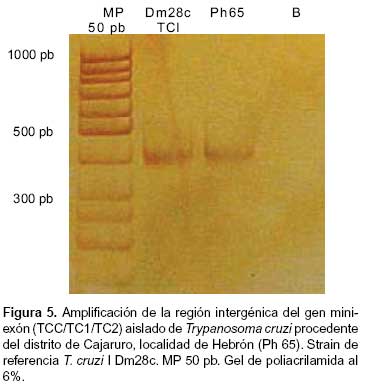
AMPLIFICACIÓN DEL ESPACIADOR INTERGÉNICO DEL GEN MINI EXÓN
Se determinó que el parásito aislado, procedente del distrito de Cajaruro, localidad Hebrón y caracterizado por amplificación de la región intergénica del gen miniexón corresponde a T. cruzi TCI (350 pb) (Figura 5).
DISCUSIÓN
En el transcurso del tiempo, el hombre ha ido colonizando los ambientes silvestres provocando que muchas especies de animales y plantas disminuyan o desaparezcan y que se adecuen a nuevos hábitats. En nuestro país se ha visto una gradual expansión del área agrícola hacia la selva, se depredan extensas áreas de bosques para sustituirlas por campos de cultivos. Estos cambios ecológicos, sumados a los procesos migratorios determinan la emergencia de problemas de salud pública, principalmente relacionadas con las enfermedades transmitidas por vectores.
La ausencia de polimorfismo de longitud, en los especímenes de P. herreri procedentes de los departamentos de Cajamarca como en los de Amazonas, nos indica que se trata de una misma población, éstos resultados concuerdan con los hallados por morfometría geométrica.
La longitud de banda encontrada para el ITS-2 del ADNr de los especímenes examinados, es similar a lo reportado por Marcilla et al. (11), quien obtiene una banda aproximada de 965 pb, y quien al realizar el análisis de secuencia de este marcador, encontró que las dos poblaciones de P. lignarius, Walter 1873, de Ecuador y Brasil fueron idénticas, como las de P. herreri de Ecuador y Perú, lo que podría significar que herreri sería sinónimo de lignarius, proponiéndose la existencia de dos subespecies Panstrongylus lignarius lignarius y Panstrongylus lignarius herreri (11); cabe señalar que los especímenes estudiados de Perú por Marcilla procedían de Cajamarca y que fueron mantenidos en el Laboratorio de FIOCRUZ (Brasil).
Los resultados obtenidos por ITS-2, no permiten distinguir si los ejemplares evaluados corresponderían a P. herreri o P. lignarius, sin embargo considerando que la principal diferenciación entre ambas especies es su distribución geográfica y aspectos ecológicos como el hábitat (P. lignarius exclusivamente silvestre y P. herreri domiciliario), podemos inferir que los estudiados corresponden a P. herreri por haber sido encontrados en el interior de la vivienda. P. herreri, actualmente es considerado como el principal vector doméstico del norte del Perú (4) y se le relaciona con la vivienda humana y presencia de cobayos (33). En nuestro estudio se observó que en casi todas las viviendas de Jaén y Cajaruro visitadas para la captura de triatominos, se criaban cobayos en los dormitorios y cocinas, ambientes donde fueron capturados los triatominos.
El aspecto general del cuerpo de un organismo está fuertemente relacionado con sus hábitos de vida y con las estrategias para sobrevivir y reproducirse. A diferencia del genoma, la morfología está en contacto directo con las condiciones físicas del ambiente y con los otros organismos (33). Según Falconer (35) los caracteres morfológicos medibles son los primeros que cambian en el transcurso de la evolución, su arquitectura responde al compromiso entre las demandas del entorno (biótico y abiótico) y las del genoma (individual y del grupo).
Uno de los rasgos informativos sobre el modo de vida de las especies de triatominos, es el dimorfismo sexual (36) y se recomienda considerar al dimorfismo sexual de tamaño, como un rasgo a tener en cuenta en los estudios de adaptación de los Triatominae a ambientes domésticos. Los resultados de estos autores demuestran que el dimorfismo sexual disminuye en los ejemplares domésticos o de laboratorio con respecto a sus parientes del campo. En nuestro trabajo el dimorfismo sexual de tamaño no fue significativo al comparar machos con hembras de ambos distritos; sin embargo, no ocurrió lo mismo con el dimorfismo de la conformación. Asimismo no se encontraron diferencias de tamaño al comparar hembras de Jaén y Cajaruro así como machos de ambas localidades, lo cual podría estar indicar que se trate de una misma población de P. herreri, resultado también encontrado al comparar el ITS-2 de los especímenes procedentes de ambas zonas.
Tanto los P. herreri procedentes de Jaén y Cajaruro presentan similar perfil alimenticio, teniendo ambos como principal fuente de alimentación sangre de cobayo, seguida de pollo y humano. Estos resultados eran de esperarse ya que en casi todas las viviendas se encontró presencia de cobayos en los dormitorios y cocina, hecho que concuerda con lo observado por Herrer en 1960 (32). En la zona sur del Perú, Solís et al. (37) encontraron como principal fuente de alimentación de T. infestans la sangre de ave seguida de roedor y humano, así como una hembra infectada por T. cruzi. En nuestro trabajo, de los cinco triatominos alimentados con sangre de pollo, tres fueron positivos a T. cruzi (Tabla 2). El hecho de encontrar triatominos alimentados con sangre de pollo, infectados con T. cruzi, se explicaría con la infección durante una alimentación anterior en mamífero ya que las aves no son susceptibles a la infección por estos parásitos. Estudios realizados en Brasil y Uruguay en diversos tipos de triatominos, encontraron una gran variedad de fuentes de alimentación como sangre de roedor, ave, perro, gato (38,39). Asimismo tanto en los triatominos procedentes de Jaén y Cajaruro, se encontró hasta dos distintas fuentes de alimentación (Tabla 1), lo cual indicaría el poco aprovechamiento de otras fuentes que estuvieran disponibles, así como la preferencia exclusiva por un determinado animal.
Analizando la relación entre la fuente de alimentación y la infección por Tripanosomatideos, se encontró a P. herreri con mayor preferencia por sangre de cobayo, lo que indicaría que estos roedores podrían actuar como principales reservorios de T. cruzi, sin embargo se requiere realizar estudios en estos reservorios para conocer como podrían estar contribuyendo en mantener la cadena de transmisión de este parásito.
Anteriormente, se consideraba que el género Panstrongylus estaba relacionado con la transmisión de T. cruzi Z1 y Z3; y que lo encontrábamos asociado primariamente con madrigueras y cavidades de árboles (40). T. cruzi linaje I (TCI), fue asociado con los ciclos de transmisión silvestre, sin embargo, se ha observado que TCI incluye parásitos que circulan tanto en ambientes silvestres como domésticos (41,42). Este argumento se relaciona con el resultado obtenido en nuestro estudio, ya que el stock de T. cruzi aislado a partir de P. herreri encontrado en el intradomicilio, corresponde a TCI (350 pb). También se ha descrito en nuestro país la presencia de TCI y TCIIa, aislados a partir de T. infestans y casos humanos (43).
17-25. Panstrongylus herreri de Cajamarca y Amazonas Los resultados obtenidos nos permiten señalar que las poblaciones de Panstrongylus herreri estudiadas de los distritos de Jaén y Cajaruro son similares al aplicar la morfometría geométrica y amplificación del ITS-2, es decir parecen proceder de un origen común y su dispersión fue favorecida por la migración de los pobladores, los cuales continuaron con la costumbre de criar animales domésticos tales como el cobayo, al cual encontramos como la fuente más frecuente de alimento y posible reservorio de T. cruzi, caracterizado por amplificación del miniexón como TCI.
El conocimiento de estos aspectos de la biología y ecología de los triatominos, son de importancia para determinar cuales con los factores involucrados en la transmisión de T. cruzi, aspecto fundamental para estratificar áreas de riesgo y poder definir mejor estrategias de control vectorial y los métodos que aseguren una adecuada vigilancia entomológica.
AGRADECIMIENTOS
A los técnicos de laboratorio Antero González y Edilberto Linares de la Dirección Regional de Salud Amazonas y Jaén respectivamente, quienes colaboraron en la captura de los triatominos; a Alejandro Arenas por su invaluable ayuda en el mantenimiento de los animales de experimentación; asimismo nuestro especial agradecimiento a la European Community Specific Support Activity (SSA): Trypanosomiasis Update. Subproyecto 3. Caracterización genética de R. ecuadoriensis, P. herreri, P. chinai y T. carrióni en el nororiente del Perú, que permitió la capacitación de integrantes de nuestro equipo.
REFERENCIAS BIBLIOGRÁFICAS
1. W orld Health Organization. Scientific Working Group on Chagas Disease. Buenos Aires: WHO; 2005.
2. Cabrera CR. Enfermedad de Chagas o trypanosomiasis americana. En: Súarez OL, Beingolea ML, Nakamoto TI, Cabrera CR, compiladores. Protocolos de vigilancia epidemiológica. Parte I, 2da ed. Lima: Dirección General de Epidemiología, Ministerio de Salud; 2006. P. 89-104.
3. Galvão C, Carcavallo R, Rocha DS, Jurberg J. A checklist of the current valid species of the subfamily Triatominae Jeannel, 1919 (Hemiptera: Reduviidae) and their geographical distribution, with nomenclatural and taxonomic notes. Zootaxa. 2003; 202: 1-36.
4. Cáceres AG, Troyes L, Gonzáles-Perez A, Llontop E, Bonilla C, Muria E, et al. Enfermedad de Chagas en la Región Nororiental del Perú. I. Triatominos (Hemiptera: Reduviidae) presentes en Cajamarca y Amazonas. Rev Peru Med Exp Salud Publica 2002; 19(1): 17-23.
5. Guillen Z, Cáceres I, Elliot A, Ramirez J. Distribución geográfica de los triatominos en el oriente del Perú. Rev Peru Med Trop. 1992; 6: 93-97.
6. Lumbreras H. El problema de la enfermedad de Chagas en los diferentes departamentos del Perú.[Tesis doctoral] Lima: Facultad de Medicina, Universidad Peruana Cayetano Heredia; 1972.
7. H errer A. Tripanosomiasis americana en el Perú: V. Triatominos del valle interandino del Marañon. Rev Med Exp. 1955; 9(1-2): 69-81.
8. Calderón FG. Actualización de la distribución geográfica de los triatominos del Perú (Hemiptera: Reduviidae). Lima: Dirección de Erradicación y Control de Enfermedades Transmisibles, Programa de Erradicación de la Malaria y Control de Chagas, Ministerio de Salud; 1977.
9. Aguilar VHM, Abad-Franch F, Racines VJ, Paucar CA. Epidemiology of Chagas disease in Ecuador. A brief review. Mem Inst Oswaldo Cruz. 1999; 94 (Suppl 1): 387-93.
10. Abad-Franch F, Paucar CA, Carpio CC, Cuba-Cuba CA, Aguilar VHM, Miles MA. Biogeography of Triatominae (Hemiptera: Reduviidae) in Ecuador: implications for the design of control strategies. Mem Inst Oswaldo Cruz. 2001; 96(5): 611-20.
11. Marcilla A, Bargues MD, Abad-Franch F, Panzera F, Carcavallo RU, Noireau F, et al. Nuclear rDNA ITS-2 sequences reveal polyphyly of Panstrongylus species (Hemiptera: Reduviidae:Triatominae), vectors of Trypanosoma cruzi. Infect Genet Evol. 2002; 1(3): 225-35.
12. Marcilla A, Bargues MD, Ramsey JM, Magallon- Gastelum E, Salazar-Schettino PM, Abad-Franch F, et al. The ITS2 of the nuclear rDNA as a molecular marker for populations, species, and phylogenetic relationships in Triatominae (Hemiptera:Reduvvidae), vectors of Chagas disease. Molecular Phylogenet Evol. 2001; 18(1): 136-42.
13. Marcilla A, Canese A, Acosta N, Lopez E, Rojas de Arias A, Bargues MD, et al. Populations of Triatoma infestans (Hemiptera:Reduviidae) from Paraguay: a molecular análisis based on the second internal transcribed spacer of the rDNA. Res Rev Parasitol. 2000; 60: 99-105.
14. J aramillo N. Morfometría geométrica, apoyo a la taxonomía. En: Vallejo GA, Carranza White JS (eds), Memorias del curso taller internacional: Morfología y morfometría aplicadas a la taxonomía de los vectores de la enfermedad de Chagas. Ibagué: Facultad de Ciencias, Universidad del Tolima; 2004. p. 96-117.
15. Organización Panamericana de la Salud. II Encuentro Regional Proyecto CDIA-EC: Herramientas para la vigilancia de Triatoma infestans y otros triatominos en países del Cono Sur con certificación de la interrupción de la transmisión vectorial en toda la zona endémica. Montevideo: OPS; 2005.
16. Pinto J. Identificación de fuentes de alimentación de Panstrongylus herreri (Hemiptera:Triatominae) mediante una prueba de precipitación, en el distrito de Cajaruro, provincia de Utcubamba, Amazonas - Perú. [Tesis para optar el título de biólogo]. Lima: Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos; 2006.
17. W eberbauer A. El mundo vegetal de los Andes Peruanos. Lima: Editorial Lume; 1945.
18. Pulgar Vidal J. Las ocho regiones naturales del Perú. Lima: Editorial Universo; 1979.
19. Lent H, Wygodzinsky P. Revision of the Triatominae (Hemiptera: Reduviidae), and their significance as vectors of Chagas disease. Bull Am Mus Nat Hist. 1979; 163(3): 125-520.
20. Adams DC, Slice DE, Rohlf FJ. Geometric morphometrics: Ten years of progress following the revolution. Ital J Zool. 2004; 71(1): 5-16
21. Bookstein FL. Morphometric tools for landmark data: geometry and biology. Cambridge: Cambridge University Press; 1991.
22. Rohlf FJ, Marcus LF. A revolution in morphometrics. Trends Ecol Evol. 1993; 8: 129-32.
23. Rohl FJ, Slice DE. Extensions of the Procrustes method for the optimal superimposition of landmarks. Syst Zool. 1990; 39: 40-59.
24. J aramillo N. Partición en tamaño y forma de los caracteres métricos y su interés en los estudios poblacionales aplicados a los Triatominae. [Tesis de doctorado]. Medellín: Corporación de Ciencias Básicas Biomédicas, Universidad de Antioquia; 2000.
25. J aramillo C, Montaña MF, Castro LR, Vallejo GA, Gulh F. Differentiation and genetic analysis of Rhodnius prolixus and Rhodnius colombiensis by rDNA and RAPD amplification. Mem Inst Oswaldo Cruz. 2001; 96(8):1043-48.
26. Sanguinetti CJ, Dias-Neto E, Simpson AJ. Rapid silver staining and recovery of PCR products separated on polyacrylamide gels. Biotechniques. 1994; 17(5): 914-21.
27. Siqueira A. Estudos sobre a reação de precipitina aplicada á identifição do sangue ingerido por triatomineos. Rev Inst Med Trop Sao Paulo. 1960; 2: 41-53.
28. Gomes LA, Duarte R, Lima DC, Diniz BS, Serrão ML, Labarthe N. Comparison between precipitin and ELISA tests in the bloodmeal detection of Aedes aegypti (Linnaeus) and Aedes fluviatilis (Lutz) mosquitoes experimentally fed on feline, canine and human hosts. Mem Inst Oswaldo Cruz. 2001; 96(5): 693-95.
29. Souto RP, Fernandes O, Macedo AM, Campbell DA, Zingales B. DNA markers define two major phylogenetic lineages of Trypanosoma cruzi. Mol Biochem Parasitol. 1996; 83(2): 141-52.
30. Brisse S, Verhoef J, Tibayrenc M. Characterization of large and small subunit rRNA and mini-exon genes further supports the distinction of six Trypanosoma cruzi lineages. Int J Parasitol. 2001; 31(11):1218-26.
31. Dujardin J. Morphometrics in medical entomology [página de internet]. Montpellier: L´IRD; 2005. [Fecha de acceso: 26 de marzo 2006]. Disponible en: http://www.mpl.ird.fr/morphometrics/
. 32. H ammer O, Harper DAT, Ryan PD. PAST: Paleontological statistics software package for education and data analysis. Palaeontol Electronica. 2001; 4(1) e4.
33. H errer A. Distribución geográfica de la enfermedad de Chagas y sus vectores en el Perú. Bol Oficina Sanit Panam. 1960; 49: 572-81.
34. J aramillo N, Caro-Riaño H. Diferencias morfométricas entre Rhodnius prolixus Stål, 1859 y R. pallescens Barber, 1932. En: Memorias del Primer Taller Internacional Sobre Control de la Enfermedad de Chagas. Bogotá: Universidad de Los Andes / SSA-ES, Tripanosiomiasis Update; 2005
35. Falconer DS, Mackay TFC. Introduction to quantitative genetics. 4th ed. London: Pearson Prentice Hall; 1996.
36. Dujardin JP, Steindel M, Chávez T, Machane M, Schofield CJ. Changes in the sexual dimorphism of Triatominae in the transition from natural to artificial habitats. Mem Inst Oswaldo Cruz. 1999; 94(4): 565-69.
37. Solís H, Carvalho E, Ferreria C, Casanova C, Huamán A, Mendoza V. Contribución al estudio de la epidemiología de la Enfermedad de Chagas en tres localidades de la zona sur del Perú. An Fac Med (Lima). 2003; 64(4): 223-27
38. Freitas SP, Lorosa ES, Rodrigues DC, Freitas AL, Gonçalves TC. Fontes alimentares de Triatoma pseudomaculata no Estado do Ceará, Brasil. Rev Saude Pública. 2005; 39(1): 27-32.
39. Salvatella R, Calegari L, Puime A, Basmadjian Y, Rosa R, Guerrero J, et al. Perfil alimentario de Triatoma rubrovaria (Blanchard, 1843) (Hemiptera: Triatominae) en ámbitos peridomiciliários, de una localidad rural de Uruguay. Rev Inst Med trop Sao Paulo 1994; 36(4): 311-20.
40. Gaunt M, Miles MA. The ecotopes and evolution of triatomine bugs (Triatominae) and their associated trypanosomes. Mem Inst Oswaldo Cruz. 2000; 95(4):557- 65.
41. Brisse S, Barnabe C, Tibayrenc M. Identification of six Trypanosoma cruzi phylogenetic lineages by random amplified polymorphic DNA and multilocus enzyme electrophoresis. Int J Parasitol. 2000; 30(1): 35-44.
42. Triana O, Ortiz S, Dujardin JC, Solari A. Trypanosoma cruzi: Variability of stocks from Colombia determined by molecular karyotype and minicircle Southern blot analysis. Exp Parasitol. 2006; 113(1): 62-66.
43. H igo H, Miura S, Agatsuma T, Mimori T, Yanagi T, Iwagami M, et al. Identification of Trypanosoma cruzi sublineages by the simple methods of single-stranded conformation DNA polymorphism (SSCP). Parasitol Res. 2007; 100(5): 1023- 31.
Correspondencia:
Blga. Silvia Vega Chirinos, Laboratorio de
Leishmaniasis y Chagas, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
Dirección: Cápac Yupanqui 1400, Lima 11.
Teléfono: (511) 471-9920 anexo
Correo electrónico: svega@ins.gob.pe
Fecha de recepción: 03-04-07
Fecha de aceptación: 09-08-07