Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.25 n.1 Lima ene./mar. 2008
ARTÍCULOS ORIGINALES
Respuesta conductual de Aedes Aegypti (Linnaeus, 1762) frente a Adulticidas Piretroides de uso frecuente en Salud Pública
Behavioural response of Aedes aegypti (Linnaeus, 1762) exposed to pyretrhoids insecticides of frequently use in public health
Yuri O. Ayala-Sulca1,a, Luis Ibarra-Juarez2,b, Jhon P. Grieco3,a,d, Nicole Achee3,a,d, Roberto Mercado-Hernandez2,c,d, Ildefonso Fernández-Salas2c,d
1 Facultad de Ciencias Biológicas, Universidad Nacional de San Cristóbal de Huamanga. Ayacucho, Perú.
2 Laboratorio de Entomología Médica, Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. Monterrey, México.
3 Department of Preventive Medicine and Biometrics, Uniformed Services University of the Health Sciences. Bethesda, USA.
a Biólogo, entomólogo médico; b Médico veterinario zootécnista; c Químico bacteriólogo parasitólogo, entomólogo médico; d Doctor en ciencias.
RESUMEN
Objetivos. Evaluar la respuesta conductual de la generación F1 de Aedes aegyti (L) colectados en el área metropolitana de Monterrey (Nuevo León, México) frente a tres adulticidas piretroides de uso frecuente en salud pública. Materiales y métodos. Se utilizó un sistema modular novedoso denominado HITSS (High-Throughput Screening System), para evaluar dos respuestas de comportamiento (irritación de contacto y repelencia espacial), así como la toxicidad de tres insecticidas DDT, permetrina y bifentrina a diferentes concentraciones (0,025, 0,25, 25 y 250 nmol/cm2). Resultados. En la concentración 2,5 nmol/cm2, el DDT (4,3 ± 2,4) y la permetrina (8,0 ± 1,4) son los insecticidas que tienen mayor efecto irritante (p<0,05); la bifentrina requiere dosis 20 veces más alta para lograr efectos similares. En repelencia espacial, los tres insecticidas evaluados producen respuestas similares en todas las concentraciones; para DDT de 7 a 14%; permetrina de 9 a 15% y bifentrina de 19 a 27%. La permetrina y bifentrina a concentraciones 0,025 nmol/cm2, producen efectos knockdown superiores a 34%, con una mortalidad 19%, el DDT requiere concentraciones diez veces más alta para lograr efectos similares. Conclusiones. El sistema HITTS puede ser usado para evaluar la respuesta conductual frente a insecticidas.
Palabras clave: Insecticidas; Repelentes de insectos; Toxicidad; Aedes aegypti (fuente: DeCS BIREME).
ABSTRACT
Objectives. To assess the behavioural response of the F1 generation of Aedes aegyti (L) collected in the Metropolitan area of Monterrey (Nuevo Leon, Mexico) vs. three adulticides pyrethroids frequently used in public health. Materials and methods. We used a novel modular system called HITSS (High-Throughput Screening System) to evaluate two behavioral responses (contact irritation and spatial repellency), as well as the toxicity of three insecticides DDT, permeathrin and bifenthrin at different concentrations (0.025, 0.25, 25 and 250 nmol/cm2). Results. In the concentration 2.5 nmol/cm2, DDT (4.3 ± 2.4) and permethrin (8.0 ± 1.4) were the insecticides that are more irritating effect (p <0.05); the bifenthrin requires 20 times higher doses to achieve similar effects. In spatial repellency, the three insecticides tested have had a similar responses at all concentrations; DDT: 7 to 14%, permethrin: 9 to 15% and bifenthrin: 19% to 27%. Permethrin and bifenthrin in 0.025 nmol/cm2 concentrations, effects knockdown above 34%, with a mortality rate 19%, DDT requires 10 times higher concentrations to achieve similar effects. Conclusions. HITTS system can be used to assess the behavioural response to insecticides.
Key words: Insecticides; Insect repellents; Toxicity; Aedes aegypti (source: DeCS BIREME).
INTRODUCCIÓN
Se ha recomendado muchas medidas de control químico contra vectores de enfermedades, algunas como las pruebas de nebulización, el ultra bajo volumen (UBV) y el uso de mosquiteros impregnados con insecticidas son medidas efectivas, seguras y prácticas que han tenido impacto en el control de enfermedades metaxénicas (1- 3). Todos los métodos de protección personal y para el control vectorial que utilizan insecticidas están basados en la capacidad irritante, repelente y tóxica de éstos productos, por lo que se ha propuesto algunas técnicas que evalúen estas características y son muchas las investigaciones que se ha desarrollado en relación con la ecología vectorial. Varios tipos de sistemas utilizan la prueba de éxito repelencia para medir las respuestas de comportamiento de los mosquitos frente a los insecticidas (4-6). Sin embargo, ningún sistema ha sido aceptado como un método estandardizado de prueba y análisis de respuestas de repelencia (7-9).
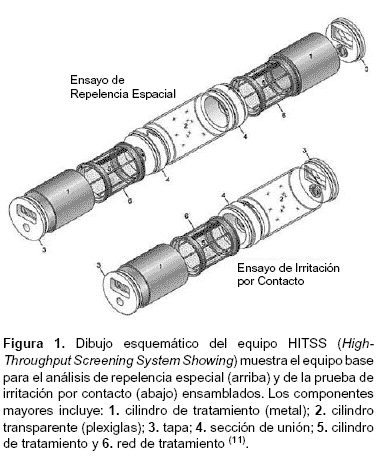
Los estudios de éxito repelencia han sido usados desde 1962 con diversos vectores de malaria, usando versiones modificadas de las cajas de éxito repelencia de la OMS. Últimamente Chareonviriyaphap et al. (10) usaron un sistema de cámara de escape, que reportó información (contacto de irritabilidad y de repelencia no contacto) para pruebas de respuesta de comportamiento en Anopheles albimanus bajo condiciones de laboratorio y campo. Grieco et al. (11), describió y desarrolló un novedoso sistema modular de ensayo para la investigación completa y rápida de los compuestos químicos, este sistema permite evaluar la acción repelente espacial, irritante de contacto y toxicidad de un insecticida contra mosquitos adultos, este dispositivo denominado como Sistema de Investigación de Alto-rendimiento de Procesamiento (HITSS, por sus siglas en inglés), es el que se uso en esta investigación.
Actualmente, con excepción de la respuesta penetrante, no hay sistema de prueba estándar para el estudio de los nuevos productos químicos que afectan el comportamiento del mosquito adulto. Idealmente, el sistema utilizado permite un alto rendimiento de procesamiento (la capacidad de realizar réplicas múltiples con varios tratamientos en periodos cortos), tiene un área superficial de tratamiento que reduce al mínimo la cantidad de producto químico a probar, puede descontaminarse fácilmente, no requiere otros dispositivos mecánicos (ej. túnel de viento), y proporciona resultados constantes dentro de los tratamientos (11); por lo que nos planteamos como objetivo general de la presente investigación, evaluar la respuesta conductual de Ae.aegypti (L), frente a adulticidas piretroides de uso frecuente en salud pública utilizando el dispositivo HITSS.
Los resultados reproducibles de toxicidad e irritación obtenidos en las pruebas biológicas de contacto y actividad espacial de repelencia con este nuevo sistema, proveen una línea de base para determinar la concentración efectiva-residual de los insecticidas químicos de uso frecuente en salud pública (en nuestro caso permetrina [i.a.] y bifentrina [i.a.] en comparación con el DDT). Adicionalmente, los resultados de este trabajo sugieren que el efecto repelente de los insecticidas sobre los mosquitos es un importante factor en los programas de control de Ae. aegypti (L).
MATERIALES Y MÉTODOS
CÁMARA DE ENSAYO DE ANÁLISIS DE COMPORTAMIENTO (IRITACIÓN DE CONTACTO YREPELENCIA ESPACIAL) ASÍ COMO TOXICIDAD
Para las pruebas de respuesta conductual de Ae. aegypti (L) frente a los insecticidas evaluados, se hizo uso de la cámara de ensayo HITSS, propuesto por Grieco et al. (11). El sistema tiene un diseño modular que permite examinar dos respuestas de comportamiento, irritación de contacto y repelencia espacial, así como la toxicidad. Los componentes principales del HITSS se describen en la figura 1. El número de módulos y el montaje requerido variaron dependiendo del tipo de análisis que se realizó.
MOSQUITOS
Los mosquitos utilizados procedieron del área metropolitana de Monterrey (Nuevo León, México) fueron colectados entre los municipios de San Nicolás de los Garza (coordenadas N: 25˚ 48 01.2; W: 100˚ 16 34) y Escobedo (coordenadas N: 25˚ 48 48,2; W: 100˚ 24 13,8). Las larvas fueron colectadas en campo utilizando dipers y duyas de acuerdo con los métodos descrito por Fay y Eliason (12), Reiter et al. (13), Villaseca et al. (14), Ordóñez et al. (15) y Vargas (16); las cuales fueron trasladadas en bolsas whirl-pak acondicionadas en termos de plástico provistos de agua y protegidos para evitar daños que perjudiquen su vialidad hasta el laboratorio de Entomología Médica de la Facultad de Ciencias Biológicas de la Universidad Autónoma de Nuevo León.
Una vez en el laboratorio, las larvas fueron colocadas en bandejas de plástico de color blanco de 30 x 20 x 5 cm conteniendo un volumen adecuado de agua libre de cloro y acondicionadas en el insectario del laboratorio, a una temperatura de 27 °C, 70% de humedad relativa y un fotoperiodo de 12:12 (D:N). Las larvas I, II, III y IV fueron alimentadas con alimento para peces tropicales tipo hojuelas hasta alcanzar el estado de pupa. Una vez logrado los estadios adultos fueron acondicionadas en jaulas comunes de 30,5 x 30,5 x 30,5 cm proporcionándoles una solución de azúcar al 10% en las primeras horas de su emergencia (24 horas), posteriormente fueron alimentadas con sangre humana hasta lograr posturas de huevos y obtener la generación F1, esta fue la población utilizada en las pruebas experimentales.
Las larvas emergidas de esta generación fueron criadas hasta lograr los estados adultos que fueron sexados; las hembras fueron alimentadas hasta un máximo de 48 h antes de someterlas a las pruebas de respuesta conductual. En este periodo fueron separados en grupos de 15 y 10 hembras en vasos de plástico desechable de 200 mL.
Se dispuso para la prueba de irritabilidad por contacto un total de 720 insectos hembras, separados en grupos de diez insectos por concentración para los tres insecticidas evaluados y 80 insectos para las pruebas control haciendo un total de 800 hembras. La prueba de repelencia espacial fue realizada con un total de 1620 hembras separadas en 15 insectos por grupo/ concentración a evaluar para los tres insecticidas. Finalmente, para la prueba de toxicidad fue hecha con 1080 hembras separados en grupos de 15 insectos para los tres insecticidas y 120 insectos para las pruebas de control haciendo un total de 1200 insectos hembras; en toda la investigación se utilizó un total de 3600 insectos. Solo las hembras fueron utilizadas en las pruebas experimentales, considerando su importancia en la transmisión de las enfermedades.
PRUEBAS DE RESPUESTA CONDUCTUAL FRENTE A PIRETROIDES Y CONCENTRACIONES DE EXPOSICIÓN
Las soluciones de tratamiento fueron formuladas a concentraciones reportadas por Grieco et al. (11), de 0,025, 2,5, 25 y 250 nmol/cm2 para el DDT, permetrina y bifentrina utilizando como diluyente acetona. Todas las formulaciones fueran hechas a partir de los ingredientes activos [i.a]. Quince minutos antes de las pruebas, se aplicó con una micropipeta 3,0 mL de modo uniforme sobre las redes de tratamiento (275 cm2) del sistema HITSS. Las redes adicionales fueron tratadas con el mismo volumen de acetona que sirvió como blanco (control) en todas las pruebas. Una vez que las redes fueron instaladas en los cilindros de tratamiento, las evaluaciones se llevaron a cabo durante todo el día. Se preparó nuevas redes para cada prueba con un nuevo insecticida así como para los controles. Las redes de tratamiento fueron preparadas al inicio de cada día de prueba.
TIEMPO Y SECUENCIA DE LAS PRUEBAS, CONDICIONES DE ENSAYO Y LIMPIEZA DEL SISTEMA HITSS
Los análisis se desarrollaron dentro de la 1a-7a h de haberse tratado las redes con los insecticidas (entre 8.00 y 16.00 horas). En general, los análisis de irritación por contacto y repelencia espacial fueron hechos ocupando todo un día para cada prueba por insecticida. La toxicidad fue evaluada durante una hora por cada insecticida y control, ocupando dos días por insecticida. La temperatura del laboratorio durante las pruebas fue mantenida a 22 °C en promedio (con un rango de 21-25 °C) y una HR de 47% en promedio (rango de 40- 60%). Los análisis se hicieron dentro de una cámara de extracción de aire. La limpieza del sistema se realizó entre los cambios de los productos químicos a evaluarse con un intervalo de un día entre cada prueba siguiendo las recomendaciones planteadas por Grieco et al. Antes de la reutilización de la cámara de respuesta conductual HITSS, se permitió el secado de las piezas lavadas con detergente y la ventilación de la acetona por lo menos durante toda la noche para cada prueba.
ENSAYOS DE IRITACIÓN POR CONTACTO
Para esta prueba, el equipo HITSS fue instalado siguiendo la secuencia de instalación modular recomendado por Grieco et al. (Figura 2a). Se transfirió diez mosquitos al equipo HITSS y 30 segundos después se abrió la válvula tipo mariposa en el punto de unión entre el cilindro claro y el de tratamiento. Después de diez minutos, la válvula fue cerrada y se llevó a cabo de inmediato el conteo del número de mosquitos escapados y derribados (knockdown o postrados de lado y no capaces de levantarse después de haberse sacudido ligeramente la cámara), en el cilindro claro como en el cilindro de tratamiento. Para todos los ensayos con los insecticidas evaluados se llevaron acabo en forma simultánea pruebas de control utilizando redes tratadas con acetona. La proporción de ensayos de tratamiento a control fue de 1:1. Para las siguientes repeticiones, los mosquitos tratados fueron extraídos del sistema de ensayo usando un aspirador de succión al interior de una jaula de crianza de insectos. Se hicieron seis repeticiones para cada concentración de insecticida.
ANÁLISIS DE REPELENCIA ESPACIAL
Para el análisis de esta prueba, el ensamblado del sistema HITSS se modificó ligeramente (Figura 2b). El cilindro de tratamiento (provisto con la red impregnada de insecticida) se unió al cilindro claro en uno de los extremos, en el otro extremo se unió al cilindro de control provisto de la red impregnada con acetona (control), tal como recomienda Grieco et al (11). Las válvulas se mantuvieron cerradas en el punto unión con ambos cilindros. Se transfirió 15 mosquitos al compartimiento (central) claro y se cubrió totalmente con un paño oscuro este cilindro. Los puertos de visión en las tapillas de los extremos de los cilindros de control y tratamiento no fueron cubiertos para permitir el paso de la luz el cual sirvió como atrayente para los mosquitos Ae. aegypti (L).
Luego de un período de aclimatación de 30 segundos se abrieron simultáneamente las válvulas tipo mariposa. Después de diez minutos, se cerraron sincronizadamente las válvulas y se hizo el conteo del número de mosquitos derribados (knockdown) en ambas cámaras. Los mosquitos se extrajeron de las cámaras usando un aspirador bucal. Entre las réplicas, el sistema ensamblado fue desmontado parcialmente evitando el contacto con cualquiera de los productos químicos o facilitar el volatilizado de éstos.
Para cada una de las pruebas con los insecticidas evaluados como para los controles se llevaron a cabo nueve repeticiones. Se utilizó el índice de actividad espacial (SAI) para evaluar la respuesta de los mosquitos hembras al análisis de repelencia espacial, este indicador está basado en el índice de la actividad de oviposición (OAI) de Kramer y Mulla (17). Los cálculos del SAI para cada replica experimental se hizo utilizando la fórmula propuesta por Grieco et al. (11):
SAI = (Nc - Nt) / (Nc + Nt) Nc = Número de hembras en el compartimiento de control del equipo HITSS. Nt = Número de hembras en el compartimiento tratado del dispositivo.
ANÁLISIS DE TOXICIDAD
El equipo HITSS fue ensamblando como se muestra en la Figura 2c (11). Después de preparar el equipo y montada la red provista de insecticida, se transfirieron 15 mosquitos a ésta sección cerrando esta unidad a nivel de la válvula tipo mariposa. Después de una hora, se registró el número de mosquitos caídos (knockdonw) así como los derribados inmóviles y móviles, para luego ser transferidos a un vaso plástico de recuperación. Estos mosquitos fueron alimentados proporcionándoles una torunda de algodón empapada con azúcar al 10% y fueron devueltos al insectario. La mortalidad en cada una de las dosis/insecticida fue registrada después de 24 horas. La proporción de ensayos de tratamiento a control fue de 1:1. Se hizó seis réplicas en cada tratamiento y por dosis de insecticida.
ANÁLISIS DE DATOS
Los datos obtenidos en las pruebas de irritación por contacto fueron examinados mediante la prueba estadística para dos muestras de Wilcoxon usando el paquete estadístico SPSS 10, a fin de determinar la diferencia entre el número de insectos que escaparon del tratamiento y del control. Los datos del análisis de repelencia espacial se evaluaron a través de una prueba no paramétrica de forma lineal para determinar si el SAI (índice de actividad espacial) para cada tratamiento es en forma perceptiblemente diferente de cero. Para los datos de la toxicidad, los valores porcentuales de los derribados y de la mortalidad fueron corregidos usando la fórmula de Abbott y transformados los valores hallados a la raíz cuadrada del arcoseno para el análisis de varianza (ANOVA). Para cada insecticida químico, el derribe como la mortalidad en cada tratamiento fue comparado y analizado usando la prueba estadística de Tukey (HSD) con un nivel de significancia de p < 0,05. Además se reportaron las medias de ± DE (desviación estándar) de los datos transformados.
RESULTADOS
IRRITACIÓN POR CONTACTO
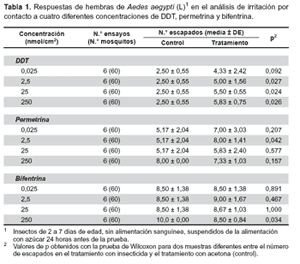
Los resultados de irritación por contacto, demuestran un comportamiento general de escape de los mosquitos, del compartimiento de tratamiento al cilindro transparente, directamente proporcional al incremento de las concentraciones en los diferentes insecticidas evaluados (DDT, permetrina y bifentrina). El DDT y la permetrina, son los insecticidas que significativamente tienen mayor efecto irritante para las hembras de Ae. aegypti (L), a una concentración de 2,5 nmol/cm2 ( x ± DE: 4,3 ± 2,4 para el DDT y 8,0 ± 1,4 para la permetrina; p < 0,05), generando efecto de fuga en más del 50% de los vectores estudiados. En tanto que, la bifentrina requiere de una dosis 20 veces más alta (250 nmol/cm2) para lograr efectos similares a los obtenidos por los otros insecticidas (x ± DE: 8,5 ± 0,8; p < 0,05) (Tabla 1).
La prueba no paramétrica de Wilcoxon (p<0,05), demostró que para concentraciones mayores de 0,025 nmol/cm2 de DDT no existen diferencias significativas entre el control y el tratamiento, por lo que, una dosis de 2,5 nmol/cm2 bastaría para producir efecto repelente del más del 50% de los vectores. Con permetrina, la concentración de 2,5 nmol/cm2 se reporta como la más adecuada y suficiente para repeler más del 50% de la población de Ae. aegypti (L). En permetrina, a la concentración de 250 nmol/cm2 existe diferencias significativas (p<0,05) entre el control y tratamiento para el efecto irritante (Tabla 1), mientras que para las otras concentraciones, no existe tal diferencia. En el caso de la bifentrina, requiere una dosis 20 veces más alta para lograr efectos similares que las conseguidas por el DDT y la permetrina, a una dosis de 2,5 nmol/cm2. Por tanto, este insecticida es el que tiene menor efecto irritante en comparación a los otros insecticidas evaluados.
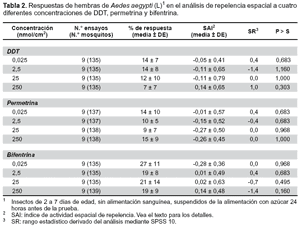
REPELENCIA ESPACIAL
El porcentaje promedio de respuesta en repelencia espacial de las hembras de Ae. aegypti (L), fue similar para cada una de las concentraciones evaluadas. El DDT, la bifentrina y la permetrina, producen respuestas repelentes en Ae. aegypti (L) en forma similar con un promedio de hembras repelidas de 7 a 27% del total de 15 hembras sometidas a prueba para DDT: 7(7) a 14(8); permetrina: 9(7) a 15(9) y bifentrina 19(8) a 27(11). Estadísticamente no existe diferencias significativas (p>0,05) para el porcentaje de la media de respuesta y la media del SAI, en las concentraciones evaluadas (Tabla 2).
TOXICIDAD
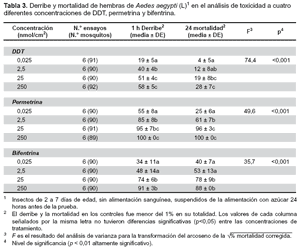
El DDT requiere de dosis > 25 nmol/cm2 para lograr efectos de derribe (KD) altamente significativos (más de 51% de la población de Ae. aegypti (L)), con una mortalidad >19% (F = 74,4, p<0,001). Con permetrina, las concentraciones >0,025 nmol/cm2, son suficientes para obtener resultados altamente significativos de derribe (KD) (>55%) y mortalidad (>25%), (F = 49,6, p<0,001). La bifentrina requiere de concentraciones >0.025 nmol/cm2 para obtener efectos KD en una población de Ae. aegypti (L), superiores a 34%; la mortalidad, bajo estas condiciones es >40%, resultados que son altamente significativos (F = 35,7, p<0,001).
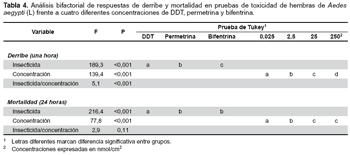
El análisis bifactorial de toxicidad mediante la prueba de Tukey (p<0,01) para las respuestas de derribe (KD) a las cuatro diferentes concentraciones (0,025(a), 2,5(b), 25(c) y 250 nmol/cm2(d)) de DDT(a), permetrina(b) y bifentrina(c), demuestran que existe marcada diferencia significativa entre los insecticidas (F = 189,3, p<0,001) y las dosis probadas (F = 139,4, p<0,001), por lo que cada producto evaluado, estaría ejerciendo efecto diferente, directamente proporcional a las concentraciones (F = 5,101, p<0,001). La prueba de Tukey (p<0,01) para la mortalidad, indica que existen diferencias significativas altas entre los efectos causados por el DDT(a) y la permetrina(b), sin embargo dichas diferencias no existen cuando se comparan la bifentrina(b) y la permetrina(b) (F = 216,4, p<0,001). En las dosis, las concentraciones 0,025(a), 2,5(b) y 25 nmol/cm2(c), son diferentes en el efecto de mortalidad, con alta significancia estadística (F = 77,8, p<0,001). La interacción entre los insecticidas y la concentración, demuestra que los productos evaluados y las dosis guardan estrecha relación en cuanto a los efectos alcanzados, no siendo diferentes estadísticamente (F = 2,9, p = 0,11) (Tabla 3 y tabla 4).
DISCUSIÓN
Es innegable que la irritación y la repelencia producidas en presencia de un insecticida pueden tener un impacto dramático en la eficacia del control químico sobre los mosquitos vectores, así afectando profundamente la transmisión local de enfermedades (18). El DDT y la permetrina, dentro de este concepto, resultan ser los insecticidas que significativamente tienen mayor efecto irritante en hembras de Ae. aegypti (L), en tanto que bifentrina requiere una dosis 20 veces más alta para lograr efectos similares.
En el análisis de repelencia, los mosquitos de la generación F1 de Ae. aegypti (L) del área Metropolitana de Monterrey (Nuevo León – México), mostraron respuestas similares en todas las concentraciones evaluadas. El posible efecto repelente de los insecticidas sobre estos mosquitos ha sido sugerido como un importante factor en los programas de control de Ae. aegypti (L) debido a su naturaleza endofílica y antropofílica, que lo hace un blanco ideal para la aplicación de insecticidas domésticos (19).
Al analizar la toxicidad, la permetrina y la bifentrina son los que generan mayor efecto knockdown y mortalidad. Los resultados hallados son importantes porque permiten conocer la respuesta conductual de Ae. aegypti (L) frente a los insecticidas evaluados, así como las dosis recomendables a ser aplicadas en tentativos programas de vigilancia y control vectorial que se desarrollen en el área Metropolitana de Monterrey (Nuevo León – México), sin embargo es necesario probar otros insecticidas con el equipo modular HITSS. El diseño modular del sistema toma en cuenta las rápidas repeticiones que se pueden realizar entre un experimento y otro, por lo que en adelante las investigaciones de campo de un insecticida deberían basarse en el uso de este equipo a fin de evitar el desarrollo de resistencia con la consecuente resurgencia en las poblaciones plaga. Los efectos tóxicos de los compuestos experimentales, que incluye el derribe y la mortalidad, deberían ser considerados al evaluar los resultados de las pruebas de respuesta de comportamiento, porque la intensa actividad tóxica podría afectar la habilidad de un mosquito para moverse (20).
El fenómeno de excito-repelencia e irritación, ha generado interés y controversia en término de los resultados hallados y la interpretación que pueden generar para adoptar medidas de control de los vectores o de la enfermedad (4,21,22). Algunos especialistas consideran a la repelencia como la razón del éxito del DDT y otros insecticidas usados como aerosoles residuales, por ser un obstáculo importante para el vector en la transmisión de la malaria (23-25). Sin embargo, otros investigadores han propuesto un reexamen serio de la repelencia a la luz del comportamiento y del poco éxito en el control vectorial.
AGRADECIMIENTO
Al Laboratorio de Entomología Médica de la Universidad Autónoma de Nuevo León por el apoyo en el desarrollo del estudio. A los doctores Adriana Flores Suárez y Gustavo Ponce García por su contribución en la discusión y análisis de los resultados. A Rosa María Sánchez Casas, Aldo Ortega, Quetzali Siller, Guadalupe Reyes, Artemio Barragán, Nidya Rodrigez y Haydee Loayza por su ayuda en la colecta y mantenimiento en insectario de la población de insectos.
REFERENCIAS BIBLIOGRÁFICAS
1. Gratz NG. Emergency and control of Aedes aegypti as disease vector in urban areas. J Am Mosq Control Assoc. 1991; 7(3): 353-65.
2. Lindsay SW, Adiamah JH, Miller JE, Armstrong JR. Pyrethroid-treated bednet effects on mosquitoes of the Anopheles gambie complex in the Gambia. Med Veter Entomol. 1998; 5(4): 477-83.
3. Sampath TR, Yadav RS, Sharma VP, Adak T. Evolution of lambdacyhalothrin-impregnated bednets in malaria endemic area of India. Part 2. Impact on malaria vectors. J Am Mosq Control Assoc. 1998; 14(4): 431-36.
4. Roberts DR, Andre RG. Insecticide resistance issues in vectors-borne disease control. Am J Trop Med Hyg. 1994; 50(6 Suppl): 21-34.
5. Rutledge LC, Echana NM, Gupta RK. Responses of male and female mosquitoes to repellents in the World Health Organization insecticide irritability test system. J Am Mosq Control Assoc. 1999; 15(1): 60-64.
6. Chareonviriyaphap T, Prabaripai A, Sungvornyothrin S. An improved excito-repellency test chamber for mosquito behavioral test. J Vector Ecol. 2002; 27(2): 250-52.
7. Roberts DR, Chareonviriyaphap T, Harlan HH, Hshieh P. Methods of testing and analyzing excito-repellency responses of malaria vectors to insecticides. J Am Mosq Control Assoc. 1997; 13(1): 13-17.
8. Evans RG. Laboratory evaluation of the irritancy of bendiocard, lambda-cyhalothrin and DDT to Anopheles gambiae. J Am Mosq Control Assoc. 1993; 9(3): 285-93.
9. Chareonviriyaphap T, Roberts DR, Andre RG, Harlan HJ, Manguin S, Bangs MJ. Pesticide avoidance behavior in Anopheles albimanus, a malaria vector in the Americas. J Am Mosq Control Assoc. 1997; 13(2): 171-83.
10. Chareonviriyaphap T, Prabaripai A, Bangs MJ. Excitorepellency of deltamethrin on the malaria vectors, Anopheles minimus, Anopheles dirus, Anopheles swadiwongporni, and Anopheles maculatus, in Thailand. J Am Mosq Control Assoc. 2004; 20(1): 45-54.
11. Grieco JP, Achee NL, Chareonviriyaphap T, Suwonkerd W, Chauhan K, Roberts DR. A new classification system for the actions of IRS chemicals traditionally used for malaria control. PLoS ONE. 2007; 2(8): e716.
12. Fay RW, Eliason DA. A preferred oviposition site as a surveillance method for Aedes aegypti. Mosq News. 1966; 26: 531-35.
13. Reiter P, Amador MA, Colon N. Enhancement of the CDC ovitrap with hay infusions for daily monitoring of Aedes aegypti populations. J Am Mosq Control Assoc. 1991; 7(1): 52-55.
14. Villaseca P, León W, Palomino M, Mostorino R, Lecca L. Validación de sustratos atractivos a oviposición para la detección de Aedes aegypti. Rev Med Exp. 2000; 18(3-4): 77-81.
15. Ordóñez-Gonzalez JG, Mercado-Hernandez R, Floressuarez AE, Fernández-Salas I. Use of the sticky ovitraps to estimate dispersal of Aedes aegypti in northeastern Mexico. J Am Mosq Control Assoc. 2001; 17(2): 93-97.
16. Vargas M. Uso de ovitrampas en los programas de prevención y control del dengue. Rev Col MQC Costa Rica. 2002; 8(5): 122-24.
17. Kramer WL, Mulla MS. Oviposition attractants and repellents of mosquitoes: oviposition response of Culex mosquitoes to organic infusions. Environ Entomol. 1979; 8(6): 1111-17.
18. Sungvornyothin S, Chareonviriyaphap T, Prabaripai A, Thirakhupt V, Ratanatham S, Bangs MJ. Effects of nutritional and physiological status on behavioral avoidance of Anopheles minimus (Diptera: Culicidae) to DDT, deltamethrin and lambdacyhalothrin. J Vector Ecol. 2001; 26(2): 202-15.
19. Surtees G. The distribution, density and seasonal prevalence of Aedes aegypti in West Africa. Bull World Health Organ. 1967; 36(4): 539-40.
20. H aynes KF. Sublethal effects of neurotoxic insecticides on insect behavior. Annu Rev Entomol. 1988; 33: 149-68.
21. Muirhead-Thomson RC. The significance of irritability, behaviouristic avoidance and allied phenomena in malaria eradication. Bull World Health Organ. 1960; 22: 721-34.
22. De Zulueta J. The irritability of mosquito to DDT and its importance in malaria eradication. Riv Malariol. 1962; 41: 169-78.
23. Bang YH. Implication in the control of malaria vectors with insecticides in tropical countries of South-East Asia region. Part I. Insecticide resistance. J Commun Dis. 1985; 17: 199- 218.
24. Bruce-Chwatt LJ. Global review of malaria control and eradication by attack on the vector. In: Conference on Anopheline Biology and Malaria Eradication. Misc Pubs Entomol Soc Am. 1970; 7: 7-27.
25. Roberts DR, Alecrim WD, Hshieh P, Grieco JP, Bangs M, Andre RG, et al. A probability model of vector behavior: Effects of DDT repellency, irritancy, and toxicity in malaria control. J Vector Ecol. 2000; 25(1): 48-61.
Correspondencia:
Blgo. MCs. Yuri Ayala Sulca, Facultad de
Ciencias Biológicas, Universidad Nacional de San Cristóbal de Huamanga. Ayacucho, Perú.
Dirección: Portal Independencia N.° 57, Ayacucho, Perú.
Teléfono: (51-66) 402596 / (51-66) 314199
Correo electrónico: yuriayala27@hotmail.com
Fecha de recepción: 18-10-07
Fecha de aceptación: 02-02-08