Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.25 n.1 Lima ene./mar. 2008
COMUNICACIONES CORTAS
Detección de parásitos intestinales en agua y alimentos de Trujillo, Perú
Detection of water-Borne and food-borne intestinal parasites of Trujillo, Perú
Gregorio Pérez-Cordón1,a, María J. Rosales1,a, Renzo A. Valdez2,a, Franklin Vargas-Vásquez2,a, Ofelia Cordova2,a
1 Departamento de Parasitología, Instituto de Biotecnología, Universidad de Granada. Granada, España.
2 Instituto de Investigación en Microbiología y Parasitologia Tropical, Universidad Nacional de Trujillo. Trujillo, Perú.
a Biólogo microbiólogo.
RESUMEN
Detectamos distintas especies de parásitos intestinales, tanto protozoos como helmintos, presentes en muestras de agua provenientes de acequias y pozos (Giardia lamblia, Blastocystis hominis, Entamoeba coli, Cyclospora cayetanensis, Cryptosporidium spp. y Balantidium coli), así como en alimentos crudos y cocidos (Giardia lamblia, Cyclospora cayetanensis., Endolimax nana, Iodamoeba butschlii y Blastocystis hominis Fasciola hepatica y Ascaris lumbricoides) recolectadas en varios distritos de la provincia de Trujillo, Perú.
Palabras clave: Abastecimiento de agua; Parasitología de los alimentos; Contaminación de los alimentos, Agua potable (fuente: DeCS BIREME).
ABSTRACT
We report the detection of different intestinal parasites, protozoan and helminthes, in samples of water from ditches and wells (Giardia lamblia, Blastocystis hominis, Entamoeba coli, Cyclospora cayetanensis, Cryptosporidium spp. y Balantidium coli), as well as in raw and cooked foods (Giardia lamblia, Cyclospora cayetanensis., Endolimax nana, Iodamoeba butschlii y Blastocystis hominis Fasciola hepatica y Ascaris lumbricoides) collected in several districts of the province of Trujillo, Peru.
Keywords: Water supply; Food parasitology; Food contamination; Potable water (source: DeCS BIREME).
INTRODUCCIÓN
Las enfermedades transmitidas por alimentos (ETA) constituyen uno de los problemas de salud más extendidos en el mundo contemporáneo y son un factor de gran importancia en la reducción de la productividad económica (1), debido a que determinan una alta tasa de morbilidad afectando la salud y calidad de vida. Son muchos los organismos incluyendo bacterias, virus y parásitos que infectan a los seres humanos y causan enfermedades específicas después de que se ingieren en alimentos contaminados (2).
La mayoría de los parásitos intestinales se transmiten por contaminación del ambiente y en este aspecto, el agua y los alimentos juegan un papel importante. Si las heces no se eliminan de manera apropiada, los quistes, ooquistes y huevos de los parásitos intestinales pueden quedar en el ambiente de las casas o contaminar fuentes de agua o cultivos regados con aguas residuales (3). Por lo que se estima que 4% del total de muertes en el mundo se deben a problemas relacionados al agua, desagüe e higiene (4).
Por su apreciable contenido de ácido ascórbico, carotenos y fibra dietética, los vegetales son ampliamente recomendados como parte de la dieta diaria. Diversos estudios de campo y laboratorio, han mostrado que los patógenos presentes en la tierra de cultivo en las aguas de irrigación de vegetales pueden sobrevivir hasta por dos meses, periodo suficiente para que alcancen en forma viable al consumidor (5). Este problema no solo afecta a los países en vías de desarrollo. Estudios procedentes de países desarrollados indican que la mayoría de las aguas superficiales tienen niveles de contaminación parasitaria que deben ser considerados en los procesos de tratamiento y desinfección del agua de consumo humano (6,7). Se estima que el 60% de los casos de giardiasis ocurridos en Estados Unidos han sido transmitidos por vía hídrica (7).
En Perú, las prevalencias de enteroparasitosis alcanzan valores muy elevados, tal como muestran los trabajos recientemente realizados (8,9). Las elevadas prevalencias, son reflejo de los bajos niveles de vida y de las condiciones deficientes de saneamiento ambiental y hábitos higiénico-alimentarios (10).
El presente estudio tuvo como finalidad determinar el grado de contaminación por enteroparásitos en muestras de agua y alimentos recolectados en diferentes distritos de la provincia de Trujillo, Perú.
EL ESTUDIO
Los alimentos se recolectaron en mercados y en puestos de venta situados tanto en el interior como en el exterior de los centros educativos Cesar Vallejo y La Caridad de los distritos de La Esperanza y El Porvenir, respectivamente, localizados en la periferia de la ciudad de Trujillo, Perú.
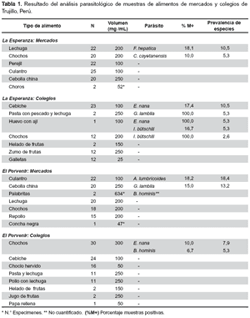
Se recolectaron un total de 352 muestras de alimentos tanto crudos o frescos (hortalizas y moluscos), como cocinados o preparados. El periodo de muestreo estuvo comprendido entre agosto de 2005 y abril de 2006. Las muestras de alimentos se recolectaron tal como se ofrecen a los consumidores y luego fueron colocadas en bolsas de plástico etiquetadas, selladas y depositadas en neveras con hielo para su transporte a los laboratorios del Instituto de Investigaciones en Microbiología y Parasitología Tropical de la Universidad Nacional de Trujillo, Perú. En el distrito de La Esperanza se obtuvieron 220 muestras: 111 de mercado y 109 de puestos de venta en los centros educativos (Tabla 1).
Las muestras de alimentos se sometieron a lavado con solución salina fisiológica (0,85% NaCl), en proporción 1:2 (alimento/solución salina) y en agitación durante dos horas. El lavado se filtró a través de doble gasa y colador. El filtrado se sometió a centrifugación durante cinco minutos a 3000 rpm y se repitió varias veces hasta quedar el sobrenadante claro. El sedimento se sometió a concentración mediante las técnicas de flotación de Willis, Sheater o Ritchie, esta última en caso de que el alimento contuviera grasas. Seguidamente el concentrado se observó con lupa binocular y posteriormente al microscopio óptico por examen directo, tras lo cual se realizó una tinción de Giemsa y Ziehl-Neelsen modificada.
En el caso de los moluscos: Donax marincovinchi, Anadara tuberculosa y Aulacomya ater, el procesamiento se realizó en base a las técnicas descritas por otros investigadores (11,12). Brevemente, se procesaron por separado las branquias y tracto digestivo, sometiéndose a lavado por agitación en buffer fosfato salino (PBS), y posteriormente el lavado se filtró a través de malla de 100 μm de tamaño de poro para su observación al microscopio óptico en fresco y tras tinción de Giemsa y Ziehl-Neelsen. Los alimentos líquidos se sometieron al mismo procedimiento, pero añadiendo menos cantidad de solución salina fisiológica (proporción 3:1, alimento: solución salina fisiológica).
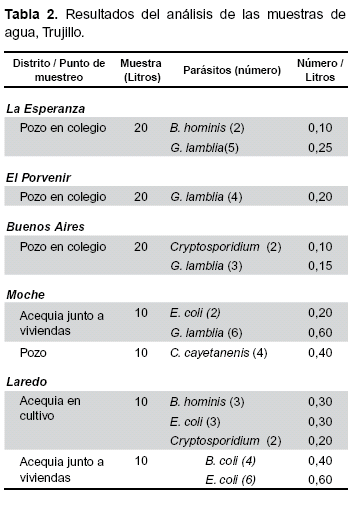
Por otro lado, se tomó muestras de agua para bebida a partir de pozos en los centros escolares anteriormente citados, y en el centro de educación inicial 1683 Mi Pequeño Mundo localizado en el poblado de Buenos Aires, en el distrito de Víctor Larco, provincia de Trujillo (Perú). Las muestras de agua destinadas a cultivo fueron tomadas de acequias en las campiñas de Moche y Laredo, situados al sur y este de la ciudad de Trujillo, respectivamente. El muestreo de aguas se realizó durante los meses de septiembre, octubre y noviembre de 2005 y febrero, marzo y abril de 2006. Las muestras de agua de los centros escolares se tomaron en ambos períodos y las muestras procedentes de las campiñas de Laredo y Moche, durante los meses correspondientes al año 2006.
Las muestras se tomaron utilizando frascos de vidrio y plástico de uno a tres litros de capacidad y convenientemente etiquetados. Posteriormente fueron trasladadas al laboratorio en neveras con hielo y conservadas a 4 ºC. De cada punto de muestreo se recogió un total de 20 litros (Tabla 2). Las muestras de agua fueron filtradas a través de filtro de acetato de celulosa de 0,2 μm de tamaño de poro utilizando una bomba de aspiración portátil. Los filtros se fueron renovando en el momento que empezaban a obstruirse y se comenzaba a interrumpir el filtrado.
Tras el filtrado, cada filtro fue cortado en tiras de 0,5 cm de ancho que se depositaron en placas petri de 10 cm de diámetro para su lavado con 50 mL de Tween 80 (0,1 %), mediante agitación. El lavado era filtrado por doble gasa y colador y después centrifugado por diez minutos a 3 000 rpm. El sedimento fue resuspendido en 0,5 mL de solución salina fisiológica (NaCl 0,85%), observado directamente al microscopio óptico y se tiñeron varias láminas tanto con Giemsa como con Zielhl-Neelsen, también para su observación. A continuación se procedió a concentrar la muestra por flotación mediante solución de Sheater. El producto obtenido de la concentración se observó al microscopio óptico por examen directo y tras tinción de Ziehl-Neelsen modificado y Giemsa.
HALLAZGOS
El análisis de los alimentos permitió aislar protozoos como Giardia lamblia, Cyclospora cayetanensis., Endolimax nana, Iodamoeba butschlii y Blastocystis hominis, este último detectado también en bivalvos moluscos del género Donax. Por su parte, el análisis de los otros tipos de moluscos (choros y conchas negras) arrojó resultados negativos. Mientras que en agua no encontramos helmintos, en alimentos aparecieron huevos de Fasciola hepatica y Ascaris lumbricoides (Tabla 1).
Por otra parte, son muchos los parásitos que se han identificado en agua (Tabla 2), entre ellos Giardia lamblia, Blastocystis hominis, Entamoeba coli, Cyclospora cayetanensis, Cryptosporidium spp. y Balantidium coli. Es destacable que los tres protozoos patógenos G. lamblia, C. cayetanensis, y Cryptosporidium spp. estuvieron presentes en el agua analizada y sin embargo no se encontraron ni huevos ni larvas de helmintos.
DISCUSIÓN
El estudio de las enfermedades transmitidas por alimentos y su vigilancia en general, son esenciales para caracterizar la dinámica epidemiológica y dirigir los planes de control, estrategias y políticas de prevención. Son también herramientas importantes para evaluar el impacto de los programas de inocuidad de los alimentos e identificar aquellas áreas que requieren de una investigación urgente, particularmente a nivel local. En este estudio, el análisis de algunos alimentos consumidos habitualmente por los pobladores de los distritos estudiados nos permitieron aislar parásitos como G. lamblia, Cyclospora spp., Endolimax nana, Iodamoeba bütschlii, B. hominis, Fasciola hepatica y Ascaris lumbricoides, observaciones similares se han encontrado particularmente en lechugas expendidas en mercados de Lima y Venezuela (13,14).
El uso indiscriminado de aguas residuales crudas en el riego de cultivos de consumo humano está relacionado con las altas tasas de morbilidad y mortalidad por gastroenteritis y disentería. En la zona costera del Perú se estima que existe un total de 4000 ha de terrenos agrícolas sometidos a riego con aguas residuales crudas, cantidad que puede llegar a 11200 ha si se utilizara el total de las aguas residuales descargadas por las ciudades ubicadas en la costa peruana (15).
De forma similar a otras áreas deprimidas, en los distritos estudiados las aguas superficiales están expuestas a un gran número de factores que posibilitan la contaminación con enteroparásitos. En el desarrollo de nuestro estudio pudimos comprobar que en el distrito de La Esperanza sólo el 48,8% de la población contaba con agua potable, el 68,2% en El porvenir y el 69% en Buenos Aires, el resto se abastecía de agua de fuentes públicas o camiones cisterna. De igual forma en los tres distritos estudiados más de la mitad de la población carecía de servicio higiénico conectado a la red pública o desagües haciendo uso el resto de pozos ciegos o letrinas. En nuestro estudio, el análisis de agua de pozos y acequias de riego destinada al consumo y al riego de cultivos nos permitió identificar los siguientes protozoos parásitos: Giardia lamblia, Blastocystis hominis, Entamoeba coli, Cyclospora cayetanensis, Cryptosporidium spp. y Balandidium coli.
Estos resultados nos permiten recomendar la vigilancia periódica a todo puesto de venta de alimentos, el cual debe estar a cargo de las entidades competentes. Así mismo, se deben establecer mecanismos básicos de control y prevención respecto al procesamiento de alimentos en los hogares, en especial de productos de consumo crudo y de fuentes de agua expuestas a una eventual contaminación.
REFERENCIAS BIBLIOGRÁFICAS
1. Rayner M, Scarborough P. The burden of food related ill health in the UK. J Epidemiol Community Health. 2005; 59(12): 1054-57.
2. Flint JA, Van Duynhoven YT, Angulo FJ, DeLong SM, Braun P, Kirk M, et al. Estimating the burden of acute gastroenteritis, foodborne disease, and pathogens commonly transmitted by food: an international review. Clin
3. Solarte Y, Peña M, Madera C. Transmisión de protozoarios patógenos a través del agua para consumo humano. Colomb Med. 2006; 37(1): 74-82.
4. Prüs A, Kay D, Fewtrell L, Bartram J. Estimating the burden of disease from water, sanitation, and hygiene at a global level. Environ Health Perspect. 2002; 110(5): 537- 42.
5. Feachmen RG, Bradley DJ, Garelick H, Mara DD. Sanitation and disease: health aspects of excreta and wastewater management. New York: John Wiley & Son; 1983.
6. Carmena D, Aquinagalde X, Zigorraga C, Fernández- Crespo JC, Ocio JA. Presence of Giardia cysts and Cryptosporidium oocyst in drinking water supplies in northern Spain. J Appl Microbiol. 2007; 102(3): 619-29.
7. Craun GF, Nwachuku N, Calderon RL, Craun MF. Outbreaks in drinking-waters systems, 1991-1998. J Environ Health. 2002; 65(1): 16-23.
8. Ibáñez N, Jara C, Guerra A, Díaz E. Prevalencia de enteroparasitismo en escolares de comunidades nativas del Alto Marañón, Amazonas, Perú. Rev Peru Med Exp Salud Publica. 204; 21(3): 126-33.
9. Iannacone J, Benites MJ, Chirinos L. Prevalencia de infección por parásitos intestinales en escolares de primaria de Santiago de Surco, Lima, Perú. Parasitol Latinoam. 2006; 61(1-2): 54-62.
10. Davelois K, Córdova O, Cubas R, Escalante, H, Reyes J. Frecuencia de protozoos y helmintos intestinales en manipuladores de alimentos en la Ciudad de Trujillo, La Libertad-Perú. Rebiol 1997; 17(1-2): 31-36.
11. Fayer R, Graczyk TK, Lewis EJ, Trout JM, Farley CA. Survival of infectious Cryptosporidium parvum oocysts in seawater and Eastern oysters (Crassostrea virginica) in the Chesapeake Bay. Appl Environ Microbiol. 1998; 64(3): 1070-74.
12. Freire-Santos F, Oteiza-López AM, Vergara-Castiblanco CA, Ares-Mazás E, Alvarez-Suárez E, García-Martín O. Detection of Cryptosporidium oocysts in bivalve mollusks destined for human consumption. J Parasitol. 2000; 86(4): 853-54.
13. Devera R, Blanco Y, González H, García L. Parásitos intestinales en lechugas comercializadas en mercados populares y supermercados de Ciudad Bolívar, Estado Bolívar, Venezuela. Rev Soc Ven Microbiol. 2006; 26(2): 100-7.
14. Tananta I, Chávez A, Casas E, Suárez F, Serrano E. Presencia de enteroparásitos en Lechuga (Lactuca sativa) en establecimientos de consumo público de alimentos en el cercado de Lima. Rev Inv Vet Peru. 2004; 15(2): 157-62.
15. Castro de Esparza ML, Sáenz R. Evaluación de riesgos para la salud por el uso de aguas residuales en agricultura. Volumen I: Aspectos microbiológicos. Lima: CEPIS/OPS; 1990.
Correspondencia.
Gregorio Pérez Cordón.
Departamento de Parasitología, Instituto de Biotecnología, Universidad de Granada.
Dirección: C/ Severo Ochoa, s/n, C.P: 18071, Granada, España.
Teléfono - Fax: (34-664) 612348/34
Correo electrónico: grego@ugr.es
Fecha de recepción: 29-12-07
Fecha de aceptación: 13-02-08