Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.25 no.2 Lima Apr./jun. 2008
Acción del antiveneno botrópico polivalente sobre las actividades proteolíticas presentes en los venenos de serpientes peruanas
Action of polivalent bothropic antivenom on proteolytic activities from peruvian snake venoms
Armando Yarlequé1,a, Dan Vivas1,a, Rosío Inga1,a, Edith Rodríguez1,a, Gustavo Adolfo Sandoval1,a, Silvia Pessah2,b, César Bonilla2,a
1 Laboratorio de Biología Molecular, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Centro Nacional de Productos Biológicos, Instituto Nacional de Salud. Lima, Perú.
a Biólogo; b Médico.
Estudio financiado por el Instituto Nacional de Salud del Perú.
RESUMEN
Los venenos de las serpientes peruanas causantes de la mayoría de accidentes ofídicos, contienen enzimas proteolíticas que pueden degradar proteínas tisulares y plasmáticas, así como causar hipotensión y coagulación sanguínea. Objetivos. Evaluar la capacidad inhibitoria del antiveneno botrópico polivalente al estado líquido producido por el Instituto Nacional de Salud del Perú (INS) sobre las actividades caseinolítica, coagulante y amidolítica de los venenos de Bothrops atrox, Bothrops brazili, Bothrops pictus y Bothrops barnetti. Materiales y métodos. Se usaron en cada caso sustratos como caseína, fibrinógeno bovino y el cromógeno benzoil-arginil-p-nitroanilida (BApNA) respectivamente, y se midieron los cambios en los valores de la actividad enzimática a ½, 1 y 2 dosis del antiveneno tanto al estado natural como calentado a 37 °C durante cinco días. Resultados. La actividad caseinolítica es la más resistente a la inhibición especialmente por el suero no calentado en tanto que, la actividad amidolítica fue severamente inhibida principalmente en los venenos de B. pictus y B. atrox. Así mismo la actividad coagulante fue totalmente inhibida en el veneno de B. pictus, mostrándose a su vez una elevada inhibición sobre los venenos de B. brazili y B. atrox. Para las actividades coagulante y amidolítica, los sueros calentados fueron menos efectivos que aquellos al estado natural. Conclusiones. El suero antibotrópico polivalente producido por el INS es efectivo para inhibir las actividades proteolíticas de los venenos de las serpientes peruanas ensayadas.
Palabras clave: Venenos de serpiente; Proteasas; Antivenenos; Mordedura de serpiente (fuente: DeCS BIREME).
ABSTRACT
Peruvian snake venoms responsible for most of ophidism accidents, contain proteolytic enzymes that can degrade tissue and plasmatic proteins, as well as cause hypotension and blood coagulation. Objectives. The inhibiting capacity of liquid polyvalent bothropic antivenom produced by Instituto Nacional de Salud (INS), has been evaluated on caseinolytic, coagulant and amidolytic activities on Bothrops atrox, Bothrops brazili, Bothrops pictus and Bothrops barnetti venoms. Material and methods. Using in each case casein, bovine fibrinogen and the chromogenic substrate BApNA respectively, measuring changes in values of enzymatic activity at ½, 1 and 2 doses of either natural and heating (incubated at 37 °C during five days) antivenom. Results. Caseinolytic activity is more resistant to inhibition especially by the natural antivenom, amidolytic activity was severely inhibited mainly in B. pictus and B. atrox venoms. Also coagulant activity was totally inhibited in B. pictus venom, being high on B. brazili and B. atrox venoms. For coagulant and amidolytic activities, heated antivenom was less effective than natural one. Conclusions. The bothropic antivenom produced by INS is effective to inhibit the proteolytic activity from Peruvian snake venoms tested.
Key words: Snake venoms; Proteases; Antivenins; Snake bite (source: MeSH NLM).
INTRODUCCIÓN
Si bien los accidentes ofídicos pueden ocurrir en prácticamente todo el mundo (con excepción de islas que carecen de ofidios), en los países tropicales y subtropicales, el ofidismo es un problema de salud pública cuya atención sanitaria tiene como principal elemento, el uso del antiveneno o suero antiofídico(1,2). Estos productos se elaboran por hiperinmunización de mamíferos como caballos, ovejas, cabras y otros, y su producción está a cargo de instituciones especializadas. El antiveneno botrópico polivalente producido en el Perú por el Instituto Nacional de Salud (INS), es el resultado de la inmunización de equinos de cuyo plasma sanguíneo se separan y purifican inmunoglobulinas (IgG) neutralizantes del o los venenos usados en el protocolo de inmunización.
Sin embargo, a pesar de que el uso del antiveneno es el único modo de atender eficazmente un accidente ofídico, existen una serie de condiciones que limitan su capacidad de uso, tales como el conocimiento del tipo de serpiente que originó el accidente, el tiempo transcurrido entre la mordedura y su aplicación, así como la sensibilidad al antiveneno de la persona accidentada(3-5). Teniendo en cuenta que los ensayos para reconocer la capacidad neutralizante de un antiveneno están ligados directamente a la acción letal y los efectos biológicos del veneno(6), es posible investigar la presencia y concentración de las enzimas proteolíticas, las cuales son frecuentes en las ponzoñas de la familia Viperidae.
Las enzimas proteolíticas en los venenos pertenecen a dos grandes grupos: las endopeptidasas que en general son proteasas inespecíficas capaces de afectar proteínas tisulares y del sistema circulatorio, y aquellas que poseen un alto grado de especificidad, tales como la enzima similar a la trombina, la kininogenasa y los activadores de factores de coagulación (7,8). Algunas proteasas están asociadas a la actividad hemorrágica pero en su mayoría son metaloproteasas con gran actividad hidrolítica sobre una variedad de sustratos, incluyendo la caseína (9), en tanto que la actividad coagulante es muy grave en los venenos vipéridos, dando lugar a la aparición in vivo de la plasmina y consecuentemente a una elevada fibrinólisis, que ocasiona la incoagulabilidad de la sangre de la víctima (10).
Por tanto en la presente investigación se ha analizado el efecto que tiene el antiveneno botrópico polivalente sobre estas enzimas, a fin de establecer una relación entre su capacidad neutralizante con el grado de inhibición que pueden sufrir tales proteínas y explorar con ello una forma alternativa y rápida para valorar la eficacia neutralizante de estos productos biológicos.
MATERIALES Y MÉTODOS
INSUMOS
Venenos
Los venenos en estudio procedieron del Serpentario del INS y correspondieron a las siguientes especies: Bothrops atrox Jergón, Bothrops brazili Jergón shushupe, Bothrops pictus Jergón de costa y Bothrops barnetti Sancarranca.
Antivenenos
El antiveneno botrópico polivalente al estado líquido fue proporcionado por el INS en ampollas de 10 mL y contiene anticuerpos equinos contra los venenos mencionados (Lote: 300143). En cuanto al antiveneno botrópico polivalente sometido a calentamiento por 5 días a 37 ºC correspondió al Lote 01000376.
DETERMINACIÓN DE PROTEÍNAS
El contenido proteico de cada veneno fue determinado tanto por la absorbancia en el rango de luz ultravioleta a 280 nm, en un espectrofotómetro UV/visible Shimadzu (11). Así mismo se determinó también el contenido proteico por el método de Lowry (12) modificado en este laboratorio (13); para ello se utilizó una solución alcalina, el reactivo de Folin Ciocalteus y la albúmina sérica bovina como proteína estándar, se midió la absorbancia a 660 nm. Para el caso de los antivenenos, la cantidad de proteína fue determinada por el método cuantitativo de Biuret, utilizándose solución de sulfato de cobre 0,15%, tartrato de sodio y potasio 0,6% e hidróxido de sodio 3%, se midió la densidad óptica a 450 nm (14).
ACTIVIDADES ENZIMÁTICAS
Actividad caseinolítica
Fue estimada empleando el método de Kunitz (15), modificado por Takahashi y Ohsaka (16), se usó caseína al 2% en buffer Tris-HCl 0.2 M pH 8,5 y 0,1 mL de muestra. La mezcla de reacción fue incubada durante 10 minutos a 37 ºC, se detuvo la reacción con la adición de ácido tricloroacético 0,44 M y se midió la actividad por la formación de productos ácido-solubles a 280 nm (7).
Actividad coagulante
Fue medida según el método de Oshima(17) empleando como sustrato fibrinógeno bovino 5 mg/mL en buffer Tris-HCl 0,05 M pH 7,4. La mezcla de reacción fue pre-incubada por 10 minutos y luego se adicionó 0,1 mL de veneno a concentraciones de 0,2 a 1 mg/mL, midiéndose los tiempos de coagulación en segundos(8).
Actividad amidolítica
Para este ensayo, la mezcla de reacción contenía 2 mL del sustrato benzoil-arginil-p-nitroanilida (BApNA) 9x10-4 M en buffer Tris-HCl 0.05 M, pH 8,1 y 0,1 mL de veneno 1 mg/mL. La mezcla fue incubada a 37 ºC por 15 minutos y la reacción se detuvo con 0,6 mL de ácido acético al 60 %, determinándose la actividad a 405 nm (18,19).
Preparación del antiveneno calentado
Los viales del antiveneno botrópico polivalente (Lote 01000376) fueron colocados a temperatura ambiente por 60 minutos y luego sometidos a calentamiento de 37 °C por cinco días en una estufa incubadora (Gallenkamp). Posteriormente se verificó la homogeneidad del producto antes de utilizarlo.
Ensayos de neutralización
Se prepararon mezclas que contenían cantidades equivalentes a ½, 1 y 2 dosis neutralizantes del antiveneno con cada uno de los venenos en estudio. Para ello se usó como referencia la valoración de la etiqueta del antiveneno que indica que una dosis neutralizante corresponde a 10 mL del antiveneno contra 25 mg del veneno de B. atrox. Luego de 30 minutos de incubación a 37 °C se ensayaron los valores de actividad enzimática por triplicado con respecto a una muestra control de veneno. Se consideró que un antiveneno fue eficaz si una dosis neutralizante logró reducir a menos del 50% la actividad enzimática respectiva.
RESULTADOS
COMPOSICIÓN PROTEICA
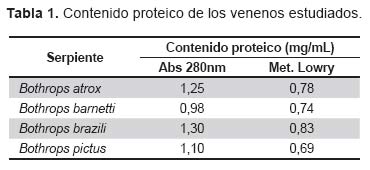
La Tabla 1 muestra los valores de proteína de los venenos en estudio tanto por absorbancia a 280 nm como por el método de Lowry. Si se considera 1 mg de veneno, se puede apreciar que los valores de absorbancia a 280, son en algunos casos mayores a una unidad óptica; en cambio, por el método de Lowry los valores corresponden a cantidades de proteína menores al peso del veneno y pueden fácilmente extrapolarse a porcentaje de proteína en cada muestra.
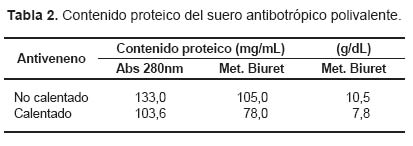
La Tabla 2 muestra los valores de proteína tanto por absorbancia a 280 nm como por el método de Biuret de los antivenenos en estudio. Al igual que los venenos, los antivenenos muestran una mayor concentración por absorbancia a 280 nm que por el método de Biuret. Así mismo se puede apreciar que en el antiveneno no calentado se registró mayor cantidad de proteína que el sometido a calentamiento de 37 °C.
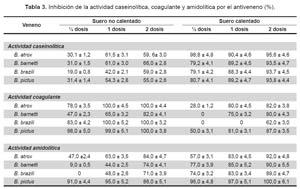
INHIBICIÓN DE LAS ACTIVIDADES PROTEOLÍTICAS POR EL ANTIVENENO
Considerando los dos tipos de antivenenos, los resultados se presentan de la siguiente manera:
Actividad caseinolítica. La tabla 3 muestra los resultados del tratamiento de cada uno de los venenos en estudio con el antiveneno botrópico. Es interesante observar que con el suero no calentado, la actividad caseinolítica es afectada en porcentajes cercanos al 30% con media dosis a excepción de B. brazili cuyo valor es de 19% de inhibición. Utilizando una y dos dosis de este tipo de suero, la inhibición registrada está en el rango de 50% con un mínimo de 42% (una dosis) para B. brazili y un máximo de 66% (dos dosis) para B. barnetti. Por otro lado, los valores de inhibición encontrados con el suero sometido a calentamiento de 37 ºC son mayores, ya que están en el rango de 79,2% (½ dosis) para B. barnetti y 98,8% (½ dosis) para B. atrox.
Actividad coagulante. En la tabla 3 se observan los resultados de la inhibición ocasionada por el antiveneno sobre la actividad coagulante. Se nota en primer lugar, la fuerte inhibición que ejerce el suero no calentado ya que los valores de inhibición para el veneno de B. atrox y B. brazili son muy semejantes, alcanzando con una y dos dosis el 100% de inhibición, en tanto que usando el veneno de B. barnetti se alcanzó valores de inhibición de 65 y 82% para una y dos dosis respectivamente.
Así mismo, el veneno de B. pictus fue totalmente inhibido por este tipo de antiveneno. Por otra parte, el suero calentado a 37 °C, mostró una reducción de su capacidad inhibitoria sobre la actividad coagulante de los venenos en estudio ya que por ejemplo en el caso de B. brazili (½ y una dosis), no se detectó inhibición, siendo el máximo valor obtenido de inhibición 87% (dos dosis) para el veneno de B. pictus.
Actividad amidolítica. Los datos obtenidos en la tabla 3 muestran que el antiveneno polivalente inhibe también esta actividad en grado variable dependiendo de la dosis. Podemos observar que el veneno de B. brazili es el menos afectado por ½ dosis del antiveneno no calentado, seguido de B. barnetti mientras que los venenos más sensibles a la inhibición son los de B. pictus y B. atrox. En relación con el suero calentado a 37 Cº, nuevamente el veneno de B. pictus es el más sensible a la inhibición en cualquiera de sus dosis, en tanto que, el veneno de B. atrox (½ dosis) es inhibido en un 57%; lográndose con dos dosis la inhibición al 89% para el veneno de B. brazili y 90% para el de B. barnetti.
DISCUSIÓN
El contenido proteico de los venenos ofídicos varía de acuerdo a las especies, e inclusive dentro de una misma especie. Estos componentes se modifican en su concentración de acuerdo a la edad, dieta alimentaria, distribución geográfica y estación del año en que se recolecta el veneno (20). Ésta es la principal causa que afecta la eficacia de un antiveneno, puesto que ciertos componentes son producidos de acuerdo al estado metabólico del ofidio, y por tanto, la cantidad de una enzima en particular no se mantiene constante durante toda la vida del animal (21,22). Por ello, antes de iniciar la hiperinmunización de un animal experimental o comercial, es conveniente evaluar la concentración proteica y los tipos de proteína que presenta cada ponzoña.
En este contexto, hemos seleccionado en primer lugar, cuatro de los cinco venenos usados en la preparación del antiveneno, dejando sólo de lado el veneno de B. hyoprora, ya que la casuística indica que en los últimos cinco años, no se han registrado accidentes por esta serpiente. Se ha podido establecer en el estudio el contenido proteico de los venenos (Tabla 1) y de los antivenenos (Tabla 2). El mayor porcentaje de proteína corresponde a B. brazili (83%), mientras que los porcentajes más bajos fueron registrados para los venenos de B. barnetti (74%) y de B. pictus (69%). Aún cuando los valores de proteína no son constantes necesariamente en un veneno ya que ellos dependen de las condiciones antes señaladas, existe una tendencia de encontrar mayor cantidad de proteína en B. brazili que en otros venenos. En todo caso, el dosaje de proteína por el método de Lowry es el procedimiento apropiado para establecer este parámetro en cualquier veneno.
Como ya se ha mencionado, el contenido proteico de un veneno y sobre todo las concentraciones de los principales componentes bioactivos que participan en el envenenamiento son cruciales para la producción de un antiveneno ya que, la respuesta inmune mediante la producción de IgG neutralizantes del animal productor, está ligada al tipo de antígeno presentes en el pool tóxico (1). Por tanto para asegurar la producción de un antiveneno de alta calidad neutralizante es absolutamente necesario que la serpiente productora de veneno, esté en condiciones fisiológicas óptimas: alimentación, ausencia de parasitismo, edad, manejo apropiado de los reptiles y sobre todo un cuidadoso procedimiento para la extracción de la ponzoña, pues los colmillos acanalados que poseen las serpientes de la familia Viperidae se pueden lastimar o romper muy fácilmente durante la extracción y generar un ulterior proceso infeccioso en las glándulas venenosas (3).
Por otra parte, son característicos de un envenenamiento botrópico los efectos locales como edema y hemorragia, así como los sistémicos en los que los trastornos en la coagulación en la presión sanguínea son muy severos y pueden causar la muerte (23). En este aspecto es importante señalar que la acción coagulante del veneno es crucial en el cuadro tóxico y se debe a la actividad de la enzima similar a la trombina. Esta proteína ya caracterizada en varios venenos vipéridos es una serinoproteasa capaz de liberar pequeños fragmentos de las cadenas Aα y Bβ del fibrinógeno y con ello dar lugar a la formación de un coágulo, el cual puede ser removido por acción de la plasmina endógena generando un fenómeno de incoagulabilidad, que desde el punto de vista clínico es una clara evidencia del envenenamiento botrópico. Por ello, es muy interesante señalar que el suero antibotrópico polivalente del INS tiene una elevada acción inhibitoria de la actividad coagulante ya que, solo el veneno de B. barnetti mostró una ligera resistencia a la inhibición en tanto que los demás venenos son inhibidos totalmente en su actividad coagulante a diferentes dosis del suero. En este caso el suero calentado a 37 °C mostró una menor actividad inhibitoria de la acción coagulante (Tabla 3). El hecho de que el antiveneno tenga este fuerte efecto sobre la acción coagulante de los venenos en estudio, sugiere que dependiendo de su rápida aplicación, la acción neutralizante es muy elevada contrarrestando de esta manera uno de los efectos más peligrosos a nivel sistémico que pueden ejercer estos venenos.
En el mismo sentido, el análisis de la actividad amidolítica, la cual como ya señalamos involucra a las actividades coagulante e hipotensora, es fuertemente inhibida por el antiveneno del INS especialmente con los venenos de B. pictus y B. atrox. Nuevamente aquí, los experimentos con el suero calentado a 37 °C mostraron una ligera pérdida de su acción inhibitoria, manteniéndose sin embargo la inhibición total para B. pictus (Tabla 3). Esto significaría que el antiveneno también posee una elevada acción bloqueadora de la actividad de kalikreina, enzima responsable del descenso brusco de la presión arterial en los accidentados ya que se liberan péptidos hipotensores como bradikinina y calidina.
En conclusión, los ensayos efectuados mostraron que sí es posible vigilar la actividad de un antiveneno a través de la acción que ese producto ejerce sobre las enzimas proteolíticas, en especial de la actividad coagulante que resultó ser la más fuertemente inhibida lo que nos señala la calidad del antiveneno producido en equinos. Así mismo, las ligeras pérdidas de la acción inhibitoria de las actividades coagulante y amidolítica observadas cuando el suero es expuesto por cinco días a 37 ºC, es un indicativo de que este producto puede ser afectado por la falta de cadena de frío y que para preservarlo es conveniente mantenerlo a temperaturas menores a 25 ºC. Este es pues un primer esfuerzo colaborativo exitoso del INS y de la UNMSM para lograr modos rápidos de valorar la calidad del suero antiofídico a base del análisis de sus enzimas proteolíticas.
REFERENCIAS BIBLIOGRÁFICAS
1. Iwanaga S, Susuki T. Enzymes in snake venoms. In: Lee CY (ed). Snake venoms, Handbook of experimental pharmacology. Berlin: Spring-Verlag; 1979. Vol 52. p. 61-144.
2. Tu AT. Venoms: chemistry and molecular biology. New York: Wiley & Sons; 1977.
3. Yarlequé A. Las serpientes peruanas y sus venenos. Lima: Fondo Editorial, Universidad Nacional Mayor de San Marcos; 2000.
4. Meneses O. Los animales venenosos y sus peligros. Lima: Instituto de Salud Pública; 1974.
5. Laing GD, Yarlequé A, Marcelo A, Rodríguez E, Warrell DA, Theakston RGD. Preclinical testing of three South American antivenoms against the venoms of five medically-important Peruvian snake venoms. Toxicon. 2004; 44(1): 103-6.
6. Warrell DA. The global problem of snake bite: its prevention and treatment. In: Gopalakrishnakone P, Tan CK (eds) Recent advances in toxinology research. Singapore: National University of Singapore; 1992. p. 121-53.
7. Rodríguez E, Yarlequé A. Aislamiento y algunas propiedades de la proteinasa I del veneno de la serpiente peruana Lachesis muta. Acta Cient Venez. 1991; 42: 219-25.
8. Yarlequé A, Campos S, Escobar E, Lazo F, Sanchez N, Marsh N, et al. Isolation and characterization of a fibrinogen-clotting enzyme from venom of the snake Lachesis muta muta (Peruvian bushmaster). Toxicon. 1989; 27(11): 1189-97.
9. Isla M, Málaga O, Yarlequé A. Características bioquímicas y acción biológica de una hemorragina del veneno de Bothrops brazili. An Fac Med (Lima). 2003; 64(3): 159-66.
10. Marsh NA. Fibrinolysis. New York: Wiley & Sons; 1981.
11. Warburg O, Christian W. [Isolation adn crystallization of the glycolytic enzyme enolase]. Biochemische Zeitschrift. 1941; 31: 384-421. [alemán]
12. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the folin phenol reagent. J Biol Chem. 1951; 193: 265-75.
13. Loayza S, Morante Y, Campos S, Yarlequé A. Enzimas proteolíticas en el veneno de las serpientes peruanas Lachesis muta y Bothrops atrox. Bol Soc Quím Peru. 1985; 52(3): 151-63.
14. A lexander P, Block RJ, Lundgren HP. Laboratory manual of analytical methods in protein chemistry. New York: Pergamon Press; 1960.
15. Kunitz M. Crystalline soybean trypsin inhibitor. II. General properties. J Gen Physiol. 1947; 30: 291-310.
16. Takahashi T, Ohsaka A. Purification and characterization of a proteinase in the venom of Trimeresurus flavoviridis. Complete separation of the enzyme from hemorrhagic activity. Biochim Biophys Acta. 1970; 198(2): 293-307.
17. O shima G, Sato-Ohmori T, Suzuky T. Proteinase, argininester hydrolase and a kinin releasing enzyme in snake venoms. Toxicon. 1969; 7(3): 229-33.
18. E rlanger B, Kokowsky N, Cohen W. The preparation and properties of two new chromogenic substrates of trypsin. Arch Biochem Biophys. 1961; 95: 271-78.
19. Magalhaes A, Ferreira RN, Richardson M, Gontijo S, Yarlequé A, Magalhaes HP, et al. Coagulant thrombin-like enzimes from the venoms of Brazilian and Peruvian bushmaster (Lachesis muta muta) snakes. Comp Bioch Physiol B. 2003; 136(2): 255-66.
20. Chippaux JP, Williams V, White J. Snake venom variability: methods of study, results and interpretation. Toxicon. 1991; 29(11): 1279-303.
21. Málaga O, Pantigoso C, Morante Y, Heredia V, Cárdenas J, Yarlequé A. Variaciones en la composición proteica, actividades enzimáticas y biológicas del veneno de la serpiente Botrhops atrox (Viperidae) en relación con la edad. Rev Peru Biol. 2000; 7(2): 161- 70.
22. Lomonte B, Gené JA, Gutiérrez JM, Cerdas L. Estudio comparativo de serpiente cascabel (Crotalus durissus durissus) de ejemplares recién nacidos y adultos. Toxicon. 1983; 21(3):379-84.
23. Marsh NA. Snake venoms affecting the haemostatic mechanism- - a consideration of their mechanisms, practical applications and biological significance. Blood Coagul Fibrinolysis. 1994; 5(3): 399- 410.
Recibido: 27-03-08
Aceptado: 24-05-08