Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.25 n.2 Lima abr./jun. 2008
Patogenicidad de las amebas de vida libre aisladas de fuentes de agua en Lima
Patogenicity of free-living amoebas isolates in body waters from Lima
María del Carmen Garaycochea1,a, María Beltrán1,a, Cecilia Morón2,b
1 Laboratorio de Enteroparásitos, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
2 Laboratorio de Patología, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
a Bióloga; b Médico patóloga.
RESUMEN
Objetivos. Determinar la presencia de amebas de vida libre (AVL) en fuentes de agua del departamento de Lima y evaluar su capacidad patógena en ratones normales e inmunosuprimidos. Materiales y métodos. Se recolectaron muestras de agua de ríos, lagos, piscinas y pozos de Lima. El aislamiento se realizó por cultivo en agar no nutritivo al 2% con E. coli o E. aerogenes a 37 °C. Posteriormente se instiló en ratones normales e inmunosuprimidos (betametasona 1,4 mg/mL, dosis única) una suspensión con las amebas aisladas. A los 15 días se evaluaron histológicamente los daños en ambos grupos. Resultados. Se identificaron AVL en 40/83 muestras, 31,3% de las muestras se desarrollaron en los cultivos. Se aislaron 26 cepas de AVL de siete géneros (Hartmannella, Acanthamoeba, Mayorella, Naegleria, Vahlkampfia, Vannella y Saccamoeba), Acanthamoeba fue la más frecuente (44,2%). Se encontraron AVL en 53,8% de los ratones inmunosuprimidos y 15,4% de los normales (p<0,05). Conclusiones. Existen AVL en cuerpos de agua de Lima, las cuales tienen un potencial patógeno en pacientes inmunosuprimidos, existiendo un riesgo de infección amebiana asociada con estas fuentes de agua.
Palabras clave: Amebiasis; Acanthamoeba; Naegleria; Cuerpos de Agua; Perú (fuente: DeCS BIREME).
ABSTRACT
Objectives. To determine the presence of free-living amoeba (FLA) in water bodies from Lima department and assess their pathogenic ability in normal mice and immunosuppressed. Material and methods. Water samples were collected from rivers, lakes, swimming pools and wells in Lima, Peru. The isolation was performed by culture in non-nutritious agar with 2% of E. coli or E. aerogenes at 37 °C. Subsequently were injected into normal mice and immunosuppressed (betamethasone 1.4 mg/mL, a single dose) with a suspension of amoeba isolated. For the 15 days were assessed histological damage in both groups. Results. AVL were identified in 40/83 samples, 31.3% of the samples were developed in cultures. 26 strains were isolated from AVL of seven genera (Hartmannella, Acanthamoeba, Mayorella, Naegleria, Vahlkampfia, Vannella and Saccamoeba), Acanthamoeba was the most frequent (44.2%). AVL was found in 53.8% of immunosuppressed mice and 15.4% of the normal (p <0.05). Conclusions. AVL exist in water bodies from Lima, which have a potential pathogen in immunosuppressed patients, there is a risk of amoebic infection associated with these water sources.
Key words: Amebiasis; Acanthamoeba; Naegleria; Water Resources; Peru (source: MeSH NLM).
INTRODUCCIÓN
Las amebas comprenden un grupo enormemente diverso, desde las amebas gigantes (Amoeba proteus, Chaos carolinense) útiles para estudios de biología celular hasta otras con potencial patogénico para el hombre (Acanthamoeba, Naegleria y Balamuthia). Las amebas de vida libre (AVL) son ubicuas en la naturaleza, encontrándose en aire, suelo, agua de mar, ríos, lagos, fuentes, piscinas, etc. alimentándose de bacterias pero, comportándose en algunas ocasiones como parásitos oportunistas. Por esta característica se les denomina también amebas anfizoicas, aludiendo a su capacidad de sobrevivir tanto en vida libre como en el interior de hospederos, pudiendo ocasionar meningoencefalitis amebiana primaria (MEAP), encefalitis granulomatosa amebiana (EGA) o queratitis amebiana (KA) (1-3).
La infección humana por AVL es poco frecuente, sin embargo hay un incremento de casos con la emergencia del VIH/ SIDA en los reportes de MEAP y EGA, ya que los pacientes inmunosuprimidos son particularmente susceptibles a estas infecciones (3,4). Por otro lado, los casos de KA son más frecuentes por el uso de los lentes de contacto (5).
Diversas AVL han sido cultivadas de material de hisopado faríngeo y nasal, sugiriendo que estos organismos son comúnmente inhalados (6), Estudios serológicos poblacionales han determinado la presencia de anticuerpos contra Acanthamoeba en personas sanas (7), por lo que se presume que tenemos exposición a estos agentes, pero sólo personas susceptibles –inmunosuprimidos principalmente- desarrollan enfermedad.
En el Perú, los estudios son limitados, siendo en su mayoría reportes de casos. En 1957, se publica el primer caso de abscesos amebianos cerebrales y meningoencefalitis sin compromiso hepático ni pulmonar (8), posteriormente en 21 casos de MEAP, se determinó que Balamuthia mandrillaris fue la causa de 10 casos, sugiriéndose que podría ser el agente etiológico más frecuente en el Perú (9), otros reportes han seguido presentando casos fatales por el mismo agente (10,11). Posteriormente se han seguido comunicando casos en diferentes hospitales de Lima (12-14), algunos de ellos que producen lesiones cutáneas (14,15) y otros queratitis (16).
Por otro lado, se han realizado aislamientos de AVL en piscinas de Lima (17) y fuentes de agua de Ica (18), pero no se ha demostrado la capacidad patogénica de las amebas aisladas en el ambiente. Esta investigación busca evidenciar la presencia de AVL en aguas de diversas fuentes de Lima y establecer experimentalmente su poder patogénico.
MATERIALES Y MÉTODOS
Se obtuvieron 83 muestras de agua procedentes de ríos, lagos, piscinas y pozos que eran empleadas por los habitantes del lugar en actividades agrícolas, recreativas y medicinales así como para consumo o aseo, de las provincias de Huarochirí, Yauyos, Oyón, Huaura y Lima del departamento de Lima, Perú durante el segundo semestre del año 2004.
AISLAMIENTOS DE AMEBAS
Para el aislamiento de AVL de muestras de agua se empleó hisopos de gasa estériles y concentración por centrifugación (2500 g por 5 min) (19). El sedimento obtenido de la centrifugación, fue aspirado y sembrado en placas de Petri con agar no nutritivo al 2%, estriadas con E.coli o E. aerogenes muertos por calor a 56 °C, (durante 2-4 horas) e incubado a 37 °C (20). Las placas fueron observadas cada cuatro días, macroscópica y microscópicamente, para observar el crecimiento de las amebas. Mediante estudio morfológico de los quistes y trofozoítos se hizo la identificación mediante la clave de Page (21). Se empleó la coloración Giemsa - May Grunwald y hematoxilina férrica para la observación de trofozotos y quistes.
Luego se preparó una suspensión amebiana a partir del lavado de las placas con agua destilada estéril, y centrifugación a 2500 rpm por dos minutos, se hizo el recuento de amebas presentes en la suspensión, hasta ajustarlo a una densidad aproximada de 2,5 x104 trofozoítos y quistes de amebas.
DETERMINACIÓN DE PATOGENICIDAD
Se formaron dos grupos de 26 ratones Balb-c de 12-15g de peso, un grupo sometido a tratamiento inmunosupresor con betametasona (1,4 mg/mL, dosis única) y el otro grupo sin ningún tipo de tratamiento. Los ratones fueron instilados vía intranasal con la suspensión amebiana en una sola ocasión (22,23). Los ratones fueron alimentados ad libitum y observados diariamente para evaluar signos de enfermedad (debilidad, menor crecimiento, pelo erizado, comportamiento anormal) y mortalidad.
A los 15 días de observación fueron sacrificados todos los ratones, se les extrajo el cerebro, hígado y pulmón y luego de la evaluación macroscópica de los órganos, fracciones de los mismos fueron cultivados en placas Petri con agar no nutritivo al 2% e inoculados con bacterias muertas por calor; el resto de los órganos fueron conservados con formol 10%. Posteriormente, se realizó el estudio histológico empleando la coloración PAS y hematoxilina-eosina.
Se comparó la presencia de AVL en ambos grupos con la prueba chi2 usando el programa Epidat 3.1.
RESULTADOS
En 48,2% (40/83) de las muestras obtenidas se aislaron AVL en la observación directa, de los cultivos o en ambos. Sólo una (1/15) de las piscinas evaluadas presentó AVL, esta piscina tenía deficiente limpieza y aparentemente se encontraba en desuso, por haber concluido la temporada de verano. La mayoría (32/40) de las muestras positivas procedía de pozos y lagos de las provincias de Huarochirí y Yauyos, que tenían gran presencia de materia orgánica.
Ante la prueba para determinar la supervivencia de las cepas a 37 °C, se determinó crecimiento de amebas en el 31,3% de la muestras. De estas, se aislaron 26 cepas de amebas pertenecientes a siete géneros: Hartmannella, Acanthamoeba, Mayorella, Naegleria, Vahlkampfia, Vannella y Saccamoeba, con predominancia de Acanthamoeba entre las cepas aisladas (44,2%).
La mitad (13/26) de los ratones pretratados con betametasona e inoculados con amebas mostraron síntomas de enfermedad, mientras que ninguno de los ratones no tratados presentó sintomatología. Dos ratones del grupo inmunosuprimido murieron antes de terminar el periodo de observación (días 9 y 11), en ambos se encontraron amebas en cerebro, hígado y pulmón.
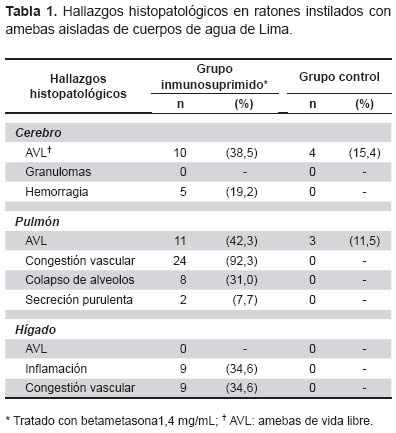
Se encontró presencia de AVL en 53,8% (14/26) ratones inmunosuprimidos a diferencia de 15,4% (4/26) del grupo no tratado (p<0,05). En los ratones tratados con betametasona se encontró evidencia de enfermedad tanto a nivel cerebral, pulmonar y hepático, a diferencia del grupo control en el cual la histopatología no mostró lesiones en ninguno de los órganos evaluados (Tabla 1).
Microscópicamente, con coloración PAS y hematoxilina-eosina, en el 38,5% de los cortes histológicos de cerebro de ratones tratados con betametasona, se encontró infiltración de quistes y trofozoítos de amebas, pero no se observó la presencia de granulomas. En los cortes histológicos de hígado se observó granulomas, necrosis, congestión vascular e inflamación, pero no se encontraron amebas. En los cortes histológicos de pulmón, se observó que la mayoría presentó congestión vascular (92%), aunque sólo en 42,3% se observaron amebas (Tabla 1).
DISCUSIÓN
Se demostró la presencia de AVL en fuentes de agua de Lima, sólo una muestra (1/15) correspondiente a piscinas públicas fue positiva, a diferencia de estudios previos realizados en Lima donde 15/34 fueron positivas (17), en Ica 5/24 (18) y en Santiago de Chile 5/8 (24). En forma similar a lo que encontró Suarez et al. (18) fueron más frecuentes las AVL en muestras de fuentes de agua natural que artificial.
Entre los géneros aislados, sólo dos de ellos son reconocidos como potencialmente patógenos para los humanos: Acanthamoeba y Naegleria. No se ha reportado patogenicidad de los géneros Hartmannella, Saccamoeba y Vahlkampfia, Mayorella y Vannella (1). Coincidiendo con estudios previos (18,24,25), Acanthamoeba fue la especie más frecuentemente aislada.
Se demostró que las AVL aisladas tiene potencial patogénico y este fue mayor en aquellos ratones que fueron inmunosuprimidos con betametasona. Si bien, otros modelos han trabajado con diferentes corticoides para generar inmunosupresión (4,23), el modelo que fue usado en este estudio demostró ser útil para estos fines.
El hallazgo de cepas de Acanthamoeba y Naegleria en estas fuentes de agua, que han demostrado su capacidad patogénica, sugiere el riesgo de adquirir una infección si existe una exposición a fuentes de agua -principalmente naturalesdel departamento de Lima, particularmente si las personas expuestas tienen algún nivel de inmunosupresión. Estudios previos han podido determinar, el riesgo de infección por Naegleria según su concentración en fuentes de agua (26).
Algunos reportes, han podido demostrar la relación entre casos clínicos de meningoencefalitis por AVL y amebas aisladas en muestras ambientales (27). Por otro lado, se ha encontrado también la presencia de AVL en muestras hospitalarias de Brasil (28,29), lugares que aún no han sido estudiados en Perú.
Podemos observar una tendencia de las cepas de Acanthamoeba de establecerse en el cerebro y el pulmón, lo cual se encuentra en concordancia con trabajos anteriores, donde se destaca la tendencia neumotrópica de algunas especies de Acanthamoeba y de asentarse en el cerebro luego de la inoculación intranasal (30).
Las fuentes de agua fueron seleccionadas por conveniencia, y no son en ningún sentido representativas de las que se encuentran en el departamento de Lima, por lo que los resultados no pueden reflejar -necesariamente- lo que sucede realmente en Lima; sin embargo, son útiles para mostrar la presencia del riesgo.
Próximos estudios deben evaluar mejor las características de las fuentes de agua que puedan estar infestadas con AVL, por otro lado, aunque no encontramos muchas piscinas con AVL, es necesario hacer una vigilancia de éstas en temporada de verano para garantizar que están libres de riesgo de infección con AVL para sus usuarios.
REFERENCIAS BIBLIOGRÁFICAS
1. Marciano-Cabral F, Cabral G. Acanthamoeba spp. as agents of disease in humans. Clin Microbiol Rev. 2003; 16(2): 273-307.
2. O ddó D. Infecciones por amebas de vida libre. Comentarios históricos, taxonomía y nomenclatura, protozoología y cuadros anátomo-clínicos. Rev Chil Infectol. 2006; 23(3): 200-14.
3. Schuster FL, Visvesvara GS. Free-living amoebae as opportunistic and non-opportunistic pathogens of human and animals. Int J Parasitol. 2004; 34(9): 1001-27.
4. E l-Fakahany AF, Fahmy RR, Mohamed AS. Free living amoebae as opportunistic parasites in immunocompromised hosts. J Egypt Soc Parasitol. 1997; 27(2): 515-27.
5. A wwad ST, Petroll WM, McCulley JP, Cavanagh HD. Updates in Acanthamoeba keratitis. Eye Contact Lens. 2007; 33(1): 1-8.
6. Lawande RV, Abraham SN, John I, Egler LJ. Recovery of soil amebas from the nasal passages of children during the dusty harmattan period in Zaria. Am J Clin Pathol. 1979; 71(2): 201-3.
7. Chappell CL, Wright JA, Coletta M, Newsome AL. Standardized method of measuring Acanthamoeba antibodies in sera from healthy human subjects. Clin Diag Lab Immunol. 2001; 8(4): 724-30.
8. Delgado J, Aguila E. Abscesos amebianos cerebrales y meningoencefalitis. Arch Peru Patol Clin. 1957; 6(1-4): 21-26.
9. Velarde C. Amebiosis de vida libre en el Perú: un estudio anatomopatológico. [Tesis doctoral]. Lima: Facultad de Medicina, Universidad Peruana Cayetano Heredia; 1996.
10. B allona R, Aguije M. Compromiso cutáneo en encephalitis granulomatosa amebiana fatal causada por Balamuthia mandrillaris. Folia Dermatol. 2003; 14(1): 28-30.
11. Seas C, Bravo F. Encefalitis amebiana granulomatosa por Balamuthia madrillaris: una enfermedad reconocida cada vez más frecuentemente en América Latina. Rev Chil Infectol. 2006; 23(3): 197-99.
12. Narvaez J. Encefalitis amebiana primaria granulomatosa. Diagnóstico (Perú). 1996; 35(2): 13-19.
13. Sánchez J, Casavilca S, Cuellar L, Klinge G, Mengoa C. Meningoencefalitis y osteomielitis por amebas de vida libre. Reporte de un caso. Rev Med Hered. 2004; 15(2): 118-21.
14. Galarza C, Larrea P, Kumakawa H. Amebiasis cutánea de vida libre. Primer caso reportado en el Hospital Nacional Dos de Mayo, Lima - Perú. Dermatol Peru. 1997; 7(1): 65-69.
15. Galarza C, Gutierrez C, Uribe M, Ramos W, Ortega A, Avila J, et al. Amebas de vida libre en lesiones cutáneas. Reporte de 4 casos. Dermatol Peru. 2006; 16(1): 36-40.
16. Suarez R, Olaya J, Huapaya P, Miranda E, Náquira C. Aislamiento de Acanthamoeba en pacientes del Servicio de Oftalmología del Hospital Nacional Cayetano Heredia. An Fac Med (Lima). 2002; 63(4): 269-74.
17. B eltrán M, Uyema N. Amebas de vida libre en muestras de agua de piscinas del departamento de Lima. Rev Med Exp. 1997; 14(1): 29-33.
18. Suarez R, Espinoza Y, Villanueva C, Ramos J, Huapaya P, Marquina R. Aislamiento de amebas de vida libre del género Acanthamoeba a partir de fuentes de agua en la ciudad de Ica. An Fac Med (Lima). 2002; 63(2): 101-5.
19. Pernin P, Pelandakis M, Ruby Y, Faure A, Siclet F. Comparative recoveries of Naegleria fowleri amoebae from seeded river water by filtration and centrifugation. Appl Environ Microbiol 1998 ; 64(3) : 955-59.
20. Schuster FL. Cultivation of pathogenic and opportunistic free-living amebas. Clin Microbiol Rev. 2002; 15(3): 342-54
21. Page FC. An illustrated key to freshwater and soil amoebae. Cambridge: Freshwater Biological Association; 1976. Scientific Publication N.° 34.
22. Muñoz V, Toche P, Cárcamo C, Araya JC. Inoculación experimental en ratas con amebas de vida libre potencialmente patógenas (AVLPP) aisladas de piscinas públicas de Santiago de Chile. Rev Chil Tecnol Med. 2002; 22(2): 1012-18.
23. Markowitz SM, Sobieski T, Martínez AJ, Duma RJ. Experimental Acanthamoeba infections in mice pretreated with methylprednisolone or tetracycline. Am J Pathol. 1978; 92(3): 733-43.
24. Muñoz V, Reyes H, Toche P, Cárcamo C, Gottlieb B. Aislamiento de amebas de vida libre en piscinas públicas de Santiago de Chile. Parasitol Latinoam. 2003; 58(3-4): 106-11.
25. Lorenzo-Morales J, Monteverde-Miranda CA, Jiménez C, Tejedor MA, Valladares B, Ortega-Rivas A. Evaluation of Acanthamoeba isolates from enviromental sources in Tenerife, Canary Islands, Spain. Ann Agric Environ Med. 2005; 12: 233-36.
26. Cabanes P, Wallet F , Pringuez E, Pernin P. Assessing the risk of primary amoebic meningoencephalitis from swimming in the presence of environmental Naegleria fowleri. Appl Environ Microbiol. 2001; 67(7): 2927-31.
27. Schuster FL, Dunnebacke TH, Booton GC, Yagi S, Kohlmeier CK, Glaser C, et al. Environmental isolation of Balamuthia mandrillaris associated with a case of amebic encephalitis. J Clin Microbiol. 2003; 41(7): 3175-80.
28. Carlesso AM, Simonetti AB, Artuso GL, Rott MB. Isolamiento e identificaçao de amebas de vida livre potencialmente patogênicas em amostras de ambientes de um hospital público da Cidade de Porto Alegre, RS. Rev Soc Bras Med Trop. 2007; 40(3): 316-20.
29. Da Silva MA, da Rosa JA. Isolamento de amebas de vida livre potencialmente patogênicas em poeira de hospitais. Rev Saude Publica. 2003; 37(2): 242-46.
30. Castro M, Arias M, Paniagua-Crespo E, Penas-Ares M. Patogenicidad experimental de Acanthamoeba polyphaga: Estudio de la influencia de la tetraciclina. Rev Iber Parasitol. 1988; 48(1):1-5.
Recibido: 20-12-06
Aceptado: 15-03-08














