Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.25 no.2 Lima Apr./jun. 2008
Prueba de Elisa indirecta del lisado total de Bartonella bacilliformis para el diagnóstico rápido de la enfermedad de Carrión
Indirect elisa of Bartonella bacilliformis total lys ate for quick diagnosis of Carrion disease
Elizabeth Anaya1,a, Giovanna Mendoza1,a, Lourdes García-Uscamayta1,a, Ysabel Fernádez1,b
1 Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
a Bióloga; b Técnica de laboratorio.
Estudio financiado por el Instituto Nacional de Salud.
RESUMEN
Se elaboró y estandarizó una prueba de ELISA indirecta con el lisado total de Bartonella bacilliformis procedentes de una cepa ATCC y de un aislamiento clínico. Se seleccionaron 86 sueros de pacientes con diagnóstico confirmado de enfermedad de Carrión por frotis y cultivo, 51 sueros negativos de pacientes de zonas no endémicas y 32 sueros de pacientes con diagnóstico serológico confirmado para otras enfermedades bacterianas como brucelosis, leptospirosis, sífilis y Rickettsiosis. Se encontró una sensibilidad de 68,6% (IC95%: 58,2-79,0%), especificidad de 94,1% (86,7-100%), valor predictivo positivo de 95,2% (89,0-100%) y valor predictivo negativo de 64,0% (54,3-71,2%), con una reacción cruzada con otras etiologías bacterianas de 78,1% (25/32). Esta no es una prueba idónea para ser usada como herramienta diagnóstica para la Enfermedad de Carrión, se debe continuar los estudios hacia la búsqueda de una prueba rápida con mayor sensibilidad.
Palabras clave: Infecciones por Bartonella; Bartonella bacilliformis; Pruebas inmunológicas; Perú (fuente: DeCS BIREME).
ABSTRACT
Was developed and standardized an indirect ELISA test with the total lysate of Bartonella bacilliformis from an ATCC strain and a clinical isolation. We selected 86 sera from patients with confirmed diagnosis of Carrion disease by smear and culture, 51 sera of negative patients for non-endemic areas and 32 sera from patients with confirmed serological diagnosis for other bacterial diseases such as brucellosis, leptospirosis, syphilis and Rickettsiosis. We found a sensitivity of 68.6% (95%CI: 58.2-79.0%), specificity of 94.1% (86.7-100%), positive predictive value of 95.2% (89.0 -100%) and negative predictive value of 64.0% (54.3-71.2%), with a cross-reaction with other bacterial aetiologies of 78.1% (25/32). This is not a recommended test to be used as a diagnostic tool for Carrion disease, is continuing studies toward finding a quick test with greater sensitivity.
Key words: Bartonella infections; Bartonella bacilliformis; Immunologic test; Peru (source: MeSH NLM).
INTRODUCCIÓN
La enfermedad de Carrión es una infección autóctona del Perú, causada por Bartonella bacilliformis, es transmitida principalmente por el mosquito Luztzomya verrucarum (1). La enfermedad se caracteriza por tener tres fases; fase anémica, que se caracteriza por la anemia severa y la presencia de fiebre; el periodo intercalar, donde persiste la anemia pero la fiebre desaparece y la fase eruptiva, donde aparece la erupción acompañada de síntomas leves como malestar general, cefaleas, etc (1-3).
La sospecha clínica de Enfermedad de Carrión se confirma en el Perú por aislamiento en agar sangre base columbia, lectura de láminas o frotís sanguíneo, las cuales detectan a la bacteria con una limitada sensibilidad (2-5). Sin embargo, un inadecuado diagnóstico clínico, la deficiente conservación de muestras en su traslado a los centros de referencia o la muerte del paciente antes de tomar la muestra, disminuyen la sensibilidad de los métodos o impiden la realización de dichas pruebas.
En otros países circulan otras especies de Bartonella y cuentan con técnicas serológicas estandarizadas entre las cuales se pueden mencionar la inmunofluorescencia indirecta (IFI), ELISA y Western blot (6-9). En Perú también circulan algunas de éstas especies (B. henselae y B. quintana) y en mayor proporción la B. bacilliformis, sin embargo; aún no se cuenta con pruebas serológicas como herramientas de diagnóstico en los centros de primer nivel de atención.
El Western blot es una técnica altamente sensible y específica pero implica métodos complejos y caros, difíciles de manejar en laboratorios regionales, en contraste con la técnica de ELISA, que es altamente sensible y de menor especificidad, de bajo costo y de fácil implementación. En nuestro país se han realizado pocos estudios de para establecer la dinámica de la infección en zonas endémicas, porque no hay una prueba rápida y estandarizada para B. bacilliformis que sea suficientemente sensible para realizar este tipo de estudios (2,3).
La detección de anticuerpos de B. bacilliformis a partir de sueros, constituiría una prueba rápida de enorme utilidad para el diagnóstico de ésta enfermedad de importancia pública en nuestro país. En éste trabajo notificaremos la sensibilidad y especificidad de un método ELISA empleando antígeno crudo total de B. bacilliformis.
EL ESTUDIO
SUEROS
En julio del año 2006 se colectaron 86 sueros de pacientes con Enfermedad de Carrión procedentes del distrito de Caraz, Ancash, con diagnóstico confirmado por frotis en sangre periférica o cultivo en el Laboratorio de Metaxénicas Bacterianas del Instituto Nacional de Salud (INS) en Lima, Perú.
Se seleccionaron como controles negativos 51 sueros de la seroteca del Laboratorio de Metaxénicas Bacterianas, de personas sin antecedente clínico-epidemiológico de Enfermedad de Carrión, con frotis y cultivo negativo a Bartonella bacilliformis procedentes de Loreto, Madre de Dios, Junín, Piura y Lima.
Adicionalmente se usaron 32 sueros de pacientes con diagnóstico serológico confirmado para otras enfermedades bacterianas como Brucelosis, leptospirosis, sífilis y Rickettsiosis provenientes de la seroteca del INS
CEPAS O ANTÍGENOS
Dos cepas de B. bacilliformis, una procedente de un aislamiento (1155-INS) confirmada por cultivo y técnicas moleculares y la cepa de B. bacilliformis del American Type Culture Collection (ATCC 35685) fueron cultivadas en medio bifásico agar sangre base Columbia suplementado con 10% sangre de carnero desfibrinada como fase sólida y RPMI como fase líquida (4), se realizaron subcultivos en diez placas con agar sangre base Columbia, incubadas a 28 ± 1 °C y cosechadas entre el séptimo y décimo día.
Las colonias de B. bacilliformis fueron resuspendidas en buffer PBS a pH 7,4. Cada cepa fue cosechada y lavada por centrifugación a 2500 rpm por cinco minutos con buffer PBS a pH 7,4 por tres veces. El pellet fue resuspendido en buffer hepes pH 7,4 (10) y sometido a lisis mediante sonicación a 0,8 mA, 20 Kz durante un minuto por cinco veces con intervalos de un minuto, el antígeno total lisado se mantuvo en condiciones de refrigeración durante todo el procesamiento de lisis (11). Finalmente se sometió a dos lavados por ultracentrifugación de 32 700 rpm por 60 minutos (10). El pellet obtenido fue finalmente resuspendido en agua destilada estéril a partir del cual se realizó el dosaje de proteínas por el método de Lowry.
Para elegir la dilución de antígeno apropiada se obtuvo 510 μg/ mL de concentración proteica con una producción en masa de antígeno de Bartonella bacilliformis del American Type Culture Collection (ATCC 35685) y cepa 1155-INS.
ENSAYO INMUNOENZIMÁTICO
De cada concentración de antígeno total de B. bacilliformis, se preparó diluciones con solución PBS a pH 7,2-7,4 para obtener concentraciones finales de 1/100, 1/200 y 1/400 equivalentes a 5, 2,5 y 1,25 μg/mL respectivamente, las que fueron impregnadas en cada pocillo de las tiras ELISA fondo plano (Inmulon®) con 100 μL de cada dilución de antígeno e incubándolas por toda la noche a 4 °C.
Utilizando un lavador de microplacas (Labsystem modelo Multiwash II) las tiras ELISA fueron sometidas al proceso de lavado por cinco veces con solución PBS a ph 7,2-7,4 más 0,05% de Tween 20 (Sigma®). En la fase de bloqueo se usó 100 μL para cada pocillo de solución PBS ph 7,2-7,4 más 3% de skim milk (Difco Laboratories®) por una hora a 37 °C. Se lavó y conservó las tiras de ELISA bloqueadas a -20 °C hasta su uso.
Se prepararon tres diluciones de cada suero (1/50, 1/100 y 1/200) en solución PBS a pH 7,2-7,4 y se agregó 100 μL en cada pocillo, se dejó en incubación a 37 °C por una hora (10,12). Se lavó las tiras ELISA y se añadió a cada pocillo 100 μL de conjugado IgG anti-humano unido a la enzima peroxidasa (Sigma®) preparado en PBS a pH 7,2-7,4 en concentraciones de 1/3000 y 1/6000, se dejó incubar a 37 °C por 30 minutos. Realizado el proceso de lavado, se adicionó 100 μL de solución cromófora ABTS (Calbiochem®) e incubó por 30 min a 37 °C. Finalmente se agregó 100 μL de solución de parada SDS al 1% y se realizó las lecturas con un lector ELISA (Thermolabsystems®) con filtro de 405 nm y filtro referencial de 630 nm.
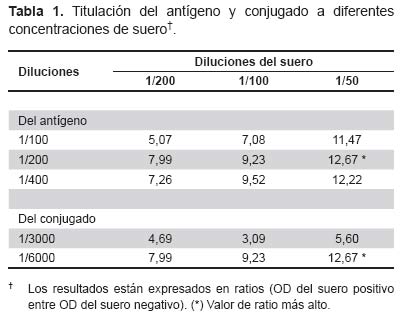
TITULACIÓN DEL ANTÍGENO Y DEL CONJUGADO
Se probaron tres diferentes diluciones seriadas (Tabla 1), de las cuales se obtuvieron valores de densidad óptica (DO) del suero positivo y del suero negativo. Se determinó la mejor dilución dividiendo el valor del DO del suero positivo entre el valor del OD del suero negativo, con el fin de obtener una valor (ratio) que represente la dilución optima a la cual el valor del OD del positivo se separa más del valor del OD del negativo. Además se probaron estas diluciones a distintos diluciones del suero positivo y del suero negativo. De ésta manera se halló que la dilución óptima del antígeno fue 1/200 con un ratio de 12,67 a una dilución de suero de 1/50 y del conjugado fue de 1/6000 con un ratio de 12,67 (Tabla 1).
DETERMINACIÓN DE SENSIBILIDAD Y ESPECIFICIDAD
Después de encontrar la dilución óptima del antígeno, del suero, y del conjugado se procesaron los sueros controles y casos y se halló el punto de corte en 0,1 considerando la media de los controles más dos desviaciones estándar.
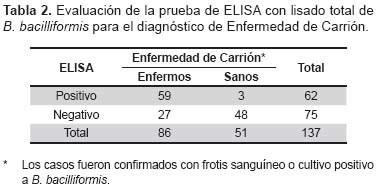
Obtenidas las lecturas, se procedió a analizar los datos para calcular los valores de especificidad, sensibilidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de la prueba con su intervalo de confianza al 95%, usando el paquete estadístico Epidat 3.1.
La prueba rápida ELISA indirecta para detectar anticuerpos y estandarizada en este estudio (Tabla 2) presentó una aceptable especificidad (94,1%; IC95%: 86,7-100%) y VPP (95,2%; IC95%: 89,0-100%), con una baja sensibilidad (68,6%; IC95%: 58,2-79,0%) y VPN (64,0%; IC95%: 54,3-71,2%). Se encontró una reacción cruzada con otras etiologías bacterianas de 78,1% (25/32), principalmente con Brucelosis y leptospirosis.
DISCUSIÓN
Pruebas de laboratorio como inmunofluorescencia (IFA), hemaglutinación indirecta (HAI) y ELISA para la detección de anticuerpos de Bartonella bacilliformis han sido desarrolladas (13,14) y utilizadas en estudios epidemiológicos de áreas donde la Enfermedad de Carrión es endémica, sin embargo; su sensibilidad y especificidad no han sido determinadas y aún no existen apropiadas pruebas comerciales.
En este trabajo, se empleó en la prueba ELISA el antígeno total de B. bacilliformis preparado a partir de cultivos en agar Columbia suplementado con 10% sangre de carnero desfibrinada a diferencia de lo reportado por Knobloch y Chamberlin (13,14) quienes emplean sangre humana desfibrinada al 5% y antígeno producido en células Vero. La preparación del antígeno se realizó siguiendo una modificación de lo señalado por Chomel y Céspedes (10,11) a fin de optimizar la prueba como lo reportado por otros autores (7,12). Sin embargo, la sensibilidad obtenida fue mucho menor a lo reportado por Regnery et al. (15) quienes al utilizar para B.henselae las proteínas de membrana externa como antígeno obtienen 88% de sensibilidad y 94% especificidad para una prueba IFA y una sensibilidad y especificidad de 94,1 y 99,2% respectivamente para detección de anticuerpos IgM y de 86,2 y 95,9% respectivamente para IgG.
Maguiña et al. (16) describen un ELISA para B. bacilliformis con 89% sensibilidad en casos de enfermedad aguda y 100% en casos con enfermedad crónica, mientras que nuestra prueba de ELISA demostró una sensibilidad de 68,6 de especificidad en casos agudos. La especificidad para la determinación de anticuerpos con antígeno crudo de Bartonella debería ser confirmada con otras pruebas como inmunoblot o inmunoprecipitación (12).
Uno de los mayores problemas de la prueba ELISA es la reacción cruzada, tal como se observó en el presente trabajo frente a sueros con brucelosis y leptospirosis principalmente. En 1985, Knobloch (13) no observó reactividad cruzada en la prueba ELISA para B. bacilliformis; sin embargo, en 1988 el mismo autor (12) reportó que el antígeno crudo de Bartonella aplicado a una ELISA reacciona con anticuerpos anti Chlamydia psitacii. Posteriormente, se describe una prueba inmunoblot empleando antígeno total sonicado para B. bacilliformis con 94% sensibilidad en enfermedad crónica y 70% en enfermedad aguda, mostrando una reacción cruzada principalmente con Brucellosis (7), tal como se observó en este trabajo.
La prueba rápida ELISA indirecta para detectar anticuerpos y estandarizada en este trabajo no es una prueba idónea para ser usada como herramienta diagnóstica para la Enfermedad de Carrión ya que a pesar de su aceptable especificidad (94,1%) presentó una baja sensibilidad (68,6) y VPN (64,0). Teniendo en cuenta la importancia de esta enfermedad en el Perú, el INS continuará los estudios hacia la búsqueda de una prueba rápida con mayor sensibilidad para ser aplicada como herramienta diagnóstica y que nos permita detectar anticuerpos antibartonela (17,18).
REFERENCIAS BIBLIOGRÁFICAS
1. B urstein Z, Mayta-Tristán P. En defensa de la denominación como Enfermedad de Carrión para la Bartonelosis humana producida por la Bartonella bacilliformis. Rev Peru Med Exp Salud Publica. 2007; 24(2): 103-6.
2. Pachas P. Epidemiología de la Bartonelosis en el Perú. Lima: Oficina General de Epidemiologia / Instituto Nacional de Salud; 2001.
3. Maguiña C, Ugarte-Gil C, Breña P, Ordaya E, Ventosilla P, Huarcaya E, et al. Actualización de la enfermedad de Carrión. Rev Med Hered. 2008; 19(1): 36-41.
4. Ventura G, Padilla C. Diagnóstico bacteriológico de la Bartonelosis humana o enfermedad de Carrion. Lima: Instituto Nacional de Salud; 2006.
5. Pachas PE, Solorzano N, Chiroque J, Rojas Y, Chancafe J, Tarazona A, et al. Value diagnosis of the thin smear in Human Bartonellosis (Carrions Disease). In: 53th ASMTH Annual Meeting. Atlanta: ASMTH; 2004. Abstract 1007.
7. B lanco JR, Raoult D. Enfermedades producidas por Bartonella spp.Enferm Infecc Microbiol Clin. 2005; 23(5): 313-19.
8. A gan B, Dolan M. Laboratory diagnosis of Bartonella infections. Clin Lab Med. 2002; 22(4): 937-62.
9. B ass JW, Vincent JM, Person DA. The expanding spectrum of Bartonella infectious: I. Bartonellosis and trench fever. Pediatr Infect Dis J. 1997 16(1): 2-10.
10. H oupikian P, Raoult D. Western immublotting for Bartonella endocarditis. Clin Diagn Lab Immunol. 2003; 10(1): 95-102.
11. Chomel BB, Carlos ET, Kasten RW, Yamamoto K, Chang CC, Carlos RS, et al. Bartonella henselae and Bartonella clarridgeiae infection in domestic cats from The Phillippines. Am J Trop Med Hyg. 1999; 60(4): 593-97.
12. Céspedes M, Gleny M. Manual de procedimientos bacteriológico y serológico para el diagnóstico de la leptospirosis. Lima: INS; 2002. Serie de Normas Técnicas N.° 34.
13. Knobloch J. Analysis and preparation of Bartonella bacilliformis antigens. Am J Trop Med Hyg. 1988; 39(2): 173-78.
14. Knobloch J, Solano L, Alvarez O, Delgado E. Antibodies to Bartonella bacilliformis as determined by fluorescence antibody test, indirect haemagglutination and ELISA. Trop Med Parasitol. 1985; 36(4): 183-85.
15. Chamberlain J, Laughlin L, Gordon S, Romero S, Solórzano N, Regnery RL. Serodiagnosis of Bartonella bacilliformis infection by indirect fluorescence antibody assay: test development and application to a population in an area of bartonellosis endemicity. J Clin Microbiol. 2000; 38(11): 4269-71.
16. Regnery RL, Olson JG, Perkins BA, Bibb W. Serological response to Rochalimaea henselae antigen in suspected cat-scratch disease. Lancet. 1992; 339: 1443-45.
17. Maguiña C, García PJ, Gotuzzo E, Cordero L, Spach DH. Bartonellosis (Carrions disease) in the modern era. Clin Infect Dis. 2001; 33(6): 772-79.
18. Padilla C, Gallegos K, Marcelo A, Chenet S, Baldeviano C. Expresión y serorreactividad de la lipoproteína recombinante de 43kDa de Bartonella bacilliformis. Rev Peru Med Exp Salud Publica. 2006; 23(3): 182-87.
19. Gallegos K, Baldevianno C, Marcelo A, Padilla C. Clonamiento, expresión y seroreactividad del antígeno recombinante flagelina de Bartonella bacilliformis. Rev Peru Med Exp Salud Publica. 2005; 22(1): 39-46.
Recibido: 09-11-07
Aceptado: 25-04-08














