Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.25 no.3 Lima July/set. 2008
Evaluación de pruebas de elisa e inmunofluorescencia indirecta para la detección de anticuerpos IgM contra rickettsiosis
Elisa and indirect immunofluorescent assays evaluation for IgM antibodies detection against rickettsiosis
Elizabeth Anaya1,a, Cecilia Morón1,b, Patricia Arias1,a, Johann Chauca1,c, Raúl Román1,d
1 Laboratorio de Metaxénicas Bacterianas, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
a Bióloga, b Médico patóloga, c Tecnólogo medico, d Técnico laboratorio.
RESUMEN
Se evaluó dos pruebas modificadas de ELISA e inmunofluorescencia indirecta (IFI) para la detección de IgM basadas en el lisado total de Rickettsia akari para el diagnóstico de Rickettsiosis. Se usaron 55 sueros negativos, 100 sueros positivos confirmados por IFI IgG Total y 15 sueros con diagnóstico confirmado para otras enfermedades bacterianas procedentes de la seroteca del Instituto Nacional de Salud. La prueba de ELISA IgM tuvo una sensibilidad de 78,0%, especificidad de 80,0%, valor predictivo positivo de 87,6% y el valor predictivo negativo de 66,7%, con una reacción cruzada con otras etiologías bacterianas de 20% (3/15). La prueba de IFI IgM tuvo una sensibilidad de 82,0%, especificidad de 91,7%, valor predictivo positivo de 94,3% y valor predictivo negativo de 75,3%, con una reacción cruzada de 13% (2/15). El método ELISA IgM no es una prueba útil, a diferencia de la prueba IFI IgM que podría ser aplicada en el diagnóstico de Rickettsiosis para estudios epidemiológicos y de vigilancia en el Perú.
Palabras clave: Rickettsiosis; Prueba ELISA; Pruebas diagnósticas (fuente: DeCS BIREME).
ABSTRACT
We evaluated two modified tests of ELISA and indirect immunofluorescence (IFI) for detecting IgM based on the total lysate of Rickettsia Akari for Rickettsiosis diagnosing. 55 negative sera were used, 100 positive sera confirmed by IFI IgGTotal and 15 sera with a confirmed diagnosis for other bacterial diseases from the serum of the Instituto Nacional de Salud (Lima, Perú). IgM ELISA test had a sensitivity of 78.0%, 80.0% specificity, positive predictive value of 87.6% and negative predictive value of 66.7%, and have a 20% (3/15) cross-reaction with other bacterial aetiologies. The IFI IgM test had a sensitivity of 82.0%, specificity of 91.7%, positive predictive value of 94.3% and negative predictive value of 75.3%, with a 13% (2/15) cross-reaction. The IgM ELISA test is not useful, unlike the IFI IgM test that could be applied in diagnosing Rickettsiosis for surveillance and epidemiological studies in Peru. .
Key words: Rickettsia infections; Enzyme-linked immunosorbent assay; Diagnosis test (source: MeSH NLM).
INTRODUCCIÓN
Las Rickettsiosis son un conjunto de enfermedades metaxénicas causadas por bacterias del género Rickettsia, que son cocobacilos Gram negativos, intracelulares obligatorios, transmitidos por diferentes artrópodos como garrapatas, ácaros, piojos y pulgas. Las Rickettsias están clasificadas en base a las proteínas de superficie inmunodominantes rOmpA y rOmpB (proteínas externas de membrana A y B) que permite la diferenciación de dos grupos; el grupo de las fiebres manchadas (SFG, spotted fever group) y el grupo tifus (TG, tifus group). El gen que expresa rOmpA se ha identificado en casi todas las especies del SFG y no se ha encontrado en el TG (1-3).
La presentación clínica de las Rickettsiosis del TG y sobre todo, del SFG, es poco específica, lo que puede llevar a confusión en el diagnóstico diferencial con otras infecciones que existen en áreas endémicas como dengue, leptospirosis, influenza, fiebre tifoidea, Bartonelosis, etc. Los síntomas y signos del tifus y en general de las demás Rickettsiosis son variados y dependen del órgano afectado así como de la liberación de citoquinas en el torrente sanguíneo. Fiebre, tos, cefalea, escalofríos, mialgias, artralgias, anorexia, vómitos y dolor abdominal ocurren en diferentes proporciones en los pacientes afectados por tifus. Otros síntomas y signos incluyen la presencia de brotes cutáneos maculopapulares, purpúricos y petequiales; y síntomas asociados con el SNC tales como convulsiones, ataxia, fotofobia; hepatoesplenomegalia e ictericia, también se pueden presentar en SFG (1,2,4,5). Todos estos síntomas son inespecíficos y, por tanto, el diagnóstico preciso depende de la sospecha clínica y epidemiológica con la confirmación por el laboratorio (6).
El Perú tiene zonas endémicas para tifus epidémico en la sierra sur y central (5-8), y se han encontrado zonas de transmisión del rickettsiosis del SFG en zonas de altura y de selva (9-12). Sin embargo, debido al cuadro febril indiferenciado con el que se presenta, y que ocurre en zonas endémicas de leptospirosis, enfermedad de Carrión, dengue, entre otras, no suele ser incluida como diagnóstico diferencial, en parte por el problema que implica su diagnóstico (6).
En el Perú, la confirmación diagnóstica de los casos de Rickettsiosis se realiza en el Instituto Nacional de Salud usando la inmunofluorescencia indirecta (IFI) IgGTotal en muestras seriadas, por lo que se requiere implementar técnicas de detección de anticuerpos IgM para la captación de casos agudos y que puedan ser realizados en las zonas donde la Rickettsiosis es endémica.
Los anticuerpos IgM pueden ser detectados a partir de la primera semana de fase aguda de la enfermedad, con procedimientos altamente sensibles y específicos como IFI y ELISA (13,14). La IFI es la prueba serológica gold standar, que permite detectar anticuerpos IgG, IgM o ambas, aunque no permite diferenciar si las infecciones son por Rickettsias del SFG o del TG. La ELISA de tipo indirecta es también útil (15-18), pero la mayor complejidad para su implementación radica en la producción del antígeno (6), debido a que los métodos descritos, exigen la separación total de las Rickettsias de la célula huésped por métodos de separación con gradiente de densidad como renografina (19,20), los cuales son muy costosos para nuestra realidad.
Este mismo problema esta presente en la purificación de varios tipos de virus, es por eso que se han publicado técnicas basadas en centrifugaciones progresivas a diferentes gravedades, las cuales logran separar parcialmente el virus del huésped eucarionte para luego usar este extracto purificado utilizado en inmunoensayos como la prueba ELISA (21).
Si bien existen pruebas ELISA e IFI IgM para el diagnóstico de Rickettsiosis, aún no se ha probado con el antígeno total y obtenido con otra forma de purificación, lo cual reduciría enormemente el costo de la prueba, lo cual serviría para reforzar el diagnóstico y la vigilancia de Rickettsiosis en el Perú, motivo que es objeto de esta investigación.
EL ESTUDIO
MATERIALES
Cepa. Se usó la cepa referencial de Rickettsia akari del Laboratorio Referencial de la University Texas Medical Branch.
Sueros. Se seleccionó 100 sueros agudos (menos de un mes de enfermedad) positivos de pacientes con Rickettsiosis de diferentes áreas geográficas del Perú de la seroteca del Laboratorio de Metaxénicas Bacterianas del Instituto Nacional de Salud (Lima, Perú). Todos fueron diagnosticados positivos para anticuerpos IgTotal (IgM + IgG + IgA) contra al antígeno rickettsial con la prueba de inmunofluorescencia indirecta (IFI) con un aumento del título serológico al cuádruple del valor obtenido en la primera muestra o un título ≥ 1:256 en la etapa aguda (8). Los sueros negativos (n = 55) fueron seleccionados de pacientes que fueron negativos para IFI tanto para anticuerpos IgTotales como para IgG contra antígeno rickettsial. Adicionalmente, se seleccionaron 15 sueros de pacientes con otras enfermedades bacterianas (Brucelosis, sífilis y leptospirosis) y negativos para Rickettsiosis.
Conjugados. Se usó el conjugado anti-human IgM elaborado en cabra ligado a peroxidasa (SIGMA) para la prueba ELISA y el conjugado anti-human IgM elaborado en cabra ligado a isotiocianato de fluoresceína-FITC (CALBIOCHEM) para la prueba IFI.
PRODUCCIÓN DE ANTÍGENO RICKETTSIAL
Se utilizó cultivos celulares VERO incubados a 37 °C en frascos para cultivo celular de 75 cm2 (FALCON) con una monocapa enriquecida al 80% con medio EMEM (medio mínimo esencial con sales de Earles, GIBCO) y 10% de suero bovino fetal (SBF). Se retiró el medio y se añadió una suspensión de antígeno Rickettsia akari reconstituida en un 1 mL de agua destilada estéril y diluida 1:15 en buffer sucrosa - fosfato - glutamato estéril. Se incubó a 34 °C por una hora, agitando suavemente cada 15 minutos y se agregó al medio EMEM con 5% SBF sin antibiótico e incubó a 34 °C por 7 a 10 días (6). Se supervisó el cultivo con ayuda de un microscopio de luz invertida (CARL ZEISS) hasta observar el efecto citopático (ECP) en 90-100% (Figura 1), se separó las células infectadas con tripsina (GIBCO) y se centrifugó por 10 minutos a 5000 rpm, se recuperó el pellet, se resuspendió en PBS y se centrifugó nuevamente, repitiendo el proceso dos veces más (6). Finalmente el pellet se diluyó en PBS 1X y se realizó el conteo de células en microscopio de luz invertida (400x) con cámara de Neubauer.
El antígeno rickettsial crudo fue procesado según Cruz et al. (21), sin embargo, la ruptura celular fue realizada por sonicación con seis toques de diez segundos cada uno con intervalos de diez segundos a 4 ºC, se centrifugó a 2000 rpm, separándose el sobrenadante para inmunofluorescencia y determinación de concentración proteica por método de Lowry. Se obtuvo 70,37 μg/mL de concentración proteica con una producción en masa de antígeno de R. akari (se descontó el peso de las células VERO tomando como referencia el peso de un cultivo similar sin R. akari).
TITULACIONES DE ANTÍGENOS, SUEROS Y CONJUGADOS
Titulación de antígeno. Se prepararon diferentes diluciones de antígeno con PBS pH 7,2 y se utilizaron microplacas para ELISA Polysorp (NUNC NALGENE) de 8 x 12 pocillos de fondo plano, donde se dispensó 100 μL de las diluciones del antígeno. Se incubaron 24 horas a 4°C (15,16). Luego de la incubación se eliminó el excedente de las diluciones y se guardó a -20 °C.
Titulación del suero. Se diluyó los sueros controles con PBS Tween-20 al 3% de leche descremada. Las diluciones se dispensaron 100 μL a cada pocillo. Se incubaron por 30 min a 37 °C y se lavó por seis veces (16).
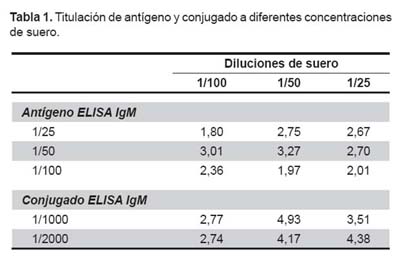
Se probaron tres diferentes diluciones seriadas, de las cuales se obtuvieron valores de densidad óptica (OD) del pool de sueros positivo y del pool de sueros negativos. Para determinar la mejor dilución se dividió el valor del OD del pool de sueros positivos entre el valor del OD del pool de sueros negativos, y obtener el valor (ratio) que represente la dilución óptima a la cual el valor del OD del pool positivo se separa más del valor del OD del pool negativo. La dilución óptima del antígeno fue 1/50 con un ratio de 3,27 con una dilución de suero de 1/50 (Tabla 1).
Titulación de conjugado. Se prepararon las diluciones con buffer PBS Tween-20 al 3% de leche descremada, se incubaron por 30 min a 37 °C y se lavaron seis veces, se agregó el sustrato o-fenilendiamina con peroxido de hidrógeno diluido en buffer citrato y se incubaron 15 min a temperatura ambiente (16). Se agregó la solución de parada con ácido sulfúrico 1M y se leyó a 490 nm en un lector para ELISA ThermoLabsystem. Se probaron dos diluciones diferentes, la dilución óptima de conjugado fue 1:1000 con un ratio de 4,93 (Tabla 1)
EVALUACIÓN DE PRUEBAS DIAGNÓSTICAS
Inmufluorescencia indirecta IgM. Se descongeló las láminas 30 minutos antes de realizar la prueba. Se diluyó el suero del paciente en buffer PBS 1:4, tomando un volumen de esta dilución y se diluyó 1:4 con el reactivo diluyente IgM pretreatment (FOCUS), incubando a temperatura ambiente por 15 min, luego se centrifugó y diluyó 1:4 con PBS más leche descremada 3% y se agregó 10 μL del suero diluido a cada círculo de la lámina e incubó en cámara húmeda a 37 °C por 30 minutos. Se retiró las láminas de la cámara húmeda y se lavó tres veces con PBS a pH 7,2 por diez minutos cada vez, dejando secar a temperatura ambiente por cinco minutos, una vez seco se agregó 10 μL del conjugado (diluido 1:10) por cada círculo de la lámina para incubar por 30 min en cámara húmeda a 37 °C. Luego se retiró las láminas de la cámara húmeda y se lavó tres veces con PBS pH 7,2. Se dejó secar y se realizó el montaje para observar al microscopio de inmunofluorescencia con objetivo 40x (LEICA DMLS).
ELISA IgM. Se diluyeron los sueros en buffer diluyente, se dispensó 100 μL en cada pocillo de la placa (Polysorb, NUNC nalgene) y se incubaron por 30 min a una temperatura de 37 °C, se lavó seis veces con 300 μL de buffer de lavado -por cada lavado- en un lavador automático (Thermolabsystem).
Se agregó 100 μL de conjugado diluido en buffer diluyente, se incubo por 30 min a una temperatura de 37 °C (16). Finalmente, se agregó 100 μL de sustrato, se incubó por 15 min a temperatura ambiente y se agregó la solución de parada. Se leyó a 490nm en un lector ELISA Thermolabsystem
Análisis de datos. Obtenidas las lecturas, se calculó el valor de corte, considerando la media de los controles negativos más dos desviaciones estándar. Luego se calcularon los valores de sensibilidad, especificidad, valor predictivo positivo y negativo usando el programa Epidat 3.0.
HALLAZGOS
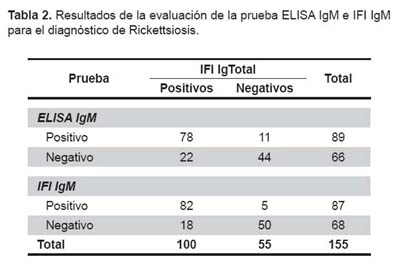
Los resultados se encuentran descritos en la tabla 2. El punto de corte para la prueba de ELISA IgM fue de 0,51, la sensibilidad fue de 78,0% (IC 95%: 69,4-86,6%), la especificidad de 80,0% (68,5-91,5%), el valor predictivo positivo de 87,6% (80,2- 95,0%) y el valor predictivo negativo de 66,7% (54,5-78,8%). Se encontró una reacción cruzada con otras etiologías bacterianas de 20% (3/15).
El punto de corte para la prueba de IFI IgM fue de 1/64, la sensibilidad fue de 82,0% (IC 95%: 74,0-90,0%), la especificidad de 91,7% (83,8-99,5%), el valor predictivo positivo de 94,3% (88,8-99,7%) y el valor predictivo negativo de 75,3% (64,8- 85,9%). Se encontró una reacción cruzada con otras etiologías bacterianas de 13% (2/15).
DISCUSIÓN
El antígeno rickettsial producido a partir de cinco frascos de cultivo celular (24 mL aproximadamente con una concentración 1,5 x 107 células/mL) fue de 70,37 μg, una cantidad menor (3,3 mg) de antígeno purificado que el que se obtiene con renografina (19,20), pero menor en costos (datos no cuantificados) y más accesible a nuestra realidad.
La sensibilidad y especificidad obtenida con el ELISA IgM no son tan satisfactorios, esto puede deberse principalmente a que la técnica de purificación del antígeno rickettsial no es la ideal (20) y a que no se realizó un tratamiento previo del suero para remover el factor reumatoideo. Se trabajó con R. akari como insumo biológico ya que para usar otras especies de Rickettsias se requieren laboratorios con mayores niveles de bioseguridad del que se disponía en el Instituto Nacional de Salud para el momento en que se realizó el estudio, por lo que la sensibilidad obtenida no es comparable si se usaban otros antígenos rickettsiales.
Aun con estas limitaciones, los resultados obtenidos para la prueba IFI IgM son alentadores con una sensibilidad de 82% y una especificidad de 92%, aunque con un importante porcentaje de reacciones cruzadas, puede ser una herramienta útil para estudios epidemiológicos y mejorando aún más su especificidad, podría ser de utilidad para su implementación en el diagnóstico de casos agudos en el Perú.
REFERENCIAS BIBLIOGRÁFICAS
1. Bernabeu-Wittel M, Segura-Porta F. Enfermedades producidas por Rickettsia. Enf Infecc Microbiol Clin. 2005; 23(3): 163-72.
2. Parola P, Paddock CD, Raoult D. Tick-borne rickettsioses around the world: emerging diseases challenging old concepts. Clin Microbiol Rev. 2005; 18(4): 719-56.
3. Zavala C, Ruiz A, Zavala V. Las Rickettsias del grupo de las fiebres manchadas: Respuesta inmune y sus proteínas inmunodominantes. Rev Med Chile. 2004; 132(3): 381-87.
4. Bechah Y, Capo C, Mege JL, Raoult D. Epidemic typhus. Lancet Infect Dis. 2008; 8(7): 417-26.
5. Morón C. Tifus exantemático: enfermedad reemergente en el Perú. Rev Med Exp.1999; 16(1-2): 51-54.
6. Morón C, Ochoa M, Laguna Torres VA. Tifus exantemático. Lima: INS/OGE; 2001.
7. Calvo A, Chevarría L, García L, Arizabal M, Quispe M. Tifus exantemático en las provincias de Quispicanchis, Paucartambo y Acomayo del departamento de Cusco, Perú. Rev Peru Med Exp Salud Publica. 2003; 20(3): 145-50.
8. Mostorino R, Anaya E, Mendoza L, Rosas A. Identificación de una nueva área de infección por rickettsias del grupo typhi: estudio de un brote de tifus en Huánuco. Rev Peru Med Exp Salud Publica. 2003; 20(1): 15-21.
9. Troyes L, Fuentes L, Troyes M, Canelo L, García M, Anaya E, et al. Etiología del síndrome febril agudo en la provincia de Jaén, Perú 2004-2005. Rev Peru Med Exp Salud Publica. 2006; 23(1): 5-11.
10. Blair PJ, Schoeler GB, Moron C, Anaya E, Caceda R, Céspedes M, et al. Evidence of rickettsial and leptospira infection in Andean northern Peru. Am J Trop Med Hyg. 2004; 70(4): 357-63.
11. Sihuincha M, Anaya E, Carranza V, Durand S. Evidencia serológica de la presencia de Rickettsas del grupo de la fiebre manchada en la Amazonía del Perú. Rev Peru Med Exp Salud Publica. 2006; 23(4): 284-87.
12. Ramal C, Díaz E, López J. Rickettsiosis, enfermedad emergente en Loreto. Evidencia serológica de 20 casos. Rev Peru Med Exp Salud Publica. 2007; 24(1): 99-100.
13. Philip RN, Casper EA, Ormsbee RA, Peacock MG, Burgdorfer W. Microimmunofluorescence test for the serological study of Rocky Mountain spotted fever and typhus. J Clin Microbiol. 1976; 3(1): 51- 61.
14. X U H, Lohr J, Greiner M. The selection of ELISA cut-off points for testing antibody to Newcastle disease by two-graph receiver operating characteristic (TG-ROC) analysis. J Immunol Method. 1997; 208(1): 61-64.
15. Dash GA, Halle S, Burgeois AL. Sensitivite microplate enzymelinked immunosorbent assay for detection of antibodies against the scrub typhus riuckettsia, Rickettsia tsutsugamushi. J Clin Microbiol. 1979; 9(1): 38-48.
16. H alle S, Dasch GA, Weiss E. Sensitive enzyme-linked immunosorbent assay for detection of antibodies against typhus rickettsiae, Rickettsia prowazekii and Rickettsia typhi. J Clin Microbiol. 1977; 6(2): 101-10.
17. Jones D, Anderson B, Olson J, Greene C. Enzyme-linked immunosorbent assay for detection of human immunoglobulin G to lipopolysaccharide of sppoted fever group Rickettsiae. J Clin Microbiol. 1993; 31(1): 138-41.
18. Keysary A, Strenger C. Use of enzyme-linked immunosorbent assay techniques with cross - reacting human sera in diagnosis of murine typhus and spotted fever. J Clin Microbiol. 1997; 35(4): 1034-35.
19. Dash G, Weiss E. Characterization of the Madrid E strain of Rickettsia prowazekii purified by renografin density gradient centrifugation. Infect Immun. 1977; 15(1): 280-86.
20. W eiss E, Coolbaugh JC, Williams JC. Separation of viable Rickettsia typhi from yolk sac L cell host components by renografin density gradient centrifugation. Appl Micriobiol. 1975; 30(3): 456- 63.
21. Cruz Malpica CD. Estandarización de la prueba de ensayo inmunoenzimático para la detección de IgG en sueros humanos para el virus Phlebotomus fever. [Tesis de bachiller] Lima: Facultad de Farmacia y Bioquímica, Universidad Nacional Mayor de San Marcos; 2001.
Correspondencia:
Blga. Elizabeth Anaya, Laboratorio de Metaxénicas Bacterianas, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
Dirección: Cápac Yupanqui 1400, Lima 11.
Teléfono: (511) 471-9920 anexo 134.
Correo electrónico: eanaya@ins.gob.pe; elizanaya@yahoo.es
Recibido: 21-12-07
Aprobado: 25-05-08














