Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.25 no.4 Lima Oct./dic. 2008
Actividad citotóxica del extracto etanólico de gnaphalium spicatum keto keto en cultivos de líneas celulares tumorales humanas
Cytotoxic activity of an ethanolic extract of gnaphalium spicatum keto keto on human tumor cell lines
David Callacondo-Riva1,a, Angel Quispe-Mauricio2,3,a, Selamir Lindo-Gamarra4,b, Abraham J. Vaisberg5,c
1 Servicio de Medicina General, Centro Médico Cono Sur, Red Asistencial Tacna, EsSalud. Tacna, Perú.
2 Posta Médica Paucartambo, Red Asistencial Pasco, EsSalud. Pasco, Perú.
3 Sociedad Científica de San Fernando, Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
4 Sociedad Científica de Estudiantes de Medicina del Centro, Facultad de Medicina, Universidad Nacional del Centro del Perú. Huancayo, Perú.
5 Departamento de Microbiología, Laboratorios de Investigación y Desarrollo, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia. Lima, Perú.
a Médico Cirujano SERUMS b Estudiante de Medicina c PhD en Biología.
RESUMEN
Objetivos. Evaluar la actividad citotóxica de extractos etanólicos de raíces, tallos, hojas y flores de Gnaphalium spicatum sobre algunas líneas celulares tumorales humanas. Materiales y métodos. Las líneas celulares HT-29, H-460, MCF-7, M-14, PC-3, DU-145, K-562, y 3T3, fueron expuestas a cuatro concentraciones de extractos etanólicos de raíces, tallos, hojas y flores de Gnaphalim spicatum, asimismo, a diferentes concentraciones de cisplatino, que se usó como control positivo. Se halló los porcentajes de crecimiento en 48 horas. Luego se determinó la concentración inhibitoria 50 (CI50) mediante análisis de regresión lineal, el índice de selectividad de cada muestra y finalmente, la relación dosis-respuesta entre las concentraciones de los extractos y cisplatino, con los porcentajes de crecimiento. Resultados. El extracto etanólico de las raíces de Gnaphalium spicatum mostró mayor actividad citotóxica en la líneas celulares MCF-7 y K-562. Los CI50 en μg/mL fueron de 98 (r= -0,98 p < 0,01) y 46 (r= -0,97 p < 0,01), respectivamente. Asimismo, su citotoxicidad en la línea celular 3T3 fue de 215 (r= 0,97 p <0,01). Los CI50 del cisplatino en μg/mL fueron de 2 (r=-0,96 p < 0,01), 7,7 (r=-0,98 p<0,01) y 3 (r=-0,97 p<0,01), para MCF-7, K-562 y 3T3, respectivamente. Los índices de selectividad del extracto de raíces y cisplatino fueron 2,2 y 0,3 para MCF-7, y 4,7 y 1,5 para K-562, respectivamente. Los extractos de tallos, hojas y flores obtuvieron CI50 > a 0,250 mg/mL en todas la líneas celulares evaluadas. Conclusiones. Los extractos etanólicos de tallos, hojas y flores de Gnaphalium spicatum no mostraron actividad citotóxica en este bioensayo. Los extractos de raíces mostraron citotoxicidad en las todas las líneas celulares tumorales, excepto en M-14. Además fueron menos citotóxicos en relación al cisplatino en la línea celular 3T3.
Palabras clave: Plantas medicinales; Fitoterapia; Citotoxicidad; Agentes antineoplásicos; Cultivo celular (fuente: DeCS BIREME).
ABSTRACT
Objectives. To evaluate the cytotoxic activity ethanolic extracts of roots, stems, leaves and flowers of Gnaphalium spicatum in some human tumor cell lines. Material and methods. The following cell lines: HT-29, H-460, MCF-7, M-14, PC-3, DU-145, K-562, and 3T3, were exposed to four different concentrations of ethanolic extracts from roots, stems, leaves and flowers of Gnaphalium spicatum, and also to different concentrations of cisplatin, which was used as a positive control. Percentage growth was assessed after 48 hours. The minimal inhibitory concentration for 50 per cent of the cells (IC50) was determined using linear regression analysis; also, the selectivity index for each sample and the dose-response relationship between the extract concentrations and cisplatin, as well as growth percentages were determined. Results. The ethanolic extract of Gnaphalium spicatum roots showed its highest cytotoxic activity in MCF-7 and K-562 cell lines. IC50 values, expressed in μg/mL, were 98 (r=-0.98; p <0.01) and 46 (r= -0.97; p <0.01), respectively. Cytotoxicity against the 3T3 cell line was 215 (r= 0.97; p <0.01). IC50 values for cisplatin were 2 (r= -0.96 p <0.01), 7.7 (r= -0.98; p<0.01), and 3 (r= -0.97; p<0.01), for the MCF7, K562 and 3T3 cell lines, respectively. The selectivity index of the ethanolic extract from Gnaphalium spicatum roots and cisplatin were 2.2 and 0.03 for the MCF-7 cell line, and 4,7 and 1.5 for the K-562 cell line, respectively. Extracts from stems, leaves and flowers of Gnapahlium spicatum acheived IC50 levels > 0.250 mg/mL in every cell lines tested. Conclusions. The ethanolic extracts of stems, leaves and flowers of Gnaphalium spicatum did not show cytotoxic activity in this bioassay. The extract from roots showed cytotoxicity in all tumor cell lines, except in M-14. Furthermore, it was less cytotoxic than cisplatin in 3T3 cell line.
Key words: Medicinal plats; Phytotheraphy; Citotoxicity; Antineoplastic agents; Cell culture (source: MeSH NLM)
INTRODUCCIÓN
El cáncer es la segunda causa de muerte en el mundo (1), cada año, 10,9 millones de personas son diagnosticadas de cáncer y se estima que hay 24,6 millones de personas que han recibido el diagnóstico de cáncer en los últimos cinco años (2). Desde 1990, ha ocurrido un incremento en la incidencia del cáncer en 22%, siendo los más frecuentes el de pulmón, mama, colon y estómago (3). En el Perú, el registro de cáncer de Lima Metropolitana de mayor relevancia, fue el realizado por el Centro de Investigación Maes Heller del Instituto Nacional de Enfermedades Neoplásicas (INEN) Dr. Eduardo Cáceres Graziani, el cual evidenció que hubo 65 680 casos en el periodo 1990-1997, siendo los más frecuentes el cáncer de estómago, mama, cuello uterino, pulmón, próstata e hígado (4).
Actualmente, se dispone de muchos fármacos quimioterapéuticos, que inducen la apoptosis en las células neoplásicas (5,6). Sin embargo, la poca tolerancia y efectos adversos de estos fármacos, hacen que haya la necesidad de seguir buscando nuevas opciones para el tratamiento del cáncer (7). Se sabe, que las terapias naturales, como el uso de productos derivados de plantas, pueden reducir estos efectos colaterales (1).
La medicina tradicional ha sido una reveladora fuente de nuevas moléculas en el descubrimiento moderno de fármacos (8). Es así, que se han buscado a través de los conocimientos etnomédicos, plantas medicinales con propiedades antitumorales, para identificar posteriormente sus sustancias activas (9,10) y así nuevos fármacos efectivos contra el cáncer.
Los agentes antitumorales derivados de plantas, en actual uso clínico, comprenden los alcaloides de la vinca, las epipodophillotoxinas, los taxanos y las camptotecinas (3). Los taxanos y las camptotecinas, forman un tercio del mercado mundial de antineoplásicos (2,75 billones de dólares) (11).
Muchas especies del género Gnaphalium (familia Asteraceae) han sido usadas en la medicina tradicional para el tratamiento de muchas enfermedades respiratorias como la gripe, asma, tos, bronquitis y afecciones bronquiales (12). Otras especies de Gnaphalium han sido usadas como agentes antiinflamatorios y antimicrobianos (13-16). En general no se considera tóxico pero se sabe que a altas dosis puede originar somnolencia y depresión del estado de alerta (17,18).
Se ha aislado varios componentes de este género de planta, demostrándose la presencia de flavonoides y terpenos como sus constituyentes principales (19). Algunos ejemplos de estos componentes químicos son: 4,2,4-trihidroxi-6-metoxichalcona- 4-glucósido, 5,7-dihidroxi-3,6,8-trimetoxiflavona, 13-epicicloesclareol, ácido-16-kauren-19-oico, ácido 11β-acetoxi- 16-kauren-19-oico, 13-epi-esclareol, sitosterol, estigmasterol, 5,8-dihidroxi-3,6,7-trimetoxiflavona, 5,8-dihidroxi-6,7-dimetoxiflavona, gnaphaliin y calycopterina (20-24).
La Gnaphalium spicatum, es originaria de Sudamérica, su distribución abarca desde el norte de Argentina a Uruguay, Paraguay, Bolivia y Perú (25) es conocido en nuestro medio con el nombre de keto keto o lengua de perro (26). Se ha reportado que la Gnaphalium spicatum posee actividad antimicrobiana frente al Staphylococcus aureus (27).
Por referencia de pobladores de zonas alto-andinas (comunicación personal de hierberos del distrito de Lampa, Puno, 2006), se tiene conocimiento, de que la Gnaphalium spicatum, es empleada para el tratamiento de síntomas asociados con diferentes tipos de cáncer. Debido a ello, el objetivo del trabajo fue evaluar la actividad citotóxica de Gnaphalium spicatum, frente a diferentes líneas celulares de cáncer, teniendo como control una línea celular normal.
MATERIALES Y MÉTODOS
Es un estudio biológico experimental in vitro. La unidad experimental fue cada célula perteneciente a las líneas celulares humanas: HT-29 (adenocarcinoma de colon), H-460 (carcinoma pulmonar tipo células no pequeñas), MCF-7 (adenocarcinoma de mama), M-14 (melanoma amelanótico), PC-3 (adenocarcinoma de próstata metastásico), DU-145 (carcinoma de próstata), K-562 (leucemia mieloide crónica) y 3T3 (fibroblastos normales de ratón) proporcionados por los Laboratorios de Investigación y Desarrollo de la Universidad Peruana Cayetano Heredia (LID-UPCH), así como, las raíces, tallos, hojas y flores de Gnaphalium spicatum, recolectadas en el distrito de Lampa (departamento de Puno, Perú) durante los meses de agosto y septiembre del año 2006, las cuales fueron clasificadas taxonómicamente en el Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos; Lima, Perú.
PREPARACIÓN DE LOS EXTRACTOS
Se realizó en los laboratorios del Departamento de Farmacología de la Facultad de Medicina de San Fernando de la Universidad Nacional Mayor de San Marcos (UNMSM). Se desecó 500 gramos de cada tipo de muestra: raíces, tallos, hojas y flores de Gnaphalium spicatum, respectivamente, a una temperatura de 40 °C por tres días. Luego, se procedió a pulverizarlas con un molino eléctrico. Cada sustancia obtenida fue introducida en un matraz conteniendo 1000 mL de etanol al 95%, por un periodo de cuatro días. Posteriormente, se filtró el macerado, utilizando para ello papel filtro de porosidad media y se sometió a una temperatura de 40 °C, para volatilizar el etanol (solvente), obteniéndose finalmente los extractos etanólicos de raíces, tallos, hojas y flores.
BIOENSAYO DE ACTIVIDAD CITOTÓXICA
El experimento se desarrolló en el Laboratorio de Biología Celular y Virología de LID-UPCH. Las líneas celulares H-460 y DU-145 fueron cultivadas y mantenidas en crecimiento logarítmico en el medio de cultivo MEM (Minimum Essential Médium) suplementado con 10% de suero bovino fetal y 50 μg/mL de gentamicina, asimismo, las líneas celulares MCF-7, M-14, HT-29 y K-562 en el medio de cultivo RPMI 1640 suplementado con 10% de suero bovino fetal y 50 μg/mL de gentamicina. Finalmente la línea celular 3T3 creció en el medio de cultivo DMEM (Dulbecco modified Eagle médium) y la línea tumoral PC-3 en el medio de HAM F12-K. Todas las líneas fueron mantenidas a una temperatura de 37 ºC, en un ambiente húmedo, con 95% de aire y 5% de CO2.
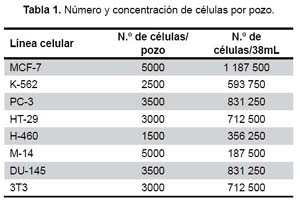
Para resuspender cada línea celular, se lavó la monocapa de células con 3 x 4 mL de la solución de Hanks sin Ca-Mg. Luego, se agregó 1 mL de la solución de tripsina-EDTA, que después de diez segundos se eliminó. Se incubó el frasco invertido, por ocho minutos a 37 ºC, al término de los cuales los cultivos fueron resuspendidos en 2 mL de cada medio de cultivo. En el caso de la línea K-562 no se utilizó este método, porque las células crecen en suspensión. Luego, se contó las células usando un hemocitómetro. Cada pozo de una placa de 96 pozos recibió 160 μL de medio, conteniendo el número de células que se especifica en la tabla 1.
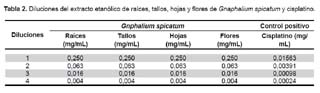
Para el ensayo de citotoxicidad se utilizó una placa 0 (control), asignándose cuatro pozos para cada línea celular y una placa 1 (experimental) con doce pozos para cada línea celular. En cada pozo de ambas placas se colocó 160 μL de medio de cultivo conteniendo las células. Se incubó a 37 ºC en una atmósfera húmeda de 5% de CO2 y 95% de aire, por 24 h. A la placa 0 se le añadió ácido tricloroacético (TCA), para fijar las células y cuantificarlas luego, en tiempo cero. A la placa 1 se le agregó las diferentes diluciones de los extractos y de cisplatino, que se muestra en la Tabla 2.
Para las diluciones de extracto, se mezcló 20 mg de extracto + 100 mL de etanol al 100% y fue centrifugado a 12 000 RPM, por diez minutos. El sobrenadante fue el stock de 20 mg/100 mL y de este 8,5 mL fueron diluidos en 340 mL de medio; con diluciones sucesivas de 1:4. La concentración inicial que se usó fue 2,5 μg/mL para el cisplatino y 250 μg/mL para los extractos. Luego, la placa 1 fue incubada por 48 horas adicionales.
Para la evaluación de la actividad antitumoral, se empleó el método del bioensayo de citotoxicidad con sulforodamina B (SRB) descrito por Skehan et al. (1990) (28). El ensayo se detuvo añadiendo ácido tricloroacético (TCA) a las placas. Las células que se fijaron con el TCA se tiñeron por 20 minutos con una solución de SRB al 0,4% en ácido acético al 1%. El SRB no unido a proteínas se removió con un lavado de ácido acético al 1%. Luego de secar las placas, el SRB unido a las proteínas se solubilizó con una solución 10 mM de Tris base (Tris (hydroximetil)aminometano) (pH 10,5) y la absorbancia a 450 nm fue leída en una lectora de microplacas. Para la línea K-562, se utilizó conteo directo, mediante el contador Coulter.
Para el análisis se creó una base de datos en el paquete Microsoft Excel 2003. La concentración inhibitoria 50 (CI50) se halló mediante el análisis de regresión lineal (ecuación de la recta: y=mx+b). Luego, se precisó el índice de selectividad de los extractos, definido como la relación de citotoxicidad entre células normales y células cancerosas: CI50 (línea celular 3T3) / CI50 (línea tumoral), el cual es >1 cuando la citotoxicidad para las células tumorales supera a la citotoxicidad en las células normales. Finalmente, se determinó los coeficientes de correlación de Pearson (r), que nos indicaron la relación dosis-respuesta entre las concentraciones y el porcentaje de crecimiento. Se consideró un p<0,05 como significativo.
RESULTADOS
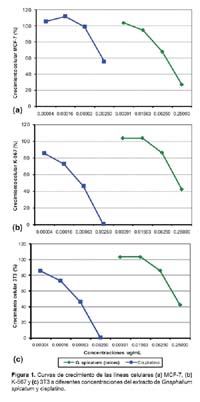
Para los extractos de raíces, tallos, hojas y flores, el comportamiento de las líneas fue el siguiente. Para la línea MCF-7 los porcentajes de crecimiento estuvieron entre 16,7 a 111,8, asimismo en la línea celular K-562, estuvieron entre 25 y 111,6. Para el caso de PC-3 fueron de 26,3 a 112,7. En HT-29 variaron de 17 a 115,9. En la línea celular H460 los valores fueron entre 41,7 a 114,3 y en M-14 fueron de 51,2 a 108. Finalmente, en la línea celular control 3T3 fueron -2,1 a 117,4. En el control cisplatino, el menor porcentaje de crecimiento fue para la línea celular DU-145 siendo de -4,8. Por el contrario, el mayor porcentaje de crecimiento frente al control cisplatino fue para la línea celular PC-3, siendo 123,1.
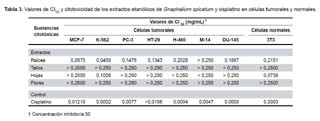
En la Tabla 3, se aprecia los valores de CI50 de los extractos de raíces, tallos, hojas y flores de Gnaphalium spicatum, así como del control cisplatino en las líneas celulares tumorales estudiadas. El comportamiento de hojas, tallos y flores de Gnaphalium spicatum mostró CI50 superiores a 0,250 mg/mL, que fue la mayor concentración utilizada en el bioensayo, no evidenciando citotoxicidad en el presente estudio. Por el contrario, las raíces mostraron actividad citotóxica, en todas las líneas celulares tumorales, excepto para M-14 (CI50 > 0,250 mg/mL).
El extracto de raíces de Gnaphalium spicatum obtuvo una mayor actividad citotóxica en las líneas celulares MCF-7 y K-562. (Figura 1a y b). Sin embargo, su citotoxicidad fue menor en comparación al cisplatino para la línea control 3T3. (Figura 1c)
Los valores de CI50 de los extractos etanólicos de raíces, tallos, hojas y flores de Gnaphalium spicatum, para la línea celular control 3T3, fueron superiores a 0,250 mg/mL (mayor concentración empleada en el estudio), excepto en el caso del extracto de hojas, el cual fue de 0,0739 mg/mL. En la línea control, el CI50 fue de 0,2151 mg/mL para el extracto de raíces.
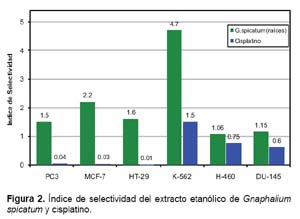
Los índices de selectividad del extracto etanólico de raíces de Gnaphalium spicatum, y el control cisplatino, para las líneas celulares tumorales MCF-7, HT-29, K-562, PC-3, DU-145 y H-460 se muestran en la Figura 2. En todos los casos los índices del extracto superaron la unidad y estuvieron entre 1,06 y 4,7. Por el contrario, el cisplatino sólo alcanzó un valor superior a la unidad para la línea K-562 siendo este índice de 1,5. Estos datos hacen ver, la amplia seguridad de los extractos al ser su citotoxicidad selectiva para las líneas celulares tumorales.
El grado de correlación de la relación dosis respuesta fue evaluado mediante el coeficiente de Pearson; los valores variaron entre -0,98 y -0,99 para el extracto de raíces y entre -0,87 y -0,99 para el control cisplatino. (Tabla 4). El extractos etanólico de raíces de Gnaphalium spicatum y el control cisplatino, mostraron una relación dosis respuesta significativa (p < 0,05), en todas las líneas celulares evaluadas en el bioensayo.
DISCUSIÓN
Se evaluó la actividad citotóxica de los extractos etanólicos de las raíces, tallos, hojas y flores de Gnaphalium spicatum, usando el método de evaluación de citotoxicidad de la sulforodamina B (28), sobre diferentes líneas celulares tumorales, así como una línea control normal. Además, se utilizó el antineoplásico cisplatino como control positivo.
El género Gnaphalium posee diferentes usos en la medicina tradicional y se ha reportado diferentes actividades biológicas (7), sin embargo, pocos son los estudios que se tienen hasta la actualidad.
Los extractos etanólicos de raíces de Gnaphalium spicatum, mostraron actividad citotóxica frente a las líneas celulares tumorales evaluadas, excepto para M-14, sin llegar a superar al cisplatino (compuesto puro). Sin embargo, la citotoxicidad fue menor para las línea control 3T3. Los extractos etanólicos de tallos, hojas y flores, no mostraron citotoxicidad a las concentraciones empleadas en este bioensayo.
Las raíces de Gnaphalium spicatum mostraron un buen perfil de seguridad al tener índices de selectividad superiores a la unidad. De igual modo, el grado de relación dosis respuesta fue significativo en todas las líneas celulares tumorales y controles.
En un estudio realizado por Itharat et al., donde evaluaron la citotoxicidad de dos especies de Dioscorea, el extracto etanólico de Dioscorea membranacea fue el más activo frente a la línea celular MCF-7 con un CI50 de 6,2 μg/mL, en tanto que para el extracto etanólico de Dioscorea birmanica fue de 7,4 μg/mL (29). En otro estudio, Jin et al., evaluaron la citotoxicidad de ocho fracciones obtenidas del extracto etanólico de Echinops grijissi, observando que en la línea celular MCF-7, las fracciones 2 y 4 mostraban citotoxicidad, con un valor de CI50 de 50 μg/mL en ambos casos (30). En nuestro estudio el CI50 de Gnaphalium spicatum para la línea celular MCF-7 fue de 98 μg/mL.
En cuanto a la línea K-562, en un estudio realizado por Schillaci et al., donde evaluaron la citotoxicidad del extracto de acetona de Peucedanum nebrodense una planta del género Umbelliferae, encontró un CI50 de 0,27 μg/mL para la línea K-562 (31), nosotros obtuvimos un CI50 de 46 μg/mL. En el caso del cáncer de colon, Colombo et al., evaluaron la citotoxicidad de la coptisina, compuesto que aislaron de Chelidonium majus, sobre en la línea celular HT-29, encontrando un CI50 de 0,49 μg/mL (32). Nosotros, en cambio, obtuvimos un valor de CI50 de 134 μg/mL en la línea celular HT-29.
Saetung et al., evaluaron la actividad citotóxica de los extractos etanólicos de varias plantas originarias de Tailandia en la línea tumoral PC-3. Bridelia ovata, Curcuma zedoaria y Derris scandens presentaron CI50 de 6,29, 17,8 y 43,5 μg/mL respectivamente (33). Nosotros obtuvimos un CI50 de 147 μg/mL. Todos estos datos evidencian la actividad citotóxica del extracto de raíces de Gnaphalium spicatum, pero menor comparada con los estudios mencionados, probablemente debido a que no se trabajó con sustancias puras o fracciones.
En cuanto a la leucemia mieloide crónica si bien es cierto que se ha logrado avances importantes con el transplante de médula ósea alogénico o el transplante de células madre (34), asimismo con el uso de los inhibidores de tirosin kinasa (35), aún se emplea la quimioterapia convencional en muchos casos (36). Como se observa, las raíces de Gnaphalium spicatum han mostrado tener un índice de selectividad de 4,7 en la línea K-562, que supera al índice del cisplatino que fue de 1,5.
En el manejo del cáncer de mama avanzado, sin respuesta a las antraciclinas, se usan antineoplásicos como la vinorelbina, el cisplatino y 5-fluoracilo (37). En nuestro estudio el cisplatino, fue superado ampliamente en índice de selectividad por el extracto etanólico de las raíces de Gnaphalium spicatum con un valor de 2,2 frente a 0,03, respectivamente.
En el caso del cáncer próstata y colon, los tratamientos actuales que admiten curación son procedimientos quirúrgicos, sin embargo, esto es para tumores en estadios tempranos. En el caso de neoplasias avanzadas no existe una terapia efectiva (38,39).
Dentro de las sesiones de quimioterapia que recibe un paciente con cáncer, uno de los medicamentos mas usados en el tratamiento de los tumores sólidos, es el cisplatino (40). La quimioterapia con cisplatino, constituye una opción terapéutica para la mayoría de pacientes con un estadio avanzado de tumores germinales, ovario, vesícula biliar, cabeza, cuello, cérvix y pulmón (31-33). Desafortunadamente, este antineoplásico tiene dos grandes limitaciones: Primero, sus efectos colaterales intensos: nefrotoxicidad, náuseas y vómitos, ototoxicidad, neuropatía periférica y mielosupresión (41). Segundo, la resistencia intrínseca o adquirida, resultado de una resistencia cruzada, la cual constituye la mayor limitación para su eficacia (40). Además, el estudio sobre el análisis de la intensificación de la dosis sugería no solo problemas con su eficacia, si no también incremento de su toxicidad con un índice terapéutico muy estrecho (42). Nuestros resultados muestran que fue muy citotóxico para la línea celular control 3T3, lo que evidencia una posible relación estrecha con sus efectos adversos en humanos.
Como se observa en los resultados, el perfil citotóxico del extracto etanólico de las raíces de Gnaphalium spicatun es alentador por su citotoxicidad para células tumorales y su baja toxicidad para las células normales; superando en cuanto a índice de selectividad al cisplatino.
El descubrimiento de fármacos a partir de plantas medicinales ha cumplido un papel importante en el tratamiento del cáncer, evidenciado en que la mayoría de aplicaciones clínicas de metabolitos secundarios y derivados de plantas se han empleado durante la última mitad de siglo, en combatir el cáncer (3). Alrededor de 100 componentes derivados de productos naturales están actualmente en ensayos clínicos y al menos 100 proyectos similares están en desarrollo preclínico (43).
Como podemos observar las raíces de Gnaphalium spicatum tienen un perfil de citotoxicidad y un buen margen de seguridad. Los resultados de este estudio evidencian sustento en su uso como anticancerígeno en la medicina tradicional. Seria interesante que futuros estudios continúen evaluando las propiedades de la Gnaphalium spicatum y sobre todo los compuestos de sus raíces, las cuales poseen un potencial como fuente de nuevas sustancias anticancerígenas, más aun teniendo en cuenta la amplia distribución de esta planta en nuestro país y el mundo.
REFERENCIAS BIBLIOGRÁFICAS
1. Desai AG, Qazi GN, Ganju RK, El-Tamer M, Singh 1. J, Saxena AK, et al. Medicinal plants and cancer chemoprevention. Curr Drug Metab. 2008; 9(7): 581-91.
2. Ferlay J, Bray F, Pisani P, Parkin DM. GLOBOCAN 2002: Cancer incidence, mortality and prevalence worldwide. Version 2.0.. Lyon: IARC Press; 2004. (IARC Cancer Base, 5).
3. Balunas MJ, Kinghorn AD. Drug discovery from medicinal plants. Life Sci. 2005; 78(5): 431-41.
4. Centro de Investigación Maes Heller, Instituto de Enfermedades Neoplásicas. Registro de Cáncer en Lima Metropolitana 1994 -1997. Lima: Instituto de Enfermedades Neoplásicas; 2004.
5. Zhang JY. Apoptosis-based anticancer drugs. Nat Rev Drug Discov. 2002;1(2): 101-2
6. Hickman JA. Apoptosis induced by anticancer drugs. Cancer Metastasis Rev. 1992; 11(2): 121-39.
7. Couffignal AL, Lapeyre-Mestre M, Bonhomme C, Bugat R, Montastruc JL. (Adverse effects of anticancer drugs: apropos of a pharmacovigilance study at a specialized oncology institution). Therapie. 2000; 55(5): 635-41 (article in French).
8. Salminen A, Lehtonen M, Suuronen T, Kaarniranta K, Huuskonen J. Terpenoids: natural inhibitors of NF-kappaB signaling with anti-inflammatory and anticancer potential. Cell Mol Life Sci. 2008; 65(19): 2979-99.
9. Chapuis JC, Sordat B, Hostettmann K. Screening for cytotoxic activity of plants used in traditional medicine. J Ethnopharmacol. 1988; 23(2-3): 273-84.
10. Cordell GA, Beecher CW, Pezzuto JM. Can ethnopharmacology contribute to the development of new anticancer drugs? J Ethnopharmacol. 1991; 32(1-3): 117-33.
11. Oberlies NH, Kroll DJ. Camptothecin and taxol: historic achievements in natural products research. J Nat Prod. 2004; 67(2): 129-35.
12. Aguilar A, Camacho, P, Chino, S, Jackez P, López, ME. Herbario Medicinal del Instituto Mexicano del Seguro Social. Información Etnobotánica. México DF: Instituto Mexicano del Seguro Social; 1994.
13. Villagomez-Ibarra JR, Sanchez M, Espejo O, Zuniga-Estrada A, Torres-Valencia JM, Joseph-Nathan P. Antimicrobial activity of three Mexican Gnaphalium species. Fitoterapia. 2001; 72(6): 692-94.
14. Duke JA, Ayensu ES. Medicinal plants of China. Algonac, MI: Reference Publications, Inc.; 1985.
15. Rojas G, Levaro J, Tortoriello J, Navarro V. Antimicrobial evaluation of certain plants used in Mexican traditional medicine for the treatment of respiratory diseases. J Ethnopharmacol. 2001; 74(1): 97-101.
16. Wang YC, Huang TL. Screening of anti-Helicobacter pylori herbs deriving from Taiwanese folk medicinal plants. FEMS Immunol Med Microbiol. 2005; 43(2): 295-300.
17. Kay M. Poisoning by gordolobo. HerbalGram. 1994; 32: 42.
18. Fajardo F. Intoxicación por gordolobo (Gnaphalium sp.) en dos recién nacidos gemelos. Bol Clin Hosp Infant Edo Son. 2004; 21(1): 34-38.
19. Campos-Bedolla P, Montaño LM, Flores-Soto E, Aguilar A, Puebla AM, Lozoya X, et al. Effect of Gnaphalium conoideum HBK on guinea pig airway smooth muscle: role of L-type Ca2+ channels. J Ethnopharmacol. 2005; 97(2): 267-72.
20. Meragelman TL, Silva GL, Mongelli E, Gil RR. Ent-pimarane type diterpenes from Gnaphalium gaudichaudianum. Phytochemistry. 2003; 62(4): 569-72.
21. Maruyama M, Hayasaka K, Sasaki S, Hosokawa S, Uchiyama H. A new chalcone glucoside from Gnaphalium multiceps. Phytochemistry. 1974; 13(1): 286-88
22. Bohlmann F, Ziesche J. Neue diterpene aus Gnaphalium-arten. Phytochemistry. 1980; 19(1): 71-74
23. Torrenegra R, Pedroso J, Robles J, Waibe R, Achenbach H. Diterpenes from Gnaphalium pellitum and Gnaphalium graveolens. Phytochemistry. 1992;31(7):2415-18
24. Guerreiro E, Kavka J, Giordano O. 5,8-Dihydroxy-3,6,7- trimethoxyflavone from Gnaphalium gaudichaudianum. Phytochemistry. 1982; 21(10): 2601-2.
25. Drury DG. The american spicate cudweeds adventive to New Zealand: (Gnaphalium Section Gamochaeta-Compositae). N Z J Bot. 1970; 9: 157-85.
26. Hammond GB, Fernandez ID, Villegas LF, Vaisberg AJ. A survey of traditional medicinal plants from the Callejon de Huaylas, Department of Ancash, Peru. J Ethnopharmacol. 1998; 61(1): 17- 30.
27. Mongelli E, Desmarchelier C, Coussio J, Ciccia G. Actividad antimicrobiana e interacción con el ADN de plantas medicinales de la amazonía peruana. Rev Argent Microbiol. 1995; 27(4): 199- 203.
28. Skehan P, Storeng R, Scudiero D, Monks A, McMahon J, Vistica D, et al. New colorimetric cytotoxicity assay for anticancerdrug screening. J Natl Cancer Inst. 1990; 82(13): 1107-12.
29. Itharat A, Houghton P, Eno-Amooquaye E, Burke P, Sampson J, Raman A. In vitro cytotoxic activity of Thai medicinal plants used traditionally to treat cancer. J Ethnopharmacol. 2004; 90(1): 33- 38.
30. Jin W, Shi Q, Hong C, Cheng Y, Ma Z, Qu H. Cytotoxic properties of thiophenes from Echinops grijissi Hance. Phytomedicine. 2008; 15(9): 768-74.
31. Schillaci D, Venturella F, Venuti F, Plescia F. Antimicrobial and antiproliferative activity of Peucedanum nebrodense (Guss.) Strohl. J Ethnopharmacol. 2003; 87(1): 99-101.
32. Colombo ML, Bugatti C, Mossa A, Pescalli N, Piazzoni L, Pezzoni G, et al. Cytotoxicity evaluation of natural coptisine and synthesis of coptisine from berberine. Farmaco. 2001; 56(5-7): 403-9.
33. Saetung A, Itharat A, Dechsukum C, Wattanapiromsakul C, Keawpradub N, Ratanasuwan P. Cytotoxicity activity of Thai medicinal plants. Songklanakarin J Sci Technol. 2005; 27(Suppl 2): 469-78.
34. Oliansky DM, Appelbaum F, Cassileth PA, Keating A, Kerr J, Nieto Y, et al. The role of cytotoxic therapy with hematopoietic stem cell transplantation in the therapy of acute myelogenous leukemia in adults: an evidence-based review. Biol Blood Marrow Transplant. 2008; 14(2): 137-80.
35. Krause DS, Van Etten RA. Tyrosine kinases as targets for cancer therapy. N Engl J Med. 2005; 353(2):172-87.
36. Silver RT. Chronic myeloid leukemia. Hematol Oncol Clin North Am. 2003;17(5):1159-73.
37. Veronesi U, Boyle P, Goldhirsch A, Orecchia R, Viale G. Breast cancer. Lancet. 2005; 365(9472):1727-41.
38. Norman G, Dean ME, Langley RE, Hodges ZC, Ritchie G, Parmar MK, et al. Parenteral oestrogen in the treatment of prostate cancer: a systematic review. Br J Cancer. 2008; 98(4): 697-707.
39. Yau T, Chan P, Ching Chan Y, Wong BC, Liang R, Epstein RJ. Current management of metastatic colorectal cancer: the evolving impact of targeted drug therapies. Aliment Pharmacol Ther. 2008; 27(11): 997-1005.
40. Misset JL, Bleiberg H, Sutherland W, Bekradda M, Cvitkovic E. Oxaliplatin clinical activity: a review. Crit Rev Oncol Hematol. 2000; 35(2): 75-93.
41. Kavanagh J, Tresukosol D, Edwards C, Freedman R, Gonzalez de Leon C, Fishman A, et al. Carboplatin reintroduction after taxane in patients with platinum-refractory epithelial ovarian cancer. J Clin Oncol. 1995; 13(7): 1584-88.
42. Nichols CR, Williams S, Loehrer PJ, Greci FA, Crawford ED, Weetlaufer J, et al. Randomized study of cisplatin dose intensity in poor-risk germ cell tumors: a Southestern Cancer Study Group and Southwest Oncology Group Protocol. J Clin Oncol. 1991; 9(7): 1163-72.
43. Harvey AL. Natural products in drug discovery. Drug Discov Today. 2008; 13(19-20): 894-901.
_______________
Correspondencia:
Dr. David Callacondo Riva.
Dirección: Urb. Rueda, Calle Jorge Chávez N.- 648. Tacna, Perú
Teléfonos: (51-52) 952841004 / (51-1) 996348794
Correo electrónico: david_medicine@hotmail.com
Recibido: 29-09-08
Aprobado: 28-12-08