Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.25 no.4 Lima Oct./dic. 2008
Características bioquímicas y evaluación preclínica de un antiveneno botrópico liofilizado contra el veneno de la serpiente Bothrops atrox*
Biochemicals characteristics and pre-clinical testing of lyophilized bothropic antivenom against Bothrops atrox snake venom
Patricia J. García1,a, Armando Yarlequé2,b, César Bonilla-Ferreyra1,b, Silvia Pessah1,a, Dan Vivas2,b, Gustavo Adolfo Sandoval2,b, Fanny Lazo2,b
1 Centro Nacional de Productos Biológicos, Instituto Nacional de Salud. Lima, Perú.
2 Laboratorio de Biología Molecular. Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos. Lima, Perú.
a Médico; b Biólogo.
RESUMEN
Se han estudiado las características bioquímicas y la capacidad neutralizante del antiveneno botrópico liofilizado producido por el Instituto Nacional de Salud (Lima, Perú), se encontró que posee 51,4 mg/mL de proteínas, las preparaciones liofilizadas se reconstituyen en un periodo de 10 min alcanzando valores de Abs600nm y pH de 0,091 y 7,0, respectivamente. Para el caso de las actividades tóxicas del veneno en estudio se obtuvieron valores de toxicidad DL50: 3,33 μg/g ratón, dosis hemorrágica mínima: 4,10 ± 0,64 μg, dosis miotóxica mínima 30,2 ± 2,5 μg, dosis coagulante mínima: 4,50 ± 0,6 μg y dosis defibrinante mínima: 8 μg, y valores de dosis efectiva del antiveneno evaluado de 140,48 (120,09-164,33), 230,67 ±11,78, 316,56 ± 40,31, 105,5 ± 4,2 y 500 μL antiveneno/mg veneno, respectivamente, lo cual indica que posee capacidad para neutralizar tales parámetros. Por estas razones se concluye que el producto biológico investigado cumple con los requerimientos de la Organización Mundial de la Salud (OMS) para ser considerado un antiveneno neutralizante de las principales actividades biológicas antes señaladas.
Palabras clave: Antiveneno; Venenos de serpiente; Bothrops; Liofilización (fuente: DeCS BIREME).
ABSTRACT
Biochemical features and neutralizing capacity of lyophilized bothropic antivenom elaborated by the Peruvian National Health Institute (Lima, Peru). It was found that the antivenom protein contents is 51.4 mg/mL. Lyophilized preparations can be reconstituted in 10 minutes, reaching Abs600nm and pH values reported as 0.091 and 7.0, respectively. Regarding toxicity of the venom for mice, LD50 was 3.33 μg, minimal hemorrhagic dose was 4.10 ± 0.64 μg, minimal myotoxic dose was 30.2 ± 2.5 μg, minimal coagulant dose was 4.50 ± 0.6 μg, and the minimal defibrinating dose was 8 μg; and the effective dose values of the antivenom for the aforementioned parameters were 140.48 (120.09-164.33), 230.67 ± 11.78, 316.56 ± 40.31, 105.5 ± 4.2, and 500 μL antivenom/mg venom, respectively, indicating that this preparation has the ability to neutralize each of the parameters tested. For these reasons we conclude that the investigated product complies with the World Health Organization (WHO) requirements to be considered an effective antivenom capable of neutralizing the main biological activities previously mentioned.
Key words: Antivenins; Snake venoms; Bothrops, Freeze drying (source: MeSH NLM).
INTRODUCCIÓN
En el Perú, las mordeduras por serpientes venenosas constituyen un problema de salud importante, reportándose accidentes tanto en la costa, en la región andina y principalmente en la selva amazónica (1). La gran mayoría de mordeduras son producidas por serpientes del género Bothrops (familia Viperidae) de las cuales la de Bothrops atrox es causante del 85 a 90% de los accidentes reportados a nivel nacional (2), siendo el edema, la necrosis y la incoagulabilidad sanguínea las principales características de su acción en humanos (3). Por esta razón, en estas regiones es necesario el uso de antivenenos que neutralicen las actividades de su veneno, ya que constituyen el único antídoto recomendado y de probada eficacia al que hace alusión la Organización Mundial de la Salud (4).
El Centro Nacional de Productos Biológicos del Instituto Nacional de Salud (INS), en Lima, produce desde 1966 un antiveneno botrópico en estado líquido, por hiperinmunización de caballos, el cual es usado para el tratamiento de envenenamientos por serpientes del género Bothrops, específicamente contra los venenos de B. atrox, B. pictus, B barnetti, B. brazili y B. hyoprora y cuya eficacia ha sido comprobada en diferentes evaluaciones preclínicas realizadas en otros laboratorios (5,6). Sin embargo, este preparado es proclive a reducir su eficacia cuando no se dispone de una cadena de frío, ya que las inmunoglobulinas equinas, a pesar de su estabilidad térmica, pueden sufrir los efectos prolongados a temperaturas mayores a 30 ºC (7).
Las mordeduras de serpientes venenosas del género Bothrops se producen en todo el país, sin embargo, existe predominancia de los accidentes ofídicos en las regiones selvático-amazónicas, donde los servicios básicos como la energía eléctrica, necesarios para mantener la cadena de frío, son insuficientes o inexistentes. Esta precariedad de servicios básicos hace que las zonas del país que más necesitan los sueros antiofídicos, no puedan tenerlos por no disponer de cadena de frío, lo cual puede ocasionar discapacidad en las víctimas e incluso la muerte. Ante esta situación es conveniente disponer de una alternativa como lo son los antivenenos liofilizados, que al ser productos congelados y luego desecados son resistentes al efecto térmico, y pueden ser transportados a lugares lejanos en los que no existe la cadena de frío (8).
Por tanto la presente investigación ha tenido por objeto analizar bioquímica y preclínicamente un producto ya existente, cuya presentación farmacéutica es distinta, y que recientemente fuera producido por el INS, con el fin de establecer si el indicado producto cumple con las exigencias internacionales en ambos aspectos, que permitirían convertirlo en un producto comercial puesto a disposición de la población, que por condiciones geográficas no tenían la posibilidad de obtener un suero que permita tratar los accidentes ofídicos.
EL ESTUDIO
Veneno de B. atrox. Se empleó el veneno de la serpiente peruana Bothrops atrox, obtenido de especímenes colectados en varias localidades del Perú y mantenidos en el Serpentario Oswaldo Meneses del Instituto Nacional de Salud en Lima. Las muestras de veneno procedieron de diversos individuos de ambos sexos y diferentes edades, con predominancia de los especímenes adultos. Luego de la extracción, los venenos fueron cristalizados y mantenidos a -20 ºC hasta su uso. Posteriormente, fueron reconstituidos en solución salina fisiológica antes de usarlos.
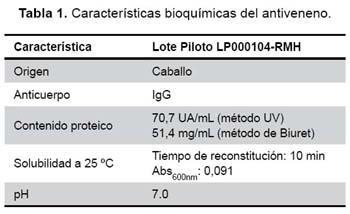
Antiveneno. Se evaluó el antiveneno botrópico liofilizado (lote piloto: LP000104-RMH), producido por el Centro Nacional de Productos Biológicos, Instituto Nacional de Salud, Lima, Perú. Éste es obtenido mediante inmunización de caballos con una mezcla de los venenos de B. atrox, B. pictus, B. barnetti, B. brazili y B. hyoprora, obteniéndose luego de un proceso de purificación, IgG completa (9). Este antiveneno es estandarizado para tener una potencia mínima de 2,5 mg de veneno de B. atrox neutralizados por mL de antiveneno. Los frascos de antiveneno liofilizado fueron almacenados a 4 ºC y usados antes de su fecha de expiración. Posteriormente, fueron resuspendidos en agua destilada antes de las pruebas de neutralización.
Cuantificación de proteínas. El contenido de proteínas del veneno y del antiveneno fue determinado por la medición de la absorbancia a 280 nm10 y expresado como unidades de absorbancia por mililitro (UA/mL). Para el caso del veneno se empleó adicionalmente el método de Lowry et al.11, y para el antiveneno el método de Biuret12. En ambos casos se empleó albúmina sérica bovina como proteína estándar y la concentración se expresó en miligramos por mililitro.
Solubilidad y pH del antiveneno. La solubilidad del antiveneno liofilizado fue analizada midiendo los tiempos de reconstitución de las preparaciones liofilizadas a temperatura ambiente (25 ºC) hasta la desaparición de material sólido en el vial luego de la adición de 10 mL de agua destilada. Posteriormente, se registró la turbidez del antiveneno midiendo su absorbancia a 600 nm. Adicionalmente, se medió el pH del antiveneno reconstituido.
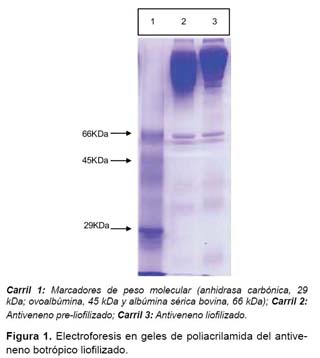
Electroforesis del antiveneno botrópico. Los electroferogramas correspondientes al antiveneno botrópico se determinaron mediante PAGE-SDS (13), empleando como proteínas estándares albúmina bovina (66 kDa), ovoalbúmina (45 kDa) y anhidrasa carbónica (29 kDa). Los geles fueron teñidos con azul brillante de Coomassie y registrados para su posterior análisis visual.
ACTIVIDADES TÓXICAS DEL VENENO Y SU NEUTRALIZACIÓN POR EL ANTIVENENO
Las pruebas toxicológicas fueron llevadas a cabo en ratones albinos BALB/c. Los protocolos experimentales estuvieron de acuerdo con el Manual de Métodos de Laboratorio del Instituto Clodomiro Picado (14), los cuales se describen a continuación:
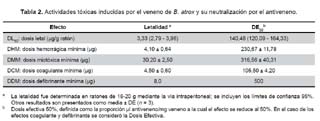
Letalidad. La letalidad fue ensayada mediante inyección por vía intraperitoneal (i.p.). Se inyectó cinco grupos de seis ratones (18-20 g) con diferentes dosis de veneno, disuelto en 200 μL de solución salina. Se registró las muertes que ocurrieron durante 48 h y se estimó la dosis letal media (DL50) mediante el método de Probits (15).
Actividad hemorrágica. Se determinó de acuerdo con Gutierrez et al. (16), para lo cual se inyectaron vía intradérmica (i.d.), cinco grupos de cuatro ratones (18-20 g) con diferentes dosis de veneno, disuelto en 100 μL de solución salina. Luego de dos horas, los animales fueron sacrificados por dislocación cervical y se les removió la piel colocándolas por el lado interno, para calcular el diámetro del área hemorrágica. La dosis hemorrágica mínima (DHM) es la cantidad de veneno capaz de inducir un área hemorrágica de 10 mm de diámetro (16).
Actividad miotóxica. Cinco grupos de cuatro ratones albinos (18-20 g) recibieron inyección intramuscular (i.m.) de veneno a concentraciones crecientes, disuelto en 100 μL de solución salina, en el músculo gastrocnemius derecho (17). Los animales control fueron inyectados con 100 μL de solución salina. Tres horas después de la inyección, los ratones fueron sangrados a partir del plexo orbital, bajo anestesia con cloroformo. La actividad de creatina quinasa (CK) del plasma fue cuantificada mediante el reactivo de CK (18) (Pointe Scientific, INC-USA), expresando la actividad enzimática en IU/L y definida como la cantidad de enzima que cataliza la transformación de un micromol de sustrato por minuto a 37 ºC.
La dosis miotóxica mínima (DMM) corresponde a la cantidad de veneno que induce un incremento de la actividad de CK del plasma correspondiente a cuatro veces la actividad enzimática encontrada en el grupo basal.
Actividad coagulante. Se preparó una mezcla de reacción constituida por cantidades crecientes de veneno, disueltas en 100 μL de solución salina, y 200 μL de plasma humano citratado, se incubó a 37 ºC y se registró el tiempo de coagulación. La dosis coagulante mínima (DCM) se define como la cantidad de veneno que indujo la coagulación del plasma en 60 segundos (4).
Actividad defibrinante. Fue determinada de acuerdo con Theakston y Reid (4), con algunas modificaciones. Cinco grupos de cuatro ratones albinos (18-20 g) fueron inyectados por vía intravenosa (i.v.), en la vena caudal, con cantidades crecientes de veneno, disuelto en 100 μL de solución salina. Una hora después de la inyección, los ratones fueron sangrados en tubos de ensayo, a partir del plexo ocular bajo anestesia con cloroformo, y la sangre mantenida a temperatura ambiente (22 a 25 ºC) durante dos horas. Luego, los tubos fueron invertidos y se observó la formación de un coágulo. La dosis defibrinante mínima (DDM) correspondió a la menor cantidad de veneno que produjo incoagulabilidad de la sangre en todos los ratones inyectados.
NEUTRALIZACIÓN POR EL ANTIVENENO Antes de evaluar la actividad correspondiente, en los diferentes sistemas de ensayo farmacológico descritos anteriormente, los ensayos de neutralización siguieron el protocolo en el cual se incubó una cantidad constante de veneno (dosis de desafío) con varias diluciones del antiveneno, durante 30 minutos a 37 ºC.
En el caso de la neutralización de la letalidad, se utilizó una dosis de veneno correspondiente a cuatro DL50. Las dosis de desafío del veneno para las actividades restantes evaluadas fueron:
(a) actividad hemorrágica: cinco DHM;
(b) actividad miotóxica: tres DMM;
(c) actividad coagulante: dos DCM; y
(d) actividad defibrinante: dos DDM.
En el caso de los efectos letal, hemorrágico y miotóxico, la capacidad neutralizante del antiveneno fue expresado como la dosis efectiva 50% (DE50), es decir la proporción, μL de antiveneno/mg de veneno, que redujo al 50% la actividad de la dosis de desafío del veneno. En el caso de las actividades coagulante y defibrinante, la neutralización fue expresada como la dosis efectiva (DE). Para la actividad coagulante, la DE corresponde a la proporción, μL de antiveneno/mg de veneno, en la cual el tiempo de coagulación es prolongado tres veces comparado con el tiempo de coagulación del plasma incubado sólo con el veneno. Para la actividad defibrinante, la DE corresponde a la proporción, μL de antiveneno/mg, de veneno, en la cual ninguno de los ratones inyectados fue defibrinado, es decir, todas las muestras de sangre coagularon.
ANÁLISIS ESTADÍSTICO
Los resultados son presentados como la media ± desviación estándar (DE) con excepción de los ensayos de letalidad en los cuales la variabilidad fue expresada como los límites de confianza al 95%.
HALLAZGOS
Las características bioquímicas del antiveneno se muestran en la Tabla 1, mientras que en la Figura 1, se muestra el electroferograma obtenido para el antiveneno liofilizado en comparación con el mismo antiveneno antes de su liofilización. Se puede observar que el contenido de proteína por el método de Biuret fue estimado en 51,4 mg/mL, mientras que por DO280 el valor fue de 70,7 mg/mL. Así mismo, el pH calculado fue de 7,0 para la solución acuosa del antiveneno la cual se solubilizó completamente en agua destilada en un tiempo máximo de 10 min a 25 ºC.
En cuanto a los electroferogramas obtenidos mediante la técnica de PAGE-SDS puede apreciarse que el antiveneno antes y después de la liofilización tienen el mismo patrón electroforético con una banda principal de 162 kDa la cual corresponde a la masa de anticuerpos IgG y sólo una banda adicional en el rango de 66 kDa que correspondería a la albúmina sérica.
En relación a las actividades toxicológicas del veneno, la estimación de sus efectos biológicos se muestra en la tabla 2. Se observa que el veneno de B. atrox tiene una toxicidad en ratones equivalente a una DL50 de 3,33 (2,79-3,96) μg/g ratón y además produjo daño tisular local, es decir, hemorragia con una DHM de 4,10 ± 0,64 μg y mionecrosis con una DMM de 30,2 ± 2,5 μg. Así también el veneno originó coagulación in vitro sobre plasma humano citratado con una DCM de 4,50 ± 0,6 μg y defibrinación del plasma de ratones con una DDM de 8 μg luego de dos horas de inoculación en ratones por vía i.v.
Por otro lado, los experimentos de neutralización de la letalidad inducida por el veneno de B. atrox (Tabla 2), mostró una DE50 de 322 μL antiveneno/mg veneno (intervalo de confianza 95%: 282-369 μL/mL).
Con respecto a la actividades hemorrágica, miotóxica, coagulante y defibrinante del veneno de B. atrox, el antiveneno se mostró efectivo en su neutralización (Tabla 2) lográndose la reducción al 50% de la actividad de las dosis de desafío correspondientes.
DISCUSIÓN
En nuestro país, durante el año 2005, se ha reportado un total de 1435 casos de mordeduras de serpiente con una tasa de mortalidad del 0,39%. Sin embargo, a pesar de los grandes esfuerzos por parte de las autoridades de salud para actualizar los registros epidemiológicos, es altamente probable que estas cifras subestimen la incidencia real de envenenamientos (19).
Existe una gran diversidad en las tecnologías usadas en la producción de antivenenos. Algunos laboratorios utilizan protocolos basados en digestión con pepsina, termocoagulación, y precipitación con sulfato de amonio para generar fragmentos F(ab)2; sin embargo, en otras instituciones se ha efectuado innovaciones en este protocolo básico, particularmente en el Instituto Butantan de Sao Paulo - Brasil, donde se usan de forma rutinaria novedosos pasos, tales como cromatografía de intercambio iónico en la producción de antivenenos. Así mismo, algunos laboratorios producen antiveneno IgG completo mediante precipitación con sulfato de amonio, mientras que otros, logran una mayor purificación usando ácido caprílico ya que este agente es capaz de precipitar todas las proteínas plasmáticas menos las IgG, las cuales permanecen solubles y pueden ser fácilmente recuperadas. Por otro lado, la mayoría de laboratorios productores a nivel mundial, elaboran antivenenos líquidos, sin embargo, el requerimiento de antivenenos liofilizados en América Latina, Asia y África es cada vez mayor, ya que la disponibilidad de estos últimos no estaría condicionada a la cadena de frío.
En un taller de la Organización Mundial de la Salud, llevado a cabo en el Instituto Nacional de Estándares Biológicos y Control (Potters Bar, Inglaterra) (8), se discutió y comparó a los antivenenos líquidos con los liofilizados en términos de estabilidad. Se notó que las preparaciones liofilizadas normalmente tienen tiempos de vida más largos que las preparaciones líquidas, si son almacenadas apropiadamente. Esto constituye una ventaja obvia en lugares donde las condiciones de distribución y almacenamiento no pueden ser bien controladas como es el caso de la selva amazónica peruana.
Una de las características más importantes de los preparados liofilizados es el tiempo de reconstitución y la solubilidad de éste, las cuales dependen críticamente de cuán bien haya sido secada en frío. La dificultad en la resuspensión de antivenenos liofilizados comerciales puede reflejar desnaturalización del producto durante los ciclos de secado en frío, implicando pérdida de estabilidad y actividad. En este trabajo determinamos tiempos de reconstitución de 10 min, los cuales son altamente contrastantes para los valores encontrados con otros dos antivenenos liofilizados utilizados en los Estados Unidos: (1) antiveneno crotálido polivalente (ACP), el cual consiste de anticuerpos policlonales de caballos inmunizados con los venenos de Crotalus adamanteus, C. atrox, C. durissus terrificus y Bothrops atrox, y (2) antiveneno crotálido Fab, el cual está constituido por los fragmentos Fab de inmunoglobulinas obtenidas de ovejas inmunizadas con los venenos de C. adamanteus, C. atrox, C. scutulatus y Agkistrodon piscivorus. Estos antivenenos presentaron tiempos de reconstitución de 40 y 90 minutos, respectivamente (20).
Por tanto, el tiempo de reconstitución encontrado para el antiveneno en estudio es mucho menor que los publicados previamente, lo que constituye una ventaja para su rápida aplicación, considerando que se logra la reconstitución de la estructura cuaternaria de las proteínas contenidas en el antiveneno liofilizado.
Por otro lado, la solubilidad del preparado liofilizado fue monitoreada registrando valores de turbidez a 600 nm. A esta longitud de onda, la absorbancia depende de la turbidez, ya que otras variables tales como la concentración de proteína, concentración de fenol y presencia de pigmentos no afectan el valor obtenido. Además, se conoce que el proceso de liofilización puede ejercer una variedad de efectos sobre la estructura proteica, como desplegamiento y desnaturalización de las proteínas, haciendo que esta solución se vuelva inefectiva. Algunos trabajos reportados previamente (21), registran valores de absorbancia a 600 nm tanto para preparaciones líquidas como liofilizadas que alcanzan valores hasta de ~0.100, los resultados obtenidos muestran que el antiveneno botrópico liofilizado tuvo un valor de absorbancia de 0,091 a 600 nm (Tabla 1) y no se observó tendencia a turbidez, por lo que las condiciones de liofilización empleadas en su preparación son apropiadas. Es necesario remarcar el hecho que la reconstitución de un antiveneno en el ámbito clínico es determinada sólo por observación del médico, de manera que mientras más rápido se perciba que el antiveneno está reconstituido, más rápido puede ser aplicado el tratamiento.
Otra de las técnicas que se emplean para monitorear la estabilidad de las preparaciones liofilizadas es la electroforesis en geles de poliacrilamida (PAGE-SDS) (8). A partir de los geles obtenidos (Figura 1), se puede concluir que las condiciones del proceso de liofilización al cual se sometieron las preparaciones líquidas del antiveneno botrópico no afectaron la estabilidad ni la integridad de las proteínas constituyendo un precedente para una posterior producción a mayor escala de este preparado.
Hay que considerar que la vida media de un antiveneno puede incrementarse si las condiciones de purificación y liofilización de los preparados son mantenidas rigurosamente.
Un paso inicial en el desarrollo de un antiveneno lo constituye la evaluación preclínica tanto in vivo e in vitro de su capacidad neutralizante contra las actividades tóxicas más importantes de un determinado veneno. Por ello, en el presente trabajo seguimos el procedimiento recomendado por la OMS para la evaluación toxicológica del veneno de Bothrops atrox, incluyendo la determinación de la potencia del veneno, DL50 (prueba de letalidad in vivo en ratones), dosis hemorrágica mínima (DHM), una evaluación de la actividad hemorrágica inducida por el veneno, dosis miotóxica mínima, dosis coagulante mínima, una evaluación del efecto procoagulante del veneno sobe el plasma (DCM-P) y dosis defibrinogenante mínima (DDM), una evaluación del efecto defibrinogenante in vivo del veneno, así como la neutralización de estas actividades por el antiveneno (4).
Con respecto a la actividad letal (Tabla 2), ésta es neutralizada por el antiveneno liofilizado en dosis similares a los reportados para diferentes lotes del mismo antiveneno en su forma líquida (5,6). Así mismo, el antiveneno en estudio mostró una capacidad neutralizante de las actividades hemorrágica y coagulante en valores similares a los del antiveneno botrópico líquido (5,6), si bien las actividades miotóxica y defibrinogenante son neutralizadas con mayor cantidad del antiveneno liofilizado.
Es importante considerar que a pesar de que el antiveneno botrópico ha sido sometido a un proceso de liofilización, mantiene una alta efectividad neutralizante sobre las principales acciones biológicas de la ponzoña como son la letalidad, la hemorragia y la actividad coagulante (5,6). Las variaciones en la potencia neutralizante al comparar el antiveneno liofilizado con el líquido han llevado a sugerir el uso de diferentes regímenes de dosis de estos antivenenos, por ejemplo, para el caso de los antivenenos en Guatemala (6). Debe tenerse también en cuenta que el tratamiento con dosis excesivas de antiveneno podría resultar en una alta incidencia de reacciones de tipo anafilácticas por parte de las personas accidentadas.
En suma, aunque el proceso de liofilización es complejo y debe realizarse en condiciones rigurosas, dada la estructura proteica del material contenido en el antiveneno, las ventajas de un producto de este tipo son evidentes, pues se puede prescindir de la cadena de frío y asegurarnos que el uso de un producto de este tipo tenga la máxima capacidad neutralizante sobre el veneno ofídico causante de un accidente en aquellas zonas donde los antivenenos líquidos prácticamente son inaccesibles por la carencia de cadena de frío.
* Estudio financiado por el Instituto Nacional de Salud
REFERENCIAS BIBLIOGRÁFICAS
1. Demarini J. Ofidismo: aspectos etiológicos, clínicos y terapéuticos. [Tesis doctoral]. Lima: Facultad de Medicina, Universidad Peruana Cayetano Heredia; 1992.
2. Perú, Ministerio de Salud. Norma técnica sobre prevención y tratamiento de accidentes por animales ponzoñosos. Lima: Ministerio de Salud; 2005.
3. Loja D, Aviles R, Necochea Y, Vilca M, Castro J. Ofidismo por Bothrops atrox: Estudio clínico-epidemiológico. Diagnostico (Perú). 2000; 38(5): 261-65.
4. Theakston RD, Reid HA. Development of simple standard assay procedures for the characterization of snake venom. Bull World Health Organ. 1983; 61(6): 949-56.
5. Laing GD, Yarleque A, Marcelo A, Rodriguez E, Warrell DA, Theakston RD. Preclinical testing of three South American antivenoms against the venoms of five medically-important Peruvian snake venoms. Toxicon. 2004; 44(1):103-6.
6. Rojas E, Quesada L, Arce V, Lomonte B, Rojas G, Gutiérrez JM. Neutralization of four Peruvian Bothrops sp. snake venoms by polyvalent antivenoms produced in Perú and Costa Rica: preclinical assessment. Acta Trop. 2005; 93(1): 85-95.
7. Yarlequé A, Vivas D, Inga R, Rodríguez E, Sandoval G, Pessah S, et al. Acción del antiveneno botrópico polivalente sobre las actividades proteolíticas presentes en los venenos de serpientes peruanas. Rev Peru Med Exp Salud Publica. 2008; 25(2): 169-73.
8. Theakston RD, Warrell DA, Griffiths E. Report of a WHO workshop on the standardization and control of antivenoms. Toxicon. 2003; 41(5): 541-57.
9. Organización Panamericana de la Salud. Manual de procedimientos: Producción y pruebas de control en la preparación de antisueros diftérico, tetánico, botulínico, antivenenos y de la gangrena gaseosa. Washington DC: OPS; 1977.
10. Warburg O, Christian W. Isolierung and Kristallisation der Garungs ferments enolase. Biochem Z. 1941; 310: 384-421.
11. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem. 1951; 193(1): 265-75.
12. Gornall AG, Bardawill CJ, David MM. Determination of serum proteins by means of the biuret reaction. J Biol Chem. 1949; 177(2): 751-66.
13. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227: 680-85.
14. Instituto Clodomiro Picado. Manual de métodos de laboratorio para la determinación de actividades tóxicas de venenos de serpientes y su neutralización por antivenenos. San José: Facultad de Microbiología, Universidad de Costa Rica; 2007.
15. Castro de la Mata R, Zavaleta Martínez-Vargas A. Programa en Basic para el cálculo de DL50 por el método de Probits. Rev Med Exp. 1998; 15(1/2): 45-54.
16. Gutiérrez JM, Gené JA, Rojas G, Cerdas L. Neutralization of proteolytic and hemorrhagic activities of Costa Rican snake venoms by a polyvalent antivenom. Toxicon. 1985; 23(6) :887-93.
17. Gutierrez JM, Arroyo O, Bolanos R. Mionecrosis, hemorragia y edema inducidos por el veneno de Bothrops asper en ratón blanco. Toxicon. 1980; 18(5-6): 603-10.
18. Horder M, MAgid E, Pitkänen E, Härkönen M, Strömme JH, Theodorsen L, et al. Recommended method for the determination of creatine kinase in blood modified by the inclusion of EDTA. The Committee on Enzymes of the Scandinavian Society for Clinical Chemistry and Clinical Physiology (SCE). Scand J Clin Lab Invest. 1979; 39(1): 1-5.
19. Gutiérrez JM, Higashi HG, Wen FH, Burnouf T. Strengthening antivenom production in Central and South American public laboratories: report of a workshop. Toxicon. 2007; 49(1): 30-35.
20. Hill RE, Bogdan GM, Dart RC. Time to reconstitution: purified Fab antivenom vs. unpurified IgG antivenom. Toxicon. 2001; 39(5): 729-31.
21. Rojas G, Vargas M, Robles A, Gutiérrez JM. Turbidity of hyperimmune equine antivenom: the role of phenol and serum lipoproteins. Toxicon. 1993; 31(1): 61-66.
___________
Correspondencia:
Dr. Armando Yarlequé Chocas. Laboratorio de Biología Molecular, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos, Lima, Perú.
Dirección: Av. Venezuela. Cdra. 34. Lima 1. Ciudad Universitaria.
Teléfono: (511) 619-7000 anexo 1528
Correo electrónico: ayarlequec@unmsm.edu.pe
Recibido: 28-05-08
Aprobado: 12-11-08