Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.25 n.4 Lima oct./dic. 2008
Exposición ocupacional a plomo y pesticidas órganofosforados: efecto sobre la salud reproductiva masculina
Occupational exposure to lead and organophosphorus pesticides:effect on male reproductive health
Sandra Yucra1,2, Manuel Gasco1,2, Julio Rubio1,2, Gustavo F. Gonzales1,2
1 Departamento de Ciencias Biológicas y Fisiológicas, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia. Lima, Perú.
2 Instituto de Investigaciones de la Altura, Universidad Peruana Cayetano Heredia. Lima, Perú.
RESUMEN
Actualmente, la exposición ocupacional a contaminantes como metales pesados y plaguicidas ha crecido por la actividad industrial, minera y agrícola. Los efectos adversos en la salud humana se presentan en el sistema respiratorio, renal, nervioso, endocrino, reproductor, siendo este último muy sensible a muchos agentes físicos y químicos generados por la actividad industrial o agrícola. Estos agentes están presentes en algunas actividades ocupacionales y en el ambiente en general. Las evidencias de estudios toxicológicos, epidemiológicos, bioquímicos y fisiológicos, demuestran que el plomo tiene efectos adversos en la salud humana de los trabajadores ocupacionalmente expuestos a diferentes concentraciones pudiendo causar infertilidad masculina. El impacto de la exposición crónica al plomo en el varón incluye reducción de la libido, alteración en la espermatogénesis (reducción en cantidad y motilidad, e incremento de formas anormales de los espermatozoides), daño cromosómico, función prostática anormal y cambios en los niveles de testosterona. Para el caso de los plaguicidas órganofosforados (OP) hay un alto riesgo de exposición ocupacional y no ocupacional de estos químicos debido a su extenso uso en la agricultura y en el ambiente doméstico, se ha demostrado, que afectan también el sistema reproductor masculino actuando como tóxicos testiculares que causan alteraciones citotóxicas y citocinéticas reversibles en las células germinales, alteran la síntesis de andrógenos y la calidad seminal en los trabajadores expuestos a OP, sobre todo los individuos dedicados a la actividad agrícola. En la presente revisión se ha recopilado diferente información de los efectos adversos de la exposición ocupacional al plomo y a los plaguicidas órganofosforados sobre la función reproductiva.
Palabras clave: Insecticidas órganofosforados; Plomo; Infertilidad; Exposición ocupacional; Contaminación (fuente: DeCS BIREME).
ABSTRACT
Nowadays there is an increased occupational exposure to different pollutants such as heavy metals and pesticides, because of the significant growth in industrial, mining, and agriculture activities. Adverse effects on human health can be observed in the respiratory, renal, nervous, endocrine, and reproductive systems, being the latter quite susceptible to many physical and chemical agents generated by industrial or agricultural activities. These agents are present in some specific activities or in the environment. Evidence from toxicological, epidemiological, biochemical, and physicioligal studies shows that lead has adverse effects on health of workers exposed to different concentrations of this metal, and the exposure may lead to male infertility. These negative effects include: libido reduction, impaired spermatogenesis (reduction in sperm number and motility, and increased number of abnormal sperm), chromosomal damage, abnormal prostate function, and changes in testosterone levels. In the case of organophosphorus pesticides (OPs), agriculture workers are at high risk for occupational and non-occupational exposure to these chemicals, because of their extensive use in agriculture and the household environment. OPs have been proven also to affect male reproductive system because of testicular toxicity leading to cytotoxic and cytokinetic reversible alterations in germinal cells, alterating androgen synthesis and quality of semen in exposed persons, particularly those individuals working in agriculture. This review focuses on the adverse effects on male reproductive function caused by occupational exposure to lead and organophosphorus compounds.
Key words: Insecticedes, Organophosphate; Lead, Infertility; Occupational exposure; Contamination (source: MeSH NLM).
INTRODUCCIÓN
Los contaminantes ambientales contribuyen a la infertilidad tanto en el hombre como en la mujer (1,2). Como ejemplos tenemos, la exposición a altos niveles de pesticidas (3), metales pesados como el plomo (4--8), cadmio (7,9) y mercurio (10), así como el abuso de drogas (11), el tabaco (12) y el alcohol (11).
La exposición a diversos contaminantes está asociada con la ocupación laboral. Es así que se ha logrado demostrar que quienes manipulan pinturas (13), trabajan con baterías para autos (14), los expendedores de gasolina5,6, los fundidores de metales (5,6) y los policías de tránsito (15-18) están expuestos a la contaminación con plomo. Igual ocurre con los agricultores, los expendedores y aplicadores de pesticidas órganofosforados se encuentran ocupacionalmente expuestos a sus efectos adversos. Muchas de estas ocupaciones tendrían, por lo tanto, un impacto negativo en la reproducción humana (1,19).
La exposición ocupacional se presenta de manera directa de las fuentes emisoras en los puestos de trabajo, y una de las vías de ingreso al organismo es la respiratoria. Podemos caracterizar en estas circunstancias tres elementos que componen la exposición ocupacional, por un lado el tiempo de exposición y por el otro la concentración del metal en el ambiente de trabajo, así como las medidas de protección utilizadas por ejemplo al aplicar los pesticidas.
Es así, que se puede reconocer dos tipos de exposición: aguda (de corta duración pero con alta concentración) y crónica (de larga duración con bajas, medianas o altas concentraciones), que van a producir efectos nocivos a la salud de tipo agudo (síntomas de intoxicación y alteraciones biológicas) o crónico (daños renales, del sistema nervioso central y periférico, cardiovascular, etc.), que de acuerdo con las medidas preventivas que se tomen y a la susceptibilidad individual pueden ser de efectos reversibles o irreversibles (20). En esta revisión se pretende conocer un poco más sobre el plomo y los plaguicidas órganofosforados y su efecto sobre la reproducción masculina.
PLOMO
El plomo es un metal pesado, cristalino, de sabor ligeramente dulce, soluble en agua y extremadamente tóxico, que desde comienzos de la civilización ha sido un aditivo en la manufactura de numerosos productos comerciales como pinturas, tintes, soldaduras para envases metálicos de comestibles, como estabilizante en la fabricación de algunos tipos de plástico, en algunos tipos de gasolina, pero principalmente en la formación de la capa vidriosa de ciertos objetos de loza de barro, piezas de alfarería y cerámica (21).
Las evidencias de los estudios toxicológicos, epidemiológicos, bioquímicos y fisiológicos, demuestran que el plomo tiene efectos adversos en la salud humana, en especial en trabajadores que por razones de su ocupación se exponen a diversas concentraciones del tóxico. En el ámbito ocupacional la exposición llega a ser excesiva, ocasionando diversas enfermedades, por tanto, se debe reducir o, en lo posible, eliminar tal riesgo. No debe dejarse de lado la contaminación que ocurre en la población que habita las zonas aledañas donde se produce o transporta el plomo. Este es el caso de la población cerca a la refinería minera en La Oroya (Yauli, Junín) o en el asentamiento humano Puerto Nuevo en el Callao, donde se ha demostrado un alto contenido de plomo en la sangre de los niños de esta zona debido a que por ese lugar se transporta plomo sin los cuidados debidos (22,23).
MECANISMOS DE ACCIÓN DEL PLOMO
El plomo afecta a casi todos los órganos o sistemas del cuerpo a través de mecanismos bioquímicos. Se propone que el plomo afecta la acción del calcio e interactúa con proteínas, uniéndose primero a grupos sulfhídrilo, amino, fosfato y carboxilo. Los dos mecanismos pueden usarse simultáneamente, como se demuestra por la activación de la calmodulina, que comprende la capacidad del plomo para imitar al calcio y por su unión a grupos carboxilo (24).
El plomo tiene la capacidad de sustituir al calcio en muchos sistemas biológicos y alterar la transmisión de señales por calcio. La interrupción de la transducción de señales puede afectar la transmisión sináptica, los canales de calcio, el sistema enzimático dependiente de calmodulina, diferenciación neuronal, permeabilidad de los capilares cerebrales, función neuroendocrina, fosforilación de proteínas, síntesis de catecolaminas, entre otras (25).
Otro mecanismo de toxicidad por plomo incluye la capacidad del plomo de interactuar con proteínas y enzimas fijadoras de metales; la interacción, por lo general, incluye la unión del plomo a grupos sulfhídrilo y en menor grado a grupos fosfato y carboxilo. La unión a proteínas puede causar que la estructura proteica sufra un cambio conformacional, alterando así la capacidad de la proteína de funcionar con normalidad. El plomo inhibe enzimas en el proceso de síntesis del grupo hemo, lo que puede resultar en anemia, disminución de la disponibilidad de citocromos para la cadena respiratoria, y también acumulación de metabolitos tóxicos como ácido δ-aminolevulínico (ALA) (24,25).
El plomo es también una sustancia oxidante por lo que puede afectar diferentes órganos produciendo estrés oxidativo. En el tracto reproductivo, se ha demostrado un efecto negativo en la espermatogénesis (26).
Diferentes estudios han demostrado el efecto oxidante del plomo sobre diferentes órganos, tejidos y sistemas tanto en humanos como en animales de experimentación. Es así que Pinon-Lataillade et al. encuentran que el plomo ingerido en alimentos tiene efectos sobre la función reproductiva (27). También se ha demostrado el efecto de estrés oxidativo tanto en el cerebro como en el hígado y en el riñón (28-31).
La intoxicación con plomo aumenta la generación de especies reactivas oxigenadas (ERO) (32,33) lo que conduce, entre otros efectos, a la inactivación del óxido nítrico (NO) disminuyendo su biodisponibilidad y regulando de forma compensatoria el NO sintasa (NOS) (34).
Es conocido que los procesos de estrés oxidativo causan daño significativo en los sistemas biológicos (35). Se conoce que el daño causado por los oxidantes comprende la inactivación de importantes enzimas, proteínas transportadoras, peroxidación de los lípidos, daño del ADN y rompimiento de macromoléculas celulares (36-38).
Así es que en estudios recientes se analizan los efectos de la administración de sustancias antioxidantes sobre animales de laboratorio intoxicados con plomo. Batra et al. demostraron que la suplementación de zinc mejora el daño testicular en ratas, producido por el plomo, tanto en el ambiente celular como al subcelular (39). Además, otro grupo de investigadores demostraron que la vitamina E y la vitamina C podían reducir la generación de ERO previniendo la disminución de la movilidad de los espermatozoides y de la capacidad de penetración de estos en los oocitos (33).
Recientemente, se estudia el efecto de diferentes plantas como protectoras contra la muerte celular inducida por la sobre producción de ERO (40-43). Rubio et al. demostraron, en un trabajo realizado en ratas, que la maca (Lepidium meyenii) previene el cese de la producción de espermatozoides inducido por plomo y sugiere que la maca podría ser un tratamiento potencial para la infertilidad masculina asociada con la exposición al plomo24. Más aun, siendo la maca una planta con propiedades antioxidantes (40), es posible que pueda ser utilizada en las poblaciones altoandinas peruanas consideradas como zonas de alto riesgo por contaminación con plomo.
TOXICIDAD
El plomo tiene efectos tóxicos en muchos órganos, sistemas y procesos fisiológicos. Al ingresar este tóxico por vía digestiva, respiratoria o a través de la piel se asocia, en una primera fase, a los eritrocitos.; a largo plazo, alrededor del 95% del metal presente en el organismo se acumula en los huesos sustituyendo al calcio, el resto se acumula principalmente en los riñones y en el hígado. El plomo ejerce un efecto tóxico doble sobre el sistema hematopoyético reduciendo, por una parte, la vida media de los eritrocitos circulantes y, por otra, inhibiendo la síntesis de hemoglobina con la consiguiente aparición de anemia (44).
Este metal también ejerce un efecto tóxico sobre el sistema nervioso central y se ha asociado con deficiencias en el desarrollo intelectual de niños contaminados, incluso a concentraciones relativamente bajas. En los riñones de hombres o animales contaminados se produce nefropatías que normalmente son de tipo crónico, aunque en los niños puede presentarse un síndrome de tipo agudo (44). La toxicidad del plomo también se refleja en el sistema cardiovascular y reproductor24. La naturaleza de las manifestaciones de toxicidad depende no sólo de la magnitud de la exposición sino también de las características de la persona expuesta; la toxicidad del plomo es más crítica para el feto en desarrollo y el niño en crecimiento que para los adultos (44,45).
ACCIÓN SOBRE EL SISTEMA REPRODUCTOR MASCULINO
El plomo se deposita en los macrófagos del tejido intersticial del testículo, en los miocitos y células epiteliales del epidídimo y con ello produce alteraciones en número, motilidad y morfología de los espermatozoides (46-49).
El impacto de la exposición crónica al plomo en el varón, incluye reducción de la libido, alteración en la espermatogénesis (reducción en cantidad y motilidad, e incremento de formas anormales de los espermatozoides), daño cromosómico, función prostática anormal y cambios en los niveles de testosterona; todos ellos relacionados con la infertilidad (32,33).
En el líquido seminal de varones expuestos ocupacionalmente al plomo, se observa oligozoospermia, teratozoospermia y astenozoospermia (5,6). Existen evidencias que demuestran que el plomo produce cambios en el tejido testicular, reduce el número total de espermatozoides y el porcentaje de espermatozoides móviles, en tanto que aumenta el número de espermatozoides anormales (50,51).
Robins et al. hallaron asociaciones significativas entre un mayor porcentaje de espermatozoides con morfología anormal y altos niveles de plomo en sangre, en trabajadores de una planta de baterías en Sudáfrica, e igualmente una relación directa entre alteraciones en la movilidad de espermatozoides y tiempo de exposición al plomo, finalmente un aumento en el porcentaje de espermatozoides inmóviles asociado con niveles altos de protoporfirina de zinc (ZPP). La protopofirina de zinc en suero es un marcador de niveles altos de plomo en sangre (48).
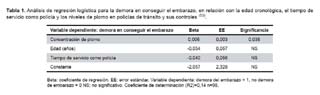
Telisman et al. demostraron, que incluso una exposición moderada al plomo puede reducir la fertilidad en los varones y aumentar los casos de abortos espontáneos en sus esposas (7). Otro grupo de investigadores evaluaron las alteraciones reproductivas en varones expuestos ocupacionalmente al plomo, y encontraron que aquellas personas que tuvieron los niveles de plomo por encima de 20 μg/dL mostraron un incremento en los niveles de ZPP (52). El grupo expuesto a plomo presentó valores superiores a 40 μg/dL. Por otro lado, en el grupo de sujetos no expuestos a plomo, la concepción retardada es de 4,5% y en los sujetos expuestos alcanza a 8,7%; similares datos se ha observado en una población de policías de tránsito en la ciudad de Arequipa estudiado por nuestro laboratorio (Tabla 1) (53).
En modelos animales se ha reportado la supresión de la espermatogénesis y de los niveles de testosterona sin cambios significantes en la LH. También se ha reportado una reducción significativa en el número de espermatozoides en el epidídimo y un incremento del número de espermatozoides anormales. Todo ello indica un efecto directo en el tracto reproductivo mas- culino. Se ha encontrado oligozoospermia, astenozoospermia y teratozoospermia en animales de experimentación sometidos a altos niveles de plomo (47,54). Estudios en ratas y otros roedores indican que concentraciones de plomo en sangre mayores a 30-40 μg/dL están asociadas a una alteración en la espermatogénesis, a la reducción de las concentraciones de andrógenos y a la disminución del peso de los testículos (55).
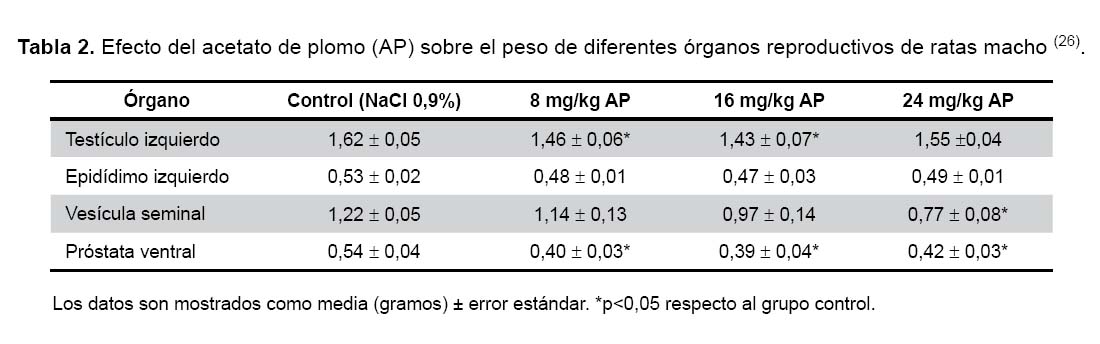
Escalante demostró, utilizando la técnica de transluminación, que el acetato de plomo puede causar un arresto de la espermatogénesis en ratas macho adultas con una dosis de 8 mg/kg/ día. Observó una disminución en la longitud total y frecuencia del estadio VII y de manera relativa un aumento en los estadios IV-V. Los estadios VII y VIII corresponden a los estadios finales de la espermatogénesis y donde ocurre la espermiación o liberación de los espermatozoides a la luz del túbulo seminífero (56). Así mismo se encontró que el acetato de plomo redujo el peso de los diferentes organos reproductivos de ratas expuestas (Tabla 2) (26).
PLAGUICIDAS ÓRGANOFOSFORADOS
Los plaguicidas son un amplio grupo de sustancias biológicamente activas utilizadas para el control de plagas. Se estima que hay 1844 compuestos plaguicidas actualmente en uso comercial en los EE.UU. Los plaguicidas pueden afectar a la salud humana y los efectos agudos de la exposición a corto plazo se encuentran bien documentados (57). Es de destacar que pequeñas cantidades de algunos de estos productos químicos pueden causar la muerte (57) o también perturbar las hormonas y reducir la capacidad de reproducirse con éxito (59-61); así mismo, se ha asociado su uso con determinados tipos de cáncer (62,63).
No debemos olvidar la muerte por envenenamiento de 24 niños en el poblado peruano de Tauccamarca en Cusco por el mal manejo de los depósitos de pesticidas en los poblados rurales, lo cual produjo contaminación en la leche de los niños (64).
La aparición de pesticidas de síntesis orgánica a partir de los años 60, cambió totalmente el sistema de control de plagas y enfermedades. Fundamentalmente debido a su elevado rendimiento y su fácil modo de aplicación, su empleo indiscriminado derivó en problemas de resistencia que convertían en inocuos los pesticidas que anteriormente habían mostrado ser eficaces. Todo ello llevó a un aumento de las dosis empleadas o a la mezcla de varios pesticidas, con el consecuente deterioro para el ambiente y la salud de los consumidores, debido al elevado contenido de residuos de plaguicidas que presentaban los productos vegetales tratados (65).

Los pesticidas cumplen una función importante en la agricultura moderna, y por ello su uso se ha incrementado (66). A la lucha contra las distintas plagas que amenazan los alimentos y otros productos agrícolas, se suma la emprendida contra los insectos y otros animales vectores de enfermedades transmisibles. Esto ha originado la existencia de una gran cantidad de sustancias químicas de alta agresividad para las plagas, pero también con efectos sobre el hombre y el equilibrio del sistema (67). El uso de los pesticidas está ampliamente difundido en la agricultura y los riesgos de estos dependen de su toxicidad, niveles de exposición y dosis absorbida (68).
En el Perú, los plaguicidas son compuestos químicos de amplio uso y están incorporados en actividades de salud pública y en la agroindustria, entre otros, siendo el sector agrícola donde estas sustancias son más usadas. Este amplio y muchas veces indiscriminado uso y sin medidas de seguridad, puede conllevar a exposición humana de variada magnitud. Es por ello importante efectuar una vigilancia biológica para determinar el grado de exposición en humanos. La vigilancia biológica provee una indicación de la absorción o el efecto del compuesto bajo estudio (69). Así por ejemplo, los residuos xenobióticos y sus metabolitos en los fluidos biológicos de la población en general son importantes indicadores de exposición a sustancias tóxicas dispersadas en el ambiente (70).
El uso indiscriminado de los plaguicidas órganoclorados, que a su vez se mantienen en los organismos por periodos prolongados y su efecto adverso en la salud ha determinado su proscripción habiéndose implantado su erradicación y prohibido su uso (72). Es por ello que se empezó a utilizar otros plaguicidas como los órganofosforados.
Varios estudios han sugerido que la calidad del semen humano ha disminuido en los últimos decenios y algunos de ellos se han asociado con la exposición laboral a plaguicidas (73).
Si bien es cierto que, los órganofosforados son ampliamente usados en la agricultura para el control de plagas (74), la exposición de humanos a los pesticidas puede ocurrir no sólo por la aplicación en la agricultura, sino por la contaminación de suelos, polvo sobre la ropa de trabajo, agua y alimentos, entre otros (70,75). En los casos de exposición no ocupacional son los niños los más expuestos.
Los órganofosforados ingresan al organismo por la vía cutánea, respiratoria o digestiva; la primera constituye la ruta común de penetración así como la forma más frecuente de intoxicación laboral. La vida media de los compuestos órganofosforados y sus productos de biotransformación, es decir de conversión metabólica, es relativamente corta (alrededor de 48 horas); dicho proceso de transformación se lleva a cabo mediante la presencia de enzimas hidrolasas y glutation-6-transferasa, principalmente hepáticas (76). Hay un alto riesgo de exposición ocupacional y no ocupacional de estos químicos debido a su extenso uso en la agricultura y en el ambiente doméstico (77). Es así que los aplicadores de plaguicidas tendrían un alto riesgo de exposición ocupacional si no practican medidas de protección adecuadas.
Los insecticidas órganofosforados dañan no sólo a los insectos sino también a los humanos, al combinarse con las colinesterasas, inactivándolas y con ello aumentando la actividad de la acetilcolina. Con ello se produce una activación del receptor muscarínico de la acetil colina con aumento del tono del parasimpático. Si la acción de los fosforados es más intensa y persistente se observa efectos neuromusculares por activación de receptores nicotínicos (temblores, convulsiones y por último, parálisis muscular) que conlleva a la muerte (78).
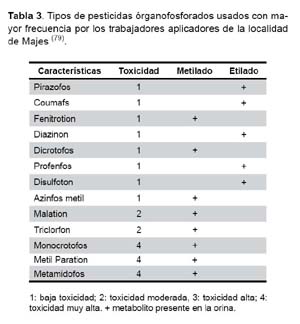
Los pesticidas usados son variados y pueden encontrarse en fluidos corporales (Tabla 3) (79). La medición de la colinesterasa en sangre es usada como un marcador biológico de contaminación por órganofosforados. Esto está basado en el hecho de que los plaguicidas órganofosforados inhiben la actividad de la enzima colinesterasa (ChE) tanto de las células rojas sanguíneas ChE (RBC) como de la enzima ChE sérica resultando en características colinérgicas que representan toxicidad por órganofosforados (80). Una reducción del 50% de la actividad de colinesterasa en suero es un indicador de toxicidad aguda por órganofosforados. La actividad de las RBC ChE, disminuye más lentamente en relación con la actividad de la ChE sérica, por lo que su medición indica la exposición crónica a órganofosforados (80). Aunque el monitoreo de colinesterasa tiene la ventaja de proporcionar una medición de respuesta fisiológica, esto tiene también desventajas (81). La interpretación del monitoreo de AChE es complicada por la variación de la actividad enzimática inter e intraindividual y el uso de otros pesticidas inhibidores de colinesterasa como los carbamatos (81). De la misma manera, la ausencia de valores basales para cada sujeto hace difícil conocer si los niveles observados de la actividad de ChE sérica o RBC representa una depresión por la exposición a un OP, o si el valor es normal para cada sujeto (82).
Asimismo, la inhibición de acetilcolinesterasa en sangre tiene una sensibilidad muy baja por lo que su actividad no varía significativamente a los niveles de exposición comúnmente encontrados en sujetos expuestos ocupacionalmente (70). Los órganofosforados son hidrolizados rápidamente a seis metabolitos dialquilfosfatos detectables en la orina antes de que se complete su excreción por lo que puede ser medido durante varios días después de la exposición (82). La medición de estos seis metabolitos alquilfosfatos ha sido extensamente utilizada teniendo buena precisión, y límites de detección de alrededor de 2-3 μg/L (70,83).
Como la agricultura es una actividad importante y fuente de ingreso económico en esta parte del mundo, se hace necesario conocer la exposición de pesticidas órganofosforados en poblaciones agrícolas. Perú es un país en vías de desarrollo en la cual la agricultura es una de las actividades económicas más importantes.
La contaminación por pesticidas en países en vías de desarrollo puede ser frecuente debido a que la población puede obtener libremente los pesticidas órganofosforados en el mercado por lo que ya se han presentado muchos casos de contaminación voluntaria e involuntaria (64,84). En los Estados Unidos algunos pesticidas órganofosforados han sido restringidos por la Agencia de Protección Ambiental (EPA) para proteger a la población humana, a los animales y al ambiente (80).
Las normas de protección al trabajador dictaminadas por la EPA (85) exigen y ordenan la supervisión del uso de equipo de protección personal y del entrenamiento que se proporciona a los trabajadores agrícolas. La ropa adecuada de protección que debe ser usada durante la aplicación y consiste en respirador, botas, máscara, guantes, lentes, y ropa impermeable. En el Perú hay una norma sólo para las etiquetas que indican el grado de riesgo por la formulación de pesticidas órganofosforados; existe todavía una carencia de un mecanismo regulador para controlar las medidas de seguridad al manejar dichos productos por parte de distribuidores, agricultores y aplicadores.
En un trabajo realizado en el valle de Majes (Arequipa), con el fin de determinar la concentración de metabolitos de órganofosforados en la orina de los aplicadores de plaguicidas y la frecuencia de dichos metabolitos en los aplicadores, se encontró que 76% de los aplicadores tenían al menos un metabolito detectado en las muestras de orina sugiriendo que era debido al uso indebido de medidas de protección (83). Otro informe en México también mostró que 87% de los trabajadores que participaron en el estudio tenían por lo menos un metabolito en su orina en el momento del estudio (86), lo que sugiere que la contaminación con plaguicidas es un problema de los agricultores de América Latina. La mayoría de los aplicadores entrevistados no eran conscientes de que el uso de la ropa de protección puede impedir los efectos perjudiciales de los plaguicidas. Es fundamental que la gente pueda obtener información acerca de los riesgos de la utilización inadecuada de plaguicidas. Esto refuerza la idea de que estos compuestos son mucho más tóxicos para las personas que los utilizan en los climas calientes y para los que viven cerca de sus lugares de trabajo y que tienen acceso limitado al equipo de protección y no los medios prácticos para el uso y desgaste. Es importante opciones preventivas como la eliminación o sustitución de determinados compuestos, la reducción en el uso, manejo integrado de plagas, métodos orgánicos, entre otros.
Entre los efectos biológicos de los contaminantes ambientales en general se ha prestado atención en los últimos años a los efectos sobre el sistema reproductivo. Los humanos están expuestos a muchos agentes ambientales que pueden ser peligrosos para su capacidad reproductiva y para su progenie. La función reproductiva masculina es altamente sensible a muchos agentes físicos y químicos generados por las actividades industriales agrícolas (87,88). Tales agentes están comúnmente presentes en algunas actividades ocupacionales y en el ambiente en general.
Estudios en ratas han podido comprobar que existen muchos mecanismos posibles para la acción antigonadal de los pesticidas órganofosforados; así, puede ejercer directamente una acción inhibitoria sobre los testículos o afectar la pituitaria y causar cambios en la concentración de gonadotropinas con el subsiguiente daño testicular (89). Los órganofosforados producen un incremento en la morfología anormal de los espermatozoides (90). Altas dosis del órganofosforado quinalpos, daña los túbulos seminíferos reduciendo el área tubular debido al colapso del epitelio seminífero (89).
Una consecuencia obvia e indeseable de los tóxicos es la infertilidad, definida como la incapacidad de concebir después de un año de cópulas sin protección que concierne aproximadamente al 15% de parejas en los países occidentales (91,92). En nuestros días, existe un incremento de riesgo potencial de los agentes ambientales físicos, químicos y genéticos sobre la infertilidad masculina, por lo que no es de extrañar que la media de la concentración de espermatozoides en varones se haya reducido progresivamente en los últimos 100 años (88,93). El daño tóxico a los testículos puede resultar en disminución en el volumen seminal, y la producción de espermatozoides defectuosos. Los plaguicidas órganofosforados también pueden influir en el factor genético. Los agropesticidas órganofosforados son tóxicos testiculares que causan alteraciones citotóxicas y citocinéticas reversibles en las células germinales (94).
El Paratión y el Paraoxón, dos plaguicidas órganofosforados, incrementan el porcentaje de espermatozoides con reacción acrosomal y también incrementan el porcentaje de espermatozoides con decondensación de la cromatina en una respuesta dependiente de la dosis. Existe también una acción directa del Paratión y Paraoxón en la vitalidad, integridad de la membrana espermática (95).
El estradiol tiene un efecto marcado en el tratamiento de animales expuestos a pesticidas, al revertir significativamente sus efectos. Esto indica que los pesticidas pueden alterar el eje hipotálamo hipófisis gonadal. El quinalpos es un plaguicida que disminuye la fertilidad en ratas macho adulto alterando las gonadotropinas de la pituitaria (89).
El Malation induce a efectos tóxicos sobre el sistema reproductor masculino en animales experimentales (96), asimismo, afecta el sistema reproductivo, disminuye el número de células germinales, seguida de una proliferación compensatoria de las espermatogonias al día 16; hay también un aumento de la apoptosis especialmente de espermatogonias y espermatocitos en preleptoteno97. El daño afecta principalmente la estructura y función del DNA (98). Asimismo, se ha demostrado que la maca mejora la espermatogénesis después del daño causado por malathion (99).
El Feniltrothión, es un insecticida órganofosforado que tiene actividad antiandrogénica tanto en ensayos in vitro como in vivo (100). En otro estudio hallaron que el Metilparatión y el Forato son mutagénicos (101). La exposición a pesticidas organofosforados ha sido asociada con la hiperploidía y poliploidía de espermatozoides (102).
Los contaminantes ambientales contribuyen a la infertilidad no sólo en el hombre sino también en la mujer (1,103). Por ejemplo, la exposición a altos niveles de pesticidas (104), metales pesados como el plomo (4,7), cadmio (7,9) , mercurio (10), el abuso de drogas (11), el tabaco (12), y el alcohol (11) favorecen la infertilidad.
En México se realizo un estudio con agricultores donde se halló que el dietiltiofosfato (DETP) fue el metabolito órganofosforado encontrado con mayor frecuencia en muestras de orina, indicando que se han utilizado compuestos derivados de acido tíofosfórico (86). En dicho estudio diazinon fue el pesticida usado más frecuentemente. Diazinon es un órganofosforados etilado y por tal razón es lógico que metabolitos etilados de órganofosforados estuvieran presentes en orina de los trabajadores. En la Irrigación Majes, el órganofosforados metilado usado con más frecuencia fue Metamidofos (70), así mismo se halló con mas frecuencia metabolitos metilados de órganofosforados en orina. El uso de metamidofos tiene como indicador una alta excreción urinaria de órganofosforados metilados (77). Dimetil fosfato (DMP) es un metabolito de mevinfos, fosfamidon, bidrin, monocrotofos, y dipterex (105), esos plaguicidas también fueron usados por los aplicadores en la Irrigación Majes.
En otro estudio se ha demostrado que trabajadores con bajos niveles de exposición a órganofosforados tienen parámetros seminales alterados (106). Esto nos conlleva a pensar que no solo las personas con exposición muy alta a órganofosforados tienen parámetros seminales alterados.
En referencia a los parámetros de calidad seminal Yucra et al. observaron variación en el pH, el cual se encuentra significativamente elevado con 8,09 en los trabajadores expuestos a pesticidas en relación al grupo control que tiene 7,53, lo que hace suponer una hipofunción prostática; esto se corrobora con los niveles de fructuosa corregida que están elevados en relación con el grupo control (83), debido a una disminución de los niveles prostáticos de zinc (107); al estar disminuida la secreción prostática en aplicadores hay disminución de la contribución ácida, predominando la secreción alcalina de las vesículas seminales (107). De esta manera, las concentraciones de zinc bajas son mayores en el grupo expuesto a pesticidas en comparación con el grupo control, esto también podría ser ocasionado por obstrucción u otras causas independientes de las concentraciones elevadas de órganofosforados; sin embargo, el análisis multivariado muestra que por cada periodo que el individuo está expuesto, los niveles de zinc disminuyen.
Muchos pesticidas han sido considerados como disruptores endocrinos por su capacidad de bloquear o activar los receptores hormonales y afectar particularmente los niveles de hormonas sexuales, testosterona y estradiol (108). Yucra et al. hallaron disminución significativa en los niveles séricos de LH del grupo expuesto (83) en contraste con otros trabajos reportados en los cuales la exposición a órganofosforados incrementó los niveles séricos de LH y FSH (109,110) mientras que los niveles de T fueron en descenso (109); ello como consecuencia de activación del sistema de retroalimentación negativa.
La falta de similitudes en los diferentes estudios realizados niveles hormonales podrían ser debido a las diferencias en la exposición, equipos de protección, pesticida usado, prácticas de seguridad usadas, lo cual cumple una función importante en la determinación de características de los efectos endocrinos (110) pero generalmente los riesgos dependen de su toxicidad y el nivel de exposición.
La capacidad de los plaguicidas para producir efectos adversos en la reproducción ha sido demostrada en animales de laboratorio, pero la gran diferencia en la función reproductiva y manejo de xenobióticos entre especies, limitan la extrapolación en los humanos (111).
Se ha observado que la administración oral de Acefato en ratones machos, produce efectos negativos que incluyen señales colinérgicas, descenso en los niveles de acetilcolinesterasa, embarazo anormal en hembras no expuestas emparejadas con machos expuestos, así como alteraciones de músculos y testículos (112). Estudios previos han mostrado que los órganofosforados pueden atravesar la barrera placentaria (113) sin embargo, los efectos de exposición a órganofosforados sobre la toxicidad parental y neonatal no han sido muy estudiados (114). Otro tipo de órganofosforado como el metil oxidemeton, altera el índice de fertilidad en la primera generación de ratas, reduciéndose significativamente con altas concentraciones del grupo expuesto (57%) comparado con el control (89%) (114).
En un trabajo realizado por Recio-Vega et al. mostraron una disminución significativa en el total de espermatozoides entre los sujetos con la mayor exposición a órganofosforados (73). La calidad del semen más pobre se observó durante la primavera, debido a que grandes cantidades de plaguicidas son rociados y, posteriormente se observó una mejora en los parámetros de los espermatozoides después de la cesación de la aplicación de plaguicidas en invierno.
COMENTARIOS FINALES
Las evidencias científicas demuestran el impacto negativo tanto de la contaminación con plomo así como con pesticidas. Estas afectan de manera aguda y crónica diferentes órganos que incluyen en ambos casos la infertilidad tanto masculina como femenina. Los diversos estudios hechos hasta la fecha revelan que la contaminación puede ocurrir tanto por exposición ocupacional como no ocupacional, por lo que es necesario medidas preventivas que incluyan un manejo adecuado de estos compuestos tanto por los trabajadores expuestos ocupacionalmente como por las medidas de seguridad sanitaria que impidan el riesgo que la población no ocupacionalmente expuesta se contamine con ellos, como ha ocurrido en Tauccamarca en Cusco, para pesticidas (64) y Puerto Nuevo en Callao para el plomo (115).
REFERENCIAS BIBLIOGRÁFICAS
1. Bonde JP, Gwereman A, Ernst 1. rnst E. Identifying environmental risk to male reproductive function by occupational studies: logistics and design options. Occup Environ Med. 1996; 53(8): 511-19.
2. Gerahard I, Waibel S, Daniel V. Impact of heavy metals on hormonal and immunological factors in woman with repeat miscarriages. Hum Reprod Update. 1998; 4(3): 301-9.
3. Silvestroni L, Fiorini R, Palleschi S. Partition of the organochlorine insecticide lindane into the human sperm surface induces membrane depolarization and Ca2+ influx. Biochem J. 1997; 321: 691-98.
4. Corrales J, Burgo R, Miralles J, Villar, E. Abnormalities in sperm acid glycosidases from infertile men with idiopathic Oligoasthenoteratozoospermia. Fertil Steril. 2000; 73(3): 470-78.
5. Alexander BH, Checkoway H, van Netten C, Muller CH, Ewers TG, Kaufman JD, et al. Semen quality of men employed at a lead smelter. Occup Environm Med. 1996; 53(6): 411-16.
6. Alexander BH, Checkoway H, Faustman EM, van Netten C, Muller CH, Ewers TG. Contrasting associations of blood and semen lead concentrations with semen quality among lead smelter workers. Am J Ind Med. 1998; 34(5): 464-69.
7. Telisman S, Cvitkovic P, Jurasovic J, Pizent A, Gavella M, Rocic B. Semen quality and reproductive endocrine function in relation to biomarkers of lead, cadmium, zinc and coopper in men. Environ Health Perspect. 2000;108(1): 45-52.
8. Rice DC. Behavioral effects of lead: commonalities between experimental and epidemiologic data. Environ Health Perspect. 1996;104(2): 1-2.
9. Benoff S, Jacob A, Hurley IR. Male infertility and environmental exposure to lead and cadmium. Hum Reprod Update. 2000; 6(2): 107-21.
10. Chia SE, Ong CN, Lee ST, Tsakok FH. Blood concentration of lead cadmium, mercury, zinc and copper and human semen parameters. Arch Androl. 1992; 29(2): 177:83.
11. Leke RJ, Oduma JA, Bassol-Mayagoitia S, Bacha AM, Grigor, KM. Regional and geographical variations in infertility, Effects of environmental, cultural and socioeconomic factors. Environ Health Perspect. 1993; 101(Suppl 2): 73-80.
12. Zavos E, Correa J, Karagounis C, Ahparaki A, Phoroglou C, Hicks C, et al. An electron microscope study of the axonemal ultrastructure in human spermatozoa from male smokers and nonsmokers. Fertil Steril. 1998; 69(3): 430-4.
13. Tong S, von Schinnding YE, Prapamontol T. Environmental lead exposure: a public health problem of global dimensions. Bull World Health Organ. 2000; 78(9): 1068-77.
14. Bonde J, Kolstad H. Fertility of Danish battery workers exposed to lead. Int J Epidemiol. 1997; 26(6): 1281-28.
15. Chiang HC, Chang PY. [Lead exposure among Kaohsiung traffic policemen]. Gaoxiong Yi Xue Ke Xue Za Zhi. 1989; 5(6): 314-19. [in Chinese]
16. Kamal AA, Eldamaty SE, Faris R. Blood lead level of Cairo traffic policemen. Sci Environ. 1991; 105: 165-70.
17. Löfstedt H, Seldén A, Storéus L, Bodin L. Blood lead in Swedish police officers. Am J Ind Med. 1999; 35(5): 519-22.
18. Pala K, Akiş N, Izgi B, Gücer S, Aydin N, Aytekin H. Blood lead levels of traffic policemen in Bursa, Turkey. Int J Hyg Environ Health. 2002; 205(5): 361-65.
19. Cohen J, Gilligan A, Esposito W, Schimmel T, Dale B. Ambient air and its potential effects on conception in vitro. Hum Reprod. 1997; 12(8): 1742-49.
20. Srianujata J. Lead--the toxic metal to stay with human. J Toxicol Sci. 1998; 23(Suppl 2): 237-40.
21. Sanin L.H, Gonzales-Cossio T, Romieu I, Hernandez-Ávila M. Acumulación de plomo en hueso y sus efectos en la salud. Rev. Salud Publica Mex. 1998; 40(4): 359-68.
22. Ramirez AV, Paucar JC, Medina JM. Plomo sanguíneo em los habitantes de cuatro localidades peruanas. Rev Panam Salud Publica. 1997; 1(5): 344-48.
23. Vega J, De Coll J, Lermo J, Escobar J, Diaz M, Castro J. Niveles intelectuales y ansiedad en niños com intoxicación plúmbica crónica. Colegio Maria Reiche. Callao-Perú 2002. An Fac Med (Lima). 2005; 66(2): 142-47.
24. Goering PL. Lead protein interactions as a basis for lead toxicity. Neurotoxicology 1993; 14(2-3): 45-60.
25. Landrigan PJ, Boffetta P, Apostoli P. The reproductive toxicity and carcinogenicity of lead: A critical review. Am J Ind Med. 2000; 38(3): 231-43.
26. Rubio J, Riqueros MI, Gasco M, Yucra S, Miranda S, Gonzales GF. Lepidium meyenii (Maca) reversed the lead acetate induced -- damage on reproductive function in male rats. Food Chem Toxicol. 2006; 44(7): 1114-22.
27. Pinon-Lataillade G, Thoreux-Manlay A, Coffigny H, Masse R, Soufir JC. Reproductive toxicity of chronic lead exposure in male and female mice. Hum Exp Toxicol. 1995; 14(11): 872-78.
28. Wadi SA. Ahmad G. Effects of lead on the male reproductive system in mice. J Toxicol Environ Health A. 1999; 56(7): 513-21
29. Moreira EG, Rosa GJ, Barros SB, Vassilieff VS, Vassillieff I. Antioxidant defense in rat brain regions after developmental lead exposure. Toxicology. 2001; 169(2): 145-51.
30. Adonaylo VN, Oteiza PI. Lead intoxication: antioxidant defenses and oxidative damage in rat brain. Toxicology. 1999; 135(2-3): 77-85.
31. Patra RC, Swarup D, Dwivedi SK. Antioxidant effects of alpha tocopherol, ascorbic acid and L-methionine on lead induced oxidative stress to the liver, kidney and brain in rats. Toxicology. 2001; 162(2): 81-8.
32. Hsu PC, Hsu CC, Liu MY, Chen LY, Guo YL. Lead-induced changes in spermatozoa function and metabolism. J Toxicol Environ Health. 1998; 55(1): 45-64.
33. Hsu PC, Liu MY, Hsu CC, Chen LY, Leon Guo Y. Lead exposure causes generation of reactive oxygen species and functional impairment in rat sperm. Toxicology 1997; 122(1-2): 133-43.
34. Vaziri ND, Ding Y. Effect of lead on nitric oxide synthase expression in coronary endothelial cells: role of superoxide. Hypertension. 2001; 37(2): 223-26.
35. Ames BN, Shigenaga MK, Hagen TM. Oxidants, antioxidants and the degenerative diseases of aging. Proc Nat Acad Sci USA. 1993; 90(17): 7915-22.
36. Beckman JS, Beckman TW, Chen J, Marshall PA, Freeman BA. Apparent hydroxyl radical production by peroxynitrite: Implications for endothelial injury from nitric oxide and superoxide. Proc Nat Acad Sci USA. 1990; 87(4): 1620-24.
37. Radi R, Beckman JS, Bush KM, Freeman BA. Peroxynitrite oxidation of sulfhydryls. The cytotoxic potential of superoxide and nitric oxide. J Biol Chem. 1991; 266(7): 4244-50.
38. Salgo M, Bermúdez E, Squadrito GL, Pryor WA. Peroxynitrite causes DNA damage and oxidation of thiols in rat thymocytes. Arch Biochem Biophys. 1995; 322(2): 500-5.
39. Batra N, Nehru B, Bansal MP. The effect of zinc supplementation on the effects of lead on the rat testis. Reprod Toxicol. 1998; 12(5): 535-40.
40. Sandoval M, Okuhama N, Ángeles F, Melchor V, Condezo L, Lao J, et al. Antioxidant activity of the cruciferous vegetable Maca (Lepidium meyenii). Food Chem. 2002; 79(2): 207-13.
41. Sandoval M, Ronzio RA, Muanza DN, Clark DA, Miller MJS. Peroxynitrite-induced apoptosis in epithelial (T84) and macrophage (RAW264.7) cell lines: Effect of legume-derived polyphenols (Phytolens). Nitric Oxide. 1997; 6(1): 476-83.
42. Sandoval-Chacón M, Thompson JH, Zhang XJ, Liu X, Mannick EE, Sadowska-Krowicha H, et al. Antiinflamatory actions of cats claw: the role of NF-kappa B. Aliment Pharmacol Ther; 1998; 12(12): 1279-89.
43. Sandoval M, Charbonnet RM, Okuhama NN, Roberts J, Krenova Z, Trentacosti AM, et al. Cats claw inhibits TNF-alpha production and scavenges free radicals: role in cytoprotection. Free Radic Biol Med. 2000; 29(1), 71-78.
44. Jacobs DE. The health effects of lead on the human body. Lead Persp. 1996; 104:10-12.
45. Sanín LH, Gonzáles-Cossío T, Romieu I, Hernández-Ávila M. Acumulación de plomo en hueso y sus efectos en la salud. Rev Salud Publica Mex. 1998; 40(4): 359-68.
46. El-Zohairi EA, Youssef AF, Abul-Nasr SM, Fahmy IM, Salem D, Kahil AK, et al. Reproductive hazards of lead exposure among urban Egyptian men. Reprod Toxicol. 1996; 10(2): 145-51.
47. Marchlewicz M. [Effectiveness of blood-testis and bloodepididymis barriers for lead]. Ann Acad Med Stetin. 1994; 40: 37- 51. [in Polish]
48. Robins TG, Bornman MS, Ehrlich IR, Cantrell AC, Piennaar -E, Vallabh J, et al. Semen quality of men employed in a South African lead acid battery plant. Am J Ind Med. 1997; 32(4): 369-76.
49. Lin S, Hwang SA, Marshall EG, Stone R, Chen J. Fertility rates among lead workers and professional bus drivers: a comparative study. Ann Epidemiol. 1996; 6(3): 201-8.
50. Sokol RZ. The effect of duration of exposure on the expression of lead toxicity on the male reproductive axis. J Androl. 1990;11(6): 521- 6
51. Aziz N, Fear S, Taylor C, Kisland CH, Lewis-Jones I. Human sperm head morphometric distribution and its influence on human fertility. Fertil Steril. 1998; 70(5): 883-91.
52. Sitarek K, Szymezak W, Berlinska B. [Evaluation of reproductive disorders in men occupational exposed to lead]. Med Pr. 1998; 49(2): 137-45. [in Polish]
53. del Carpio A. Exposición ocupacional a plomo y su relación con la infertilidad masculina. [Tesis doctoral]. Lima: Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia; 2004.
54. Chowdhury AR, Dewan A, Gandhi DN. Toxic effect of lead on the testes of rat . Biomed Biochim Acta. 1984; 43(1): 95-100.
55. Apostoli P, Kiss P, Porru S, Bonde JP, Vanhoorne M. Male reproductive toxicity of lead in animals and humans. ASCLEPIOS Study Group Occup Environ Med. 1988; 55(6): 364-74.
56. Escalante G. La transiluminación como método para evaluar la espermatogénesis: efecto del plomo en ratas macho adultas. [Tesis de licenciatura]. Lima. Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia; 2001
57. Perry MJ. Effects of environmental and occupational pesticide exposure on human sperm: a systematic review. Hum Reprod Update. 2008; 14(3): 233-42.
58. Brandt VA, Moon S, Ehlers J, Methner MM, Struttmann T. Exposure to endosulfan in farmers: two case studies. Am J Ind Med 2001; 39(6): 643-49.
59. Bonde JP. Occupational risk to male reproduction. G Ital Med Lav Ergon. 2002; 24(2): 112-17.
60. Claman P. Men at risk: occupation and male infertility. Fertil Steril 2004;81(Suppl 2):19–26.
61. Sharpe RM, Irvine DS. How strong is the evidence of a link between environmental chemicals and adverse effects on human reproductive health. BMJ. 2004; 328(7437): 447-51.
62. Fleming LE, Gomez-Marin O, Zheng D, Ma F, Lee D. National Health Interview Survey mortality among US farmers and pesticide applicators. Am J Ind Med. 2003; 43(2): 227-33.
63. Alavanja MC, Hoppin JA, Kamel F. Health effects of chronic pesticide exposure: cancer and neurotoxicity. Annu Rev Public Health. 2004; 25:155-97.
64. Rosenthal E. The tragedy of Tauccamarca: a human rights perspective on the pesticide poisoning deaths of 4 children in Peruvian Andes. Int J Occup Environ Health. 2003; 9(1):53-58.
65. Albert LA. Contaminantes ambientales y criterios de evaluación. En: Albert LA(Ed): Introducción a la toxicología ambienta. México DF: Centro Panamericano de Ecología Humana y Salud; 1997. p. 101-12.
66. Garaj-Vrhovac V, Zeljezic D. Assessment of genome damage in a population of Croatian workers employed in pesticide production by chromosomal aberration analysis, micronucleus assay and Comet assay. J Appl Toxicol. 2002; 22(4): 249-55.
67. Ferrer A. Intoxicación por plaguicidas. Anales Sis San Navarra. 2003; 26 (Supl1): 155-71.
68. Larsen SB, Giwercman A, Spano M, Bonde JP. A longitudinal study of semen quality in pesticide spraying Danish farmers. The ASCLEPIOS Study Group. Reprod Toxicol. 1998; 12(6): 581-89.
69. Schneider F, Steenland K, Hernandez B, Wilson B, Krieger R, Spencer J, et al. Monitoring peach harvest workers exposed to azinphosmethyl residues in sutter county, California, 1991. Environ Health Perspect. 1994; 102(6-7): 580-85.
70. Aprea C, Sciarra G, Orsi D, Boccalon P, Sartorelly P, Sartorelly E. Urinary excretion of alkylphosphates in the general population (Italy). Sci Total Environ. 1996; 177(1-3): 37-41.
71. Yucra S, Steeland K, Chung A, Choque F, Gonzales GF. Diakyl phosphate metabolites of organophosphorus in applicators of agricultural pesticides in Majes - Arequipa (Peru). J Occup Med Toxicol. 2006; 1:27.
72. Ecobichon DJ. Toxic effects of pesticides. In: Klassen CD (Ed): Casarett and Doulls toxicology, 5th Ed. New York: Mc Graw Hill; 1996. p. 643-98. 73. Recio-Vega R, Ocampo-Gómez G, Borja Aburto VH, Moran- Martínez J, Cebrian-García ME. Organophosphorus pesticide exposure decreases sperm quality: association between sperm parameters and urinary pesticide levels. J Appl Toxicol. 2008; 28(5): 674-80.
74. Maroni M, Colosio C, Ferioli A, Fait A. Biological monitoring of pesticide exposure: a review. Introduction. Toxicology. 2000; 143(1): 1-118.
75. McCauley LA, Lasarev MR, Higgins G, Rothlein J, Muniz J, Ebbert C, Phillips J. Work characteristics and pesticide exposures among migrant agricultural families: a community-based research approach. Environ Health Perspect. 2001; 109(5): 533-36.
76. Heano S, Finkelman J, Albert L, De Koning H. Plaguicidas y salud en las Américas. Washington DC: OPS; 1993.
77. Azaroff L. Biomarkers of exposure to organophosphorus insecticides among farmers families in rural El Salvador: Factor associated with exposure. Environ Res. 1999; 80:138-47
78. Reigart JR, Roberts JR. Recognition and Management of pesticide poisoning. 5th ed. Washington DC: Environmental Protection Agency; 1999.
79. Yucra S. Calidad seminal en trabajadores agrícolas (aplicadores) expuestos a plaguicidas órganofosforados de la irrigación Majes- Arequipa. [Tesis de maestría]. Lima. Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia; 2005.
80. Jaga K, Dharmani C. Sources of exposure to and public health implications of organophosphate pesticides. Rev Panam Salud Publica. 2003; 14(3):171-85
81. Wessels D, Barr DB, Mendola P. Use of biomarkers to indicate exposure of children to organophosphate pesticides: implications for a longitudinal study of children´s environmental health. Environ Health Perspect. 2003; 111(16): 1939-46
82. McCurdy SA, Hansen ME, Weisskopf CP, Lopez RL, Schneider F, Spencer J, et al.. Assessment of Azinphosmethyl exposure in California peach harvest workers. Arch Environ Health. 1994; 49(4): 289-96
83. Yucra S, Rubio J, Gasco M, Gonzales C, Steenland K, Gonzales GF. Semen quality and reproductive sex hormone levels in Peruvian pesticide sprayers. Int J Occup Environ Health. 2006; 12(4):355-61.
84. Pires DX, Caldas ED, Recena MC. Pesticide poisoning in Dourados, Mato Grosso do Sul State, Brazil, 1992/2002. Cad Saude Publica. 2005; 21(3): 804-14.
85. Coronado GD, Thompson B, Strong L, Griffith WC, Islas I. Agricultural task and exposure to organophosphate pesticides among farmworkers. Environ Health Perspect. 2004; 112(2): 142-47.
86. Sanchez-Peña LC, Reyes BE, López-Carrillo L, Recio R, Morán- Martinez J, Cebrian ME, et al. Organophophorous pesticida exposure alters sperm chromatin structure in Mexican agricultural workers. Toxicol appl Pharmacol. 2004; 196(1): 108-13.
87. Bonde J. Environmental factors. In: Comhaire FH (ed). Male infertility, clinical investigation, cause evaluation and treatment. London: Chapman and Hall; 1996. p. 267-84.
88. Spira A, Multigner L. The effect of industrial and agriculture pollution on human spermatogenesis. Hum Reprod. 1998; 13(8): 2041-42.
89. Sarkar R, Mohanakumar KP, Chowdhury M. Effects of an organophosphate pesticide, quinalphos, on the hypothalamopituitary- gonadal axis in adult male rats. J Reprod Fertil. 2000; 118(1): 29-38.
90. Mathew G, Vijayalaxmi KK, Abdul Rahiman M. Methyl parathioninduced sperm shape abnormalities in mouse. Mutat Res. 1992; 280(3): 169-73.
91. Thonneau P, Spira A. Prevalence of infertility: international data and problems of measurement. Eur J Obstet Gynecol Reprod Biol. 1991; 38(1): 43-52.
92. Irvine DS. Epidemiology and aetiology of male infertility. Hum Reprod. 1998; 13(Supp.1): 33-44.
93. Oliva A, Spira A, Multigner L. Contribution of environmental factors to the risk of male infertility. Hum Reprod. 2001; 16(8): 1768-76.
94. Sobarzo C, Bustos-Obregón E. Sperm quality in mice acutely treated with parathion. Asian J Androl. 2000; 2(2): 147-50.
95. Contreras HR, Badilla J, Bustos-Obregón E. Morphofunctional disturbances of human sperm after incubation with organophosphorate pesticides. Biocell. 1999; 23(2): 135-41.
96. Choudhary N, Goyal R, Joshi SC. Effect of malathion on reproductive system of male rats. J Environ Biol. 2008; 29(2): 259-62.
97. Bustos-Obregón E, Gonzáles-Hormazabal P. Effect of a single dose of malathion on spermatogenesis in mice. Asian J Androl. 2003; 5(2): 105-7.
98. Bustos-Obregón E, Gonzáles-Hormazabal P. Mice testicular damage elicited by malathion. Int J Morphol. 2003; 21(2): 155-59.
99. Bustos-Obregón E, Yucra S, Gonzáles GF. Lepidium meyenii (Maca) reduces spermatogenic damage induced by a single dose of malathion in mice. Asian J Androl. 2005; 7(1): 71-76.
100. Turner KJ, Barlow NJ, Struve MF, Wallace DG, Gaido KW, Dorman DC, et al. Effects of in utero exposure to the organophosphate insecticide fenitrothion on androgen-dependent reproductive |development in the Crl:CD (SD) BR rat. Toxicol Sci. 2002; 68(1):174-83
101. Grover IS, Malhi PK. Genotoxic effects of some organophosphorus insecticides. I. Induction of micronuclei in bone marrow cells in rats. Mutat Res. 1985; 155(3): 131-34.
102. Recio R, Robbins WA, Borja-Aburto V, Moran-Martinez J, Froines JR, Hernandez RM, Cebrian ME. Organophosphorous pesticide increases the frequency of sperm sex null aneuploidy. Environ Health Perspect. 2001; 109(12): 1237-40.
103. Sinawat S. The Environmental impact on male fertility. J Med Assoc Thai. 2000; 83(8): 880-5.
104. Hougaard KS, Hannerz H, Feveile H, Bonde JP, Burr H. Infertility among women working in horticulture. A follow-up study in the Danish Occupational Hospitalization Register. Fertil Steril. 2008; 91(4): 1385-87.
105. Tarbah FA, KardeL B, Pier S, Temme O, Daldrup T. Acute poisoning with phosphamidon: determination of dimethyl phosphate (DMP) as a stable metabolite in a case of organophosphate insecticide intoxication. J Anal Toxicol. 2004; 28(3):198-203.
106. Padungtod CH, Savitz D, Overstreet JW, Christiani DC, Ryan LM, Xu X. Occupational pesticide exposure and semen quality among chinese workers. J Occup Environ Med. 2000; 42(10); 982-92.
107. Gonzales GF. Andrología: fertilidad e Infertilidad. Lima: Instituto de Investigación de la Altura, Universidad Peruana Cayetano Heredia; 1992.
108. Vingaard AM, Hnida C, Breinholt V, Larsen JC. Screening of selected pesticide for inhibition of CYPi19 aromatase activity in vitro. Toxicol In Vitro. 2000; 14(2): 227-34.
109. Padungtod C, Lasley BL, Christiani DC, Ryan LM, Xu X. Reproductive hormone profile among pesticides factory workers. J Occup Environ Med. 1998; 40(12): 1038-47.
110. Recio R, Ocampo-Gómez G, Morán-Martínez J, Borja-Aburto V, López-Cervantes M, Uribe M, et al. Pesticide exposure alters follide – Stimulating hormone levels in Mexican agricultural workers. Environ Health Perspect. 2005; 113(9): 1160-63.
111. Mármol-Maneiro L, Fernández- D´Pool J, Sanchez B, Sirit Y. Perfil seminal en trabajadores expuestos a plaguicidas inhibidores de la colinesterasa. Invest Clin. 2003; 44(2):105-17.
112. Farag AT, Eweidah MH, El-Okazy AM. Reproductive toxicology of acephate in male mice. Reprod Toxicol. 2000; 14(5): 457-62.
113. Chanda SM, Harp P, Liu J, Pope CN. Comparative developmental and maternal neurotoxicity following acute gestational exposure to chlorpyriphos in rats. Toxicol Environ Health. 1995; 44(2): 189-202.
114. Astroff A, Freshwater K, Eingenberg D. Comparative organophosphate-induced effects observed in adult and neonatal Sprague-dawley rats during the conduct of multigeneration toxicity studies. Reprod Toxicol. 1998; 12(6): 619-45.
115. Espinoza R, Hernández-Ávila M, Narciso J, Castañaga C, Moscoso S, Ortiz G, et al. Determinants of blood-lead levels in children in Callao and Lima metropolitan area. Salud Publica Mex. 2003; 45(Suppl 2): S209-19.
_______________
Correspondencia:
Sandra Yucra.
Dirección: Honorio Delgado 430, Lima31. P.O. Box 1843.
Teléfono: (511) 482-1195
Correo electrónico: 23411@upch.edu.pe
Recibido: 10-10-08
Aprobado: 12-11-08