Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.26 no.1 Lima Jan./mar. 2009
Evaluación de dos técnicas analíticas para la especiación de arsénico en aguas superficiales del sur del Perú
Evaluation of two analytical techniques for speciation of arsenic in surface waters from Southern Peru
Manuel Chávez1
1 Magister en Química, Centro Nacional de Salud Ocupacional y Protección del Ambiente para la Salud, Instituto Nacional de Salud. Lima, Perú.
RESUMEN
El arsénico es altamente tóxico, la exposición crónica a este elemento causa diversos daños en la salud de las personas, en el Perú se han reportado niveles elevados, sobre todo en ríos de la costa sur. Objetivo. Evaluar dos técnicas analíticas de especiación de las dos formas de arsénico inorgánico en agua fluvial de Tacna, en el sur del Perú. Materiales y métodos. Se desarrolló un estudio comparativo entre la técnica de separación por resina de intercambio aniónico y la cromatografía iónica para la especiación del arsénico (V) y arsénico (III) en muestras de agua de cuatro ríos de la vertiente del Pacífico en dos distritos de la región Tacna. La cantidad de arsénico total se determinó con el sistema de inyección de flujo asistido con absorción atómica. Resultados. Se obtuvo un buen grado de separación en ambos procedimientos, sin embargo, la técnica de resinas de intercambio aniónico tiene un límite de detección inferior que la cromatografía iónica, 2,0 μg/L y 32 μg/L, respectivamente. En cuatro de las seis muestras se obtuvieron valores superiores a los recomendados por la Agencia de Protección Ambiental de los Estados Unidos, y en ellas se logró determinar las cantidades de arsénico (III) y arsénico (V). Conclusiones. La técnica de separación por resina de intercambio aniónico tiene mayor sensibilidad de detección de arsénico que la cromatografía iónica y permite un alto grado de especiación del arsénico inórganico en muestras de agua fluvial.
Palabras clave: Arsenicales; Cromatografía por intercambio iónico; Aguas superficiales; Contaminación de ríos; Salud ambiental; Perú (fuente: DeCS BIREME).
ABSTRACT
It is widely known that arsenic is highly toxic to humans, and the chronic exposure to this element produces various damages to the health of people. In Peru have been reported particularly high levels in rivers of the south coast. Objective. Evaluate two analytical techniques of speciation of the two forms of inorganic arsenic in river water of Tacna, in southern Peru. Material and methods. Developed a comparative study of the technique of separation by anion-exchange resin and ion chromatography for the speciation of arsenic (V) and arsenic (III) in water samples from four rivers of the Pacific slope in two districts of the region Tacna. The total amount of arsenic was determined with flow injection system with atomic absorption attended. Results. We obtained a good degree of separation in both procedures, however, the technique of anionic exchange resins have a lower detection limit of ion chromatography, 2.0 mg/L and 32 mg/L, respectively. In four of the six samples were higher than those recommended by the Environmental Protection Agency of the United States, and they succeeded in determining the amounts of arsenic (III) and arsenic (V). Conclusions. Both techniques can be considered applicable for different types of water; nevertheless, the technique of separation by anion-exchange resin has higher detection sensitivity than the technique of separation by arsenic ion chromatography; and allows a high degree of speciation of inorganic arsenic in samples of river water.
Key words: Arsenicals, Chromatography, ion exchange; Surface waters; River pollution; Environmental health; Peru. (Source: MeSH NLM).
INTRODUCCIÓN
Dentro de los objetivos de desarrollo del milenio el aumento de la proporción de la población con acceso sostenible a mejores fuentes de abastecimiento de agua se enmarca como prioritario, sustentado en la repercusión directa sobre la mejora de la salud global (1,2). Sin embargo, la contaminación por especies orgánicas como bacterias y virus (3), y elementos inórganicos, como los metales pesados es una grave amenaza para la humanidad (4).
En este contexto, el arsénico, si bien es un elemento ubicuo –vigésimo en la corteza terrestre, décimo segundo en el agua del mar y décimo cuarto en el cuerpo humano– es uno de los contaminantes con más alta toxicidad (5), reconocido como cancerígeno por el Instituto Nacional de Ciencias de Salud Ambiental de los Estados Unidos y una de las prioridades de investigación de la Organización Mundial de la Salud (6,7).
Si bien este elemento a bajas concentraciones puede ser producto de procesos naturales, como la meteorización de minerales o la actividad biológica, la posibilidad de fuentes antropogénicas es cada vez mayor, principalmente de la minería y la agricultura (5,8,9).
En las personas, las formas primarias de exposición al arsénico son por inhalación e ingesta de alimentos o agua, se ha demostrado en diversos grupos de edad y en distintas áreas del mundo, que este contacto crónico y en algunos casos agudo esta asociado con el desarrollo de cáncer de hígado, pulmones, vejiga, piel, riñones, útero, próstata, entre otros; asimismo, problemas de salud a nivel cardiovascular, dermatológico, pulmonar, inmunológico, hepáticos, neurológicos, reproductivo y endocrinológicos, además, se ha asociado con parto prematuro, abortos espontáneos, y morbimortalidad neonatal e infantil (10-17), proponiéndose una relación dosis dependiente (15,18).
La legislación peruana considera 100 µg de arsénico por cada litro de agua, como el máximo nivel permisible (19), por su parte, la Agencia de Protección Ambiental de los Estados Unidos (EPA) a partir de enero del 2006 ha adoptado el nivel de 10 µg/L como nivel de contaminación máximo para aguas de consumo humano (20); similar a las leyes argentinas y a la Comunidad Económica Europea, por su parte, países como Chile, México, India, Taiwán y China lo estipulan en 50 µg/L (9).
Las investigaciones desarrolladas en distintas latitudes han reportado concentraciones de arsénico en aguas que varían desde los 100 µg/L hasta 2000 µg/L, siendo la situación de Bangladesh una de las más conocidas. No obstante, se estima que en varios países de Latinoamérica entre los que se incluyen Perú, Argentina, Bolivia, Chile, El Salvador, México y Nicaragua, son algo más de cuatro millones de personas que beben en forma permanente agua con niveles de arsénico que van en detrimento de su salud, condición que ha trascendido a ser un problema de salud pública (5,9,18,21-25). En Perú se han encontrado niveles altos de arsénico en aguas superficiales, principalmente en las regiones de Moquegua, Tacna y Lima (9,26).
La especiación de arsénico en muestras de agua fluvial, incluye tanto especies inorgánicas como orgánicas; sin embargo, las primeras son dominantes, sobre todo por la oxidación de sulfuro (24,27), presentándose fundamentalmente como arsénico (V) bajo la forma de arseniato AsO4-3, y como arsénico (III) bajo la forma de arsenito AsO3-3; las cantidades de cada especie dependen principalmente de las condiciones redox del agua, con los valores de pH de las aguas naturales. La especie arsenito se encuentra en su estado neutro, lo cual dificulta su remoción y la hace más móvil, ya que al ser neutro no se adsorbe en la mayoría de superficies minerales, como si lo hace el arseniato (9,28,29). La toxicidad depende del estado de oxidación, la estructura química, el estado físico, el tamaño de las partículas, la tasa de eliminación, la solubilidad en el medio biológico, la tasa de absorción en las células y el estado preexistente en el paciente (5). La Academia Nacional de Ciencias de los Estados Unidos reporta que la toxicidad del As+3 es diez veces mayor que la del As+5 y la dosis letal para adultos es de 1-4 mg As/kg (9,30). De allí que la especiación química de este elemento, sea de alta importancia, más aun, al permitir una planificación más efectiva de la remoción (27,31,32).
Son varias las técnicas que se recomiendan para la especiación de este metal, entre ellas, la espectroscopía de absorción atómica electrotérmica (33), la espectroscopía de absorción atómica asistida por la generación de hidruros en forma manual y en forma automática (34); más específicamente para el análisis de las dos formas en que se presenta el arsénico inorgánico en el agua, se ha desarrollado la separación con resinas de intercambio aniónico (8,35), y la cromatografía iónica (36-38), también se ha estudiado métodos para separarlos de otros metales como el cobre (39).
Con el objetivo de conocer la técnica para especiación de arsénico de mayor efectividad en nuestro medio, se comparó la separación con resinas de intercambio iónico y la cromatografía iónica, con el propósito de postular su posterior implementación en la evaluación de aguas superficiales en nuestro país, asimismo, se analizó las concentraciones del metal en aguas fluviales de la zona costera más septentrional del Perú.
MATERIALES Y MÉTODOS
TIPO Y ÁREA DE ESTUDIO
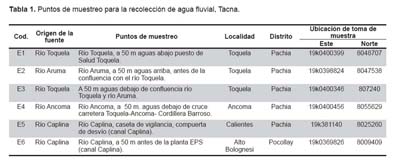
Se desarrolló un estudio transversal comparativo entre dos técnicas de especiación de arsénico inorgánico sobre muestras de agua de cuatro ríos en dos distritos de la región Tacna en el sur del Perú durante el año 2007, donde se encuentren los ríos con mayores niveles de arsénico de nuestro país (Figura 1). En la Tabla 1 se presentan los lugares específicos donde se obtuvo las muestras de agua para efectuar el estudio.
RECOLECCIÓN, PREPARACIÓN Y TRANSPORTE DE MUESTRAS
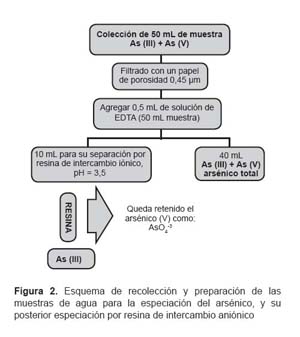
Una porción de la muestra de agua fue filtrada en campo con un filtro de 0,45 μm, colectándose 50 mL del resultante, a ello se le agregó 500 μL de EDTA 0,25M para evitar la oxidación del arsénico III por parte del hierro II, se hizo pasar 10 mL por la columna con la resina, para posteriormente, depositarlo en tubos y transportarlo al laboratorio con las medidas de refrigeración recomendadas (Figura 2).
PROCEDIMIENTOS DIAGNÓSTICOS
Análisis de arsénico total. Se usó un sistema de inyección de flujo acoplado a un equipo de absorción atómica (FIAS-AA), cuyos parámetros instrumentales usados se aprecian en la tabla 2. Especiación de arsénico por resina de intercambio aniónico. Esta técnica se basa en el intercambio iónico de los grupos acetato, presentes inicialmente en la resina por los grupos arseniato (AsO4-3), intercambio que es efectivo a un determinado pH, donde solamente la especie arsénico (V) se encuentra cargado como iones arseniato (AsO4-3), mientras que el arsénico (III) se mantiene neutro como ácido arsenioso (H3AsO3) y pasa a través de la resina sin sufrir retención alguna (8,35,40).
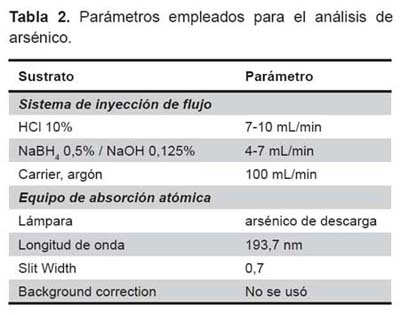
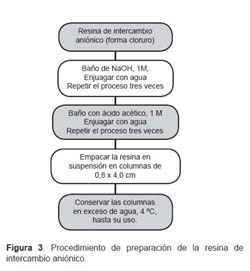
En esta investigación, se modificó la resina comercial en la forma cloruro por el acetato a fin de lograr un mayor intercambio, debido a que el grupo acetato tiene la propiedad de formar un sistema buffer controlando el pH en el cual se produce la separación de ambas especies de arsénico (Figura 3).
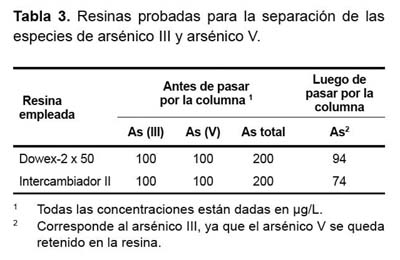
Una vez que el arsénico (V) fue retenido en la resina, se analizó la muestra que logró atravesarla con el mismo método empleado en el análisis del arsénico total (FIAS-AA), este resultado correspondería sólo a la concentración de arsénico (III); otra porción de la muestra que no ha pasado por la resina se analizó también por la técnica de FIAS-AA para arsénico total, al restar la concentración de arsénico (III) a este último resultado obtenemos el contenido de arsénico (V) en la muestra (Tabla 3). Para evaluar la eficiencia de la separación de las especies As(III) y As(V) se usó una solución control que contiene 100 µg/L de As(III) y 100 µg/L As(V); además de dos tipos de resinas comerciales: la resina denominada Dowex-2 x 50 y la resina denominada Intercambiador II .
Especiación de arsénico por cromatografía iónica. La muestra con la mezcla de arsenito y arseniato son inyectadas al equipo de cromatografía iónica, luego son arrastradas a través de un sistema de capilares a presiones elevadas donde pasan por algunos procesos como la degasificación de la muestra, la neutralización de los iones hidronio (H3O+) e hidroxilo (OH-), llegando luego a una columna cromatográfica, la cual separa las distintas especies iónicas, que son localizadas por un detector de conductividad de alta sensibilidad 36-38.
Se empleó un equipo de cromatografía iónica DIONEX ®, modelo IC–2000, inyectándose por separado estándares de As (III) y As (V), buscando apreciar la diferencia de los espectros de ambas especies de arsénico.
RESULTADOS
ESPECIACIÓN POR RESINAS DE INTERCAMBIO ANIÓNICO
La evaluación de la efectividad en la separación de las especies de arsénico (III) y arsénico (V), en las muestras realizadas con las resinas de intercambio aniónico, la resina Dowex-2x50 logró un mejor grado de separación que el Intercambiador II, con una efectividad del 94% y 74%, respectivamente (Tabla 3).
ESPECIACIÓN CON CROMATOGRAFÍA IÓNICA
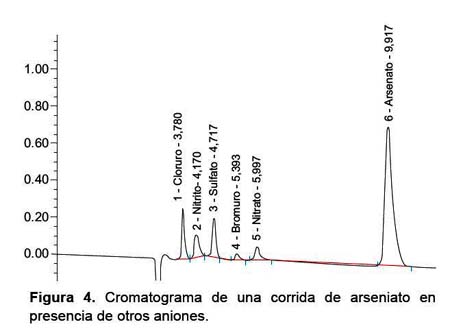
De las dos especies de arsénico que fueron inyectadas en el equipo, el arsénico (V) dio un pico notorio a un tiempo de retención de 9,92 minutos (Figura 4), sin embargo, el arsénico (III) no fue encontrado. El pico de la especie detectada está bastante separado de los otros aniones que comúnmente se encuentran en aguas como cloruro, nitrito, sulfato, bromuro, nitrato, los cuales salen a tiempos de retención menores.
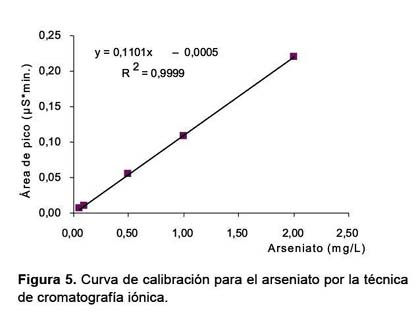
A partir de las áreas de los picos del arseniato se ha podido construir una curva de calibración, para ello se prepararon estándares de 0,05; 0,10; 0,50 y 2 mg/l de As (V) en agua ultrapura (Figura 5); de manera similar a la técnica de especiación por resinas de intercambio aniónico, la cantidad de As (III) se obtiene al restar del As total (obtenida por la técnica de FIAS-AA) lo obtenido de As (V) con esta técnica. Los límites de detección se presentan en la Tabla 4.

NIVELES DE ARSÉNICO EN LOS PUNTOS DE MUESTREO
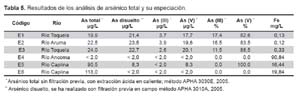
Al analizar las muestras obtenidas en los ríos estudiados, el arsénico total y arsénico disuelto en los cuatro primeros puntos (E1- E4) son muy cercanas; sin embargo, en los dos últimos (E5, E6) la cantidad de arsénico disminuye de 90,5 a 8,3 en E5 y de 118 hasta ser no detectable en E6. En la Tabla 5 se observan estos resultados, incluyendo la especiación del arsénico (III) y arsénico (V) en el arsénico disuelto, tanto en valores absolutos de la concentración encontrada como en frecuencia relativa entre esas dos especies. Es importante mencionar que en las muestras de los puntos E4 y E6 no se ha podido realizar la especiación debido a que la cantidad de arsénico disuelto es mínima y no se ha podido detectar (Tabla 5).
Asimismo, en esta tabla, se exhiben los valores de hierro total, nótese que en los tres primeros puntos de muestreo la densidad de hierro es inferior a 1 mg/L, no obstante, las otras tres muestras presentan niveles superiores de hierro, sobre todo la muestra E4, esto sugeriría una potencial relación inversa entre las cantidades de arsénico disuelto y de hierro.
DISCUSIÓN
La especiación de arsénico con resinas de intercambio aniónico ha mostrado una separación efectiva en ambas especies, no obstante, en este estudio se cambió la resina de su forma inicial como cloruro a su forma acetato, este último le da propiedades amortiguadoras a la superficie, favoreciendo un pH de separación óptimo entre 3 y 4 (8,36,40).
Mediante la técnica de cromatografía iónica, no se logró detectar el arsénico (III), esto se explicaría porque en el equipo todas las soluciones se llevan a pH que oscila entre 7 y 7,5; ambiente donde el arsénico (III) se mantiene en su forma neutra sin carga como ácido arsenioso (H3AsO3), de modo que no ha existido retención alguna en la columna, no se generó señal en el detector de conductividad y, por ende, no se produjo pico en el espectro. Por otro lado, el arsénico (V) se encuentra bajo su forma de arseniato (AsO4-3) y debido a su carácter trivalente es retenida más tiempo por la columna, favoreciéndose su separación de los otros aniones que se encuentran comúnmente en las muestras de agua –como cloruro, sulfato y nitrato– y siendo un proceso sin interferencias, por lo que puede ser aplicada para la detección de esta especie (9,28,31,36,37).
El límite de detección es de alta significación, ante menores valores existe una mayor sensibilidad para la cuantificación de este metal pesado, en este estudio el método de resinas de intercambio iónico tiene un menor límite de detección que el método de cromatografía iónica para el arsénico (V), esto se explica por el uso de FIAS-AA en la primera y de un detector de conductividad en la segunda, con límites de detección de 2,0 μg/L y 32 μg/L, respectivamente. Si bien, la cromatografía no deja de ser una alternativa válida cuando no se requiera determinar concentraciones a nivel de trazas, su capacidad de detección está por encima de los niveles considerados como perjudiciales por la USEPA y por la Comunidad Europea (1,9,20,32).
A pesar de que al considerar la legislación peruana sólo el punto de muestra E6 en el río Caplina superaría a los 100 μg/L permisibles, las concentraciones de arsénico total encontradas, a excepción de las muestras recolectadas en el río Ancoma, se encuentran en niveles no recomendados por otros estamentos internacionales (7,9,20). Asimismo, es en el río Caplina donde se evidencian grandes diferencias entre el arsénico total y el arsénico disuelto, lo que apunta a que el metal estaría sobre partículas suspendidas que se separarían en el momento del filtrado.
A pesar del reducido número de muestras, se observa una potencial relación entre la cantidad de arsénico disuelto y de hierro, esto como producto de la propiedad del hierro para enlazarse en el arsénico y precipitarlo, inclusive algunos métodos de remoción se fundamentan en esta propiedad (41-43).
A pesar de las limitaciones de este estudio, se encuentran resultados valiosos, que dan pie a investigaciones posteriores, no sólo en la evaluación de los niveles de arsénico en aguas fluviales de otras regiones mediante la técnica de intercambio aniónico, sino también, partiendo de que existe una fracción de la población en riesgo de consumo crónico del metal, se proponen pesquisas epidemiológicas que incluyan la frecuencia de consumo humano de esas aguas, la determinación de arsénico en sangre, cabello y uñas de la población, así como, la medición de otros efectos posibles.
AGRADECIMIENTOS
Al laboratorio de la Dirección General de Salud Ambiental y al laboratorio de sección Química de la Pontificia Universidad Católica del Perú por las facilidades brindadas durante el desarrollo del presente estudio, asimismo, agradecimiento a la biológa Juana Sosa Arias y a la ingeniera Marisol Mendoza quienes laboran en la Dirección de Ejecución en Salud Ambiental de Tacna por el apoyo y las facilidades ofrecidas.
Fuente de Financiamiento
Instituto Nacional de Salud.
Conflicto de Intereses
El autor declara no tener conflictos de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Hutton G, Bartram J. Global costs of attaining the Millennium Development Goal for water supply and sanitation. Bull World Health Organ. 2008; 86(1): 13-19.
2. Bartram J, Lewis K, Lenton R, Wright A. Focusing on improved water and sanitation for health. Lancet. 2005; 365(9461): 810-12.
3. Craun G, Calderon R. Observational epidemiologic studies of endemic waterborne risks: cohort, case-control, time-series, and ecologic studies. J Water Health. 2006; 4(Suppl2): 101-19.
4. Wahaab R, Badawy M. Water quality assessment of the River Nile system: an overview. Biomed Environ Sci. 2004; 17(1):87-100.
5. Mandal B, Suzuki K. Arsenic round the world: a review. Talanta. 2002; 58(1): 201-35.
6. The National Institute of Environmental Health Sciences. Report on carcinogens. 11 ed. North Caroline: U.S. Department of Health and Human Services, Public Health Service, National Toxicology Program; 2005.
7. World Health Organization. United Nations synthesis report on arsenic in drinking water. Geneva: WHO; 2001.
8. Bednar A, Garbarino J, Ranville J, Wildeman T. Preserving the distribution of inorganic arsenic species in groundwater and acid mine drainage samples. Environ Sci Technol. 2002; 36(10): 2213-18.
9. Castro de Esparza ML. Presencia de arsénico en el agua de bebida en América Latina y su efecto en la salud pública. In: International Congress: Natural Arsenic in Groundwaters of Latin America. Ciudad de México: 2006.
10. Mink P, Alexander D, Barraj L, Kelsh M, Tsuji J. Low-level arsenic exposure in drinking water and bladder cancer: a review and meta-analysis. Regul Toxicol Pharmacol. 2008; 52(3): 299-310.
11. States J, Srivastava S, Chen Y, Barchowsky A. Arsenic and cardiovascular disease. Toxicol Sci. 2009; 107(2): 312-23.
12. Wang C, Hsiao C, Chen C, Hsu LI, Chiou HY, Chen SY, et al. A review of the epidemiologic literature on the role of environmental arsenic exposure and cardiovascular diseases. Toxicol Appl Pharmacol. 2007; 222(3): 315-26.
13. Guha Mazumder DN. Chronic arsenic toxicity & human health. Indian J Med Res. 2008; 128(4): 436-47.
14. Guha Mazumder DN. Effect of drinking arsenic contaminated water in children. Indian Pediatr. 2007; 44(12): 925-27.
15. Yoshida T, Yamauchi H, Fan Sun G. Chronic health effects in people exposed to arsenic via the drinking water: doseresponse relationships in review. Toxicol Appl Pharmacol. 2004; 198(3): 243-52.
16. Ferreccio C, González C, Milosavjlevi V, Marshall G, Sancha A, Smith A. Lung cancer and arsenic concentrations in drinking water in Chile. Epidemiology. 2000; 12(12): 673-79.
17. Hopenhayn-Rich C, Browning S, Hertz-Picciotto I, Ferreccio C, Peralta C, Gibb G. Chronic arsenic and risk of infant mortality in two areas of Chile. Environ Health Perspect. 2000; 108(7): 667-73.
18. Yusof A, Salleh S, Wood A. Speciation of inorganic arsenic and selenium in leachates from landfills in relation to water quality assessment. Biol Trace Elem Res. 1999(71-72): 139-48.
19. Perú, Ministerio del Ambiente. Decreto Supremo Nº 002- 2008-MINAM. Estandares nacionales de calidad ambiental para agua. Lima: Ministerio del Ambiente; 2008.
20. U.S. Environmental Protection Agency. Fact Sheet: Drinking water standard for arsenic. Washington DC: EPA; 2001.
21. Sánchez-Rodas D, Gómez-Ariza J, Giráldez I, Velasco A, Morales E. Arsenic speciation in river and estuarine waters from southwest Spain. Sci Total Environ. 2005; 345(1-3): 207-17.
22. Caussy D, Priest N. Introduction to arsenic contamination and health risk assessment with special reference to Bangladesh. Rev Environ Contam Toxicol. 2008; 197: 1-15.
23. Zheng J, Hintelmann H, Dimock B, Dzurko M. Speciation of arsenic in water, sediment, and plants of the Moira watershed, Canada, using HPLC coupled to high resolution ICP-MS. Anal Bioanal Chem. 2003; 377(1): 14-24.
24. Sarmiento A, Nieto J, Casiot C, Elbaz-Poulichet F, Egal M. Inorganic arsenic speciation at river basin scales: the Tinto and Odiel rivers in the Iberian Pyrite Belt, SW Spain. Environ Pollut. 2009; 157(4): 1202-9.
25. Smith AL, E.; Rahman, M. Contamination of drinking-water by arsenic in Bangladesh: a public health emergency. Bull World Health Organ. 2000; 78(9): 1093-103.
26. Infante Fernández LM, Sosa Palomino SJ. Cuantificación espectrofotométrica de arsénico en aguas de consumo humano en la vertiente del río Rímac. [Tesis de licenciado]. Lima: Universidad Nacional Mayor de San Marcos; 1994.
27. Baeyens W, De Brauwere A, Brion N, De Gieter M, Leermakers M. Arsenic speciation in the River Zenne, Belgium. Sci Total Environ. 2007; 384(1-3): 409-19.
28. Cherry JA, Shaikh AU, Tallman DE, Nicholson RV. Arsenic species as an indicator of redox conditions in groundwater. J Hydrol. 1979; 43(1-4): 373-92
29. Meng X, Korfiatis G, Jing C, Christodoulatos C. Redox. Transformations of arsenic and iron in water treatment sludge during aging and TCLP extraction. Environ Sci Technol. 2001; 35(17): 3476-81.
30. Gil Hernández F. Toxicología laboral (III): metales pesados. In: Gil Hernández F (ed). Tratado de Medicina del Trabajo. Madrid: Masson; 2007.
31. Saqib K, Dennis C, Ganesh G, S G. Development of a field speciation method for inorganic arsenic species in groundwater. JAWWA. 2006; 98(5):128-41.
32. Tamaki S, Frankenberger W. Environmental biochemistry of arsenic. Rev Environ Contam Toxicol. 1992; 124(1): 79-110.
33. Walsh PR, Fasching FL, Dusche R. Matrix effects and their control during the flameless atomic absorption determination of arsenic. Anal Chem. 1976; 48(7): 1014-16.
34. Narasaki H, Ikeda M. Aumated determination of arsenic and selenium by atomic absorption spectrometry with hydride generation. Anal Chem. 1984; 56(12): 2059-63.
35. Wilkie J, Herin J. Rapid oxidation of geothermal arsenic(III) in streamwaters of the Eastern Sierra Nevada. Environ Sci Technol. 1998; 32(5): 657-62.
36. Hung DQ, Nekrassova O, Comptom RG. Analytical methods for inorganic arsenic in water: a review. Talanta 2004; 64(2): 269-77.
37. Le X, Ma M. Short-column liquid chromatography with hydride generation atomic fluorescence detection for the speciation of arsenic. Anal Chem. 1998; 70(9): 1926-33.
38. Ricci G, Shepard L, Colovos G, Hester N. Ion chromatography with atomic absorption spectrometric detection for determination of organic and inorganic arsenic species. Anal Chem. 1981; 53(4): 610-13.
39. Narváez J, Richter P, Toral M. Arsenic speciation in water samples containing high levels of copper: removal of copper interference affecting arsine generation by continuous flow solid phase chelation. Anal Bioanal Chem. 2005; 381(7): 1483-87.
40. Pizarro I, Gómez M, Cámara C, Palacios A. Arsenic speciation in environmental and biological samples extraction and stability studies. Analytica Chimica Acta. 2003; 495(1): 85-98.
41. Chen W, Parette R, Zou J, Cannon F, Dempsey B. Arsenic removal by iron-modified activated carbon. Water Res. 2007; 41(9): 1851-58.
42. Beak D, Wilkin R. Performance of a zerovalent iron reactive barrier for the treatment of arsenic in groundwater: Part 2. Geochemical modeling and solid phase studies. J Contam Hydrol. 2008 Dec 24. [Epub ahead of print]
43. Meng X, Korfiatis P, Bang S, Bang K. Combined effects of anions on arsenic removal by iron hydroxides. Toxicol Lett. 2002; 133(1): 103-11.
Correspondencia: Mg. Quím. Manuel Chávez Ruiz.
Dirección: Las Amapolas 350, Lince, Lima - Perú.
Teléfono: (511) 617-6200 Anexo 7728
Correo electrónico: mchavezr@ins.gob.pe;manuel_ch_r@hotmail.com
Recibido: 06-05-08
Aprobado: 24-09-08