Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.26 n.2 Lima abr./jun. 2009
Efecto de un extracto hidroalcohólico de Uncaria tomentosa (uña de gato) sobre la población de células dendríticas y sus moléculas hla-dr y cd86 ante el estímulo con lipopolisacáridos
Effect of an hydro-alcoholic extract of Uncaria tomentosa (cat´s claw) over dendritic cell subsets and hla-dr/cd86 molecules by lipopolysacarides stimulus
Iván Lozada-Requena1,a, César Núñez1,b, Yubell Álvarez1,c, José Luis Aguilar1,d
1 Sección Inmunología. Departamento de Microbiología, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia. Lima, Perú.
a Biólogo; b Médico Cirujano; c Estudiante de Biología; d Médico Inmuno-reumatólogo.
RESUMEN
Objetivo. Determinar el efecto de un extracto hidroalcohólico de uña de gato, Uncaria tomentosa (UG) sobre células dendríticas (DC) de sangre periférica y la expresión de HLA-DR y CD86 en muestras de sangre periférica de individuos sanos tratadas con lipopolisacáridos (LPS). Materiales y métodos. El polvo de la corteza de UG se preparó como una decocción estéril a 30g/L por 30 minutos. Se obtuvo muestras de sangre periférica de individuos sanos. Las células mononucleares de sangre periférica (CMSP) fueron separadas por gradiente de centrifugación, pretratadas o no durante dos horas con distintas concentraciones de UG y estimuladas 24 h con LPS, luego fueron marcadas con anticuerpos monoclonales fluorescentes específicos para HLA-DR, Linaje tipo 1 (Lin1), CD11c y CD86 y preparadas para la citometría de flujo. Resultados. Comparando con el grupo de CMSP con LPS pero sin UG se observó, de manera dosis dependiente, una disminución en el porcentaje de DC mieloides (DCm) (p<0,05) y una tendencia a incrementar el porcentaje de DC plasmacitoides (DCp). En las DCp se observó una disminución de la intensidad de fluorescencia media (IFM) de HLA-DR sólo a 500 y 1000 μg/mL de UG (p<0,001); mientras que hubo un incremento de la IFM de CD86 en todo el rango (p<0,05). En DCm a las mismas concentraciones no se observó efecto de UG sobre la IFM de HLA-DR y CD86. Conclusiones. Este extracto estandarizado de UG tiende a incrementar el porcentaje de DCp y disminuye el porcentaje de DCm. UG no afecta la expresión de HLA-DR y CD86 en DCm. Este estudio demuestra que este extracto de UG favorece la activación/diferenciación de DCp, la cual participa en mecanismos de respuesta inmune adaptativa.
Palabras clave: Uncaria; Uña de gato; Células dendríticas; Antígenos CD86; Plantas medicinales (fuente: DeCS BIREME).
ABSTRACT
Objective. To determine the effect of an hydro-alcoholic extract of cat´s claw Uncaria tomentosa (UG) over lipopolysaccharides – treated dendritic cells (DC) and HLA-DR and CD86 molecules expression of peripheral blood samples obtained from healthy individuals. Materials and methods. Peripheral blood samples were collected from healthy individuals. Peripheral Blood Mononuclear Cells (PBMC) were isolated by centrifugation over density gradient, pre-treated with and without the addition of UG, and then stimulated for 24 h with lipopolysaccharides (LPS), then the cells were labelled with specific fluorescent monoclonal antibodies to HLA-DR, Linage type 1 (Lin1), CD11c and CD86 and prepared for flow. Results. Compared to PBMC with LPS but without UG group, we found a decrease of myeloid DC (mDC) percentage (p<0.05) and a tendency to increase plasmacytoid DC (pDC) percentage, both in a dose-dependent manner. There was a decrease in media fluorescence intensity (MFI) of HLA-DR in DCp between 500 and 1000 μg/mL of CC (p<0,001), but we found a increase in MFI of CD86 at all concentrations (p<0,05). There was no effect of UG over MFI of the HLA-DR or CD86 expression in mDC. Conclusions. UG showed a tendency to increase pDC percentage and decreased mDC percentage. UG did not affect the expression of CD86 and HLA-DR from mDC. This study demonstrates that UG promotes activation/differentiation of pDC, which has a demonstrated involvement in the adaptive immune response mechanisms.
Key words: Uncaria; Cat´s claw; Dendritic cells; Antigens, CD86; Plants, medicinal (source: MeSH NLM).
INTRODUCCIÓN
Actualmente existe un gran interés en el estudio de las células dendríticas (DC), para conocer su funcionamiento tanto en condiciones de normalidad, como en diferentes tipos de enfermedades humanas, debido a su función crucial en la activación de linfocitos T (LT), linfocitos B, células NK e incluso de LT reguladores, ya que se está reconociendo su actividad condicionante de la activación o tolerancia hacia antígenos propios o extraños (1-4).
Existen, en general, dos principales poblaciones de DC: i) las de tipo mieloide (DCm); y ii) las de tipo plasmacitoide (DCp). Las DCm se caracterizan por inducir respuestas tipo Th1 y además con producción de citoquinas proinflamatorias como IL-12, TNF-α e IL-6, participando principalmente en respuestas antibacterianas; mientras que las DCp inducen respuestas tipo Th2 y son productoras de grandes cantidades de IFN-α, por lo que participan activamente en la defensa contra infecciones virales, canalizando la activación del LT CD8+ (5-11). El reclutamiento local de estas dos subpoblaciones está principalmente condicionado por receptores para quimioquinas (moléculas de comunicación intercelular secretadas por células del tejido blanco hacia el medio extracelular donde ejercen una función de quimoatracción) que expresan diferencialmente estas dos poblaciones celulares (DCm o DCp) (4,12). Al llegar a los tejidos las DC terminan su proceso de desarrollo, que es condicionado por la presencia de algunas citoquinas como GM-CSF, TNF-α e IL-13. Luego de la captura de antígenos y durante su transporte a los ganglios linfáticos regionales o tejidos periféricos inmunológicamente comprometidos, las DC deben madurar e incrementar la expresión de moléculas accesorias o coestimuladoras como las moléculas HLA-DR, CD80 y CD86, críticamente imprescindibles para poder producir un adecuado proceso de activación e inducción de la maduración del LT naive (virgen) (4,9,10).
Recientemente se ha destacado la importancia de la participación de las DC en diferentes enfermedades autoinmunes como artritis reumatoidea (AR) (13-15). Thomas et al. (13), encuentran que en el fluido y tejido sinovial de pacientes con AR, entre el 20 – 45% de células mononucleares denominadas no T corresponden a células CD33+CD14dim, las cuales, por su morfología, corresponderían a DC. Estas DC de fluido y tejido sinovial expresan constitutivamente las moléculas de superficie HLA-DQ, ICAM-1 (CD54), CD58, CD40 y B7 (CD80/CD86) e intensidades de fluorescencia media incrementadas de las moléculas HLA-DR y MHC-I (lo cual significa mayor cantidad de expresión de estas moléculas por célula) a diferencia de las mismas moléculas en DC de sangre periférica. Estos mismos autores demostraron que las DC tuvieron mejor capacidad para la presentación de antígenos a los LT infiltrantes de sinovia (16).
También se ha determinado que las DC, aquellas que tienen una gran capacidad de procesar antígenos cancerígenos, son piezas clave en el proceso de activación de los LT que a su vez pueden generar una eficaz respuesta antitumoral. En este sentido, se ha encontrado que ciertos factores tumorales liberados por el tumor afectan directamente a las DC modulando la producción de estas células, inmunológicamente competentes, maduras y sus principales moléculas accesorias. Esto se evidenció por la baja producción de MHC II y falta de expresión de moléculas coestimuladoras (CD80, CD83, CD86) o a la inversa, en la que factores tumorales como espermina inducen la sobreexpresión de CD83 alterando la función de las DC, como se ha demostrado en el cáncer de mama (17,18).
Nuestro grupo ha descrito efectos inmunomoduladores de extractos estandarizados de Uncaria tomentosa, donde quedó demostrado, en el aspecto biológico, su capacidad para la inhibición de procesos inflamatorios en animales de laboratorio, así como a nivel celular, la inhibición en la producción de TNF-α- en células animales y humanas en cultivo, y la inhibición de la expresión de ICAM-1 en macrófagos humanos, una molécula de adhesión crítica en la quimoatracción de las células inflamatorias hacia el tejido inflamado en macrófagos humanos (19-21).
Igualmente, hemos descrito a nivel molecular, la inhibición de algunos mecanismos intracelulares vía el factor de transcripción NF-kB (19). Otros autores también han demostrado actividad de extractos de UG en la inhibición de otras citoquinas, claves en el proceso inflamatorio como IL-1 e IL-6 (22). No existen muchos estudios sobre los efectos de la UG a nivel celular y menos aun sobre DC y su efecto en la expresión de moléculas de superficie, claves en la inducción de una respuesta inmune en individuos sanos. Sin embargo, recientemente hemos demostrado in vitro que la UG es capaz de disminuir la proporción de DCm y sobreexpresar las moléculas HLA-DR y CD86 en sangre periférica de pacientes con AR, lo cual podría constituir otra evidencia de su efecto inmunomodulador (15).
Dado el papel crítico de las DC, en los mecanismos inmunopatogénicos de diversas enfermedades, hemos evaluado el efecto de la exposición a diferentes concentraciones de un extracto hidroalcohólico estandarizado de uña de gato (UG) sobre células mononucleares de sangre periférica (CMSP) en cultivo estimuladas con el antígeno de lipopolisacárido (LPS) y Efecto de la uña de gato sobre células dendríticas determinado la modificación en el porcentaje de DCm y DCp y su efecto sobre la expresión de las moléculas HLA-DR y CD86 en ambas subpoblaciones celulares, mediante la técnica de citometría de flujo en muestras frescas de individuos sanos.
MATERIAL Y MÉTODOS
GRUPO DE ESTUDIO
Se captó diez individuos sanos, adultos (33 ± 9 años), entre varones y mujeres que concurrieron al Laboratorio de Inmunología de la Universidad Peruana Cayetano Heredia (UPCH). Los individuos fueron considerados sanos si no tuvieron historia de enfermedades crónicas de importancia, no tuvieron infecciones clínicamente diagnosticadas, no habían recibido suplementos nutricionales, transfusiones e inmunosupresores como corticosteroides por al menos seis meses previos a la toma de muestra.
Previa lectura y firma del consentimiento informado, los individuos donaron 15 mL de sangre periférica en tubos vacutainer con anticoagulante (Becton Dickinson-BD), según técnicas convencionales de toma de muestra. Este estudio cumplió los principios éticos estipulados en la Declaración de Helsinki 2000, acerca de la investigación médica que involucra a seres humanos y ha sido aprobado por el Comité Institucional de Ética de la Universidad Peruana Cayetano Heredia (Código N.º 52185).
EXTRACTO HIDROALCOHÓLICO DE UNCARIA TOMENTOSA ESTANDARIZADO AL 5% DE ALCALOIDES OXINDÓLICOS PENTACÍCLICOS (UG-POA)
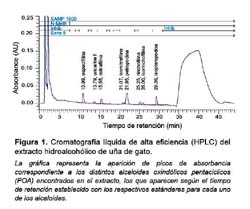
Se utilizó un extracto hidroalcohólico obtenido a partir de la corteza de UG, en forma de un polvo fino color marrón rojizo. Este preparado fue proporcionado cordialmente por CIFARMA SA (lote N.º 0008000345) y contenía 5% de alcaloides oxindólicos pentacíclicos (POA), cuantificados por cromatografía líquida de alta eficiencia (HPLC) Figura 1.
Se preparó una solución stock de UG-POA a partir del polvo fino (30 g del polvo), el cual se agregó a un matraz de 5L y se diluyó en 1L de agua bidestilada, luego se dejó hervir la mezcla por 30 minutos. Después de dejar la solución en reposo; se obtuvo una solución de aspecto similar al vino tinto, con restos sólidos visibles, después de dejar en reposo la solución. Una vez enfriada, se decantó, luego fue filtrada dos veces en papel Whatman N.º 3 y, finalmente, microfiltrada en cabina de flujo laminar con filtro de 0,22 μm. De este último filtrado se obtuvo una solución más transparente y de color amarillo pálido (solución stock), la cual fue conservada a -70 ºC.
AISLAMIENTO DE CMSP
A partir de la muestra de sangre periférica fresca, obtenida de cada sujeto sano, se procedió a realizar la separación del grupo de células mononucleares mediante la técnica de gradiente de centrifugación. Previamente, se preparó tubos de polipropileno con 15 mL de Histopaque (Sigma, St Louis, MO, USA). Se diluyó la muestra de sangre en partes iguales con RPMI-1640 (Sigma, St Louis, MO, USA) completo a temperatura ambiente (TA). Se agregó la muestra de sangre diluida (30 mL) al tubo que contiene el Histopaque. Se centrifugó a 1800 revoluciones por minuto (RPM) a TA por 30 minutos, sin utilizar freno. Se recuperó con una pipeta de transferencia el anillo celular formado en la parte intermedia (capa de células mononucleares) y se vertió a otro tubo de 50 mL. Se lavó dos veces con 40 mL de RPMI-1640 completo a TA el primer lavado y a 4 ºC el segundo lavado por diez minutos a 2500RPM. En el primer lavado se eliminó el sobrenadante y se resuspendió el pellet en RPMI-1640 completo a TA. Después del segundo lavado se hizo lo mismo pero se resuspendió en 1 mL de RPMI-1640 completo a 4 ºC. Se contó las células en cámara de Neubauer, relación 1:1 con el colorante azul de Trypan (Sigma, St Louis, MO, USA). Se realizó los cálculos para obtener la cantidad de células necesarias a ensayar.
CITOMETRÍA DE FLUJO PARA LAS CMSP TRATADAS CON EL EXTRACTO DE UG-POA Y ESTIMULADAS CON LPS
Para cada individuo, se distribuyó 100 μL de la suspensión de CMSP (5x105 células) por tubo en cinco tubos estériles para citometría (Becton Dickinson, San Jose, CA, USA). El primer tubo fue tratado con 50μL del diluyente del extracto de UG (medio de cultivo RPMI- 1640) y los cuatro tubos adicionales fueron tratados con 50μL del extracto de UG a las concentraciones finales de 50, 100, 500 y 1000 μg/mL, respectivamente. Todos los tubos fueron incubados a 37 ºC con 5% de CO2 por dos horas. Luego se agregó 50 μL del agente estimulante LPS (500 ng/mL) (Sigma, St Louis, MO, USA) a todos los tubos, y se incubaron a 37 ºC con 5% de CO2 por 24 h.
Para la determinación del porcentaje de células dendríticas y la intensidad de fluorescencia media (IFM) de las moléculas HLA-DR y CD86, las suspensiones celulares fueron marcadas con los siguientes anticuerpos monoclonales, incluyendo los controles de isotipo: anti-HLA-DR-PerCP (5μL) (isotipo IgG2a-PerCP), anti- CD11c-APC (5 μL) (isotipo IgG2b-APC), Lineage cocktail 1 (Lin 1)-FITC (7μL) (isotipo IgG1-FITC), anti-CD86-PE (5μL) (isotipo IgG1-PE) (Becton Dickinson, San Jose, CA, USA). Todos los tubos fueron incubados por 30 minutos a 4 ºC, se lavaron dos veces con 2 mL de Cell wash (solución de lavado celular, 1% suero fetal bovino (Hyclone, Logan, UT, USA) en PBS (tampón fosfato salino) pH 7,4) a 1800RPM por cinco minutos. Finalmente, los sedimentos celulares fueron resuspendidos con 500 μL de Cell fix (1% paraformaldehído en PBS pH 7,4) y guardados a 4 ºC hasta su lectura.
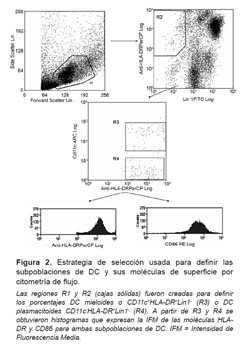
La adquisición de los datos se realizó usando un citómetro de flujo FACSCalibur (BD Immunocytometry Systems, USA). El análisis de los datos obtenidos se realizó con el software Summit 4.3 (Dako Colorado, Inc., USA). Previo a ello, se realizó una selección (R1) para incluir linfocitos y monocitos en una gráfica dot plot de forward scatter (FSC) vs side scatter (SSC). A partir de aquí se establecieron estrategias de selección secuenciales para definir las subpoblaciones de DC sanguíneas: DC mieloides CD11c+HLA-DR+Lin1- y DC plasmacitoides CD11c-HLADR+ Lin1-, como se demuestra en la Figura 2.
Para la adquisición y análisis de las subpoblaciones de DC y sus moléculas de superficie, se utilizaron 30 000 eventos (o células). Los eventos de la región R1 fueron presentados en una gráfica de dot plot entre el cocktail de anticuerpos Lin1 vs HLA-DR y se creó R2 para incluir a las células Lin1-HLA-DR+. Los eventos de R1 y R2 fueron presentados en una gráfica dot plot de CD11c vs HLA-DR y se creo R3 para incluir a todas las DCm CD11c+HLA-DR+, las que fueron expresadas en porcentaje; mientras que R4 incluyo a todas las DCp CD11c-HLA-DR+, las que también fueron expresadas en porcentaje. Finalmente, se crearon gráficas de histogramas para medir cuantitativamente la expresión de las moléculas HLA-DR y CD86 tanto para las DCm como para las DCp, a través de la obtención de l intensidad de fluorescencia media (IFM) captada por el equipo.
ANÁLISIS ESTADÍSTICO
El análisis estadístico comparativo de los datos se realizó utilizando la prueba de rangos de Friedman, para muestras relacionadas, la prueba t-student, usando el software estadístico SPSS v10 y la prueba de tendencias y análisis de medidas repetidas, utilizando el software estadístico STATA v10. Se consideró un valor estadísticamente significativo si p<0,05.
RESULTADOS
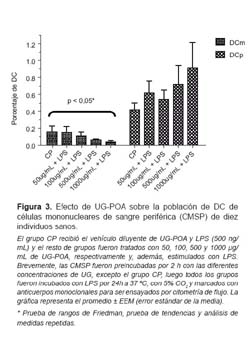
EFECTO DE UG-POA SOBRE LA CANTIDAD DE LAS SUBPOBLACIONES DE DC.
Tal como puede verse en la Figura 3, analizando las subpoblaciones de DC, se aprecia que la población de DCm disminuye de manera dosis dependiente luego del tratamiento con UG-POA (p<0,05, según la prueba de rangos de Friedman para muestras relacionadas y la prueba de tendencias y análisis de medidas repetidas). En el caso de las DCp, se puede apreciar una tendencia al aumento de estas subpoblaciones de manera dosis dependiente; sin embargo, no se encontró diferencia estadísticamente significativa (p>0,05).
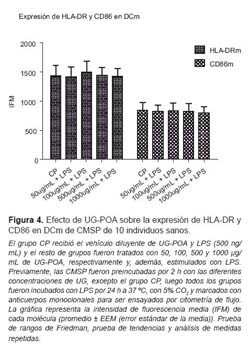
EFECTO DE UG SOBRE LA EXPRESIÓN DE LAS MOLÉCULAS HLA-DR Y CD86 EN LA SUPERFICIE DE DCm Y DCp
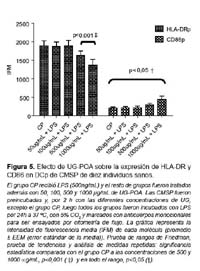
Ambas moléculas de activación (HLA-DR y CD86) en las DCm no variaron su expresión tras el tratamiento con UG-POA comparados con el grupo CP (Figura 4). Sin embargo, en el caso de la población de DCp cuando se les compara con CP, existe un aumento de manera dosis dependiente en la expresión de la molécula CD86 a lo largo de todas las dosis usadas (p<0,05) y una disminución en la expresión de la molécula HLA-DR, manifiesta a las concentraciones de 500 y 1000 μg/mL (p<0,001) (Figura 5).
DISCUSIÓN
Los resultados muestran que el extracto hidroalcohólico de Uncaria tomentosa estandarizado al 5% de alcaloides oxindólicos pentacíclicos (UG-POA) tiene un efecto sobre las DC presentes en muestras de CMSP de individuos sanos. Este efecto aparentemente es antagónico, causando una disminución dosis-dependiente en el porcentaje promedio de la subpoblación de DCm (p<0,05) y una tendencia al aumento, también dosis dependiente, de la subpoblación de DCp.
Núñez et al. (16) encontraron un resultado similar con el porcentaje de DCm tratadas con el mismo extracto de UG pero en pacientes con AR, por lo que este hallazgo podría interpretarse como una evidencia más del efecto inmunomodulador a nivel celular de la UG (4-7,15,22). Sin embargo, resultados más concluyentes podrían requerir un mayor número de muestras para definir las tendencias encontradas en este estudio sobre todo en el caso del porcentaje de DCp y la expresión de su molécula HLA-DR.
También es importante indicar que al trabajar con CMSP, las cuales están conformadas por poblaciones celulares heterogéneas, se debe tener en cuenta el grado de variabilidad en los resultados, ya que a pesar de provenir de individuos sanos estos pueden ser inmunológicamente distintos como se pudo observar en el estudio realizado con pacientes con AR por Núñez et al. en el cual el extracto de UG sólo tuvo un efecto modulador sobre las DCm y sus moléculas HLA-DR y CD86 (15). Según lo anterior, sería importante un estudio similar con DC separadas y cultivadas selectivamente (con factores de crecimiento) a partir de las CMSP o precursores de médula ósea o mediante el uso de líneas celulares en cultivo, ya que existen diferencias entre DC obtenidas de CMSP o de sangre periférica.
Como es conocido, la diferenciación entre DCm y DCp depende de la expresión de la molécula CD11c. Zuñiga y col. (7) demostraron que tras un estímulo antigénico viral las DCp se pueden diferenciar a DCm, posiblemente por la activación de la expresión de la molécula CD11c. En nuestro estudio, podríamos hipotetizar un efecto opuesto en el que la UG-POA inhibiría la expresión de la molécula CD11c por lo tanto redirigiendo la población de DCm hacia un mayor porcentaje de DCp, como lo demuestra la tendencia al aumento en el porcentaje de esta población.
Esta direccionalidad hacia DCp podría explicar un efecto potenciador de la UG en la respuesta contra infecciones virales o explicaría una potencial mejora en las manifestaciones clínicas de enfermedades autoinmunes, en las que las DC se encargan de la presentación de los antígenos virales y autoantígenos (13,16,23).
Además, encontramos que la UG-POA indujo en las DCp un aumento estadísticamente significativo en la expresión de CD86 de manera dosis-dependiente (p<0,05) y mantuvo la expresión de HLA-DR de manera similar a la ejercida por LPS, excepto a 500 y 1000 μg/mL donde se observó una disminución significativa (p<0,001), lo que podría ser una evidencia del control de activación/ diferenciación de la UG-POA.
Podría objetarse que a alguna de estas concentraciones ocurre un efecto citotóxico del extracto; sin embargo, un estudio previo de nuestro grupo no encontró evidencias de citotoxicidad a las dosis mencionadas, siendo el IC50 (concentración inhibitoria al 50% en CMSP) del extracto de UG-POA de 16mg/mL, concentración mucho mayor a las usadas en este estudio (50 a 1000 μg/mL) (5). En el mismo estudio, también se demostró que a esas dosis, el extracto no induce apoptosis en CMSP a las 4 h ni a las 20 h (5).
Existen otros productos naturales con efecto modulador sobre las DC. Fukui et al. (24) evaluaron los marcadores HLA-DR y CD86 de DC con 99 extractos de plantas medicinales usadas en 210 formulaciones de la medicina China, encontrando que por lo menos uno de los extractos (Amomi semen) a la concentración de 100 μg/ mL incrementó la expresión de HLA-DR y CD86 en una línea celular de DC epidermales de ratón (XS106) y en DC aisladas de médula ósea de ratón. Podemos ver que a pesar de utilizar grupos celulares y donadores celulares distintos y en nuestro caso muy variables como las CMSP; sin embargo, observamos efectos similares a los encontrados con otros productos naturales sobre las DC.
También es posible concluir que la UG-POA, en el rango de 50 a 100 μg/mL, no altera el nivel de activación/diferenciación inducido por LPS (conocido factor antigénico inductor) (1,2,24). Sin embargo, en el rango de 500 a 1000 μg/mL esta propiedad disminuye significativamente, lo que evidencia que incluso se requerirían concentraciones más bajas para lograr efectos específicos, siendo esta una tendencia cuando se evalúan las propiedades de productos naturales.
A diferencia de la molécula HLA-DR, el incremento en la expresión de la molécula CD86 en DCp y por consiguiente la propiedad activadora/diferenciadora de la UG-POA se mantiene de manera dosis dependiente en el rango de las concentraciones utilizadas, siendo CD86 una molécula coestimuladora, miembro de la familia B7 y un indicador del efecto de activación/diferenciación de las DC (1,2,24). Bajo estas circunstancias podemos concluir que el extracto de UG-POA tiene un efecto inmunomodulador que incrementa la función de presentación de antígenos de las DCp y que probablemente induce la conversión favorable para el sistema inmune de DCm a DCp.
Todos estos mecanismos claramente son importantes en la etiopatogenia de diversas enfermedades humanas, así como en los mecanismos inmunológicos de defensa contra diversos tipos de patógenos.
Por lo tanto, este estudio aporta información inmunológica adicional a los ya conocidos mecanismos inmunorreguladores demostrados de la UG, lo que justificaría continuar buscando los pasos moleculares y celulares de estas acciones, así como la evaluación clínica del uso de extractos estandarizados de UG individualmente o en asociación con otros fármacos, incluyendo el establecimiento de la equivalencia con la dosis-efecto.
Fuente de Financiamiento
El presente estudio ha sido íntegramente financiado por la Sección Inmunología – Departamento Académico de Microbiología – Facultad de Ciencias y Filosofía – Universidad Peruana Cayetano Heredia, Lima, Perú.
Conflictos de Interés
Los investigadores declaran que no tienen conflictos de interés con ninguna organización, incluyendo a la empresa CIFARMA, para la ejecución y publicación del presente estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Banchereau J, Briere F, Caux Ch, Davoust J, Lebecque S, Liu Y-J, et al. Immunobiology of dendritic cells. Annu Rev Immunol. 2000; 18: 767-811.
2. Lipscomb MF, Masten BJ. Dendritic cells: immune regulators in health and disease. Physiol Rev. 2002; 82(1): 97-130.
3. Cerundolo V, Hermans IF, Salio M. Dendritic cells: a journey from laboratory to clinic. Nat Immunol. 2004; 5(1): 7-10.
4. Falgarone G, Jaen O, Boissier M-C, Breban M. Dialogue entre les lymphocytes et les cellules dendritiques au cours de linflammation rhumatoïde. Rev Rhum. 2005; 72(4): 297-302.
5. Pulendran B. Division of labor and cooperation between dendritic cells. Nat Immunol. 2006; 7(7): 699-700.
6. Pulendran B, Smith JL, Gaspary G, Brasel K, Pettit D, Maraskovsky E, et al. Distinct dendritic cells subsets differentially regulate the class of immune response in vivo. Proc Natl Acad Sci USA. 1999; 96(3): 1036-41.
7. Zuniga EI, McGavern DB, Pruneda-Paz JL, Teng Ch and Oldstone MBA. Bone marrow plasmacytoid dendritic cells can differentiate into myeloid dendritic cells upon virus infection. Nat Immunol. 2004; 5(12): 1227-34.
8. Geissmann F. The origin of dendritic cells. Nat Immunol. 2007; 8(6): 558-60.
9. Walker JG, Ahem MJ, Coleman M, Weedon H, Papangelis V, Beroukas D, et al. Characterisation of a dendritic cell subset in synovial tissue which strongly expresses jak/STAT transcription factors from patients with rheumatoid arthritis. Ann Rheum Dis. 2007; 66(8): 992-99.
10. Athanassopoulus P, Vaessen LM, Maat AP, Balk AH, Weimar W, Bogers AJ. Peripheral blood dendritic cells in human end-stage heart failure and the early post-transplant period: evidence for systemic Th1 immune responses. Eur J Cardiothorac Surg. 2004; 25(4): 619-26.
11. O´Neill DW, Adams S, Bhardwaj N. Manipulating dendritic cell biology for the active immunotherapy of cancer. Blood. 2004; 104(8): 2235-46.
12. Howard CJ, Hope JC. Dendritic cells, implications on function from studies of the afferent lymph veiled cell. Vet Immunol Immunopathol. 2000; 77(1-2): 1-13.
13. Thomas R, Davis LS, Lipsky PE. Rheumatoid synovium is enriched in mature antigen-presenting dendritic cells. J Immunol. 1994; 152(5): 2613-22.
14. Lutzky V, Hannawi S, Thomas R. Cells of the synovium in rheumatoid arthritis. Dendritic cells. Arthritis Res Ther. 2007; 9(4): e219.
15. Núñez C, Lozada-Requena I, Akamine I, Carbajal L, Aguilar JL. Efecto de Uncaria tomentosa (uña de gato) sobre la población y activación de células dendríticas en sangre periférica de pacientes con artritis reumatoidea. Acta Med Peru. 2008; 25(3): 135-39.
16. Thomas R, Lipsky. Could endogenous self-peptides presented by dendritic cells iniciate rheumatoid arthritis? Immunol Today. 1996; 17(12): 559-64.
17. Gabrilovich D. Mechanisms and functional significance of tumour-induced dendritic-cell defects. Nat Rev Immunol. 2004; 4(12): 941-52.
18. Della-Bella S, Gennaro M, Vaccari M, Ferraris C, Nicola S, Riva A, et al. Altered maturation of peripheral blood dendritic cells in patients with breast cancer. Br J Cancer. 2003; 89(8): 1463-72.
19. Aguilar J, Rojas P, Marcelo A, Plaza A, Bauer R, Reininger E, et al. Anti-inflammatory activity of two different extracts of Uncaria tomentosa (Rubiaceae). J Ethnopharmacol. 2002; 81(2): 271-76.
20. Lozada-Requena I. Efecto inmunomodulador de capsaicina y uncaria tomentosa (uña de gato) sobre la producción del factor de necrosis tumoral de tipo alfa e interleuquina 10 y sobre la inducción de apoptosis en células mononucleares de sangre periférica humanas. (Tesis de Magister). Lima: Universidad Peruana Cayetano Heredia; 2006.
21. Sandoval M, Charbonnet R, Okuhama N, Roberts J, Krenova Z, Trentacosti M, et al. Cat´s claw inhibits TNF-α production and scavenges free radicals: Role in cytoprotection. Free Radic Biol Med. 2000; 29(1): 71- 8.
22. Lemaire I, Assinewe V, Cano P, Awang DV, Arnason JT. Stimulation of interleukin-1 and -6 production in alveolar macrophages by the neotropical liana, Uncaria tomentosa (uña de gato). J Ethnopharmacol. 1999; 64(2): 109-15.
23. van Duivenvoorde LM, van Mierlo GJ, Boonman ZF, Toes RE. Dendritic cells: vehicles for tolerance induction and prevention of autoimmmune diseases. Immunobiology. 2006; 211(6-8): 627-32.
24. Fukui H, Mitsui S, Harima N, Nose M, Tsujimura K, Mizukami H and Morita A. Novel functions of herbal medicines in dendritic cells: Role of Amomi Semen in tumor immunity. Microbiol Immunol. 2007; 51(11): 1121-33.
Correspondencia:
MSc. Iván Lozada Requena.
Dirección: Av. Honorio Delgado 430, Urbanización Ingeniería,
Lima31, Perú.
Teléfono: (511) 319-0000 Anexo 2511
Correo electrónico: ilr@upch.edu.pe
Recibido: 25-02-09
Aprobado: 12-06-09