Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.26 n.2 Lima abr./jun. 2009
Características biológicas de una cepa de Trypanosoma cruzi en un modelo murino y análisis de supervivencia
Characteristic biological of a strain of Trypanosoma cruzi in a murine model and analysis of survival
Nicolás Suárez1,2 a, Rufino Cabrera3,a, Luis Cartagena2,a, Rolando Ayaqui4,b
1 Centro de Salud de Colcabamba, Dirección Regional de Salud de Huancavelica, Ministerio de Salud. Huancavelica, Perú.
2 Departamento de Ciencias Biológicas, Facultad de Ciencias, Universidad Nacional San Luis Gonzaga. Ica, Perú.
3 Grupo Temático de Enfermedades Metaxénicas, Dirección General de Epidemiología, Ministerio de Salud. Lima, Perú.
4 Departamento de Microbiología y Patología de la Facultad de Medicina, Universidad Nacional de San Agustín de Arequipa, Perú.
a Biólogo; b Biólogo Doctor en Ciencias Biomédicas.
RESUMEN
Conocer las características biológicas de una cepa de Trypanosoma cruzi, procedente de Tiabaya, Arequipa, Perú, y determinar la supervivencia de los ratones inoculados con relación a la dosis infectante y al sexo. Se utilizaron 14 ratones BALB/C-53 (machos y hembras) de 30 días. Los grupos I y II fueron inoculados por vía intraperitoneal con 1,8 x 105 y 1,8 x 104 trypomastigotes metacíclicos de T. cruzi, respectivamente; el grupo III con 1,5 x 107 trypomastigotes sanguíneos. El grupo control (IV) recibió solo solución salina fisiológica al 0,9 %. Los parásitos fueron evaluados en sangre periférica de los ratones. El análisis de supervivencia fue realizado por el método de Kaplan-Meier, test de Logaritmo de rangos y Wilcoxon al 95 % de nivel de confianza. Se encontraron formas delgadas y gruesas de T. cruzi. La letalidad fue 100 % al día 40 postinfección (pi). La parasitemia fue detectada desde el 6to hasta el 40mo día pi y el pico máximo global (6747 parásitos) fue observado al 29no día pi. Existen diferencias significativas en la supervivencia de los ratones inoculados de acuerdo a la dosis por la prueba de Logaritmo de rangos (p = 0,0202). La cepa de T. cruzi, procedente de Tiabaya, Arequipa es de mediana virulencia. La supervivencia de los ratones infectados está relacionada a la dosis de inoculación.
Palabras clave: Trypanosoma cruzi, Patogenicidad; Ratón; Modelos animales de enfermedad; Perú (fuente: DeCS BIREME).
ABSTRACT
To know the biological characteristics of a strain of Trypanosome cruzi, coming from the district of Tiabaya, Arequipa, Peru, and to determine the survival of inoculated mice relating the infecting dose ante and sex. Were used 14 BALB/C-53 mice (males and females) of 30 days of age as biological model. The groups I and II were inoculated via intraperitoneum with 1,8 x 105 and 1,8 x 104 meta-cyclic trypomastigotes of T. cruzi, respectively; group III with 1,5 x 107 sanguine trypomastigotes. Control group (IV) received only physiologic saline solution at 0.9%. The parasites were searched in peripheral blood of the mouse. The analysis of survival was carried out by Kaplan-Meier method, Logrank test and Wilcoxon to 95 % of confidence level. Were find thin and thick forms of T. cruzi. The fatality rate was 100% groups at day 40 -post-infection- (pi). The parasitemy was detected from the 6th until the 40th day pi and the global maximum pick (6747 parasites) was observed on the 29th day pi. Significant differences exist in the survival of inoculated mice according to the dose by the Logrank test (p = 0,0202). The strain of T. cruzi, coming from Tiabaya, Arequipa is of medium virulence. The survival of the infected mice is related to the dose of inoculation.
Key words: Trypanosoma cruzi; Pathogenicity; Mice; Animal disease model; Peru (source: MesH NLM).
INTRODUCCIÓN
La enfermedad de Chagas o Trypanosomiosis americana es ocasionada por el parásito, Trypanosoma cruzi, y es trasmitida al hombre, principalmente, por insectos hematófagos de la subfamilia Triatominae. Es endémica, entre otros países de América, en Brasil, Argentina, Chile, Bolivia y Perú (1).
En el Perú, se estima que existen 621 000 personas infectadas por T. cruzi (1) y una de las áreas endémicas de mayor importancia en la región sudoccidental es Arequipa, de donde provienen más del 80% de los casos reportados al sistema de vigilancia epidemiológica del Ministerio de Salud (MINSA) (2).
El T. cruzi presenta gran variabilidad intraespecífica en el aspecto bioquímico, inmunológico, genético y biológico (3), por ello, las poblaciones que circulan han sido clasificadas en dos linajes, TCI y TCII, y éste último en cinco subgrupos (4), que difieren en su distribución y en las características clínicas y epidemiológicas. Los estudios de caracterización biológica permiten conocer el comportamiento de una cepa en un modelo animal, y de esa forma intentar comprender el cuadro clínico que ocasiona en el hombre.
En otros países endémicos las poblaciones y subpoblaciones de T. cruzi que circulan en diferentes fuentes incluyendo a humanos, presentan variaciones en la morfología, letalidad, virulencia e incluso en la tasa de infectividad (5-7). En el Perú, también se han caracterizado las cepas de T. cruzi, tanto en las mantenidas en medios de cultivo (8), o procedentes de un área con presencia de Triatoma infestans (9), aislados de Panstrongylus chinai en el norte (10) y de P. lignarius (Sin. P. herreri) en Amazonas (11). Todas tienen un patrón biológico diferente, por lo que se hace necesario continuar con la caracterización en las áreas endémicas con el propósito de conocer mejor las poblaciones de T. cruzi que se distribuyen en el Perú. Por otro lado, los estudios publicados sobre supervivencia en modelos biológicos son muy pocos (12).
El objetivo de nuestra investigación fue conocer las características biológicas de una cepa de T. cruzi aislada de Triatoma infestans, procedente del distrito de Tiabaya, Arequipa, Perú y determinar la supervivencia de los ratones inoculados de acuerdo a la dosis y sexo.
EL ESTUDIO
CEPA DE T. CRUZI, AISLAMIENTO E IDENTIFICACIÓN DE TRYPANOSOMAS
Se usó una cepa de T. cruzi aislada de un espécimen de T. infestans infectado naturalmente, capturado en el peridomicilio de una vivienda del distrito de Tiabaya, departamento de Arequipa, en el sur del Perú. El triatomino fue examinado en búsqueda del parásito por presión abdominal y por extracción del tubo digestivo, la lectura se realizó en un microscopio óptico a 400 X. Parte del material fue coloreado con Giemsa para la identificación de T. cruzi realizándose mediciones de los parásitos. No se realizó secuenciamiento genético ni caracterización bioquímica. Otra parte del contenido intestinal del triatomino se mezcló con solución salina fisiológica al 0,9% (SSF) y fue inoculado intraperitonealmente a dos ratones BALB/ C-53 de 21 días para aislar la cepa y obtener las formas sanguíneas. A partir del 7mo día después de la infección, se les aplicó el xenodiagnóstico para obtener las formas metacíclicas, los que fueron leídos a partir del trigésimo día después de la alimentación, en búsqueda de formas metacíclicas que se usaron para inocular a los ratones de los grupos experimentales. Los dos ratones utilizados para el aislamiento de la cepa fueron sacrificados después en búsqueda de amastigotes.
MODELO ANIMAL
Se emplearon 14 ratones BALB/C- 53 de 30 días, hembras y machos, de dos camadas, libres de infección por T. cruzi, adquiridos en el Bioterio del Instituto Nacional de Salud en Lima. Para el diseño del experimento se tomaron en cuenta las recomendaciones y los principios éticos para el uso de animales en la investigación publicadas por el Institute of Laboratory Animal Resources (13).
PREPARACIÓN DEL INÓCULO
Los trypomastigotes metacíclicos obtenidos de las heces de los triatominos utilizados para el xenodiagnóstico fueron mezclados en SSF, contados al microscopio en cámara de Neubauer e inoculados de acuerdo al diseño descrito más adelante. Otro grupo de ratones fueron inoculados con las formas sanguíneas mezcladas con SSF estéril y contadas por el método de Pizzi, estas formas también fueron obtenidas de los ratones infectados experimentalmente para el aislamiento.
GRUPOS DE ESTUDIO
Estudio cuasi-experimental, sin aleatorización para la asignación de la intervención y con grupo control.
Ratones inoculados con la forma metacíclica: Conformados por los grupos I y II de cuatro ratones cada uno, se les inocularon 1,8 x 105 y 1,8 x 104 parásitos por mL por vía intraperitoneal en 0,2 mL de contenido intestinal de los dos triatominos infectados.
Ratones inoculados con la forma sanguínea: Conformado por el grupo III se inocularon trypomastigotes sanguíneos también por vía intraperitoneal con 1,5 x 107, parásitos por mL.
Ratones control: El grupo IV (dos ratones) fue el grupo control a los cuales solo se les inoculó SSF (0,9%) estéril por vía intraperitoneal y fueron mantenidos en forma similar que a los otros animales; fueron marcados para distinguirlos de los infectados.
EVALUACIÓN DEL COMPORTAMIENTO BIOLÓGICO
Se examinó 10 μL de sangre extraído de la cola del ratón para evaluar los siguientes parámetros:
Morfometría: Medidas de los trypomastigotes sanguíneos en láminas coloreadas con Giemsa en un microscopio calibrado y expresadas en micras (μm).
Período prepatente: El periodo entre el momento de la infección experimental y el día de la aparición de los parásitos en sangre circulante, evaluado según el método de Pizzi.
Parasitemia: Evaluada diariamente en sangre circulante desde el 4to día pi hasta que se negativizó o murió el ratón por conteo en 50 campos microscópicos por el método de Pizzi.
Letalidad: Se evaluó el porcentaje de ratones muertos durante el curso de la infección14.
Supervivencia: El tiempo de supervivencia máxima de los hospederos infectados experimentalmente con la cepa de T. cruzi14.
ANÁLISIS ESTADÍSTICO
Se usó el software STATGRAPHICS® Plus v 4.0 para el análisis de datos. La curva de la parasitemia global (cantidad de parásitos, promedio y el rango) fue graficada en MS-Excel®. El análisis de supervivencia previo análisis de homogeneidad y normalidad fue realizado por el método de Kaplan Meir y las pruebas de significancia estadística fueron realizadas por método de Logaritmo de rangos y la prueba generalizada de Wilcoxon. Se incluyeron en el análisis sólo a los ratones inoculados con T. cruzi. Se consideró que existía diferencia significativa cuando el valor de p fue menor de 0,05.
HALLAZGOS
CARACTERÍSTICAS BIOLÓGICAS DE TRYPANOSOMAS AISLADOS
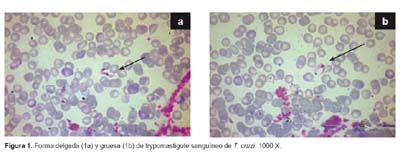
Morfometría. En 22 parásitos medidos se encontró que es una cepa pleomórfica con formas delgadas y gruesas (Figura 1a, 1b). El promedio de la longitud total de los trypomastigotes sanguíneos gruesos de T. cruzi fue 21,94 ± 1,27 μm (21,13 - 24,33) y el promedio del ancho total fue 4,04 ± 0,21 μm (3,47 - 4,17). La longitud total promedio de las formas delgadas fue 21,46 ± 2,59 μm (17,38– 24,39) y el promedio del ancho total fue 1,99 ± 0,69 μm (1,39 - 2,78). En ambas formas el kinetoplasto voluminoso se situaba en el extremo posterior y núcleo central.
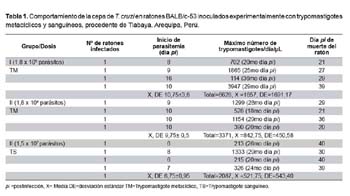
Período prepatente. En el grupo I fue entre el 6to y 8vo día pi, en el grupo II fue entre el 8vo y 16vo día pi y en el grupo III fue entre el 9no y 10mo día pi (Tabla 1).
Parasitemia. Todos los ratones inoculados con T. cruzi desarrollaron parasitemia. Los parásitos fueron detectados en la sangre a partir del 6to hasta el 40vo día pi. Contamos 6747 parásitos a los 29no días pi como pico máximo de parasitemia global (en todos los ratones vivos de los tres grupos) con un promedio de 1124,5 y un rango (0 - 3947 parásitos por 10 μL), la curva de parasitemia fue irregular. Otros datos de la parasitemia por grupo y por ratón inoculado se muestran en la tabla 1.
SUPERVIVENCIA Y LETALIDAD
Al análisis por el método de Kaplan-Meier el promedio de días de supervivencia fue de 30,91 ± 2,23 y la mediana de supervivencia fue de 29 días, asimismo, a los 40 días pi todos los ratones fallaron (murieron). La probabilidad de supervivencia más de 29 días sin considerar el sexo, dosis o forma parasitaria fue 50,0% (IC 95% 48,3-51,7), en el caso de las hembras fue de 66,7%, (IC95%: 47,4- 85,2) y la del macho fue 33,3%, (IC95%: 14,1 - 52,6), sin embargo, esto no fue una diferencia estadísticamente significativa.
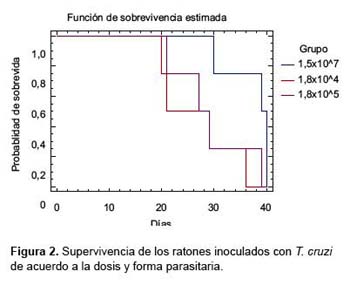
Los ratones inoculados con la dosis de 1,8 x 105 (forma metacíclica) tuvieron una supervivencia mediana de 27 días y de 21 en aquellos con la dosis de 1,8 x 104 (forma metacíclica). La probabilidad de supervivencia más de 29 días en ambos casos sin considerar el sexo fue 25,0% (IC95%: 3,4-46,7), por su parte, la mediana de supervivencia con la dosis de 1,5 x 107 (trypomastigotes sanguíneas) fue de 39 días (Figura 2), existieron diferencias estadísticamente significativas al comparar los tres grupos (p = 0,02).
DISCUSIÓN
Las medidas de la cepa evaluada de T. cruzi están dentro del rango para esta especie; sin embargo, es más larga que las cepas descritas para el Perú (9,11,15). El hallazgo de diferencias en la longitud total de las cepas que infectan en forma natural a ratones y ratas en una misma zona endémica en Arequipa (15), podría tener importancia en la transmisión de ciertas cepas para determinados reservorios.
La cepa aislada de T. cruzi es pleomórfica, similar a las cepas de otros países (16) e incluso a tres cepas peruanas (9,11,17). Se ha planteado como una hipótesis para explicar el pleomorfismo de los trypomastigotes, la incapacidad de la forma delgada para invadir una nueva célula después de su liberación del pseudoquiste (18); sin embargo, el predominio de una forma depende también, de la cepa (6), de la fuente y de la fase de infección(19). Conocer el pleomorfismo de las cepas tiene utilidad en la investigación de la infección de los reservorios y en el curso de la infección.
El periodo prepatente en los ratones inoculados con la forma sanguínea fue más corto que los infectados con la forma metacíclica. En los inoculados con la forma sanguínea fue similar al periodo de cinco días de la cepa peruana aislada de P. chinai (10) y también a la cepa brasileña CL inoculados en canes por vía intraperitoneal (7), pero se diferencia de la cepa TCI de Ica que fue entre 7 y 21 días (9). En cambio, en los murinos infectados con la forma metacíclica el periodo prepatente fue similar a la cepa aislada de P. lignarius (Sin. P. herreri) en Amazonas (11) y a las cepas de otros países (5, 7,16).
Los trypomastigotes en sangre circulante aparecen más temprano en los inoculados con la forma sanguínea a diferencia de los que recibieron la forma metacíclica como se ha visto con otras cepas (6), que estarían asociadas con la exposición previa al sistema inmune del hospedero (7). Estas formas producen proteínas específicas de la familia de la trans-sialidasas que podrían desviar la respuesta inmune o bloquear la respuesta de la célula T (20), en cambio, las formas metacíclicas producen proteínas ribosomales y presentan un mecanismo de defensa antioxidante como adaptación previa al estallido de la célula fagocítica del hospedero (21), que explicarían las diferencias en la aparición de la parasitemia en sangre circulante de los ratones usados como modelo.
En los ratones inoculados con las formas metacíclicas las parasitemias fueron más altas, con predominio de la forma delgada como ha sido descrito (16), a diferencia, de los que desarrollaron parasitemias moderadas donde predominó la forma gruesa, que indicaría la presencia de dos subpoblaciones (clones) en una misma cepa. El clon C5 de la cepa SF2 a los 21 días del curso de la infección mostró dos subclones (19). El pico de la parasitemia varió de 18 a 36 días, pero la parasitemia mas alta fue a los 29 días en un ratón inoculado con la forma metacíclica, comportamiento similar a la cepa de Amazonas (11) y CL(7). El pico de la parasitemia fue diferente de la cepa 167, que está por debajo de los 23 días pi (5) y también difiere de la cepa peruana (17) y de la tipo I Z2b (22).
La curva de parasitemia fue irregular como el comportamiento de las cepas brasileñas (5,19), explicable por la dosis, formas parasitarias y muerte de ratones con elevadas parasitemias. A pesar de inocularse la misma dosis de una cepa peruana de T. cruzi en dos cepas distintas de ratones presentó diferentes picos de parasitemia (22), pero una misma dosis presenta picos diferentes en un mismo grupo de ratones como el observado en este modelo, esto podría deberse a la patogenicidad, virulencia y a otros factores más complejos como la estructura antigénica.
La letalidad de los ratones inoculados con el aislado de T. cruzi fue mas baja que la cepa aislada de P. chinai en el norte, donde los ratones no sobrevivieron mas allá de los 18 días pi (10), también es menos virulenta que la cepa peruana mantenida en diferentes medios (17), y de cepas que circulan en Brasil (5); sin embargo, es más virulenta que la cepa 21 SF (19), 19 SF y 22 SF (6) y la cepa TCI procedente de Ica (9).
La probabilidad de supervivencia de los ratones inoculados con la forma metacíclica fue más bajo que los infectados con la forma sanguínea, asimismo, también varía de acuerdo a la dosis como ha sido observado en ratones ACA inoculados con 200 y 2000 trypomastigotes, respectivamente (12). No se encontraron diferencias significativas en la supervivencia de acuerdo al sexo; sin embargo, se ha visto que las hembras infectadas con el clon Dm 28c de T. cruzi (12) y una cepa peruana (23) tienen mayor supervivencia que los machos, diferencias explicables por el tamaño pequeño de la muestra. También se ha planteado que la supervivencia y la parasitemia de ratones inoculados con una cepa peruana muy virulenta están controlados por algunos genes (23). Las características biológicas de la cepa de T. cruzi, aislada de T. infestans procedente de Tiabaya, Arequipa e inoculada en ratones BALB/C-53, son diferentes de los aislados peruanos, puede clasificarse como una cepa de mediana virulencia.
Nuestro estudio es exploratorio, consideramos que debe profundizase con un modelo más apropiado, tenemos algunas limitaciones que son convenientes de comunicar, como la asignación no aleatoria de la intervención, el reducido número de ratones por grupo, el no haber controlado el peso del hospedero, no incluir una cepa control y el no conocer el tipo o biodema de la cepa; no obstante, es prudente mencionar algunas de las fortalezas como el empleo de ratones BALB/C-53 de la misma edad (uno de los mejores modelos para la enfermedad de Chagas) procedentes de un bioterio certificado, la medición diaria de la parasitemia y el aislamiento de la cepa de una fuente conocida.
La caracterización biológica de la cepa evaluada debe ser completada con una de tipo enzimática y molecular; sin embargo, la nuestra es una contribución a la caracterización biológica de las cepas que circulan en zonas endémicas del sur del Perú, donde el comportamiento de las cepas circulantes es relevante, más aún, si se considera su asociación con el cuadro clínico de la enfermedad (22).
AGRADECIMIENTO
Nuestro agradecimiento a Kennedy Alva y Jorge Miranda, por apoyarnos en el análisis de supervivencia y al Dr. Sandro Casavilca del Instituto de Enfermedades Neoplásicas.
Fuente de Financiamiento
Autofinanciado.
Conflictos de Interés
Los autores declaran no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. World Health Organization. Control of Chagas disease. Second report of the WHO Expert Committee. Geneva: WHO; 2002. Technical Report Series 905.
2. Cabrera CR. Enfermedad de Chagas. Bol Epidemiol (Lima). 2008; 17(53): 1005-7.
3. Macedo AM, Pimenta JR, Aguiar RS, Melo AI, Chiari E, Zingales B, et al. Usefulness of microsatellite typing in population genetic studies of Trypanosoma cruzi. Mem Inst Oswaldo Cruz. 2001; 96(3):407-13.
4. Brisse S, Dujardin JC, Tibayrenc M. Identification of six lineages by sequence-characterised amplified region markers. Mol Biochem Parasitol. 2000; 111(1): 95-105.
5. Carneiro M, Romanha AJ, Chiari E. Biological characterization of Trypanosoma cruzi strains from different zymodemes and schizodemes. Mem Inst Oswaldo Cruz. 1991; 86(4): 387-93.
6. Magalhães JB, Andrade SG, Sherlock I. Trypanosoma cruzi strains: behavior after passage into authoctonous or foreing species of triatominae (Biological and biochemical patterns). Rev Inst Med Trop São Paulo. 1996; 38(1): 23- 28.
7. Pedreira de Castro MA, Brener Z. Estudo parasitológico, e anátomo-patológico da fase aguda da doença de Chagas en cães inoculados com duas diferentes cepas do Trypanosoma cruzi. Rev Soc Bras Med Trop. 1985; 18(4): 223-29.
8. Náquira C. Caracterización de cepas de Trypanosomas procedentes de dos zonas diferentes del Perú. Biológica. 1962; 33(1):13-23.
9. Arrojo L, Tantaleán M, Miranda E. Aspectos del comportamiento biológico de la cepa TCI de Trypanosoma cruzi. Rev Peru Parasitol. 2000; 15(1): 9-14.
10. Díaz–Limay E, Escalante H, Jara C. Niveles de parasitemia y alteraciones histopatológicas en Mus musculus Balb/c infectado con Trypanosoma cruzi obtenido de Panstrongylus chinai del valle Chaman, La Libertad – Perú. Parasitol Latinoam. 2004; 59(2):153-58.
11. Sulca L, Martínez R, Guillén Z, Cáceres A. Comportamiento y morfometría de Trypanosoma cruzi en Mus musculus Balb/ c-53 aislado de P. herreri de la localidad de Hebrón, distrito de Cajaruro, provincia de Utcubamba, departamento de Amazonas-Perú 2001. En: XIV Reunión Científica, Instituto de Ciencias Biológicas Antonio Raymondi, Universidad Nacional Mayor de San Marcos. Lima: UNMSM; 2005.
12. Urzúa C, Morales MA, Vergara U, Palau MT, Zúñiga C. Sexo del hospedero y dosis infectante de parásitos como factores en el desarrollo de la infección con Trypanosoma cruzi en un modelo murino. Parasitol Latinoam 2004; 59(3-4): 104-9.
13. Institute of Laboratory Animal Resources, Commission on Life Sciences, National Research Council, National Academy of Sciences. Guide for the care and use of laboratory animals. Washington DC: National Academy Press; 1996.
14. Zúñiga C, Vargas R, Courcelles MT, Vergara U. Infección experimental con Trypanosoma cruzi en machos y hembras de tres cepas de ratones. Parasitol Día. 1997; 21(1): 85- 91.
15. Ayaqui R, Córdova E. Infección natural de roedores sinantrópicos por Trypanosoma cruzi Chagas, 1909 en el valle del río Vítor (Arequipa-Perú). Acta Med Agustina. 1990; 1: 66-70. 16. Andrade SG, da Silva AA, Carvalho ML, Figueira RM. Comportamento de uma cepa do Trypanosoma cruzi em hospedeirows com baixa resistência. Rev Inst Med trop São Paulo. 1972; 14(1): 154-61.
17. Magalhäes JB, Pontes AL, Andrade SG. Comportamento das cepas Y e Peruana do Trypanosoma cruzi no camundongo, após passagem em diferentes meios. Mem Inst Oswaldo Cruz. 1985; 80(1): 41-50.
18. Tyler KM, Engman DM. The life of Trypanosoma cruzi revisited. Int J Parasitol. 2001; 31(5-6): 472-81.
19. Campos RMF, Andrade SG. Characterization of subpopulations (clones and subclones) of the 21 SF strain of Trypanosoma cruzi after long lasting maintenance in the laboratory. Mem Inst Oswaldo Cruz. 1996; 91(6): 795-800.
20. Martin D, Tarleton R. Generation, specificity, and function of CD8+ T cells in Trypanosoma cruzi infection. Immunol Rev. 2004; 201: 304-17.
21. Atwood JAIII, Weatherly DB, Minning TA, Bundy B, Cavola C, Opperdoes FR, et al. The Trypanosoma cruzi proteoma. Science. 2005; 309(5793): 473-76.
22. Andrade SG, Magalhães JB. Biodemes and zymodemes of Trypansoma cruzi strains: correlations with clinical data and experimental pathology. Rev Soc Bras Med Trop. 1997; 30(1): 27-35.
23. Wrightsman R, Krassner S, Watson J. Genetic control of responses to Trypanosoma cruzi in mice: multiple genes influencing parasitemia and survival. Infect Inmun. 1982; 36(2): 637-44.
Correspondencia:
Nicolás Suárez Machahuay
Dirección: Av. José María Eguren Nº 491, Urbanización San Joaquín, Ica, Perú.
Teléfono: (51)-056-216950.
Correo electrónico: nicsuarez@hotmail.com
Recibido: 14-01-09
Aprobado: 20-05-09