Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.26 n.3 Lima jul./set. 2009
Vigilancia nacional de la resistencia a medicamentos antituberculosos, Perú 2005-2006*
National surveillance of anti-tuberculosis drug resistance, Peru 2005-2006
Luis Asencios1,a, Neyda Quispe1,a, Alberto Mendoza-Ticona1,b, Elena Leo1,a, Lucy Vásquez1,a, Oswaldo Jave2,c, César Bonilla2,c
1 Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
2 Estrategia Sanitaria Nacional de Prevención y Control de la Tuberculosis, Ministerio de Salud. Lima, Perú.
a Biólogo; b Médico infectólogo; c Médico neumólogo
* Algunos resultados de este estudio forman parte del reporte mundial elaborado por la Organización Mundial de la Salud y se encuentran publicados en: World Health Organization. Anti-tuberculosis drug resistance in the World. Fourth Global Report. Geneva: WHO; 2008.
RESUMEN
Objetivo. Determinar la prevalencia de resistencia a medicamentos antituberculosos en el Perú. Materiales y métodos. Se realizó un muestreo por conglomerados en las 33 regiones de salud de Perú. Se utilizó el método de las proporciones de Canetti en medio sólido Lowenstein Jensen para la susceptibilidad de Mycobacterium tuberculosis a medicamentos antituberculosos con isoniacida (INH) rifampicina (RMP), estreptomicina (SM) y etambutol (EMB). Las cepas con resultado de TB MDR se sometieron a susceptibilidad a medicamentos de segunda línea por el método de las proporciones en agar 7H10, en placas. Resultados. Se analizaron 1809 cultivos de pacientes nuevos y 360 de antes tratados. El 51,6% residía en Lima y el 59,3% fueron varones. La prevalencia nacional de la resistencia primaria fue de 23,2% (IC95%: 21,3 - 25,1) y la resistencia adquirida fue de 41,7% (IC95%: 36,5 - 46,8). Se detectó 180 casos de TB MDR de los cuales la prevalencia de TB MDR primaria fue 5,3% (IC95%: 4,2 - 6,3) y la adquirida fue de 23,6% (IC95%: 19,2 – 28,0). El 20% de aislamientos de pacientes nunca tratados en Lima fueron resistentes a INH o RIF. La resistencia global y la TB MDR primarias fueron más prevalentes en Lima que en el resto del país. La TB XDR estuvo presente en el 5,9% de pacientes con TB MDR y el 36% de las cepas de TB MDR fueron resistentes a por lo menos una droga de segunda línea. Conclusiones. Comparado con los estudios previos, la resistencia a drogas antituberculosas primaria y adquirida se ha incrementado significativamente en los últimos 10 años en Perú.
Palabras clave: Tuberculosis, Resistencia a medicamentos; Agentes antituberculosos; Perú (fuente: DeCS BIREME).
ABSTRACT
Objective. To determine the anti-tuberculosis drug resistance prevalence in Peru. Material and methods. We performed a conglomerated sampling in 33 health regions from Peru. We used a Canneti proportions method in solid medium L-J for testing Mycobacterium tuberculosis susceptibility with isoniazid (INH) rifampicin (RMP), streptomycin (SM) and ethambutol (EMB). Strains with TB MDR was evaluated to second line drug susceptibility by proportion methods in 7H10 agar in plates. Results. We analyzed 1809 cultures from new patients and 360 pre treated. 51.6 coming from Lima and 59.3% were males. The national prevalence of primary resistance was 23.2% (CI95%: 21.3 - 25.1) and acquired resistance was 41.7% (95% CI: 36.5 - 46.8). We detected 180 TB MDR cases, the prevalence of primary TB MDR was 5.3% (95%CI: 4.2 - 6.3) and acquired was 23.6% (95%CI: 19.2 - 28.0). 20% of never treated patients isolated were resistant to INH or RIF. Global resistance and primary TB MDR were more prevalent in Lima than rest of the country. TB XDR was present in 5.9% of patients with TB MDR and 36% of TB MDR strains were resistant at least one secondline drug. Conclusions. Compared with previous studies, primary and acquired anti-tuberculosis drug resistant have significantly increased in the last 10 years in Peru.
Key words: Tuberculosis; Drug resistance; Antitubercular agents; Peru (source: MeSH NLM).
INTRODUCCIÓN
Se estima que la tercera parte del mundo está infectado por el M. tuberculosis y según reportes de la Organización Mundial de Salud, en el año 2006 se produjo en el mundo 9,2 millones de casos nuevos de tuberculosis (TB) (139 por 100 000 habitantes), de los cuales 500 000 fueron multidrogo resistentes (resistentes a isoniacida y rifampicina) y se produjeron 1,7 millones de muertes por tuberculosis (1).
La resistencia a drogas antituberculosas y la coinfección TB-VIH son una seria amenaza de los programas nacionales de control de TB en el mundo, principalmente en los países en desarrollo (2). La prevalencia de TB resistente, multidrogo resistente (TB MDR) y la reciente TB con resistencia extendida a drogas de segunda línea (TB XDR, resistencia a isoniacida, rifampicina, una fluoroquinolona y una droga parenteral de segunda línea) (3,4), son indicadores inversamente proporcionales a la efectividad de los programas nacionales de control de la tuberculosis; por lo que la determinación de su tendencia sirve para evaluar y optimizar las actividades de control que viene realizando el país (5-7).
En 1994, la Organización Mundial de la Salud (OMS) y la Unión Internacional Contra la Tuberculosis y Enfermedades Pulmonares (IUATLD) impulsaron el Proyecto Global de Vigilancia de la Resistencia a Drogas Antituberculosas con la finalidad de conocer la resistencia a estas drogas en el mundo siguiendo una misma metodología (8). En el Perú se han llevado a cabo dos estudios de vigilancia de acuerdo a las guías propuestas por OMS – IUATLD, en los años 1996 y 1999 (9,10).
El presente estudio fue diseñado e implementado para continuar la vigilancia de la resistencia a drogas antituberculosas a nivel nacional y evaluar su tendencia. El informe preliminar de esta vigilancia ha sido reportado a la OMS y los resultados principales han sido incluidos en el cuarto reporte de la resistencia a drogas antituberculosas en el mundo (11).
MATERIALES Y MÉTODOS
El tercer estudio de vigilancia nacional de resistencia a drogas antituberculosas, ha seguido las guías vigentes de la OMS (8). En Perú, el 58,7% de los casos de TB, el 80% de casos de MDR y el 91% de casos de TB XDR, se concentran en la ciudad de Lima, capital del Perú. La razón hombre/mujer es de 1,5 y el principal grupo de edad afectado es entre los 15 a 59 años (12).
Para determinar el número de pacientes nunca tratados se consideró el número total de casos nuevos de TB frotis positivo reportados en el año 2004: 18 289 casos, la prevalencia esperada de la resistencia primaria a isoniacida encontrada en el segundo estudio de vigilancia nacional de 1999: 3,4% (10), una precisión de 1,2% y un nivel de confianza de 95%. Se aplicó un factor de ajuste de 2, debido al muestreo por conglomerados. Finalmente se obtuvo un valor de 1678 personas a enrolar. Se consideró un 10% por posibles pérdidas.
Se realizó un muestreo por conglomerados proporcional a la población de las 33 regiones de salud de Perú. Se incluyeron en el estudio pacientes de ambos sexos y de todas las edades con diagnóstico de tuberculosis con baciloscopía de esputo positivo, quienes refirieron no tener antecedentes de tratamiento de la tuberculosis y dieron su consentimiento informado para participar en la investigación.
Se registraron datos de edad, sexo, región de salud, establecimiento de salud, antecedente de infección por VIH y antecedente de tratamiento tuberculoso previo. El estudio no consideró la realización de prueba serológicas para VIH en las personas enroladas. Los datos tomados por anamnesis directa fueron confirmados con los registros clínicos en cada centro de salud, y en los casos en los que se detectó TB MDR, se verificaron los datos en la Unidad Técnica Nacional de Tuberculosis MDR del programa nacional de control.
Siguiendo las guía de OMS, el muestreo para los pacientes antes tratados consistió en incluir a todos los pacientes con antecedentes de haber padecido tuberculosis y haber recibido tratamiento de por lo menos 30 días, detectados en los establecimientos de salud durante el periodo de enrolamiento de los pacientes nunca tratados (8). En este grupo se incluyó a pacientes con recaídas, abandonos recuperados, fracasos y pacientes crónicos.
Se emplearon los procedimientos estandarizados en el manual de normas técnicas del Instituto Nacional de Salud (INS) concordantes con los procedimientos de laboratorio recomendadas por la OPS/OMS. Los laboratorios locales realizaron la baciloscopía y la técnica de coloración fue de Ziehl Neelsen, los laboratorios intermedios realizaron los cultivos; para la descontaminación-digestión de las muestras se utilizó la solución de hidróxido de sodio al 4% y las siembras se efectuaron en dos tubos con medio Ogawa (13).
Antes del inicio del estudio, entre mayo y agosto del 2005, el Instituto de Salud Pública de Chile, Laboratorio Supranacional de la OMS para Perú, realizó una evaluación externa de la calidad de la prueba de susceptibilidad a drogas antituberculosas de primera línea con paneles de 20 cepas de referencia. El Laboratorio de Micobacterias del INS y el Laboratorio Regional de la Dirección de Salud (DISA) Lima Norte, calificaron para realizar la prueba de susceptibilidad por el método de las proporciones de Canetti, Rist y Grosset, variante económica (14). Se usaron las concentraciones críticas: isoniacida (INH) 0,2 μg/mL, rifampicina(RMP) 40 μg/mL, etambutol(EMB) 2 μg/ mL y estreptomicina(SM) 4 μg/mL. El laboratorio de la DISA Lima Norte, procesó la prueba de susceptibilidad para los casos asignados a su jurisdicción y el INS para el resto del país.
Durante el desarrollo del estudio, se envió al laboratorio supranacional de Chile 200 cepas resistentes y una proporción de sensibles de las pruebas de susceptibilidad procesadas para el control de calidad externo.
Las cepas con resistencia a rifampicina e isoniacida, fueron procesadas por el método de proporciones en agar 7H10 en placa para drogas de segunda línea: ciprofloxacina (CX) 2 μg/mL, kanamicina (KM) 5 μg/mL, etionamida (ETH) 5 ug/ml, capreomicina (CP) 10 ug/ml, ácido para amino salicílico (PAS) 2ug/ml y cicloserina (CS) 30 ug/ml, de acuerdo a guía para laboratorios de nivel III-CDC de Kent y Kubica (15). Se determinó cepas con resistencia extendida a drogas de segunda línea, es decir, resistencia a isoniacida, rifampicina, una quinolona y una droga parenteral de segunda línea (CX y KM o CX y CP) (12). El Laboratorio de Micobacterias del INS ha demostrado proficiencia satisfactoria en este método al participar en el programa de evaluación externa de la calidad por el Laboratorio Supranacional de la OMS del Estado de Massachusetts USA (Massachusetts State Laboratory Institute).
El protocolo fue revisado y aprobado por el Comité de Ética del INS y fue coordinado con la Estrategia Sanitaria Nacional de Prevención y Control de la Tuberculosis. Cada paciente enrolado dio su consentimiento informado a participar en el estudio y su médico tratante recibió el reporte de su prueba de susceptibilidad.
La información recolectada se registró electrónicamente en el Instituto Nacional de Salud (INS) y en la Estrategia Sanitaria Nacional de Prevención y Control de la Tuberculosis (ESN PCT). Los datos fueron ingresados al software SDRTB 4.1 de la OMS, para el análisis de datos. Se presentan datos agrupados con medidas de tendencia central y dispersión con intervalos de confianza al 95%. Se usó el estadístico Chi cuadrado para evaluar las diferencias de las proporciones entre grupos de interés epidemiológico y la tendencia de la resistencia con respecto a los estudios previos, considerando un valor de p< 0,05, como significativo.
RESULTADOS
CONTROL DE CALIDAD EXTERNO POR LABORATORIO SUPRANACIONAL.
La sensibilidad encontrada para INH, RIF, EMB y SM fue de 100%,100%, 100% y 94%, respectivamente. La especificidad en el mismo orden fue: 96%, 93%, 99%, 93% y la concordancia fue de: 95%, 97%, 98% y 94%, respectivamente. Los resultados obtenidos fueron calificados como satisfactorios por el laboratorio supranacional.
POBLACIÓN EVALUADA
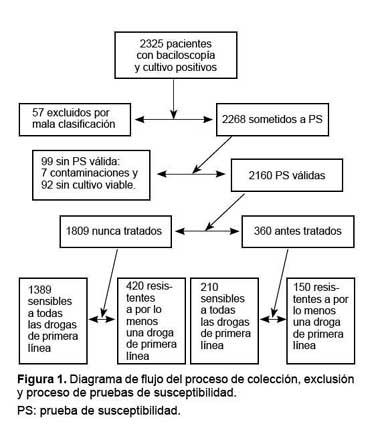
Se recibieron encuestas de 2325 pacientes. Se excluyeron 156 encuestas: 57 por duplicidad en el reporte o mala clasificación y 99 porque no se obtuvo un resultado válido de sus pruebas de susceptibilidad (92 sin desarrollo en los medios de control sin droga y 7 se contaminaron). Finalmente, se incluyeron en el análisis 2169 pacientes, de los cuales 1809 (83,4%) fueron nunca tratados y 360 (16,6%) fueron antes tratados. En la figura 1 se presenta el flujo de colección y exclusión del proceso de pruebas de susceptibilidad seguido.
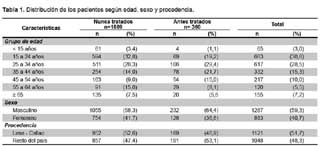
El 52,6% de casos nuevos y el 47% de antes tratados, residían en Lima y Callao. El 59,3% de los pacientes fueron de género masculino (razón hombre/mujer de 1,5) y la edad promedio fue de 34,1 ± 16,1 años con un rango de 1 a 97 años. En la tabla 1 se presenta la distribución de la población según grupos de edad, sexo y procedencia.
En 230 pacientes se pudo constatar una prueba de ELISA para VIH. En 12 (7,0%) de 171 pacientes nuevos y 4 (6,8%) de 59 pacientes antes tratados se reportó serología reactiva para VIH. En 34 pacientes con TB MDR se obtuvo el antecedente de infección por VIH, encontrándose un solo caso (2,9%) con resultado positivo.
RESULTADOS DE LA PRUEBA DE SUSCEPTIBILIDAD A DROGAS ANTI-TUBERCULOSAS DE PRIMERA LÍNEA
De los 2169 pacientes, 1599 (73,7%) fueron sensibles a las 4 drogas evaluadas y 570 (26,3%) fueron resistentes a por lo menos una droga. La prevalencia a nivel nacional de la resistencia a una o más drogas en pacientes nunca tratados (resistencia primaria) fue 23.2%, (IC95%: 21,3 - 25,1) y en pacientes antes tratados (resistencia adquirida) fue 41,7%, (IC95%: 36,5 - 46,8).
Se detectó 180 casos de TB MDR en los 2169 pacientes, haciendo una prevalencia global nacional de TB MDR de 8,3% (IC95%: 7,1 - 9,5). La prevalencia de TB MDR en pacientes nunca tratados fue de 5,3%, (IC95%: 4,2 - 6,3) y en pacientes antes tratados fue de 23,6%, (IC95%: 19,2 – 28).
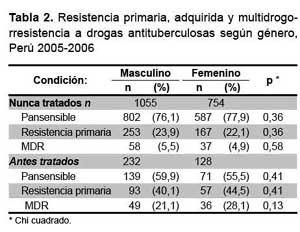
La prevalencia de resistencia global y TB MDR, primaria y adquirida, de acuerdo a género, se presenta en la tabla 2. En ningún caso se encontró diferencia estadísticamente significativa en la proporción de resistencia global o TB MDR según género.
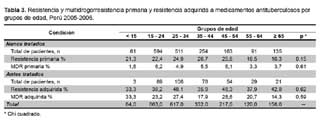
El mayor número de casos y la mayor proporción de TB MDR primaria se dio entre los 15 y 24 años y el mayor número de casos de TB MDR adquirida se dio entre los 25 y 34 años. Sin embargo, en el análisis de la proporción de la resistencia entre grupos de edad, no se produjeron diferencias estadísticamente significativas (Tabla 3).
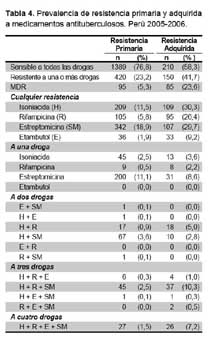
Los valores de la prevalencia a nivel nacional de cepas pansensibles, con resistencia primaria y adquirida a cualquier droga, monorresistencia, polirresistencia y multidrogorresistencia, se presenta en la tabla 4. En el grupo de nunca tratados la estreptomicina fue la droga que registró la mayor prevalencia de resistencia, seguido por isoniacida, rifampicina y etambutol. En los pacientes antes tratados la resistencia adquirida fue mayor a isoniacida seguido de estreptomicina; luego rifampicina y finalmente etambutol. La estreptomicina tuvo el valor más alto de monorresistencia tanto en casos nuevos como en antes tratados. La polirresistencia es más frecuente con estreptomicina, isoniacida y rifampicina.
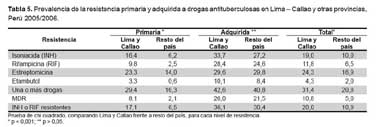
La resistencia a cualquier droga y la multidrogorresistencia primarias fueron estadísticamente mayores en Lima-Callao que en el resto de provincias del país (Tabla 5). En cambio en la resistencia adquirida no se observó esta misma diferencia. Se encontró que el residir en Lima y Callao se asoció con una mayor resistencia primaria, OR: 2,3 (IC95%: 1,7 - 2,7) y de TB MDR primaria, OR: 4,1 (IC95%: 2,4 - 7,2).
RESULTADOS DE LA PRUEBA DE SUSCEPTIBILIDAD A DROGAS ANTI-TUBERCULOSAS DE SEGUNDA LÍNEA
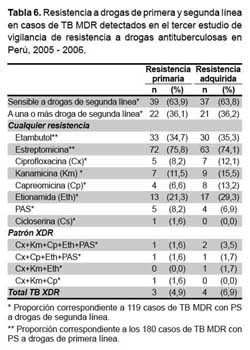
De los 180 pacientes con TB MDR, 95 fueron nunca tratados y 85 fueron antes tratados, de estos grupos se obtuvo, respectivamente, 61 (64%) y 58 (68%) resultados de susceptibilidad a drogas de segunda línea. La resistencia a drogas de segunda línea se presenta en la tabla 6. De las 119 cepas evaluadas, 7 (5,9%) cumplieron criterio de TB XDR, 3 en pacientes nunca tratados. El 36,1% de las cepas MDR de pacientes nunca tratados y el 36,2% de las cepas MDR de antes tratados fueron resistente a por lo menos una droga de segunda línea. La etionamida fue la droga de segunda línea con mayor prevalencia de resistencia primaria y secundaria, seguido por kanamicina y la cicloserina fue la droga con menor prevalencia de resistencia primaria o secundaria (Tabla 6).
DISCUSIÓN
La resistencia a drogas antituberculosas es un problema creado por el hombre y está relacionado con una administración inadecuada de esquemas de tratamiento y un pobre desempeño de las actividades en el primer nivel de atención de los programas de control (16); por ello la vigilancia nacional de la prevalencia de la resistencia a drogas antituberculosas es un indicador del desempeño del programa de control y provee información para optimizar las medidas de control y de tratamiento (5). Los resultados obtenidos permiten establecer la tendencia de la resistencia a las drogas antituberculosas en el Perú en los últimos 10 años, debido a que se ha realizado estudios de vigilancia nacional en los años 1996 y 1999 con la misma metodología propuesta por la OMS (8).
El presente estudio ha cumplido con los estándares de representatividad de la población dado que se mantuvo la proporcionalidad en cuanto a edad, sexo y procedencia de la población. Los resultados satisfactorios de la evaluación externa de la calidad por el laboratorio supranacional correspondiente, garantizan la calidad de los resultados reportados (8). Como es de esperar el sexo y el grupo de edad fueron factores independientes a la ocurrencia de TB resistente y TB MDR en Perú.
RESISTENCIA A DROGAS DE PRIMERA LÍNEA
En el contexto del cuarto reporte de la resistencia entre el 2004 y 2007 de la OMS (11), el 23,2% de resistencia primaria reportada en el tercer estudio de vigilancia nacional, sitúa a Perú en el segundo lugar en la región de las Américas, precedido por Guatemala; y en el primer lugar en cuanto a la TB MDR primaria con 5,3% registrado. En números absolutos, considerando que cada año se reportan 35 000 casos de TB en Perú (12) y según el 8,3% de prevalencia de TB MDR en general, se espera que cada año se produzcan 2905 pacientes con TB MDR. La OMS, considerando el subregistro y otras variables, ha estimado que en Perú en el 2006 se han producido 3972 casos de TB MDR (IC95%: 2842 - 5192) (11). Estas cifras de pacientes con TB MDR convierten a Perú en el país con mayor carga de TB resistente en la región.
En cuanto a la resistencia adquirida, existe la probabilidad de no reflejar la real magnitud del problema porque tiene un número limitado de casos evaluados, la metodología planteada por la OMS, está diseñada para calcular muestra para casos nuevos. Además en el Perú se han producido cambios frecuentes en las políticas de terapia de pacientes antes tratados y este grupo de pacientes constituye un grupo muy heterogéneo de pacientes, que no son completamente diferenciados en las actuales directivas de OMS (8). En tal sentido, la inclusión o no de pacientes crónicos que han recibido varios esquemas terapéuticos y que continúan con enfermedad activa, no se encuentra expresamente indicada en las guías de vigilancia; por tal motivo, en los estudios de 1996 y 1999 los casos crónicos, fueron excluidos del análisis final; sin embargo, en nuestro estudio, estos casos fueron incluidos en el análisis. Esta decisión puede explicar la alta prevalencia de la resistencia adquirida en este reporte comparado con la vigilancia de años previos.
Para conocer mejor la situación real de la resistencia en pacientes antes tratados es necesario realizar la vigilancia de la resistencia adquirida con mejores criterios de representatividad, porque es precisamente en esta población donde se tiene la mayor proporción de casos de TB resistente y TB MDR (17).
Como en otros países con alta carga de TB resistente, la estreptomicina es la droga de primera línea que tiene la prevalencia más alta de resistencia primaria en Perú con 18,9%. Esta realidad es similar a lo reportado en Irán con 23,8% de resistencia primaria a SM (18), en Benin, 20,1% (19); en el sur de la India, 23,6% (20), Lituania, 21,6% (21), Hanoi, Vietnam, 29% (22) entre otros; por lo que consideramos que la SM en países con alta prevalencia de resistencia primaria, debiera ser usada sólo cuando se haya demostrado su susceptibilidad in vitro. Lamentablemente la SM se continúa usando en el esquema primario empírico en Perú y en muchos de estos países para pacientes antes tratados (esquema dos), en quienes la prevalencia de la resistencia a SM fue aún mayor, 29,7%; por lo que la actual recomendación del uso de SM en esquemas acortados empíricos debe ser revisada en países con alta prevalencia de resistencia (23,24). Por otro lado, etambutol aún conserva altos valores de sensibilidad por lo que junto con pirazinamida, deben administrarse junto a drogas antituberculosas con alta probabilidad de eficacia para evitar el desarrollo de resistencia (25).
Los datos de resistencia primaria son estadísticamente mayores en Lima y Callao que en el resto del país, lo que refleja la mayor transmisión urbana de la TB y TB resistente en Perú. Este fenómeno debe orientar la oportunidad y precisión de las intervenciones de control dados los recursos limitados que cuenta el país. En cambio la resistencia adquirida no es diferente entre Lima y las demás provincias; para estos pacientes es determinante el antecedente de historia de tuberculosis previa antes que el lugar de residencia.
Otro hallazgo significativo es que el 20% de los pacientes de Lima y 11% de otras provincias del país tienen cepas resistentes a INH o RIF. La resistencia a una o las dos drogas ha demostrado ser un factor de riesgo altamente significativo de fracaso de los esquemas empíricos acortados. Según el estudio multicéntrico de Espinal et al. (24) esta propuesta de tratamiento empírico acortado debe ser revisada en escenarios con alta resistencia como Perú.
TENDENCIA DE LA RESISTENCIA A DROGAS ANTITUBERCULOSAS DE PRIMERA LÍNEA
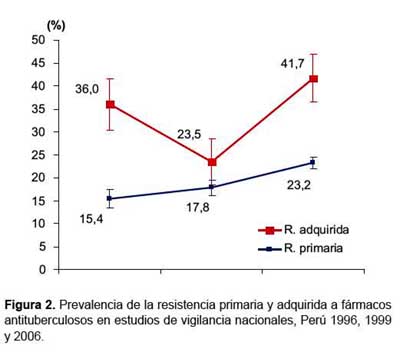
En las figuras 2 y 3 se muestran la tendencia de la resistencia a drogas antituberculosas en el Perú según los estudios de 1996, 1999 y el presente reporte. En cuanto a la resistencia global y TB MDR primarias se evidencia un incremento a lo largo de los años, observándose que los intervalos de confianza al 95% entre 1999 y 2006 no se sobreponen, lo que claramente demuestra el aumento significativo de la prevalencia de la resistencia y multidrogo-resistencia primaria en el país en los últimos 10 años.
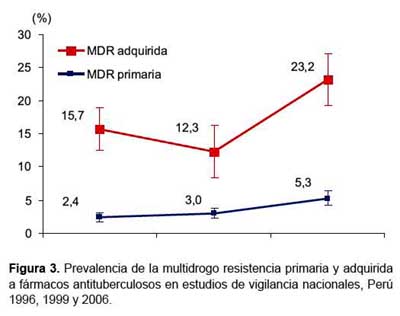
El incremento de la resistencia primaria y secundaria no es coherente en un escenario donde la estrategia DOTS alcanza al 100% de la cobertura nacional, con la estrategia DOTS Plus implementada en áreas de elevado riesgo de TB MDR y la expansión progresiva de la estrategia STOP TB. Esta realidad también ha sido vista en países como Corea (26) donde se evidenció un incremento estadísticamente significativo de la resistencia en casos nuevos en un periodo entre 1994 y 2004 a pesar de contar con un programa con cobertura nacional y con una prevalencia baja de TB MDR. Sin embargo, la justificación de este incremento se debió a una mejor cobertura en el reporte del sector privado (11). Esta misma realidad, aunque en menor grado, se ha visto en Vietnam, que igual que Perú, fue premiado por su exitoso programa de control de tuberculosis por la extensión de la estrategia DOTS, a pesar de esto se registra una alta prevalencia de resistencia a drogas antituberculosas (27).
La explicación de este fenómeno es aún incierta, pero deja ver que la estrategia DOTS no es suficiente para lograr el control oportuno de la TB en países en desarrollo y con alta carga de enfermedad. Si bien al inicio de su implementación, la efectividad del DOTS fue notable al reducir la morbilidad por TB; este logro no se ha mantenido constante y en nuestro país ha desacelerado al punto de mantenerse en una meseta en los últimos años con tasas de incidencia mayores a 120 casos por 100 000 habitantes, que nos ubica siempre en el segundo lugar a nivel de América después de Haití (1), y lo que es más grave se ha desencadenado una alta incidencia de fracasos a los esquemas cortos, cuya causa hasta en un 88%, ha sido la ocurrencia de TB MDR (28).
A mayor tiempo de la presencia de drogas antituberculosas en un país con alta morbilidad tuberculosa y con debilitamiento del sistema de salud, existe un alto riesgo de generar progresivamente resistencia bajo condiciones de un programa de control (29). En tal sentido, el incremento de la resistencia en Perú puede explicarse como consecuencia de una mala decisión política en los primeros años del presente siglo, que cambió el programa vertical de control de la TB, a un programa de control horizontal. Luego de 10 años de mantener un programa con establecimientos de salud locales y regionales acostumbrados a recibir pasivamente del nivel central las políticas y recursos para actividades de captación de sintomáticos respiratorios, diagnóstico y tratamiento, el cambio de política y la descentralización del sector salud, hizo que las autoridades regionales y locales no asuman como propia la morbilidad tuberculosa y continúen esperando recursos del gobierno central para cumplir con la promoción y control de la tuberculosis de sus jurisdicciones. Todo esto no hizo más que debilitar al programa de control de tuberculosis, que pasó a llamarse la Estrategia Sanitaria Nacional de Prevención y Control de la Tuberculosis, que en la actualidad no es un organismo ejecutivo, sino eminentemente técnico asesor sin presupuesto para actividades a nivel nacional.
Otras causas del debilitamiento del programa nacional en Perú, han sido la falta de soporte y fortalecimiento de la red de laboratorios de tuberculosis, la falta de capacitación y estabilidad laboral del personal de salud, agravado por el frecuente contagio de TB en establecimientos de salud, donde nadie quiere asumir sus funciones, y la estigmatización de que trabajar en TB es considerado una forma de sanción al personal de salud que suele incumplir sus funciones, disminuyendo la calidad del recurso humano dedicado a esta enfermedad en establecimientos de salud del país (30). Todas estas causas vienen siendo atendidas con recursos financieros nacionales y tres rondas del Fondo Mundial, por lo que se espera mejorar la efectividad de la estrategia en los siguientes años (31).
RESISTENCIA A DROGAS DE SEGUNDA LÍNEA
Desde el año 2005 el Laboratorio de Micobacterias de Referencia Nacional de Perú ha validado y da el servicio a pruebas de susceptibilidad a drogas segunda línea a todo paciente detectado con TB MDR a nivel nacional, bajo la evaluación externa del Laboratorio Supranacional de la OMS en Massachusetts USA. Entre el 2005 y 2008 hemos detectado 3871 personas con TB MDR, de las cuales 2901 tuvieron una prueba válida de susceptibilidad a drogas de segunda línea, detectándose 173 (5,9 %) personas con TB XDR, que es el mismo resultado encontrado en este estudio y similar al 6,4% reportado en el primer semestre del año 2007 (32), a pesar de que sólo se evaluó al 70% del total de pacientes con TB MDR.
Esta prevalencia es menor al 7% reportado en el cuarto reporte de resistencia de la OMS en 35 países y al 10% de nueve países de la ex repúblicas socialistas soviéticas que reportaron a OMS (11). Sin embargo, constituye el valor más alto reportado en América, por encima del 3% reportado en EEUU (33) y otros países de la región (11).
El 90% de los casos de TB XDR en Perú, se concentra en la capital Lima (32), por lo que es imperativa una intervención para evitar la expansión de este tipo de cepas al resto del país, como viene sucediendo con la TB MDR. La susceptibilidad a drogas de segunda línea reportada es importante para la elaboración de esquemas de re-tratamiento empíricos en el país, por lo que se viene observando resistencia a etionamida, medicamento de administración oral y kanamicina, de administración parenteral, por lo que se debe evaluar su utilización en esquemas empíricos de retratamiento en Perú.
Se concluye que se ha producido un incremento significativo de la prevalencia de la resistencia a drogas antituberculosas en el Perú. Se han hecho medidas correctivas que esperamos se reflejen en mejores cifras de desempeño de la ESNPCT, lo que deberá ser corroborado en el siguiente estudio nacional de vigilancia de la resistencia a drogas antituberculosas y la tendencia de los indicadores de incidencia y morbilidad. Los datos de la resistencia adquirida en este estudio son referenciales por lo que es necesario realizar un estudio de resistencia en pacientes antes tratados con una mejor representatividad de la población.
AGRADECIMIENTOS
A todo el personal de salud de la Red de Laboratorios de Salud Pública del Ministerio de Salud del Perú y al personal de las Estrategias Sanitarias de Prevención y Control de la Tuberculosis de cada uno de los establecimientos de salud que participaron en el estudio. Un especial reconocimiento a los coordinadores de la Estrategia Regional de Prevención y Control de la Tuberculosis y responsables del Laboratorio de Tuberculosis de Salud Pública de las 33 Direcciones de Salud (DISA) de Perú, ya que sin su apoyo no hubiese sido posible realizar este estudio:
DISA Lima Norte: Dr. Juan Saravia y TM. Hugo Cornejo; DISA Lima Ciudad: Dr. Miguel Saavedra y Dra. Gloria Yale; DISA Lima Este: Dr. Cayo Salazar y Blga. Carmen Suárez; DISA Lima Sur: Dra. Silvia Suarez y Dr. Alfredo Torres; DISA Callao: Lic. Adriana Valencia y Dr. Ivan Sabogal; DISA Amazonas: Dra. Luz Salazar y Blgo. Lisandro Gonzales; DISA Ancash: Lic. Bigida Vílchez y Blgo. Alicia Enriquez; DISA Apurímac I: Blgo. Darwin Pezo; DISA Apurímac II: Lic. Violeta Campos y Blgo. Merly; DISA Arequipa: Dr. Fredy Delgado y Blga. Mary Perea; DISA Ayacucho: Maura Arbaiza y Blga. Miriam Meneses; DISA Bagua: Lic. Hurtado Elbia y Blgo. Edison Purizaga; DISA Cajamarca: Magda Ramirez y MV. Boyd Saucedo; DISA Cusco: Lic. Angélica Zapata y Blgo. Luis Ayma; DISA Huancavelica: Blga. Ana Gonzales; DISA Huánuco: M. Salcedo y Blga. Margarita Zuñiga; DISA Ica: Dra. Graciela Guillén y Dra. Nancy Brizuela; DISA Jaén: Lic. Eugenia López y Blga. Lucinda Troyes; DISA Junín: Lic. Flor Berríos y Blgo. Lidia Llantoy; DISA La Libertad: Lic. Lucy Barrantes y Blgo. Percy Amat; DISA Lambayeque: Lic. Blgo. Oscar Horna; DISA Loreto: Blgo. Ernesto Curto; DISA Madre de Dios: Blgo. Carlos Peralta; DISA Moquegua: Eliana Alfaro y Dr. Germán Ocampo; DISA Pasco: Rosabel Lino y Blgo. Vilma de la Cruz; DISA Piura I: Blgo. Rosa Elena Cruz; DISA Piura II: Lic. Vilma Aguilar; DISA Puno: Blgo. Vicente Quispe; DISA San Martín: Blgo. Reney Melgar; DISA Tacna: Lic. Iris Guisa y Blgo. Verónica Machaca; DISA Tumbes: Lic. Balbina Vílchez, Blga. Isabel Martínez, DISA Ucayali: Blgo. Wilson Meza y al personal de la unidad de la Estrategia Nacional de Prevención y Control de la Tuberculosis del MINSA: Dr. Cesar Herrera, Dra. Yvonne Cortez, Lic. Rula Aylas, Lic. Eladia Quispe y Lic. Ana M. Chávez.
Fuente de Financiamiento
Estudio financiado por el Instituto Nacional de Salud, Proyecto Vigía de USAID y Organización Mundial de Salud.
Conflictos de Interés
Los autores declaran no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. World Health Organization. WHO report: global tuberculosis control surveillance, planning, financing. Geneva: WHO: 2008.
2. Aziz MA, Wright A, Laszlo A, De Muynck A, Portaels F, Van Deun A, et al. Epidemiology of antituberculosis drug resistance (the Global Project on Anti-tuberculosis Drug Resistance Surveillance) an updated analysis. Lancet 2006; 368: 2142-54.
3. World Health Organization. Report of the meeting of the WHO Global Task Force on XDR-TB. Geneva: WHO; 2006.
4. Centers for Disease Control and Prevention. Emergence of Mycobacterium tuberculosis with extensive resistance to second-line drugs-worldwide, 2000-2004. MMWR Morb Mortal Wkly Rep. 2006; 55(11): 301-5.
5. Van Deun A, Salim AH, Daru P, Das AP, Aung KG, Hossain MA, et al. Drug resistance monitoring: combined rates may be the best indicator of programme performance. Int J Tuberc Lung Dis. 2004; 8(1): 23-30.
6. Raviglione M, Smith IM. XDR tuberculosis--implications for global public health. N Engl J Med. 2008; 356: 656-59.
7. Van Rie A, Enarson D. XDR tuberculosis: an indicator of public-health negligence. Lancet. 2006; 368(7): 1554-56.
8. World Health Organization. Guidelines for surveillance of drug resistance in tuberculosis. Geneva: WHO; 2003.
9. Vásquez L, Asencios L, Quispe N, Díaz S, Carrillo C, Portocarrero J, et al. Vigilancia de la resistencia a los medicamentos antituberculosos en el Perú, 1995-96. Rev Med Exp. 1997; 14(1): 5-14.
10. Instituto Nacional de Salud. Vigilancia de la resistencia a los medicamentos antituberculosos en el Perú, 1999. Lima: Instituto Nacional de Salud; 2000.
11. World Health Organization. Anti-tuberculosis drug resistance in the world. Fourth Global Report. Geneva: WHO; 2008. WHO/HTM/TB/2008.394.
12. Perú, Ministerio de Salud. Evaluación de la Estrategia Sanitaria Nacional de Prevención y Control de la Tuberculosis año 2006. Lima: MINSA; 2007.
13. Instituto Nacional de Salud. Manual de normas y procedimientos en bacteriología de tuberculosis. Lima: INS; 1995. Serie de Normas Técnicas N.° 10.
14. Canetti G, Froman S, Grosset J, Hauduroy P, Langerová M, Mahler HT, et al. Mycobacteria: laboratory methods for testing drug sensitivity and resistance. Bull World Health Organ. 1963; 29: 565-78.
15. Kent P, Kubica G. Public health mycobacteriology. A guide for the level III laboratory. Atlanta: CDC; 1985.
16. Gillespie SH. Evolution of drug resistance in Mycobacterium tuberculosis: clinical and molecular perspective. Antimicrob Agents Chemother. 2002; 46(2): 267-74.
17. Van Deun A, Salim AH, Rigouts L, Rahman M, Fissette K, Portaels F. Evaluation of tuberculosis control by periodic or routine susceptibility testing in previously treated cases. Int J Tuberc Lung Dis. 2001; 5(4): 329-38.
18. Namaei MH, Sadeghian A, Naderinasab M, Ziaee M. Prevalence of primary drug resistant Mycobacterium tuberculosisin Mashhad, Iran. Indian J Med Res. 2006; 124(1): 77-80.
19. Affolabi D, Adjagba OA, Tanimomo-Kledjo B, Gninafon M, Anagonou SY, Portaels F. Anti-tuberculosis drug resistance among new and previously treated pulmonary tuberculosis patients in Cotonou, Benin. Int J Tuberc Lung Dis. 2007; 11(11): 1221-24
20. Joseph MR, Shoby CT, Amma GR, Chauhan LS, Paramasivan CN. Surveillance of anti-tuberculosis drug resistance in Ernakulam District, Kerala State, South India. Int J Tuberc Lung Dis. 2007; 11(4): 443-49.
21. Dewan P, Sosnovskaja A, Thomsen V, Cicenaite J, Laserson K, Johansen I, et al. High prevalence of drug-resistant tuberculosis, Republic of Lithuania, 2002. Int Tuberc Lung Dis. 2005; 9(2): 170-74
22. Quy HT, Buu TN, Cobelens FG, Lan NT, Lambregts CS, Borgdorff MW. Drug resistance among smear-positive tuberculosis patients in Ho Chi Minh City, Vietnam. Int J Tuberc Lung Dis. 2006; 10(2):160-66.
23. Quy HT, Lan NT, Borgdorff MW, Grosset J, Linh PD, Tung LB, et al. Drug resistance among failure and relapse cases of tuberculosis: is the standard re-treatment regimen adequate? Int J Tuberc Lung Dis. 2003; 7(7): 631-36.
24. Espinal MA, Kim SJ, Suarez PG, Kam KM, Khomenko AG, Migliori GB, Baez J, Kochi A, Dye C, Raviglione MC. Standard short-course chemotherapy for drug-resistant tuberculosis: treatment outcome in six countries. JAMA 2000; 283(19): 2537-45.
25. World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis. Emergency update 2008. Geneva: WHO; 2008.
26. Bai GH, Park YK, Choi YW, Bai JI, Kim HJ, Chang CL, et al. Trend of antituberculosis drug resistance in Korea, 1994 – 2004. Int J Tuber Lung Dis. 2007; 11(5): 571-76.
27. Khuê PM, Phuc TQ, Hung NV, Jarlier V, Robert J. Drug resistance and HIV co-infection among pulmonary tuberculosis patients in Haiphong City, Vietnam. Int J Tuberc Lung Dis. 2008; 12(7): 763-68.
28. Saravia JC, Appleton SC, Rich ML, Sarria M, Bayona J, Becerra MC. Retreatment management strategies when first-line tuberculosis therapy fails. Int J Tuberc Lung Dis. 2005; 9(4): 421-29.
29. Caminero JA. Likelihood of generating multidrug-resistant and extensively drug-resistant tuberculosis under the Nacional Tuberculosis Programme conditions. Int J Tuberc Lung Dis. 2008; 12(8): 869-77.
30. Smith-Nonini, S. When "the program is good, but the disease is better": Lessons from Peru on drug-resistant tuberculosis. Med Anthropol. 2005; 24(3): 265-96.
31. Perú, Ministerio de Salud. Situación de la tuberculosis en el Perú. Informe de Gestión 2008. Lima: MINSA; 2008.
32. Mendoza-Ticona A, Asencios-Solis L, Quispe-Torres N, Leo-Hurtado E. Evidencia de tuberculosis con resistencia extendida a drogas de segunda línea (TB XDR) en el Perú. Rev Peru Med Exp Salud Publica. 2007; 24(3): 313-14.
33. Shan NS, Pratt R, Armstrong L, Robinson V, Castro KG, Cegielski JP. Extensively drug-resistant tuberculosis in the United States, 1993-2007. JAMA. 2008; 300(18): 2153-60.
Correspondencia:
Blgo. Luis Asencios Solis.
Dirección: Cápac Yupanqui 1400, Lima 11, Perú.
Teléfono: (511) 617-6200 anexo 2141
Correo electrónico: lasencios@ins.gob.pe
Recibido: 08-05-09
Aprobado: 20-09-09