Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.26 n.3 Lima jul./set. 2009
Historia de obesidad como factor asociado al cáncer de mama en pacientes de un hospital público del Perú
History of obesity as risk factor for breast cancer in patients at a public hospital in Peru
José Rojas-Camayo1,a, Iván Huamaní2,a
1 Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Facultad de Medicina, Universidad Privada San Juan Bautista. Lima, Perú.
a Médico Cirujano.
RESUMEN
Realizamos un estudio de casos y controles, en 123 pacientes con diagnóstico de cáncer mamario (casos) y 208 pacientes sanas (controles). En la medición se consideró el índice de masa corporal (IMC) antiguo (peso promedio de la vida adulta de la persona) e IMC actual (peso cuantificado al momento de efectuar la investigación) y otros factores de riesgo conocidos. Los IMC antiguos mostraron un riesgo incrementado tanto en mujeres en la premenopausia: sobrepeso OR: 7,29 (IC95%: 1,75 - 30,38) y obesidad OR: 23,43 (IC95%: 2,4 - 229.7); como en mujeres posmenopáusicas: obesidad OR: 3,33 (IC95%: 1,54 - 7,19) y obesidad OR: 6,04 (IC95%: 1,78 - 20,50). Por otro lado, al evaluar el IMC actual, se encontró asociación en las premenopáusicas donde el sobrepeso es un factor protector OR: 0,23 (IC95%: 0,05 - 0,99) y la obesidad no muestra asociación OR: 0,37 (IC95%: 0,08 - 1,8), asimismo, en las posmenopáusicas no se evidenció asociación con el sobrepeso OR: 0,79 (IC95%:0,35 - 1,85) ni con la obesidad OR: 1,19 (IC95%: 0,42 - 3,38). Se concluye que la historia de obesidad está asociada con un incremento de riesgo de cáncer mamario tanto en mujeres premenopáusicas y posmenopáusicas.
Palabras clave: Cáncer de mama; Obesidad; Sobrepeso; Menopausia; Perú (fuente DeCS: BIREME).
ABSTRACT
A case control study was performed including 123 patients with breast cancer diagnosis as cases and 208 healthy women as controls. For analysing obesity we had two parameters: Past BMI (with weight during a long period of patients lifetime) and current IMC (with quantified current weight). Also other known risk factors were included. Past BMI shown increased risk both in premenopausal women: in 25.0-29.99 kg/m2 OR:7.29(CI95%:1.752-30.38); in ≥ 30.0 kg/m2 OR:23.43(CI95%:2.401–229.7); as in postmenopausal women: in 25.0-29.99 kg/m2 OR:3.33(CI95%:1.54-7.19); in ≥30.0 kg/m2 OR:6.04(CI95%:1.78-20.50). On the other hand current BMI didnt show the same association both in premenopausal women: in 25.0-29.99 kg/m2 OR:0.229(CI95%:0.053-0.99); in ≥30.0kg/m2 OR:0.369 (CI95%:0.076– 1.802); as in postmenopausal women: in 25.0-29.99 kg/m2 OR:0.79(CI95%:0.35-1.85); in ≥ 30.0 kg/m2 OR:1.19(CI95%: 0.42–3.38). In conclusion, the history of obesity is associated with increased risk of breast cancer both in premenopausal and postmenopausal women
Key words: Breast cancer; Obesity; Overweight; Menopause; Peru (source: MeSH NLM).
INTRODUCIÓN
El cáncer de mama es un problema de salud pública a nivel mundial, según estimados en el 2002, hubieron alrededor de 1 151 298 nuevos casos diagnosticados y 410 712 muertes causadas por esta enfermedad y más de 4,4 millones de mujeres en el mundo viven con cáncer de mama (1). Entre los factores de riesgo se mencionan la edad, el hecho de vivir en un país desarrollado, menarquia temprana, menopausia tardía, edad tardía al primer hijo, mujeres que no dieron de lactar, historia familiar, antecedente de hiperplasia atípica, obesidad posmenopáusica, consumo de alcohol, exposición a radiación ionizante, uso de terapia de reemplazo hormonal, uso de anticonceptivos hormonales y dietilbestrol (1-10).
Se menciona que la obesidad tiene un efecto dual en el riesgo de cáncer de mama (11,12); en las mujeres premenopáusicas en la mayoría de los estudios casocontrol y de cohortes se ha encontrado una asociación inversa entre el peso y el riesgo de cáncer de mama (11,13-17). Sin embargo, en mujeres posmenopáusicas la mayoría de estudios epidemiológicos reportan un riesgo incrementado de desarrollar cáncer mamario en mujeres con obesidad (11,18-22). Se postula que las mujeres obesas premenopáusicas podrían tener un mayor de grado de anovulación, resultando en menores niveles de progesterona y estradiol, conduciendo a tasas bajas de división de células mamarias y consecuentemente menor riesgo de cáncer (23,24). Por otro lado las mujeres obesas postmenopáusicas podrían tener su riesgo incrementado debido a los altos niveles de estrógeno circulante secundario al incremento de la conversión de andrógenos en estrógeno por el tejido adiposo (25) y una alta proporción de estrógeno biodisponible debido a los bajos niveles de la globulina transportadora de hormonas sexuales producida por la obesidad (26).
Se menciona que las mujeres hispánicas podrían tener un fenotipo diferente de cáncer mamario distinto a las mujeres blancas no-hispánicas, se ha encontrado que en las mujeres hispanas el incremento de la obesidad estuvo asociado de forma inversa con el tamaño tumoral y con una menor extensión, y compromiso de nódulos, todo lo contrario que sucede las mujeres blancas no hispánicas (27).
Resulta interesante evaluar la historia de obesidad y su relación con el riesgo de cáncer mamario en una población con raíces hispánica como la nuestra donde no se han realizado estudios previos.
EL ESTUDIO
Se realizó un estudio observacional analítico de casos y controles desde julio del 2006 a marzo del 2008, en el Hospital Nacional Arzobispo Loayza, en la ciudad de Lima en Perú, en los consultorios de atención ambulatoria de la sección de mamografía del Servicio de Radiología y el servicio de Oncología Médica.
Se tomaron como casos a las pacientes mujeres del servicio de Oncología Médica con diagnóstico confirmado de cáncer de mama (casos prevalentes), por su parte, los controles fueron pacientes que acudían al servicio de Radiología en la sección de mamografía y que tuvieran como informe radiológico BIRADS 1 ó 2 (Breast Imaging and Data System) (28), sin antecedentes personales de cáncer de mama.
En ambos grupos, previa aceptación del consentimiento informado, se realizó una entrevista de forma ciega e independiente usando un cuestionario estructurado que abordó datos acerca de la edad, paridad, lactancia materna, menarquia, estado menopáusico, edad de la menopausia, historia familiar de cáncer mamario, uso de anticonceptivos hormonales, uso de terapia de reemplazo hormonal, consumo de tabaco y consumo de alcohol. Los datos antropométricos obtenidos se centraron en lo referido por el paciente con respecto al peso promedio la mayor parte de su vida adulta y la variación de peso durante los últimos doce meses, y con la medición directa del peso y talla en el momento de la entrevista con instrumentos calibrados. Además, en el caso de las pacientes con cáncer de mama se consignó la edad al diagnóstico y el tipo histológico; y en las pacientes control se consignó el BIRADS 1 ó 2.
La historia de obesidad se definió como el IMC antiguo calculado a partir del peso promedio en la mayor parte de la vida adulta, todas las mujeres del estudio eran mayores de 30 años, esta alternativa es válida y viable en el sentido que es improbable encontrar la cuantificación exacta del peso. La literatura donde se mostró que el autorreporte del peso es confiable y puede ser usado en investigaciones donde no se pueda obtener un peso cuantificado previo (28). Esto se refuerza con la alta concordancia encontrada por nosotros entre el peso estimado por las personas y lo obtenido en una balanza calibrada.
Basados en un estudio previo donde reportan porcentaje de obesidad como parte de una de sus variables (10) se calculó de la muestra con el software Epiinfo versión 6.0, considerando un 95% de confianza, el 90% de potencia y una razón controles casos de 2, requiriéndose como mínimo 104 casos y 208 controles.
Para efectos del análisis estadístico usamos el software Statistical Package for Social Sciences (SPSS) versión 15.0. La comparación de las variables cuantitativas entre ambos grupos de estudio se realizó con la prueba t de student. Además, se efectuó un modelo multivariado de regresión logística considerando como variable de respuesta el cáncer de mama, se realizó la prueba de linealidad de cada una de las variables de exposición no dicotómicas que ingresaron al modelo, en aquellas que no se comprobó se optó por la transformación a variables dummies. Se realizó la prueba de bondad de ajuste de Hoshmer Lemeshow. Se consideró un p<0,05 como significatvo.
HALLAZGOS
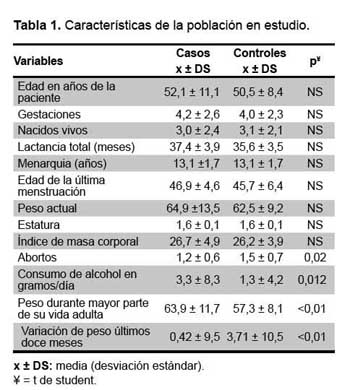
Participaron del estudio 123 casos y 208 controles, no encontramos diferencias estadísticamente significativas entre ambos grupos en cuanto a edad, paridad, lactancia total, menarquía, peso actual, talla actual, índice de masa corporal actual. Sin embargo, observamos diferencia en el consumo de alcohol en gramos/día (p<0,05) y de manera muy significativa en el peso la mayor parte de su vida adulta (p<0,001), asimismo, se observó una ganancia de peso en los últimos meses de 0,42 kg en los casos y de 3,71 en los controles (p<0,01). En la Tabla 1 podemos visualizar las características generales de las personas que fueron estudiadas.
En la Tabla 2 se presenta la evaluación de diferentes factores de riesgo de cáncer de mama, analizados en un modelo de regresión logística, observamos que la edad al primer hijo, la lactancia materna, el antecedente familiar de cáncer de mama, el haber usado anticonceptivos hormonales, el consumo de tabaco y el consumo de alcohol no mostraron asociación. Amerita mencionar que el uso de terapia de reemplazo hormonal (TRH) tuvo un efecto protector, explicado en el hecho que las pacientes del grupo control fueron las que las acudían al servicio de mamografía a realizarse un examen de control precisamente por ser usuarias de TRH. En la sección que corresponde al IMC, encontramos diferencias interesantes; el peso actual no mostró asociación alguna, situación contraria ocurrió con el IMC antiguo y con el peso de la mayor parte de la vida adulta, donde se observa que teniendo como grupo de comparación a las de IMC normal, el grupo de sobrepeso tuvo un OR significativo de 3,83 (IC 95%: 2,01 - 7,27) y el grupo con obesidad presentó un OR significativo mucho mayor de 7,38 (IC 95%: 2,66 - 20,85).
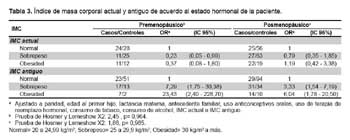
En la Tabla 3 se muestra la asociación entre el IMC con el riesgo de cáncer de mama, estratificado según el estado menopáusico. Se visualiza que en las premenopáusicas, el sobrepeso actual sería un factor protector, en cambio, la obesidad tiende a la protección pero esto no es estadísticamente significativo. En las posmenopáusicas, el sobrepeso y obesidad actuales no presentaron asociación relevante con el desarrollo de cáncer de mama. En cuanto al IMC a lo largo de su vida adulta, se visualiza que frente a las mujeres con peso normal, que tanto el grupo de mujeres con sobrepeso y con obesidad se asocian al desarrollo de cáncer de mama, tanto en la menopausia como en la posmenopausia.
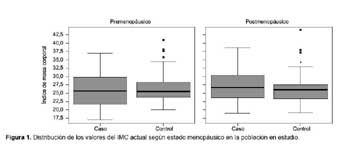
En la Figura 1 se presenta un gráfico de cajas donde se visualiza al IMC actual según el estado menopáusico, se observa que en la premenopausia las mujeres con diagnóstico de cáncer tiene una mediana similar del IMC actual frente a los controles, aunque puede observarse una mayor variación en los cuartiles de éste grupo. En la posmenopausia, se evidencia una mínima diferencia en la mediana del IMC actual entre casos y controles con una mayor variación en los cuartiles en los primeros.
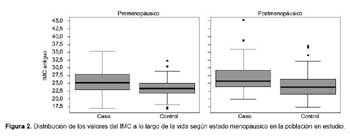
En la Figura 2 se presentan otro gráfico de cajas basado en los IMC a lo largo de la vida en ambos estados menopáusicos; en las mujeres con cáncer mamario diagnosticado en la premenopausia, se visualiza que la mediana es mayor que las pacientes control, asimismo los cuartiles toman valores superiores comparados con sus respectivos controles. En la posmenopausia, esta diferencia es aún más marcada, observando además de que la mediana toma un valor superior a la de los controles, su cuartil inferior esta incluso casi al nivel de la mediana de los controles.
Cuando se exploró acerca de la variación del peso en los últimos doce meses, se notó que en la pre menopausia las pacientes control tuvieron la tendencia a ganar mayor cantidad de peso (4,8 kg) en comparación a los casos (1,4 kg) lo que es estadísticamente significativo (p<0,05). Inclusive en la posmenopausia, se pudo notar una disminución del peso en los casos (-0,4 kg) –que puede explicarse como consecuencia de la misma enfermedad– frente a un aumento en los controles (3,2 kg) resultando también estadísticamente significativo (p<0,05).
DISCUSIÓN
De acuerdo a nuestros hallazgos la historia de obesidad se asocia a un incremento del riesgo de cáncer mamario tanto en mujeres premenopáusicas como en postmenopáusicas. En general, las mujeres con historia de sobrepeso y obesidad, tuvieron un OR de 3,82 y 7,38 frente a las que tuvieron un IMC en rangos normales, respectivamente. Cuando se analizó el IMC actual, se encontró una asociación inversa en mujeres premenopáusicas y una asociación directa (no significativa) en mujeres posmenopáusicas; siendo similar a lo encontrado por diversos estudios donde señalan que IMC altos disminuyen el riesgo de cáncer mamario en mujeres pre menopáusicas (12,29), asimismo, en otros estudios se encontró una asociación directa significativa entre la obesidad y el cáncer mamario postmenopáusico (12,16).
Sin embargo, cuando analizamos el IMC durante la mayor parte de la vida adulta de la paciente, observamos que tanto en pacientes premenopáusicas y postmenopáusicas hubo un incremento del riesgo de cáncer de mama, contrariamente a lo reportado en algunos estudios donde resulta ser un factor protector (12,29). Esto podría explicarse en que los estudios mencionados consideraron un IMC actual, y es conocido que el cáncer está asociado con disminución de peso. Desde nuestra perspectiva, el cálculo de un IMC con el peso durante la mayor parte de la vida adulta de la paciente basada en un autorreporte (no utilizada en estudios previos) es a nuestro criterio una mejor aproximación para intentar evaluar este factor durante largos periodos de tiempo, sin la influencia de la pérdida de peso que se presenta con cierta frecuencia en las neoplasias, y nos muestra claramente que la historia de obesidad puede ser un factor de riesgo importante para cáncer mamario. La influencia que pudo tener la baja de peso por el proceso neoformativo se evidencia en las preguntas sobre la variación de peso en los últimos meses y efectivamente se encontró diferencias significativas entre los casos y controles, identificándose una tendencia ganar muy poco peso o incluso en promedio negativo en las pacientes con cáncer mamario, mientras que las pacientes control, hubo una tendencia a ganar peso. Esto nos muestra que el peso con datos actuales pueden llevar a confusión por el proceso neoformativo.
El efecto de la obesidad, podría basarse en el subsecuente aumento de los estrógenos y especialmente el estradiol biodisponible (26), se ha evidenciado que los estrógenos son carcinógenos a través de metabolitos genotóxicos, mutagénicos y mediante la estimulación del crecimiento tisular mamario (30).
Es importante mencionar que el dato obtenido en nuestro estudio tiene limitaciones al estar sometido a un sesgo de memoria; puesto que al ser casi imposible disponer de un registro fehaciente de los pesos de las pacientes durante largos periodos de tiempo, la información se obtuvo por autorreporte. Sin embargo, la información brindada por los pacientes acerca de sus propios datos antropométricos, es bastante fiable según mencionan un estudio donde analizaron las respuestas de 4808 participantes sobre sus datos antropométricos y los datos reportados por los participantes se correlacionaban bien con los datos antropométricos reales y mencionan que estos datos reportados son válidos para identificar asociaciones en los estudios epidemiológicos (28).
Otra limitación fue que un entrevistador sólo obtuvo datos de los casos y otro entrevistador sólo de los controles y pudo haber existido un sesgo en el estilo de entrevistar a las pacientes, por ende sobreestimando o subestimando valores, sobretodo en los valores autorreportados por las participantes del estudio. Un sesgo de selección importante, puede haberse dado en la elección de los controles, donde algunas pacientes pudiesen haber tenido neoplasias muy incipientes que no pudiesen haber sido detectadas por la mamografía.
La información analizada en el presente estudio muestra que la obesidad está asociada con el cáncer mamario, pero principalmente por la historia de obesidad durante la mayor parte de la vida adulta de una mujer. Sería interesante ampliar el estudio en otros grupos poblacionales considerando el peso durante la mayor parte de la vida adulta, considerando que la obesidad es un factor potencialmente modificable.
AGRADECIMIENTOS
Al Dr. César Gutiérrez Villafuerte del Departamento de Medicina Preventiva UNMSM, por su valioso apoyo en el análisis estadístico. A la Srta. Carolina Gallegos Campos del Servicio de Oncología Médica y la Sra. Magaly Quiroz Samamé de la Sección de Mamografía del Servicio de Radiología del Hospital Nacional Arzobispo Loayza, por el apoyo en la realización de las entrevistas.
Fuente de Financiamiento
Autofinanciado.
Conflictos de Interés
Los autores declaran no poseer conflictos de interés.
REFENCIAS BIBLIOGRÁFICAS
1. Veronesi U, Boyle P, Goldhirsch A, Orecchia R, Viale G. Breast cancer. Lancet. 2005; 365(9472): 1727-41.
2. McPherson K, Steel CM, Dixon JM. ABC of breast diseases. Breast cancer-epidemiology, risk factors, and genetics. BMJ. 2000; 321(7261): 624-28.
3. Smith-Warner SA, Spiegelman D, Yaun SS, van den Brandt PA, Folsom AR, Goldbohm RA, et al. Alcohol and breast cancer in women: a pooled analysis of cohort studies. JAMA. 1998; 279(7): 535-40.
4. Hamajima N, Hirose K, Tajima K, Rohan T, Calle EE, Heath CW, et al. Alcohol, tobacco and breast cancer--collaborative reanalysis of individual data from 53 epidemiological studies, including 58,515 women with breast cancer and 95,067 women without the disease. Br J Cancer. 2002; 87(11): 1234-45.
5. [Not authors listed]. Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53 297 women with breast cancer and 100 239 women without breast cancer from 54 epidemiological studies. Collaborative Group on Hormonal Factors in Breast Cancer. Lancet. 1996; 347(9017): 1713-27.
6. [Not authors listed]. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52,705 women with breast cancer and 108,411 women without breast cancer. Collaborative Group on Hormonal Factors in Breast Cancer. Lancet. 1997; 350(9084):1047-1059.
7. Beral V. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet. 2003; 362(9382): 419-27.
8. [Not authors listed]. Familial breast cancer: collaborative reanalysis of individual data from 52 epidemiological studies including 58,209 women with breast cancer and 101,986 women without the disease. Lancet. 2001; 358(9291): 1389-99.
9. [Not authors listed]. Breast cancer and breastfeeding: collaborative reanalysis of individual data from 47 epidemiological studies in 30 countries, including 50302 women with breast cancer and 96973 women without the disease. Lancet. 2002; 360(9328): 187-95.
10. Rojas Camayo J. Lactancia materna y cáncer de mama: un estudio caso-control en pacientes del Hospital Nacional Arzobispo Loayza, Lima-Perú. An Fac Med (Lima). 2008; 69(1): 22-28.
11. Huang Z, Hankinson SE, Colditz GA, Stampfer MJ, Hunter DJ, Manson JE, et al. Dual effects of weight and weight gain on breast cancer risk. JAMA. 1997; 278(17): 1407-11.
12. Tehard B, Clavel-Chapelon F. Several anthropometric measurements and breast cancer risk: results of the E3N cohort study. Int J Obes (Lond). 2006; 30(1): 156-63.
13. Katoh A, Watzlaf VJ, D'Amico F. An examination of obesity and breast cancer survival in post-menopausal women. Br J Cancer. 1994; 70(5): 928-33.
14. London SJ, Colditz GA, Stampfer MJ, Willett WC, Rosner B, Speizer FE. Prospective study of relative weight, height, and risk of breast cancer. JAMA. 1989; 262(20): 2853-58.
15. Pathak DR, Whittemore AS. Combined effects of body size, parity, and menstrual events on breast cancer incidence in seven countries. Am J Epidemiol. 1992;135(2):153-68.
16. Van den Brandt PA, Spiegelman D, Yaun SS, Adami HO, Beeson L, Folsom AR, et al. Pooled analysis of prospective cohort studies on height, weight, and breast cancer risk. Am J Epidemiol. 2000; 152(6): 514-27.
17. Vatten LJ, Kvinnsland S. Prospective study of height, body mass index and risk of breast cancer. Acta Oncol. 1992; 31(2): 195-200.
18. Tretli S. Height and weight in relation to breast cancer morbidity and mortality. A prospective study of 570,000 women in Norway. Int J Cancer. 1989; 44(1): 23-30.
19. Folsom AR, Kaye SA, Prineas RJ, Potter JD, Gapstur SM, Wallace RB. Increased incidence of carcinoma of the breast associated with abdominal adiposity in postmenopausal women. Am J Epidemiol. 1990; 131(5): 794-803.
20. Tornberg SA, Carstensen JM. Relationship between Quetelet's index and cancer of breast and female genital tract in 47,000 women followed for 25 years. Br J Cancer. 1994; 69(2): 358-61.
21. Li CI, Stanford JL, Daling JR. Anthropometric variables in relation to risk of breast cancer in middle-aged women. Int J Epidemiol. 2000; 29(2): 208-13.
22. Morimoto LM, White E, Chen Z, Chlebowski RT, Hays J, Kuller L, et al. Obesity, body size, and risk of postmenopausal breast cancer: the Women's Health Initiative (United States). Cancer Causes Control. 2002; 13(8): 741-51.
23. Key TJ, Pike MC. The role of oestrogens and progestagens in the epidemiology and prevention of breast cancer. Eur J Cancer Clin Oncol. 1988; 24(1): 29-43.
24. Pike MC, Spicer DV, Dahmoush L, Press MF. Estrogens, progestogens, normal breast cell proliferation, and breast cancer risk. Epidemiol Rev. 1993; 15(1): 17-35.
25. MacDonald PC, Edman CD, Hemsell DL, Porter JC, Siiteri PK. Effect of obesity on conversion of plasma androstenedione to estrone in postmenopausal women with and without endometrial cancer. Am J Obstet Gynecol. 1978; 130(4): 448-55.
26. Key TJ, Appleby PN, Reeves GK, Roddam A, Dorgan JF, Longcope C, et al. Body mass index, serum sex hormones, and breast cancer risk in postmenopausal women. J Natl Cancer Inst. 2003; 95(16): 1218-26.
27. Baumgartner KB, Hunt WC, Baumgartner RN, Crumley DD, Gilliland FD, Mc Tiernan A et al. Association of body composition and weight history with breast cancer prognostic markers: divergent pattern for Hispanic and non-Hispanic White women. Am J Epidemiol. 2004; 160(11): 1087-97.
28. Spencer EA, Appleby PN, Davey GK, Key TJ. Validity of self-reported height and weight in 4808 EPIC-Oxford participants. Public Health Nutr. 2002; 5(4): 561-65.
29. Sonnenschein E, Toniolo P, Terry MB, Bruning PF, Kato I, Koening KL, et al. Body fat distribution and obesity in pre- and postmenopausal breast cancer. Int J Epidemiol. 1999; 28(6): 1026-31.
30. Yager JD, Davidson NE. Estrogen carcinogenesis in breast cancer. N Engl J Med. 2006; 354(3): 270-82.
Correspondencia:
José Rojas Camayo
Dirección: Pj Canda 319 Urb. Perú, San Martín de Porres, Lima Perú.
Teléfono: (511) 9977-11400
Correo electrónico: joserojas18@hotmail.com
Recibido: 18-05-09
Aprobado: 22-08-09