Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.26 n.4 Lima oct./dic. 2009
ARTÍCULO ORIGINAL
Equivalencia clínica entre el rociador nasal de propionato de fluticasona genérico y comercial en pacientes con rinitis alérgica
Clinical equival ence between generic and branded fluticasone propionate nasal spray in patients with alergic rhinitis
Vikki Brandi1,a, Edmundo G. Stahl2,b
1 Kendle International Inc. Miami, USA.
2 LatAmScience, LLC. Virginia Gardens, Florida, USA.
a Physician assistant, doctora en ciencias de la salud; b Médico internista.
RESUMEN
Objetivo. Establecer la equivalencia clínica de un rociador nasal de propionato de fluticasona (RNF) genérico comparado con dos formulas farmacéuticas comerciales del mismo producto (Flonase® y Flixonase®) durante la estación de polinización del cedro de montaña (Juniperus ashei) en Texas, EEUU. Materiales y métodos. Estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo, en grupos paralelos diseñado para investigar la seguridad y eficacia de RNF (200 mcg una vez al día), Flonase® (200 mcg una vez al día) y Flixonase® (200 mcg una vez al día), comparados con placebo, administrados por 13 a 15 días. Los pacientes registraron diariamente, en la mañana y en la tarde, sus síntomas nasales totales (SNT). La variable de desenlace primaria fue la suma de SNT en la mañana y tarde + 1. Las variables de desenlace secundarias fueron los SNT AM + 1 y SNT PM + 1, y la evaluación de seguridad. Resultados. No se observó diferencia estadísticamente significativa en ningún día de estudio, ni en todo el periodo de tratamiento, ni al punto de final entre SNT promedio tanto de Flonase® como Flixonase® y RNF. La equivalencia clínica entre RNF y Flonase® (cociente=0,98; intervalo de confianza [IC] al 90%, 0,91 a 1,06), y entre RNF y Flixonase® (cociente=1,02; IC 90%, 0,94 a 1,10) fue demostrada tanto para la variable de desenlace primaria como para las otras variables de eficacia. Conclusiones. Estos resultados respaldan la equivalencia clínica entre RNF 200 mcg una vez al día tanto con Flonase® como Flixonase® en el tratamiento de rinitis alérgica estacional.
Palabras clave: Rinitis alérgica estacional; Medicamentos genéricos; Equivalencia terapéutica (fuente: DeCS BIREME).
ABSTRACT
Objective. The primary objective of this study was to establish the clinic equivalence of a new Fluticasone Propionate Aqueous Nasal Spray (FANS) compared to two commercially available active treatments of fluticasone propionate nasal spray (Flonase® and Flixonase®) during the mountain cedar (Juniperus ashei) pollen season in Texas. Material and methods. This was a multicenter, randomized, double-blind, double-dummy, active-controlled and placebo-controlled, parallel group study designed to investigate the safety and efficacy of FANS (200 mcg QD), Flonase® and Flixonase® (200 mcg QD) compared to placebo administered for 13 to 15 days. Patients recorded the total nasal symptoms dcores (TNSS) in a diary in the morning and evening every day. The primary endpoint was the patient-rated am and pm TNSS +1. Other key efficacy endpoints were patient-rated AM TNSS+1, patient-rated PM TNSS+1, and safety. Results. Mean TNSS values for Flonase® and Flixonase® were not statistically significantly different from FANS during any study day, over the entire treatment period, or at endpoint. Bioequivalence between FANS and Flonase® (ratio=0.98, 90% CI 0.91 to 1.06) as well as FANS and Flixonase® (ratio=1.02, 90% CI 0.94 to 1.10) was demonstrated for the primary endpoint [Patient-Rated am and pm TNSS +1] as well as for the other key efficacy endpoints. Conclusions. The findings from this study support that FANS 200 mcg QD is therapeutically bioequivalent to both Flonase® and Flixonase® in the control of the symptoms of seasonal allergic rhinitis.
Key words: Rhinitis, allergic, seasonal; Fluticasone; Drugs, generic; Therapeutic Equivalency (source: MeSH NLM).
INTRODUCIÓN
La prevalencia de rinitis alérgica ha ido incrementándose durante los últimos 20 o 30 años (1). Aproximadamente 9,3 a 30% de todos los adultos y hasta 10% de los niños en los EEUU tienen rinitis alérgica (2-5). La rinitis alérgica no se asocia con mortalidad, sin embargo, puede afectar la calidad de vida resultando en dificultades para dormir y para concentrarse, pérdida del sentido del gusto e incomodidad general. La rinitis alérgica también tiene un impacto financiero importante, pues se estima que en EEUU se gasta entre mil y 3500 millones de dólares por año en costos directos por la enfermedad y unos 3800 a 5200 millones de dólares en pérdida de productividad tanto en el trabajo como en el hogar (3,6-8).
La rinitis alérgica puede ser estacional (causada por polen u hongos) o perenne (causada por otros alérgenos como son ácaros del polvo, hongos, cucarachas y descamación de animales). Tanto para la rinitis alérgica estacional como para la perenne, el tratamiento se dirige a aliviar los síntomas nasales y oculares. Los agentes terapéuticos utilizados en el tratamiento de la rinitis alérgica incluyen descongestionantes, estabilizadores de membrana del mastocito, antihistamínicos orales y tópicos, y corticosteroides nasales. Desde que fueron introducidos hace más de 20 años, los corticosteroides nasales se han establecido como la terapia de primera línea para el alivio de los síntomas asociados tanto con la rinitis alérgica estacional como la perenne (9-12). Además, los corticosteroides nasales son considerados la terapia más eficaz para controlar los síntomas de la rinitis alérgica (13).
El objetivo primario de este estudio fue establecer la equivalencia clínica de un producto en investigación, rociador nasal de propionato de fluticasona (RNF, 200 mcg una vez al día) con dos fórmulas farmacéuticas del mismo producto (Flonase® y Flixonase®; 200 mcg una vez al día) durante la estación de polinización del cedro de montaña (Juniperus ashei) en el estado de Texas en EEUU. El J. ashei es un pequeño arbusto de hojas perennes, nativo de Texas, que se usa comúnmente como planta ornamental. Su polen es uno de los más alergizantes en EEUU y ha sido ampliamente estudiado (14-17). Está confinado a una región geográfica y poliniza en un periodo preciso. Es el aeroalérgeno principal en el área central de Texas de diciembre a febrero y es una causa común de rinitis alérgica o fiebre de cedro (cedar fever) en la parte central y occidental de ese Estado.
Además de Texas, también se le encuentra en el sur del estado de Oklahoma, en el estado Nuevo México y en Coahuila (México). Es un modelo efectivo para el estudio de medicamentos nasales de investigación usados para el tratamiento rinitis alérgica estacional porque el cedro de montaña se dispersa en el aire muy fácilmente, alcanzando altas concentraciones. Además, tiene una estación de polinización claramente definida con un comienzo y un final discretos, es el único alérgeno presente en el aire, en cantidades significativas durante ese periodo, tiene una distribución geográfica limitada e induce síntomas homogéneos y predecibles que pueden ser moderados o intensos. Estas características permiten la presentación de un gran número de pacientes afectados por el mismo alérgeno dentro del mismo periodo. Además de la equivalencia clínica, también se evaluó la seguridad y eficacia de cada formulación farmacéutica comparada con placebo.
MATERIALES Y MÉTODOS
DISEÑO DEL ESTUDIO
El estudio fue multicéntrico, aleatorizado, doble ciego, con controles activos y placebo, en grupo paralelo diseñado para investigar la seguridad y eficacia de un rociador nasal de propionato de fluticasona (RNF) genérico y demostrar su equivalencia clínica con Flonase® y Flixonase® administrados por 13 a 15 días.
El estudio se llevo a cabo en seis centros médicos de investigación localizados en la zona central de Texas durante la estación de polinización de Juniperus ashei entre diciembre de 2001 y febrero de 2002. El estudio consistió en cuatro visitas: visita de selección, día 1 (visita de tratamiento 1), día 8 (visita de tratamiento 2) y día 15 (visita de tratamiento 3).
MEDICAMENTOS DE ESTUDIO
Fue administrado RNF 200 mcg una vez al día (IVAX Research, Inc., Miami, Florida, EEUU, lote RD-01093- 01, vencimiento octubre 2003), Flonase® 200 mcg una vez al día (GlaxoSmithKline - GSK, EEUU, lote #1F728, vencimiento agosto 2003) y Flixonase®, 200 mcg una vez al día (GSK, Reino Unido, lote Z63, vencimiento julio 2003). Los tres productos contenían una suspensión acuosa de propionato de fluticasona equivalente a 0,05% peso/peso (weight/weight), 0,02% peso/peso alcohol feniletílico y 0,02% peso/peso de cloruro de benzalconio. La dosis utilizada fue de 50 mcg por rociada para los tres productos. El placebo utilizado fue elaborado por el mismo laboratorio que fabricó el RNF (lote RD-0110-03, vencimiento octubre de 2002). Tanto Flonase® como Flixonase® se escogieron como agentes comparativos pues el productor comercializa el rociador nasal de propionato de fluticasona bajo ambos nombres en diversos países.
POBLACIÓN
Se estimó que sería necesario reclutar 504 pacientes para asegurar que 483 terminen todo el estudio: 138 por grupo con terapia activa y 69 en el grupo placebo. Se incluyó pacientes varones así como mujeres que no estuvieran lactando ni embarazadas, de 12 años de edad o más, con función adrenal normal y una historia clínica de rinitis alérgica a J. ashei por 2 años o más dentro de los 24 meses anteriores a la visita de selección, confirmada por una reacción positiva al polen de cedro de montaña (prueba de puntura de piel con una pápula de >3 mm mayor que con diluyente; o una prueba intradérmica con una pápula de ≥7 mm mayor que con diluyente; o Radio Allergo Sorbent Test-RAST; o Paper Radio Immuno Sorbent Test-PRIST) y en buen estado de salud general. Además de la información histórica, los pacientes tenían que demostrar sintomatología activa antes de recibir tratamiento el día 1.
Se excluyó aquellos pacientes con evidencia clínica o historia de enfermedades concomitantes que incluyeran hipertensión arterial no controlada, úlcera péptica, diabetes mellitus, herpes simplex ocular, glaucoma o cataratas, historia de asma persistente, evidencia histórica o actual de una enfermedad o infección aguda, pólipos nasales, desviaciones del septum nasal o anormalidades anatómicas asociadas con obstrucción de las fosas nasales que pudieran dificultar prevenir la aplicación del medicamento con el rociador nasal (obstrucción ≥ 50%), otros procesos nasales incluyendo rinitis infecciosa, sinusitis aguda, rinitis medicamentosa, rinitis atrófica y rinitis perenne. Además, se excluyó a pacientes con evidencia, al examen clínico, de candidiasis en las fosas nasales, a quienes iniciaron inmunoterapia o cualquier cambio en la inmunoterapia en las última cuatro semanas anteriores a la visita de selección; también a quienes se encontró anormalidades significativas en el examen clínico, el electrocardiograma o en los exámenes de laboratorio (hematología, química sanguínea, cortisol matutino y análisis de orina), a los que planeaban viajar fuera de la región de estudio y a quienes se conocía que tenían reacciones de hipersensibilidad o idiosincráticas al propionato de fluticasona o sus excipientes, así como aquellos pacientes con afiliación al centro del estudio.
Se requirió además, los siguientes periodos de lavado de medicamentos concomitantes: corticosteroides nasales u oculares (tres semanas), corticosteroides intramusculares o intrarticulares (doce semanas), corticosteroides inhalados, tópicos de potencia media a alta y otros de aplicación sistémica (cuatro semanas); anticolinérgicos nasales (una semana); rociadores nasales de venta libre (24 horas); descongestionantes (72 horas); cromonas (dos semanas); antibióticos y antifúngicos sistémicos (cuatro semanas); e inhibidores de citocromo P3A4 (CYP3A4) (cuatro semanas).
PROCEDIMIENTOS
A los pacientes que pasaron todas las pruebas, se les entrenó en el uso y se les proveyó un diario para registrar sus síntomas nasales utilizando una escala de intensidad de síntomas. Los síntomas registrados diariamente incluyeron los siguientes: rinorrea, congestión nasal, prurito nasal y estornudos. Se instruyó a los pacientes a registrar los síntomas en forma reflexiva (evaluación de la intensidad de los síntomas en las últimas 12 horas que refleja el grado total de eficacia sobre las 12 horas previas utilizando una escala de 0 a 3, donde 0=ausencia de síntomas, 1=síntomas leves, 2=síntomas moderados y 3=síntomas intensos) (18). Los síntomas no nasales (por ejemplo oculares) no se registraron. El diario de registro debía completarse dos veces al día aproximadamente a la misma hora cada día en la mañana y la tarde. El uso de medicamentos de rescate se prohibió durante todo el estudio.
Después de la visita de selección, a los pacientes se les citó entre 3 y 21 días después para la visita de día 1. Para ser aleatorizados y dosificados en forma doble ciega, los pacientes debían satisfacer los criterios de aleatorización: (1) La cuenta de síntomas nasales combinados de la mañana y la tarde registrados en forma reflexiva de ≥ 6 (valor máximo: 24) en los tres días anteriores al día 1 y, (2) la cuenta total de intensidad de síntomas autoevaluados por el paciente de ≥ 2 en el centro de estudio, durante la visita, utilizando la escala de evaluación de 0 a 3 mencionada anteriormente (18). Esta última evaluación se consideraba la evaluación instantánea, es decir la evaluación de los síntomas al momento de registrarlos.
Para prevenir el sesgo de selección, no se les explicó a los pacientes de la existencia de los criterios de aleatorización. El día 1, un médico capacitado para el estudio hizo una evaluación de los síntomas nasales esa mañana y la cuenta total de intensidad de síntomas antes de dosificar a los pacientes seleccionados. Ambos puntajes representan una evaluación instantánea, es decir la evaluación por el médico antes de dosificar la primera dosis.
Se asignó a los pacientes a un grupo de tratamiento de acuerdo con una tabla de aleatorización, con una relación 2/1, tratamiento activo/placebo. Se dio instrucciones por escrito a cada paciente para el uso y almacenamiento de los productos. Cada paciente se autoadministró cuatro rociadas (dos por cada narina) a las 08,00 h por 13 a 15 días.
Los pacientes recibieron el tratamiento durante las visitas de día 1 y día 8 en el centro médico. Para mantener el estudio doble ciego se usó placebos idénticos a los frascos de RNF y de Flonase®/Flixonase®. Todo el personal del estudio y los pacientes se mantuvieron a ciegas en referencia a qué frascos contenían medicamento activo y cuáles placebo.
Luego de la asignación al tratamiento en el día 1 se les entregó a los pacientes un nuevo diario para registrar sus síntomas en forma reflexiva, dos veces al día, aproximadamente a la misma hora (la evaluación de síntomas en la mañana debía hacerse antes de dosificar el tratamiento), cualquier efecto adverso, la hora y número de aplicaciones de medicamento en la mañana.
Durante las visitas de los día 8 y día 15, los pacientes y el médico hicieron una evaluación instantánea de la cuenta total de intensidad de síntomas. El médico, además, evaluó los síntomas nasales de cada paciente. Además, el día 15 también, tanto el paciente como el médico, evaluaron en forma reflexiva la mejoría global utilizando una escala de 1 a 5 puntos (1=Alivio completo: sin síntomas; 2=Alivio marcado: signos y síntomas muy mejorados pero presentes y no causan problemas al paciente; 3=Alivio moderado: signos y síntomas presentes, pueden ser problemáticos para el paciente pero hay una mejora notable; 4=Alivio leve: signos y síntomas presentes con solo una mejoría mínima; y 5=Sin alivio: signos y síntomas sin cambio o peor que en la evaluación basal). Al terminar las evaluaciones del día 15 el paciente era dado de alta.
CONSIDERACIONES ÉTICAS
Este estudio fue aprobado por el Comité de Ética del IntegReview Ethical Review Board (Austin, Texas), se cumplió con todas las normas vigentes del FDA. El diseño de este estudio estuvo en conformidad con las guías para estudios con productos nasales y rinitis alérgica de la agencia federal reguladora de EEUU (FDA) (18-21) y fue llevado a cabo en cumplimiento de las normas establecidas por el código federal de EEUU (Title 21, CFR Parts 50, 56 y 312) y las guías de buena práctica clínica del ICH (International Conference of Harmonization).
ANÁLISIS DE DATOS
Para el análisis de equivalencia y eficacia se incluyó aquellos pacientes aleatorizados que utilizaron el tratamiento por ≥ 4 días, registraron sus síntomas nasales (am y pm) por ≥ 4 días, y no utilizaron un inhibidor de CYP3A4 durante todo el estudio (análisis por protocolo). En el análisis de seguridad se incluyó a todos los pacientes aleatorizados.
De estudios previos, se asumió que los síntomas nasales totales (SNT) promedio, con Flonase®/Flixonase®, era aproximadamente 5,3 unidades, con una desviación estándar de 3,0 y se calculó que se requeriría un tamaño de muestra de 138 pacientes por grupo de tratamiento activo, para que las pruebas estadísticas tengan un poder de 80% a un nivel de significancia de 0,05 a dos colas, para evaluar la hipótesis de equivalencia. Para la hipótesis de eficacia de cada uno de los tratamientos activos se consideró que una diferencia de 1,5 unidades en el SNT sería clínicamente relevante. Para detectar esa diferencia se calculó que se necesitaban 64 pacientes por grupo de tratamiento. Como consecuencia, se aleatorizó a los pacientes con una relación de 2/1 para activo/placebo. La variable primaria de eficacia fue el resultado de los SNT evaluados a diario por el paciente en su diario de registro entre los días 1 y 14 utilizando la siguiente fórmula (21):
SNT =[(promedio SNT AM días 2-14) + (promedio SNT PM días 1-14)]/ 2
El valor basal se obtuvo calculando el promedio de los valores obtenidos en am y pm, registrados durante los tres días anteriores a la visita día 1 incluyendo la mañana del día 1.
El objetivo primario del estudio fue demostrar equivalencia entre RNF y Flonase®, y RNF y Flixonase®. Para la hipótesis de equivalencia se derivaron intervalos de confianza al 90% del análisis del modelo de covariancia (ANCOVA) con efectos de tratamiento y de investigador, y el SNT basal como covariante. La equivalencia debía establecerse con un intervalo de confianza del 90% para la relación entre RNF a Flonase® y RNF a Flixonase® contenida entre los limites 0,80 y 1,25.
Para estos análisis se hizo una transformación logarítmica (SNT+1), para luego ser transformado nuevamente a la escala original, lo que resultó en la relación de las medias. Debido a que los valores de SNT podían teóricamente ser cero, lo que resultaría en una transformación logarítmica no definida para los valores de SNT de cero, se decidió añadir uno a la media de SNT para cada paciente.
Se utilizó pruebas T derivadas de ANCOVA a dos colas para hacer comparaciones entre los tratamientos activos y placebo. El modelo de ANCOVA a dos colas se utilizó para las comparaciones entre los grupos de tratamiento para todos los parámetros de eficacia.
Se resumió además, en gráficas diarias, el conteo de polen de J. ashei en el aire desde el día del ingreso del primer paciente al estudio hasta la salida del último paciente del estudio y se le comparó a las cuentas promedio de SNT por grupo de tratamiento y por centro de estudio.
Los parámetros de seguridad se resumieron utilizando estadística descriptiva. La incidencia de efectos colaterales, codificado con el diccionario COSTART (Coding Symbols for a Thesaurus of Adverse Reaction Terms) se resumió por grupo de tratamiento, sistema corporal y término preferido. Los cambios promedio de las pruebas de laboratorio (hematología, química sanguínea, cortisol matutino, y análisis de orina) se resumieron por grupo de tratamiento.
RESULTADOS
POBLACIÓN ESTUDIADA
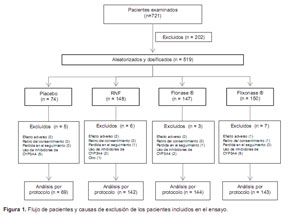
Se evaluó 721 pacientes pero se incluyó a 519. Las causas de exclusión de los 202 pacientes no seleccionados fueron: prueba de piel negativa (58), retiro del consentimiento informado (34), falla en los criterios de aleatorización (34), uso de medicamentos contraindicados para el estudio (21), presencia de enfermedades concomitantes (17), pérdida durante el seguimiento (15), pruebas de laboratorio/ electrocardiograma anormal (14) y otros causas (9).
Se incluyó a 498 pacientes al análisis de equivalencia y eficacia. Las causas de exclusión de los 21 pacientes que no ingresaron al análisis por protocolo, se muestran en la Figura 1.
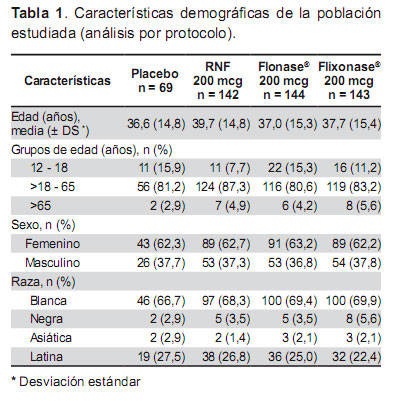
Las características demográficas de los diferentes grupos de tratamiento se presentan en la Tabla 1. De los 498 pacientes incluidos en el análisis por protocolo, 312 (62,7%) pertenecían al sexo femenino y 343 (68,9%) fueron de raza blanca. La media de la edad fue 37,9 años (± 15,1), el 83,3% (343) de los pacientes incluidos tenían entre 19 a 65 años de edad.
EVALUACIÓN DE EQUIVALENCIA CLÍNICA
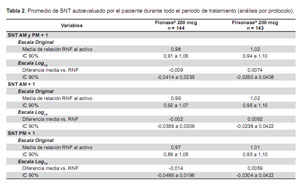
El objetivo primario del estudio fue demostrar la equivalencia clínica o terapéutica entre RNF tanto con Flonase® como Flixonase®. La equivalencia terapéutica fue demostrada al encontrarse que el IC90% para la diferencia en la media en escala logarítmica de la medida de desenlace primaria (log10 [Autoevaluación de SNT AM y PM +1]) dentro del rango aceptable de -0,0969 a 0,0969, es decir, log100,80 a log101,25 (Tabla 2). También se demostró equivalencia de SNT AM y SNT PM.
RESULTADOS DE EFICACIA
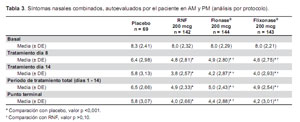
La Tabla 3 muestra la autoevaluación de los pacientes, de sus síntomas nasales combinados en am y pm. Tanto RNF, como Flonase® y Flixonase® mostraron ser más efectivos que el placebo, en forma estadísticamente significativa durante cualquiera de los días de estudio (día 1 a día 15), durante todo el periodo de estudio en forma global, y en el punto de desenlace (último valor disponible). Además, los valores promedio observados de Flonase® y Flixonase® no mostraron ser estadísticamente diferentes de los de RNF evaluados en cualquier día de estudio, durante todo el periodo de estudio en forma global, y en el punto de desenlace. Los efectos beneficiosos observados que siguieron al tratamiento con RNF se mantuvieron a lo largo de todo el periodo de estudio.
RESULTADOS DE SEGURIDAD
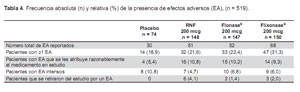
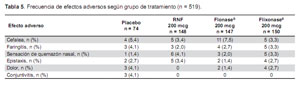
En general, se encontró que el perfil de efectos adversos era consistente con el que se espera en pacientes con una atopia alérgica. Todos los tratamientos fueron bien tolerados. El perfil de seguridad de RNF fue comparable a Flonase® y Flixonase®, y no se encontró diferencias clínicas relevantes entre los tres tratamientos activos. Un total de 126 (24,3%) pacientes reportaron al menos un efecto adverso emergente con el tratamiento. El 18,9% de los pacientes tratados con placebo, 21,6% de los pacientes en el grupo RNF, 22,4% de los pacientes en el grupo Flonase®, y 31,3% de los pacientes en el grupo Flixonase® reportó por lo menos un efecto adverso (Tabla 4). No se observó ningún efecto adverso serio ni inesperado durante el estudio.
Hubo pocos efectos adversos con una incidencia mayor al 3% en cualquiera de los grupos de tratamiento. Se encontró que los efectos adversos más comunes estaban relacionados con el proceso de fondo del paciente o eran farmacológicamente predecibles. El efecto adverso más observado fue cefalea, reportado por 5,4% de los pacientes que recibieron placebo, comparado con 3,4; 7,5; y 3,3% de los pacientes que recibieron RNF, Flonase®, y Flixonase®, respectivamente.
Se encontró que los efectos locales esperados por el uso de corticosteroides nasales (como son faringitis, sensación de quemazón nasal y epistaxis) ocurrieron con poca frecuencia y eran de incidencia comparable entre los grupos de tratamiento. No se observó ningún efecto sistémico discernible como tampoco hubo evidencia que sugiriera exposición sistémica a corticosteroides. No se encontró evidencia clínica de cambios relevantes en los signos vitales, hallazgos electrocardiográficos, pruebas de laboratorio, ni en los hallazgos en el examen clínico general, ni nasal. No se observó diferencias relevantes entre los grupos de tratamiento (Tabla 5).
DISCUSIÓN
Los medicamentos genéricos cumplen una función muy importante al mantener en control los precios de los medicamentos bajo receta. La oficina de presupuestos del congreso de EEUU (The US Congressional Budget Office) estima que en 1994 el público norteamericano ahorró entre 8 y 10 mil millones de dólares al sustituir los productos de marca con productos genéricos (19). Este estudio fue llevado a cabo para proveer una alternativa más económica de la fluticasona nasal al público.
La bioequivalencia es definida por la agencia reguladora norteamericana (FDA) como La ausencia de una diferencia significativa en la proporción y alcance con los que un ingrediente activo o parte activa de un equivalente farmacéutico o producto alternativo farmacéutico se encuentra disponible en el sitio de acción de la droga al ser administrado en la misma dosis molar bajo condiciones similares en un estudio apropiadamente diseñado. Además, afirma que El uso de estudios de bioequivalencia con medidas de desenlace clínicas, pueden ser apropiados para demostrar bioequivalencia (18,20). Este estudio trató exitosamente de demostrar la equivalencia clínica del producto genérico, cumpliendo con todos los requisitos regulatorios. En otro documento guía se describe los requerimientos específicos para los medicamentos de aplicación nasal (21). La equivalencia clínica entre RNF tanto con Flonase® como con Flixonase® fue demostrada, ya que el IC90% para la relación de SNT autoevaluados por el paciente se encontró dentro del intervalo de 0,80 a 1,25, que es el rango aceptable establecido por la agencia reguladora norteamericana para demostrar bioequivalencia (20,22).
Los pacientes tratados con placebo también mostraron mejora de sus síntomas, este hallazgo era de esperarse, ya que es consistente con otros estudios con corticosteroides nasales, donde las evaluaciones de eficacia demostraron superioridad de los tratamientos activos sobre placebo (23-25). El rociador nasal de propionato de fluticasona (RNF), Flonase® y Flixonase® demostraron mejoría estadísticamente significativa en comparación con el placebo en la variable de desenlace primaria y todas las variables secundarias, ya sean estos evaluados por el médico investigador o el paciente. Además, Flonase® y Flixonase® no mostraron diferencias significativas en comparación con RNF en ningún parámetro de eficacia secundaria.
Todos los tratamientos activos redujeron la sintomatología de rinitis alérgica rápidamente. El inicio del efecto ocurrió al anochecer del día 1 en el análisis por protocolo. Entre el quinto y noveno día se observó el efecto máximo para los tres grupos con principios activos, llegando o estando cerca del efecto plateau al día 5. Los efectos beneficiosos de RNF se observaron a todo lo largo del tratamiento, sin evidencia de disminución de la eficacia. Este efecto de mejoramiento sostenido es comparable a los otros dos tratamientos activos del estudio. La información generada por este estudio confirma que la dosificación con RNF una vez al día prevé un control eficaz de los síntomas de la rinitis alérgica estacional en adolescentes y adultos.
El perfil de efectos adversos para todos los tratamientos estaba dentro de lo que se espera para una población atópica y alérgica. Los tratamientos activos utilizados demostraron buena tolerancia y relativamente pocos efectos adversos. Se encontró que el perfil de seguridad de RNF es consistente con el observado tanto para Flonase® como para Flixonase®. Tampoco se observó diferencias clínicamente relevantes entre los tratamientos activos para ninguno de los parámetros de seguridad medidos. En general, la incidencia de efectos adversos fue baja y comparable entre los tratamientos. No se observó ningún efecto adverso serio, ni inesperado, ni tampoco cambios clínicamente relevantes en los signos vitales, exámenes físico ni nasal, ni en los hallazgos electrocardiográficos.
En conclusión, los resultados de este estudio confirman que RNF 200 mcg una vez al día es clínicamente equivalente tanto a Flonase® como a Flixonase® en el control de los síntomas de rinitis alérgica estacional. RNF demostró ser eficaz y bien tolerado en adolescentes y adultos con rinitis alérgica estacional. Los perfiles de seguridad y eficacia observados para RNF son consistentes con los observados para Flonase® y Flixonase®.
Fuente de financiamiento
Ivax Corporation - Teva Pharmaceutical Industries Ltd.
Conflictos de interés
Los autores declaran no tener conflictos de interés para la publicación de este artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. McMenamin P. Costs of hay fever in the United States in 1990. Ann Allergy. 1994; 73(1): 35-39.
2. Nightingale CH. Treating allergic rhinitis with secondgeneration antihistamines. Pharmacotherapy. 1996; 16(5): 905-14.
3. Malone DC, Lawson KA, Smith DH, Arrighi HM, Battista C. A cost of illness study of allergic rhinitis in the United States. J Allergy Clin Immunol. 1997; 99(1 Pt 1): 22-27.
4. Nathan R, Meltzer E, Selner J, Storms W. Prevalence of allergic rhinitis in the United States. J Allergy Clin Immunol. 1997; 99(Suppl 6 Pt 2): S808-14.
5. Ross R. The cost of allergic rhinitis. Am J Manag Care. 1996; 2(3): 285-90.
6. Storms W, Meltzer E, Nathan R, Selner J. The economic impact of allergic rhinitis. J Allergy Clin Immunol. 1997; 99(Suppl 6 Pt 2): S820-4.
7. Crystal-Peters J, Crown W, Goetzel R, Schutt D. The cost of productivity losses associated with allergic rhinitis. Am J Manag Care. 2000; 6(3): 373-8.
8. Day J, Briscoe M, Clark R, Ellis A, Gervais P. Onset of action and efficacy of terfenadine, astemizole, cetirizine, and loratadine for the relief of symptoms of allergic rhinitis. Ann Allergy Asthma Immunol. 1997; 79(2): 163-72.
9. Siegel S. Topical intranasal corticosteroid therapy in rhinitis. J Allergy Clin Immunol. 1988; 81(5 Pt 2): 984-91.
10. Druce H, Kaliner M. Allergic rhinitis. JAMA. 1988; 259(2): 260-3.
11. Mabry R. Corticosteroids in the management of upper respiratory allergy: the emerging role of steroid nasal sprays. Otolaryngol Head Neck Surg. 1992; 107(6 Pt 2): 855-60.
12. Naclerio R. Allergic rhinitis. N Engl J Med. 1991; 325(12): 860-9.
13. Dykewicz M, Fineman S, Skoner D, Nicklas R, Lee R, Blessing-Moore J, et al. Diagnosis and management of rhinitis: complete guidelines of the Joint Task Force on practice parameters in allergy, asthma, and immunology. Ann Allergy Asthma Immunol. 1998; 81(5 Pt 2): 478-518.
14. Gross G, Zimburean J, Capra J. Isolation and partial characterization of the allergen in mountain cedar pollen. Scand J Immunol. 1978; 8: 437-41.
15. Fein B, Kamin P. A 10-year survey of the hay fever plants and important allergens in the San Antonio, Texas metropolitan area. J Allergy. 1962; 33: 141-52.
16. Pence H, Mitchell D, Greely R, Updegraff B, Selfridge H. Immunotherapy for mountain-cedar pollienosis - a doubleblind controlled study. J Allergy Clin Immunol. 1976; 58: 39-50.
17. Ramirez D. The natural history of mountain cedar pollinosis. J Allergy Clin Immunol. 1984; 73: 88-93.
18. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research-CDER. Guidance for Industry. Allergic rhinitis: clinical development programs for drug products. Maryland: FDA, CDER; 2000.
19. The Congress of the United States, Congressional Budget Office. How increased competition from generic drugs has affected prices and returns in the pharmaceutical industry. Washington DC: Congressional Budget Office; 1998.
20. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research-CDER. Guidance for Industry. Bioavailability and Bioequivalence for Orally Administered Drug Products. General Considerations. Maryland: FDA, CDER; 2003.
21. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research-CDER. Guidance for industry. Bioavailability and bioequivalence studies for nasal aerosols and nasal sprays for local action. Maryland: FDA, CDER; 2003.
22. Advisory Committee for Pharmaceutical Science Meeting. Report from the Orally Inhaled and Nasal Drug Products Subcommittee. Maryland: FDA; 2001. p. 24-91.
23. Nathan RA, Berger W, Yang W, Cheema A, Silvey M, Wu W, et al. Effect of once-daily fluticasone furoate nasal spray on nasal symptoms in adults and adolescents with perennial allergic rhinitis. Ann Allergy Asthma Immunol. 2008; 100(5): 497-505.
24. Vaidayanathan S, Barnes M, Lipworth BJ. Comparative safety and efficacy of 2 formulations of fluticasone aqueous nasal spray in persistent allergic rhinitis. Ann Allergy Asthma Immunol. 2009; 102(1): 76-83.
25. Di Lorenzo G, Pacor ML, Pelliteri ME, Morici G, Di Gregoli A, Lo Blanco C, et al. Randomized placebocontrolled trial comparing fluticasone aqueous nasal spray in mono-therapy, fluticasone plus cetirizine, fluticasone plus montelukast and cetirizine plus montelukast for seasonal allergic rhinitis. Clin Exp Allergy. 2004; 34(2): 259-67.
Correspondencia: Edmundo G. Stahl, MD.
Dirección: LatAmScience, LLC; 6405 NW 36th Street, Suite
#216. Virginia Gardens, Fl (US) 33166-6973.
Teléfono: +1 (305) 871-0701
Correo electrónico: egstahl@latamscience.com
Recibido: 03-11-09
Aprobado: 23-12-09