Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.26 no.4 Lima Oct./dec. 2009
ARTÍCULO ORIGINAL
Brote de leptospirosis asociado a la natación en una fuente de agua subterránea en una zona costera, Lima – Perú
An outbreak of leptospirosis associated with swimming in a spring of underground water in a coastal area, Lima - Peru
Manuel Céspedes1,a, Rafael Tapia1,a, Lourdes Balda1,a, Dana Gonzalez1,a, Martha Glenny1,a, Joseph M. Vinetz2,b
1 Laboratorio de Referencia Nacional de Leptospirosis, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
2 Division of Infectious Diseases, Department of Medicine, University of California San Diego School of Medicine. California, USA.
a Biólogo; b Médico internista.
RESUMEN
Objetivos. Determinar la magnitud de un brote y los factores asociados a la presencia de leptospirosis en la localidad de residencia de un menor de edad que presentó un cuadro de síndrome ictérico hemorrágico. Materiales y métodos. Fueron entrevistados y examinados niños y adolescentes de la zona de residencia del caso índice que frecuentaban una fuente común de infección entre los meses de enero y febrero del 2004. Se realizaron exámenes de ELISA IgM, MAT, PCR y cultivo para el diagnóstico de leptospirosis. Resultados. Fueron incluidos 77 sujetos entre 2 a 18 años de edad, siendo confirmados 21 casos (27,3%). Los signos y síntomas de los casos confirmados fueron fiebre, cefalea, mialgias, dolor abdominal, náusea, vómitos e hiporexia. Tres de ellos presentaron ictericia, hemorragia y falla renal. El análisis bivariado mostró que aquellos que estuvieron en contacto con la fuente de infección de agua clara (cristalina) tuvieron un OR=3,26 (IC95% 1,22 a 8,72) y el contacto con perros en la fuente de agua un OR de 5,63 (IC95% 1,40 a 22,63). Conclusiones. Se confirmó un brote de leptospirosis dentro de un contexto epidemiológico nuevo relacionados a una fuente común de agua subterránea y asociada al contacto con perros dentro de esta fuente. Esta investigación permitirá ampliar el conocimiento acerca de esta patología, así como considerar la leptospirosis como causa de enfermedad febril aguda.
Palabras clave: Leptospirosis; Leptospira interrogans serovar canicola; Factores de riesgo; Brotes de enfermedades; Perú (fuente: DeCS BIREME).
ABSTRACT
Objectives. Identify the frequency and risk factors of leptospirosis outbreak in the locality of residence of an index case with icterohemorrhagic syndrome. Material and methods. Were interviewed and examined children and teenagers from residence area of index case who frequented a common source of infection between January and February, 2004. All of them were screened for leptospirosis using IgM-ELISA and microscopic agglutination test (MAT), PCR and culture. Results. Were enrolled 77 subjects between 2 to 18 years old, only 21 (27.3%) were confirmed cases. The signs and symptoms of the confirmed cases were fever, headache, myalgia, abdominal pain, nausea, vomiting and anorexia. Three of them presented with jaundice, bleeding and renal failure. The presence of contact with the source of infection of underground water (OR=3.26, 95%IC 1.22 to 8.72), and the contact with dogs in the water source of infection (OR = 5.63, 95%IC = 1.40 to 22.63) were identified as significant factors associated with leptospirosis. Conclusions. It was confirmed an outbreak of leptospirosis in a new epidemiological context related to a common source of underground water and associated by contact with dogs in the same source. This data will allow to expand the knowledge about this disease as well as to consider leptospirosis as an important cause of acute febrile disease.
Key words: Leptospirosis; Leptospira interrogans serovar canicola; Risk factors; Disease outbreaks; Peru (source: MeSH NLM).
INTRODUCCIÓN
La leptospirosis es una enfermedad zoonótica de distribución mundial, es frecuente en áreas tropicales donde las condiciones para su transmisión son favorables. Esta se adquiere accidentalmente al estar en contacto directo o indirecto con suelos y fuentes de agua contaminados con orina de animales infectados con leptospira como roedores, canes, vacunos, cerdos, entre otros. Es causada por cualquiera de los numerosos serovares patogénicos del género Leptospira (1-3).
En la leptospirosis la presentación clínica es muy variable. La fase aguda está caracterizada por fiebre, ceartículo falea, escalofríos y mialgias, sin embargo, en muchos casos la fiebre es el único síntoma. En un 10 a 20% de todos los casos la enfermedad es grave y causa complicaciones como ictericia, falla renal y diátesis hemorrágica (4). Clínicamente desde el inicio de la enfermedad no se puede predecir como evolucionará el paciente, por tanto, una terapia antibiótica temprana es efectiva (5,6). Por ello el diagnóstico temprano de todas las formas de leptospirosis anictérica e ictérica es importante para realizar un tratamiento oportuno y nos permitirá diferenciarlas de otras enfermedades con sintomatología parecida como influenza, arbovirosis y otros (7,8). En menores de edad las manifestaciones clínicas son poco conocidas y existen pocos reportes de brotes o estudios retrospectivos de esta enfermedad (9-21).
Los estudios de leptospirosis realizados en el Perú han revelado seroprevalencias en personas asintomáticas hasta 36% de positividad, estas diferencias se deben al área geográfica, ocupación, clima y reservorios (22). En la actualidad se observa que hay un incremento de casos humanos y brotes relacionados a esta enfermedad, reflejándose en la cantidad de muestras procesadas en el Instituto Nacional de Salud, principalmente de las regiones selváticas (23). En enero del 2004 el Hospital Nacional Alberto Sabogal Sologuren de EsSalud de la ciudad de Lima, notifica al Instituto Nacional de Salud del Perú (INS) la presencia de un menor con fiebre, malestar general, dolor muscular, dolor abdominal, náuseas, vómitos, epistaxis, hemoptisis, hematemesis, hematuria, ictericia, hepatomegalia, falla renal (inicio de síntomas: 12 de enero), y es catalogado como un caso de síndrome febril ictérico hemorrágico el cual fue confirmado posteriormente como leptospirosis. Este paciente procede de la provincia de Cañete al sur de Lima.
A raíz de este caso fue emprendida una investigación en la localidad de residencia del menor para determinar cuántos casos más de leptospirosis estaban relacionados y determinar la magnitud del brote.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional de corte transversal para determinar la magnitud del brote y los factores asociados a la presencia de leptospirosis en la localidad de residencia de un caso índice con cuadro de síndrome ictérico hemorrágico presentado en el Hospital Nacional Alberto Sabogal Sologuren (Callao) de EsSalud el 26 de enero del 2004.
INVESTIGACIÓN EPIDEMIOLÓGICA
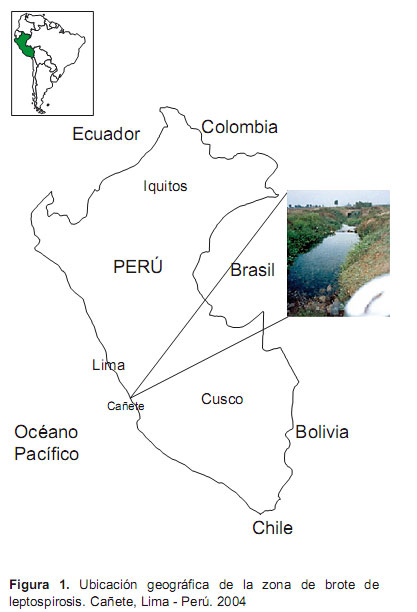
Descripción del área de estudio. San Vicente de Cañete, capital de la provincia de Cañete, es un valle costero con una altitud de 479 msnm, ubicado a 148 Km al sur de Lima, capital del Perú (Figura 1), cuenta con una población de 38 057 habitantes. La actividad principal de la zona es la ganadería y agricultura para exportación y consumo nacional, los principales cultivos son: algodón, espárrago, uva, maíz y otros frutales, además se realiza la producción de bebidas alcohólicas como vino y pisco.
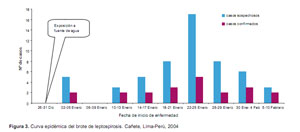
Según los antecedentes epidemiológicos, el menor (caso índice) refería haber frecuentado con los amigos del barrio una semana antes de enfermar a un canal de regadío que se encuentra ubicado a 1,5 Km del local de su residencia. Este canal de regadío (el túnel) presenta un ensanchamiento en un diámetro de cinco metros, en esta parte el agua fluye a una velocidad promedio de 2 m/s, en dicho canal los menores practicaban natación y buceo. A cinco metros del canal de regadío existe una fuente de agua subterránea limpia (cristalina) donde se enjuagaban después del baño en el canal; esta fuente también era frecuentada por canes que tomaban baño junto con los niños y adolescentes de la zona (Figura 2).

Definición de caso probable de leptospirosis. Paciente con fiebre o antecedentes de fiebre entre el 02 de enero al 10 de febrero seguido de uno o más síntomas como cefalea, mialgias, escalofríos, malestar general, dolor abdominal, subfusión conjuntival y diarrea. Además, haber estado expuesto al canal de regadío o la acequia cristalina.
Definición de caso confirmado. Todo caso probable de leptospirosis con resultados positivos a las pruebas de ELISA IgM y MAT en un titulo ≥ 1/200 de dilución de suero, o la presencia de un amplificado de 351 Pb del gen ribosomal 16SrRNA de leptospira por PCR ó cultivo positivo.
Definición de sólo expuesto. Fueron considerados en esta categoría aquellos niños y adolescentes sin antecedentes de fiebre pero con antecedentes epidemiológicos de exposiciones similares en la misma época a los casos probables o confirmados de leptospirosis (canal de regadío o la acequia cristalina).
Encuesta. Con ayuda de los niños y adolescentes que frecuentaban la fuente de infección, se identificó al 100% de sujetos expuestos. Fue realizada una encuesta entre el 28 de enero al 14 de febrero del 2004, obteniéndose datos demográficos (edad, sexo, dirección, nivel educativo), clínicos y epidemiológicos.
INVESTIGACIÓN DE LABORATORIO
Toma de muestra. Fue realizada una colecta de sangre en todos los sujetos encuestados: 5 mL de sangre total en tubos al vacío, 5 mL de sangre con ácido etilendiaminotetraacético (EDTA) en tubos al vacío, y 15 mL de orina en tubos de centrifuga. De la muestra de sangre con anticoagulante se realizó el PCR y cultivo. La muestra de sangre total fue centrifugada, separándose el suero, a partir del cual se realizaron las pruebas de ELISA IgM y la prueba de aglutinación microscópica (MAT). Siete a 21 días después de la primera colecta, se tomó una segunda muestra de sangre (muestra pareada) en tubos al vacío sin anticoagulante. Esta etapa fue la que presentó mayores limitaciones para estudio, debido a que no fue posible obtener todas las muestras necesarias en el íntegro de pacientes principalmente por ser la mayoría niños de corta edad tanto para la primera como la segunda toma de muestras.
Cultivo. El cultivo se realizó en dos tubos con medio Ellinghausen & McCullough, modificado por Johnson & Harris (EMJH) y PLM-5 (Bovuminar PLM-5 Microbiological Medium; Intergen, Purchase, N.Y.), a estos se agregó 2 a 3 gotas de sangre anticoagulada por medio, luego se incubaron entre 28 a 30 ºC, los tubos se observaron semanalmente por un lapso de tres meses; posteriormente fueron descartados.
Pruebas serológicas. El ELISA IgM se realizó usando un kit de ELISA preparado y estandarizado por el Instituto Nacional de Salud-Perú, que utiliza como antígeno un pool de serovares patogénicos; en una evaluación previa mostró una sensibilidad y especificidad mayor al 95% (24). Asimismo se realizó la prueba de aglutinación microscópica (MAT). El MAT se realizó utilizando los siguientes serovares: andamana, bratislava, autumnalis, ballum, bataviae, canicola, celledoni, pomona, hebdomadis, cynopteri, djasiman, georgia, grippotyphosa, icterohaemorrhagiae, javanica, pyrogenes, sejroe y tarassovi (25).
Pruebas moleculares. Para la reacción en cadena de la polimerasa (PCR) se trabajó con ADN extraído de la muestra de sangre y orina, se utilizó un primer que amplifica una secuencia ribosomal de leptospiras (26). La extracción de ADN de sangre se realizó usando el kit DNA Blood Mini Kit (QIAGEN-cat 51106). Se utilizó además un método alternativo de extracción de ADN a partir de orina, el cual no requiere de extensivas etapas de purificación; donde se aprovecha la capacidad quelante que tiene la resina Chelex-100 (SIGMA) para extraer ADN (27).
TRAMPEO DE ROEDORES
Como parte de la investigación epidemiológica, también se realizó la captura de roedores en los canales de regadío y la fuente de agua subterránea, para ello se usó trampas Tomahawk, esta actividad se ejecutó durante dos noches.
ASPECTOS ÉTICOS
Esta investigación no requirió la aprobación de un comité de ética, ya que se enmarcó dentro del contexto de una investigación de brote según procedimientos de rutina del INS. Sin embargo, por tratarse de niños y adolescentes fue necesaria la autorización verbal de los padres para la toma de muestra así como, una explicación exhaustiva de la investigación previo a la aplicación de la encuesta y la realización de los procedimientos.
ANÁLISIS DE DATOS
Los datos recopilados se ingresó a una base elaborada en Microsoft Excel®. Para el procesamiento y análisis de datos se utilizó el paquete estadístico SPSS v.10.0. Se calculó las frecuencias absolutas y relativas para todas las variables estudiadas. La presencia de asociación fue evaluada mediante la prueba de chi-cuadrado, considerando un p<0,05 como significativo. Se calculó además el odds radio (OR) y sus respectivos los intervalos de confianza al 95% (IC95%).
RESULTADOS
Fueron estudiados un total de 77 niños y adolescentes, 50 (65%) de ellos fueron clasificados como casos probables de leptospirosis, y 21 (27,3%) tuvieron confirmación de laboratorio (cultivo o ELISA IgM o MAT o PCR). La edad promedio de los casos probables fue de 11,8 ± 8 años (rango de 2-18 años), y 60% de ellos fueron varones (Tabla 1). No se encontró diferencias significativas entre los casos confirmados de leptospirosis y aquellos con resultados de laboratorio negativo en edad, sexo, grupo etario y procedencia.
Muestras. Se obtuvieron 77 muestras de sangre total para suero, 31 (40,2%) muestras de sangre con EDTA, y 19 (24,7%) muestras de orina. El promedio entre el inicio de la enfermedad y la toma de muestra fue de 9 días (rango 1- 30 días). Se obtuvieron 31 segundas muestras de sangre total para suero.
Cultivo. De los 31 cultivos realizados, cinco fueron positivos; en la tipificación serológica con antisueros policlonales y secuenciamiento, estos pertenecían al serogrupo canicola.
Serología. 18 muestras resultaron positivas por ELISA IgM y MAT, de estas 16 seroconvirtieron de negativo a positivo con títulos ≥ 1/200 de anticuerpos para los serovares canicola e icterohaemorrhagiae.
Molecular. De las 31 pruebas de PCR realizados en muestras de sangre con EDTA, seis resultaron positivos. De 19 pruebas de PCR realizados en orina 11 resultaron positivos al PCR.
Exámenes de roedores. El cultivo de riñones de los 4 roedores capturados fue negativo, siendo todos PCR positivos.
Todos los entrevistados eran residentes de San Vicente de Cañete, el 57% residían en el área urbana, el 43% residía en el área urbana marginal que no cuenta con los servicios básicos de agua y desagüe.
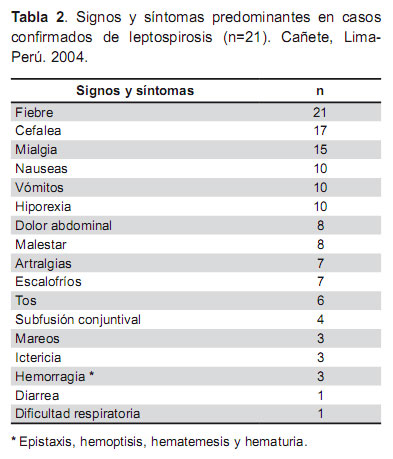
Los síntomas más comunes reportados en los 21 casos confirmados fueron: fiebre (la mediana de duración fue de 5 días, con un rango de 1 a 7), además presentaron cefalea, mialgias, dolor abdominal, náusea, vómitos, hiporexia, subfusión conjuntival como se muestra en la tabla 2. En tres pacientes hubo manifestaciones más graves como ictericia, hemorragia y falla renal.
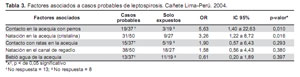
El promedio en horas de exposición a las fuentes de agua fue de 1 hora (rango 1-4). El intervalo entre la exposición, la fuente de infección y el inicio de síntomas fue de 16 días (rango 2-34), se observó un pico elevado de febriles entre el 22-25 de enero (Figura 3); no hubo más casos después del 10 de febrero; 3(14,2%).
Los casos hospitalizados recibieron tratamiento de bencilpenicilina G sódica 100,000 a 200,000 UI/Kg por día vía endovenoso en fracción de 4 a 6 dosis día durante siete días, el resto fue tratado ambulatoriamente por consultorio externo con doxiciclina 100 mg cada12 horas por vía oral durante siete días y amoxicilina 30- 50 mg por kg de peso por día dividido en tres dosis por siete días dependiendo de la edad del menor. No se reportaron fallecimientos dentro de este brote.
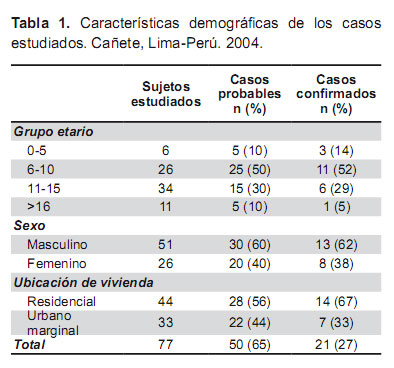
El análisis bivariado de los factores asociados los cuales incluyen el contacto con roedores, perros y el haber practicado natación o lavarse en las distintas fuentes de agua de los casos y controles se muestran en la tabla 3. En el análisis entre los casos probables y los no probables, aquellos que nadaron en la seguía tuvieron un OR=3,93 (IC95% 1,49 a 10,33), p=0,005 y el contacto con perros en la fuente de agua tuvieron un OR=5,63 (IC95% 1,40 a 22,63), p=0,010.
DISCUSIÓN
El presente estudio es el primero que describe un brote de leptospirosis en el año 2004 ocurrido en niños y adolescentes que fueron enrolados en una búsqueda activa de casos, a partir de un caso confirmado, luego de haber estado expuesto a dos tipos de fuente de agua en un área costera desértica del Perú.
La falta de investigación de estos casos, conlleva a un tratamiento no adecuado de la enfermedad, pérdida de muchos casos relacionados a la misma fuente de infección, y actividades de control deficientes o nulas. Asimismo el sistema de vigilancia epidemiológica no detecta las personas con leptospirosis relacionados con el caso índice. Con el presente trabajo nosotros describimos y demostramos que a partir de un sólo paciente con leptospirosis caso se puede encontrar más casos relacionados a una misma fuente común de infección.
Esta investigación tiene implicaciones en salud pública ya que abre una puerta de conocimientos y permite tener una visión amplia del problema de la leptospirosis, ya que generalmente vemos los casos más dramáticos, por ello recomendamos que todos los casos individuales deban ser investigados para encontrar la fuente de infección común o individual y conocer cuantos casos más están relacionados a un caso índice.
La etapa aguda de una leptospirosis leve y anictérica generalmente se presenta con fiebre de inicio brusco y este puede ser el único síntoma identificable, por ello en la búsqueda nosotros usamos como criterio de inclusión este síntoma; similares investigaciones han reportado el mismo criterio para el inicio de casos sospechosos (5,16,17,21,28-31). El porcentaje de pacientes diagnosticados como leptospirosis en estos estudios estuvieron entre 4,9 a 50%. En nuestro estudio encontramos una positividad para leptospirosis de 54% (27/50); este brote se diferencia de los anteriores porque se produjo en un área costera desértica, donde anteriormente no ha existido reporte de casos.
En las regiones costeras son pocas las enfermedades que podrían confundirse clínicamente, dentro de ellas tenemos la brucelosis y la fiebre tifoidea. En esta región costera generalmente la leptospirosis no es considerada en el diagnóstico diferencial debido a la poca o nula presentación de casos y por qué el personal de salud desconoce esta enfermedad. Hay sospecha una vez que la presentación clínica es tan estrepitosa como un síndrome de Weil. En la investigación del brote hemos identificado tres características clínicas básicas como la fiebre de inicio abrupto, cefalea y mialgia y otras adicionales como hiporexia, náuseas, vómitos, dolor abdominal la presencia de éstas más, el antecedente epidemiológico de exposición a fuentes de agua, podrían ayudar a un médico a sospechar de un caso de leptospirosis.
Karande et al. (32) reportan en brotes de la India que la fiebre, cefalea, mialgia y dolor abdominal han sido los síntomas más predominantes. En nuestro estudio encontramos la presencia de dolor abdominal en ocho de los 21 casos confirmados, tres pacientes presentaron la forma grave de la enfermedad con presencia de ictericia, falla renal y hemorragia (epistaxis, hemoptisis, hematemesis y hematuria), que fue más evidente en el primer caso debido a la sospecha clínica tardía. Los trabajos sobre leptospirosis en menores de edad muestran que existe poca sospecha clínica debido a que la presentación clínica no es especifica (9-15). Se han descrito pocos reportes de leptospirosis de la forma anictérica en menores (10,11), los reportes que están más descritos son de la forma grave llamada enfermedad de Weil (9,12) y sus complicaciones como el deterioro de la función renal (9-12), meningitis (14) y hemorragia generalizada (13,14,32).
En el Perú no se ha reportado un brote similar al presente, inclusive tampoco se han publicado botes similares en otros países, es el primero reportado por la particularidad del brote. Al inicio de la investigación se pensó que el canal de regadío era la fuente principal de infección, no obstante, se llegó a la conclusión que la fuente de contagio fue la fuente de agua subterránea (cristalina). Entre las razones para descartar el canal de regadío estuvieron la velocidad del agua (1-2 m/s), lo que permitiría una mayor dilución del agente, los menores de 10 años no practican natación en el canal por la profundidad y la velocidad de las aguas, las niñas tenían poca exposición y los perros tampoco eran bañados en el canal, asimismo, no se encontraron roedores en las trampas colocadas. La acequia de agua subterránea a diferencia del canal presenta un volumen de agua menor, no se observó un flujo continuo y rápido, la fuente de agua era clara lo que permitiría un mayor tiempo de sobrevivencia de las leptospiras, los menores después de bañarse en el canal de regadío iban a enjuagarse en esta fuente por ser aparentemente más limpia, los perros también eran bañados en este lugar, además, se observaron y capturaron roedores.
Los reservorios considerados como fuente de contaminación fueron probablemente roedores (Rattus rattus) los cuales salieron positivos al PCR, y posiblemente también los perros, sin embargo, no pudimos obtener muestras de estos animales por la dificultad para ubicarlos a los expuestos a la fuente de agua subterránea. Se han encontrado reportes asociados a brotes, las precipitaciones y el contacto con fango (5,33) y fuentes de agua (16). En áreas urbanas donde las condiciones de saneamiento son deficientes han estado asociados a la presencia de ratas (34,35) y perros (36,37).
En áreas tropicales como Asia y Brasil se ha descrito brotes asociados a inundaciones posteriores a precipitaciones fuertes haciendo que el contacto fuera mayor con orina contaminada de perros callejeros y roedores (21,38). En dos investigaciones que nosotros hemos realizado en la selva peruana encontramos que también la exposición a fuentes de agua contaminada fue un factor para contraer la enfermedad (39) similar a lo reportado en Asia (19,20,40).
La prueba ELISA IgM desarrollada por nosotros es una técnica muy sensible y específica que nos ha permitido detectar brotes tempranamente y tomar decisiones en forma oportuna (28,39). El ELISA detecta anticuerpos IgM en pacientes con sospecha clínica a partir del cuarto día de enfermedad permitiendo iniciar un tratamiento precoz. Otros estudios realizados también refieren el uso del ELISA IgM para confirmar brotes (17,32,41,42). Nosotros utilizamos la prueba de ELISA IgM y MAT (7,17,24,28,39), con un título de 1/200 en una sola muestra para confirmar un caso, esta es la técnica más adecuada en una zona donde la leptospirosis es esporádica o nula, lo que nos permitió detectar más casos.
Mediante cultivo se logró aislar el patógeno en cinco de los 21 casos confirmados (24%), mayor a lo mencionado en la literatura donde se menciona el aislamiento entre 1 a 10%. Otro método importante fue el desarrollo del PCR a partir de sangre y orina, lo que permitió un diagnóstico precoz, ya que las pruebas serológicas al inicio suelen salir negativas, semejante a lo mencionado por otros autores (26,39,43-45).
Nuestros resultados sugieren que la leptospirosis en esta zona es una enfermedad infecciosa esporádica que emerge como brotes asociados a alguna fuente de agua o suelo contaminado; por tanto las pruebas de laboratorio para el diagnóstico de esta enfermedad se deben considerar rutinariamente en menores febriles con un antecedente epidemiológico de contacto con fuentes de agua (acequias, ríos, riachuelos, desagües entre otros).
Nosotros confirmamos la presencia de un brote de leptospirosis dentro de un contexto epidemiológico nuevo, relacionado a una fuente común de agua subterránea, y asociada al contacto con perros dentro de esta fuente. Los datos obtenidos en esta investigación permitirán ampliar el conocimiento acerca de esta patología, que debe ser considerada como causa de enfermedad febril para esta zona.
Fuente de Financiamiento
Instituto Nacional de Salud, Lima - Perú.
Conflictos de Interés
Los autores declaran no tener conflictos de interés en la publicación de este artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. Faine S, Adler B, Bolin C, Perolat P. Leptospira and Leptospirosis. 2nd ed. Melbourne: MediSci; 1999.
2. Bharti A, Nally J, Ricaldi J, Matthias M, Diaz M, Lovett M, et al. Leptospirosis: a zoonotic disease of global importance. Lancet Infect Dis. 2003; 3(12): 757-71.
3. Ricaldi J, Vinetz J. Leptospirosis in the tropics and in travelers. Curr Infect Dis Rep. 2006; 8(1): 51-58.
4. Levett P. Leptospirosis. Clin Microbiol Rev. 2001; 14(2): 296-326.
5. Ko AI, Reis M, Dourado C, Johnson W, Riley L. Urban epidemic of severe leptospirosis in Brazil. Salvador Leptospirosis Study Group. Lancet. 1999; 354(9181): 820-25.
6. Karande S, Kulkarni H, Kulkarni M, De A, Varaiya A. Leptospirosis in children in Mumbai slums. Indian J Pediatr 2002; 69(10): 855-58.
7. Blair P, Schoeler G, Moron C, Anaya E, Caceda R, Cespedes M, et al. Evidence of rickettsial and leptospira infections in Andean northern Peru. Am J Trop Med Hyg. 2004; 70(4): 357-63.
8. Suttinont C, Losuwanaluk K, Niwatayakul K, Hoontrakul S, Intaranongpai W, Silpasakorn S, et al. Causes of acute, undifferentiated, febrile illness in rural Thailand: results of a prospective observational study. Ann Trop Med Parasitol. 2006; 100(4): 363-70.
9. Wong M, Kaplan S, Dunkle L, Stechenberg B, Feigin R. Leptospirosis: a childhood disease. J Pediatr. 1977; 90(4): 532-7.
10. Suarez M, Bustelo J, Perez L, Gorgoy V. Brote de leptospirosis en niños con predomino meningoencefalico, en el municipio Morón. Rev Cubana Med Trop. 1991; 43(2): 136-39.
11. Jackson L, Kaufmann A, Adams W, Phelps M, Andreasen C, Langkop C, et al. Outbreak of leptospirosis associated with swimming. Pediatr Infect Dis J. 1993; 12(1): 48-54.
12. Giudicelli J, Lemaitre D, Fournier V, Contamin B, Hartemann E, Floret D. Trois observations pédiatriques de leptospirose. Pediatrie. 1993; 48(6): 455-58.
13. Cruz M, Andrade J, Pereira M. Leptospirose em crianças no Rio de Janeiro. Rev Soc Bras Med Trop. 1994; 27(1): 5-9.
14. Marotto PC, Marotto MS, Santos DL, Souza TN, Seguro AC. Outcome of leptospirosis in children. Am J Trop Med Hyg. 1997; 56(3): 307-10.
15. Suarez M, Martinez R, Posada P, Vidal I, Bravo F, Sanchez A. Brotes de leptospirosis humana en la provincia de Ciego de Ávila, Cuba. Rev Soc Bras Med Trop. 1999; 32(1): 13-18.
16. Sugunan A, Vijayachari P, Sharma S, Roy S, Manickam P, Natarajaseenivasan K, et al. Risk factors associated with leptospirosis during an outbreak in Middle Andaman, India. Indian J Med Res. 2009; 130(1): 67-73.
17. Mathur M, De A, Turbadkar D. Leptospirosis outbreak in 2005: L.T.M.G. hospital experience. Indian J Med Microbiol. 2009; 27(2): 153-55.
18. Yoder J, Hlavsa M, Craun G, Hill V, Roberts V, Yu P, et al. Surveillance for waterborne disease and outbreaks associated with recreational water use and other aquatic facility-associated health events--United States, 2005- 2006. MMWR Surveill Summ. 2008; 57(9): 1-29.
19. Narita M, Fujitani S, Haake D, Paterson D. Leptospirosis after recreational exposure to water in the Yaeyama islands, Japan. Am J Trop Med Hyg. 2005; 73(4): 652-6.
20. Nakamura M, Taira K, Itokazu K, Kudaka J, Asato R, Kise T, et al. Sporadic cases and an outbreak of leptospirosis probably associated with recreational activities in rivers in the northern part of Okinawa Main Island. J Vet Med Sci. 2006; 68(1): 83-5.
21. Koay T, Nirmal S, Noitie L, Tan E. An epidemiological investigation of an outbreak of leptospirosis associated with swimming, Beaufort, Sabah. Med J Malaysia. 2004; 59(4): 455-9.
22. Céspedes M, Fernández R, Rimarachín R, Taipe H, Cenepo J, Mori M, et al. Leptospirosis: Una enfermedad zoonótica hiperendémica en la provincia de Coronel Portillo. Ucayali, Perú. Rev Peru Med Exp Salud Publica. 2004; 21(2): 62-70.
23. Céspedes M, Balda L, González D, Tapia R. Situación de la leptospirosis en el Perú: 1994-2004. Rev Peru Med Exp Salud Publica. 2006; 23(1): 52-62.
24. Céspedes M, Glenny M, Felices V, Balda L, Suarez V. Prueba de ELISA indirecta para la detección de anticuerpos IgM para el diagnostico de leptospirosis humana. Rev Peru Med Exp Salud Publica. 2002; 19(1): 24-27.
25. Cole J Jr, Sulzer C, Pursell A. Improved microtechnique for the leptospiral microscopic agglutination test. Appl Microbiol. 1973; 25(6): 976-80.
26. Mérien F, Amouriaux P, Perolat P, Baranton G, Saint Girons I. Polymerase chain reaction for detection of Leptospira spp. in clinical samples. J Clin Microbiol. 1992; 30(9): 2219-24.
27. Willard J, Lee D, Holland M. Recovery of DNA for PCR amplification from blood and forensic samples using a chelating resin. Methods Mol Biol. 1998; 98: 9-18.
28. Céspedes M, Ormaeche M, Condori P, Balda L, Glenny M. Prevalencia de leptospirosis y factores de riesgo en personas con antecedentes de fiebre en la provincia de Manu, Madre de Dios, Perú. Rev Peru Med Exp Salud Publica. 2003; 20 (4): 180-85.
29. Everard C, Fraser-Chanpong G, Hayes R, Bhagwandin L, Butcher L. A survey of leptospirosis in febrile patients mainly from hospitals and clinics in Trinidad. Trans R Soc Trop Med Hyg. 1982; 76(4): 487-92.
30. Sasaki D, Pang L, Minette H, Wakida C, Fujimoto W, Manea S, et al. Active surveillance and risk factors for leptospirosis in Hawaii. Am J Trop Med Hyg. 1993; 48(1): 35-43.
31. Trevejo R, Rigau-Pérez J, Ashford D, McClure E, Jarquin- González C, Amador J, et al. Epidemic leptospirosis associated with pulmonary hemorrhage-Nicaragua, 1995. J Infect Dis. 1998; 178(5): 1457-63.
32. Karande S, Bhatt M, Kelkar A, Kulkarni M, De A, Varaiya A. An observational study to detect leptospirosis in Mumbai, India, 2000. Arch Dis Child. 2003; 88(12): 1070-75.
33. Everard C, Bennett S, Edwards C, Nicholson G, Hassell T, Carrington D, et al. An investigation of some risk factors for severe leptospirosis on Barbados. J Trop Med Hyg. 1992; 95(1): 13-22.
34. Thiermann A. Incidence of leptospirosis in the Detroit rat population. Am J Trop Med Hyg. 1977; 26(5 Pt 1): 970-4.
35. Vinetz J, Glass G, Flexner C, Mueller P, Kaslow D. Sporadic urban leptospirosis. Ann Intern Med. 1996; 125(10): 794-98.
36. Myers D. Leptospiral antibodies in stray dogs of Moreno, Province of Buenos Aires, Argentina. Rev Argent Microbiol. 1980; 12(1): 18-22.
37. Farrington N, Sulzer K. Canine leptospirosis in Puerto Rico. Int J Zoonoses. 1982; 9(1): 45-50.
38. Barcellos C, Sabroza P. The place behind the case: leptospirosis risks and associated environmental conditions in a flood-related outbreak in Rio de Janeiro. Cad Saude Publica. 2001; 17(Suppl): 59-67.
39. Segura E, Ganoza C, Campos K, Ricaldi J, Torres S, Silva H, et al. Clinical spectrum of pulmonary involvement in leptospirosis in a region of endemicity, with quantification of leptospiral burden. Clin Infect Dis. 2005; 40(3): 343-51.
40. Biswas D, Roy S, Vijayachari P, Sugunan AP, Natarajaseenivasan K, Sehgal S. Comparison of immunoreactive proteins of commonly circulating serogroups of Leptospira in Andaman Islands, India. Indian J Med Res. 2005; 121(3): 151-58.
41. Tangkanakul W, Tharmaphornpil P, Plikaytis B, Bragg S, Poonsuksombat D, Choomkasien P, et al. Risk factors associated with leptospirosis in northeastern Thailand, 1998. Am J Trop Med Hyg. 2000; 63(3-4): 204-8.
42. Ashford D, Kaiser R, Spiegel R, Perkins B, Weyant R, Bragg S, et al. Asymptomatic infection and risk factors for leptospirosis in Nicaragua. Am J Trop Med Hyg. 2000; 63(5-6): 249-54.
43. Bal A, Gravekamp C, Hartskeerl R, De Meza-Brewster J, Korver H, Terpstra W. Detection of leptospires in urine by PCR for early diagnosis of leptospirosis. J Clin Microbiol. 1994; 32(8): 1894-98.
44. Romero E, Billerbeck A, Lando V, Camargo E, Souza C, Yasuda P. Detection of Leptospira DNA in patients with aseptic meningitis by PCR. J Clin Microbiol. 1998; 36(5): 1453-55.
45. Truccolo J, Serais O, Merien F, Perolat P. Following the course of human leptospirosis: evidence of a critical threshold for the vital prognosis using a quantitative PCR assay. FEMS Microbiol Lett. 2001; 204(2): 317-21.
Correspondencia: Msc, MPH(c) Manuel Céspedes Zambrano.
Dirección: Av. Defensores del Morro 2268, Chorrillos, Lima.
Teléfono: (511) 617 6200
Correo electrónico: mcespedes@ins.gob.pe, manuel.cespedesz@gmail.com
Recibido: 27-10-09
Aprobado: 16-12-09