Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.26 no.4 Lima Oct./dec. 2009
ORIGINAL BREVE
Caracterización y optimización del antígeno del líquido hidatídico de ovino y su aplicación en la prueba de látex
Characterization and optimization of sheep hydatid fluid antigen and its application in the latex test
Flor Fuentes1,a, Nelly Incio1,a, Juan Lévano1,b, Yovanna Torres2,c
1 Centro Nacional de Productos Biológicos, Instituto Nacional de Salud. Lima, Perú.
2 SAIS Tupac Amaru, EsSalud. Junín Perú.
a Químico farmacéutico; b Médico veterinario; c Médico.
RESUMEN
Se caracterizó y optimizó el antígeno del líquido hidatídico de ovino y se aplicó en la prueba de látex como prueba tamiz para el diagnóstico serológico de pacientes con quistes de Echinococcus granulosus. Se evaluó 40 sueros, 15 de hidatidosis positivos por inmunoblot, 10 de pacientes con otras enfermedades parasitarias y 15 de personas sanas. Tres de los 15 sueros de hidatidosis resultaron negativos y 0/25 sueros sin hidatidosis fueron reactivos. Se obtuvo una sensibilidad de 80% (IC95%: 56,4 a 100%), especificidad de 100% (96,7 a 100%), valor predictivo positivo de 100% (95,8 a 100%) y valor predictivo negativo de 83,3 (30,4 a 69,6%) y una concordancia del 100% al evaluar la repetibilidad y reproducibilidad de la prueba. Se recomienda el uso de esta prueba para el diagnóstico de la hidatidosis por ser simple, rápida y reproducible, como kit en laboratorio o en campo para estudios epidemiológicos.
Palabras clave: Prueba de aglutinación; Pruebas de fijación de látex; Equinococosis (fuente: DeCS BIREME).
ABSTRACT
It was characterized and optimized sheep hydatid fluid antigen and applied in latex fixation tests as screening test for serological diagnosis of patients with Echinococcus granulosus cysts. We evaluated 40 sera, 15 sera positive by immunoblot from patients with E. granulosus infection, 10 sera from patients with other parasitic diseases and 15 sera from healthy subject. Three of the 15 hydatidosis sera were negative and 0 / 25 sera with hydatidosis were reactive. The sensitivity was 80% (95%CI: 56.4 to 100%), specificity was 100% (96.7 to 100%), positive predictive value of 100% (95.8 to 100%), negative predictive value of 83.3 (30.4 to 69.6%), and repeatability and reproducibility of 100%. We recommended the use of this test for the diagnosis of hydatid disease, because it is simple, fast and reproducible, as a kit in the laboratory or in epidemiological field studies.
Key words: Echinococcosis, diagnosis, Latex Fixation Tests, Agglutination tests (source: MeSH NLM).
INTRODUCCIÓN
La hidatidosis es una zoonosis producida por el cestodo del género Echinococcus granulosus, que infecta al hombre cuando éste ingiere, en forma accidental, los huevos de dicho parásito; en el ciclo de este parásito el perro es el hospedero definitivo y el ganado ovino, bovino, caprino, porcino y otros herbívoros son hospederos intermediarios (1-3).
Esta zoonosis es de distribución mundial y se encuentra relacionada a la ganadería con infraestructura sanitaria deficiente, también es asociada generalmente con bajos niveles socioeconómicos y a la ausencia de educación sanitaria. Alcanza una alta incidencia en países como Argentina, Uruguay, Chile, Argelia, Australia, Nueva Zelandia y en Europa, fundamentalmente Grecia, Italia, Portugal y España (4).
El Perú tiene áreas ganaderas que constituyen zonas endémicas, las cuales se encuentran en las regiones de Junín, Apurímac, Huánuco, Ancash, Arequipa, Puno, y Cajamarca (5,6).
La importancia de la hidatidosis en la salud pública está relacionada con el alto índice de morbilidad humana, pues cerca del 70% de los casos ocurre en personas en plena actividad productiva, afectando el rendimiento laboral y causando gastos por hospitalización, intervenciones e incapacidades (1,4).
En el hombre, las localizaciones más frecuentes son el hígado (55-70%), el pulmón (30%) y más raramente otros órganos (cerebro y riñones), los quistes hidatídicos tienen una tasa de crecimiento lento y no provocar síntomas durante 10 años o más (5).
El cuadro clínico de la hidatidosis y la respuesta inmunológica del portador, esta relacionada con el estado físico del quiste y la integridad de sus membranas, la formación de microfisuras libera su contenido e induce la formación de anticuerpos por el sistema inmunológico del individuo (7).
La cirugía sigue siendo el tratamiento de elección para la mayoría de los casos, por esta razón, las pruebas serológicas deben contribuir en forma oportuna al diagnóstico de la enfermedad (5,8).
En el diagnóstico por estudios serológicos destacan la hemaglutinación indirecta (HAI), la doble difusión arco 5 (DD5), la inmunoelectroforesis arco 5 (IEF), el inmunoensayo (ELISA), la inmunoflorescencia indirecta (IFI) y el inmunoblots (Western blot); mientras que en el diagnóstico por imágenes se tiene a la radiología, la tomografía, la resonancia magnética y la ecografía, cuya desventaja es requerir equipos y materiales de alto costo así como un laboratorio acondicionado y personal especializado (5,9,10).
El antígeno más usado para la preparación de reactivos de diagnóstico es el líquido hidatídico de ovino, debido a su fertilidad y propiedades antigénicas. Las sustancias existentes en el quiste hidatídico son variables y complejas entre ellas la histamina, que es un aglutinógeno con actividad anafiláctica y un ingrediente citotóxico termoestable de bajo peso molecular que penetra a través de la pared del quiste e interfiere localmente la acción de las células inmunocompetentes, facilitando la supervivencia del parásito, también hay anticuerpos inespecíficos, inmunoglobulinas específicas (IgG2a e IgG2b), una poliexamina y tres poliaminas (putresinas, espermidina y ornitina descarboxilasa) (4).
La prueba de aglutinación de látex (AL) para el diagnóstico de hidatidosis, es una suspensión de partículas de látex de poliestireno sobre el cual el antígeno (Ag) es adsorbido a fin magnificar o ampliar la reacción antígeno - anticuerpo frente a un suero positivo, esta suspensión es de aspecto uniforme lechoso, si es observado sobre una lámina de vidrio de fondo oscuro (11).
La unión de moléculas de inmunoglobulinas G son anticuerpos multivalentes que se acoplan a múltiples antígenos adheridos a partículas de látex, produciendo un entramado que da como resultado una aglutinación o agrupamiento visible de las partículas de látex (12).
La reacción de aglutinación se ve influenciada por factores como el exceso o escasez antígeno hidatídico, partículas de látex muy diluidas o concentradas, exceso de anticuerpos y el uso de tampones o buffers a pH adecuados, a fín de estabilizar el sistema látex-antígenoanticuerpo, logrando la equivalencia cuyo efecto es una reacción de aglutinación óptima (13,14).
Las pruebas que actualmente se usan en nuestro medio son poco prácticas, demoran en dar resultados, requieren equipos y materiales de alto costo y personal especializado; por ello, se planteó como objetivo caracterizar y optimizar el antígeno del líquido hidatídico de ovino y su aplicación en la prueba de látex.
EL ESTUDIO
Durante el año 2005 se realizó un estudio observacional transversal en tres etapas: caracterización y optimización del antígeno hidatídico, sensibilización de las partículas de látex y determinación de la eficiencia diagnóstica de la prueba de látex (7,9,15).
SUEROS ESTUDIADOS
Se seleccionó 40 muestras de suero, procedentes de Junín y Huancavelica así como de la seroteca del Laboratorio de Zoonosis del Instituto Nacional de Salud (INS) en Lima, Perú; quince de ellas pertenecientes a pacientes diagnosticados con hidatidosis por el método de inmunoblot, diez de pacientes con otras enfermedades parasitarias (cisticercosis, toxoplasmosis) y quince de personas sanas procedentes.
CARACTERIZACIÓN Y OPTIMIZACIÓN DEL ANTÍGENO HIDATÍDICO
Obtención de los quistes hidatídicos infectados con larvas de Echinococcus granulosus. Se extrajo el líquido hidatídico de los pulmones y el hígado de ovinos recién faenados en camales de Lima, mediante punción - aspiración con jeringa o con una bomba de vacío conectada a un matraz Kitazato, a fin de recolectar el líquido hidatídico en menor tiempo. Se descartó los quistes calcificados, supurados o infectados. Al microscopio se observó abundantes elementos formados, tales como escólex, protoescólex envainados de morfología ovoidea, protoescólex desenvainados, presencia de ganchos rostelares intactos, abundantes corpúsculos calcáreos de los protoescólex, cápsulas incubatrices y quistes hijos endógenos.
Diálisis y liofilización del líquido hidatídico. Al líquido hidatídico obtenido se adicionó azida de sodio 1g/L y EDTA 10 mM, se sedimentó y decantó, el sobrenadante se centrifugó a 1000 rpm por treinta minutos, se dializó con una membrana (MWCO: 6000 – 8000) por cuatro días en cámara fría de 2 a 8 °C, frente a varios cambio de agua destilada, luego se concentró mediante el proceso de liofilización, de acuerdo con el protocolo establecido, para lo cual se utilizó tres bandejas con 500 mL c/u por cada proceso de liofilización de 96 horas en promedio, luego fue almacenado entre 2 a 8 °C.
Determinación de las proteínas del antígeno hidatídico. El antígeno hidatídico liofilizado fue reconstituido con tampón de glicina de pH 8,2; se centrifugó por treinta minutos a 2000 rpm, del sobrenadante se determinó el contenido de proteínas totales por el método Lowry, luego fue conservado a -20 °C hasta su uso.
Control del antígeno hidatídico. El antígeno hidatídico liofilizado se controló mediante la prueba de immunoelectroforesis (IEF) a fin de verificar la presencia del arco 5 utilizando agarosa al 0,9%, en solución tampón de veronal pH 8,2. Para visualizar el perfil de bandas antigénicas frente a suero positivo de hidatidosis, se realizó la prueba de Western Blot en gel de poliacrilamida 12 % (SDS-PAGE) en condiciones reductoras.
REACTIVO DE AGLUTINACIÓN EN LÁTEX
Preparación de la suspensión stock de partículas de látex y concentración del antígeno hidatídico liofilizado óptimo. Se usó partículas de látex comercial (Bangs Laboratories, Inc. USA) de poliestireno, de 0,19 μm de diámetro, se sensibilizó diferentes concentraciones de suspensiones de partículas de látex al 9,7%, 9% y 5% en una dilución 1:4 V/V con tampón fosfato salino a pH 7 y concentraciones de antígeno hidatídico liofilizado 12 mg/mL; 8 mg/mL; 4 mg/mL; 2 mg/mL con tampón glicina a pH 8,2 y para estabilizar el sistema látex - antígeno se dejó en reposo por 15 días a temperatura de 2 a 8 °C. La concentración de 12 mg/mL de antígeno hidatídico liofilizado y la preparación al 9,7 % de partículas de látex fue la óptima ya que se logró la equivalencia del sistema látex-antígeno-anticuerpo, logrando una buena sensibilidad, especificidad y una reacción de aglutinación a los treinta segundos.
Sensibilización de las partículas de látex con el antígeno hidatídico preparado. A 3 mL de tampón de glicina pH 8,2 se agregó 1 mL de la solución de antígeno de líquido hidatídico de una concentración de 12 mg/mL y 0,6 mL de la suspensión 9,7 % stock de partículas de látex, se agitó e incubó la mezcla durante treinta minutos a 37 °C y luego por 15 días de 2 a 8 °C.
Preparación del control de partículas de látex sin sensibilizar. Se preparó el control de las partículas de látex sin sensibilizar tomando 0,3 mL de la suspensión stock de partículas de látex, más 2 mL de tampón de glicina. Los sueros positivos no aglutinaron con el reactivo de látex sin sensibilizar.
ENSAYO DE AGLUTINACIÓN DE LÁTEX
Para iniciar la prueba, los sueros sin diluir deben inactivarse a 56 °C en baño María por treinta minutos, la prueba se realiza con 20 uL del suero, más 20 uL del reactivo de látex sensibilizado sobre una placa de vidrio de fondo oscuro, se mezclan ambas con un palillo aplicando un movimiento circular, se balancea continuamente durante treinta segundos y se realiza la lectura visualmente.
Lectura de resultados. Un suero positivo mostrará grumos de partículas látex. El suero negativo y el control de partículas de látex sin sensibilizar se mantendrán uniformemente turbios o permanecen en suspensión.
ASPECTOS ÉTICOS
Este estudio fue aprobado por el Comité de Investigación del Instituto Nacional de Salud, con Resolución Jefatural N.º 0133-2002-J-OPD/INS. Todos los sueros fueron manejados de manera anónima.
ANALISIS ESTADÍSTICO
Se calculó la sensibilidad y especificidad de la prueba con un intervalo de confianza de 95% (IC95%) usando el paquete estadístico Epidat v.3.1. Para medir la reproducibilidad de la prueba se realizó cinco ensayos por duplicado usando sueros positivos y negativos. La reproducibilidad fue realizada en el laboratorio de control de calidad interno del Centro Nacional de Productos Biológicos (CNPB) usando el mismo panel de sueros positivos y negativos usados en la prueba inicial. La concordancia de la repetibilidad y reproducibilidad de la prueba de aglutinación de látex fue calculada en porcentajes.
HALLAZGOS
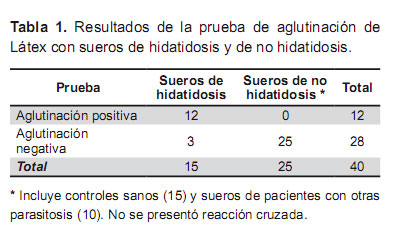
De acuerdo con estos resultados, la prueba de látex detecta anticuerpos en los sueros hidatídicos con una sensibilidad de 80% (IC 95%: 56,4 a 100%), especificidad de 100% (96,7 a 100%), con valor predictivo positivo de 100 % (95,8 a 100%) y valor predictivo negativo de 83,3 (30,4 a 69,6%). No se evidenció reacción cruzada con sueros de pacientes con cisticercosis ni toxoplasmosis.
DISCUSIÓN
En los últimos años, el diagnóstico serológico de la hidatidosis se enfocó en mejorar las técnicas de diagnóstico, tanto en su sensibilidad como en su especificidad, los cuales varían de acuerdo con la naturaleza, pureza, calidad de los antígenos empleados y la sensibilidad y especificidad intrínseca de las técnicas serológicas frente a las respuestas del huésped (9).
La obtención de líquido hidatídico de pulmones e hígado de ovinos recién faenados; previo estudio de su viabilidad, con la adición de preservantes y estabilizadores, purificado y concentrado por liofilización (un volumen de 1,5 L durante 96 horas), permitió obtener un antígeno de buena calidad, que se evidenció por la pruebas de inmunoelectroforesis e inmunoblots.
Las cantidades de antígeno, anticuerpo, partículas de látex y los sistemas buffer permiten una equivalencia antígeno-anticuerpo cuyo efecto es una reacción de aglutinación óptima (13,14). Es así que la concentración 12 mg/mL de antígeno hidatídico liofilizado, la preparación al 9,7 % de partículas de látex y el reposo de 15 días de 2 a 8 ºC para estabilizar el sistema látex-antígeno, fue la óptima ya que permitió obtener la equivalencia del sistema látex-antígeno-anticuerpo logrando una buena reacción de aglutinación a los treinta segundos.
La prueba tiene muy buena sensibilidad y especificidad para detectar anticuerpos en los sueros hidatídicos además de valores predictivos altos. Sólo tres pacientes hidatídicos dieron resultado negativo a la prueba de látex. Esto es posible ya que el cuadro clínico de la hidatidosis esta relacionado con el estado físico del quiste, la integridad de sus membranas y la respuesta inmunológica del huésped (7).
De los 15 sueros positivos de hidatidosis, el reactivo de aglutinación de látex preparado ha detectado 12 sueros. No se observó reacción cruzada con los sueros utilizados de cisticercosis, toxoplasmosis y el suero control negativo.
Szyfres y Kagan evaluaron un conjunto de 60 sueros de pacientes con hidatidosis, mediante la prueba de látex impregnado con liquido hidatídico, obteniendo una sensibilidad de 93% (16). Barbieri et al. trabajaron con partículas de látex de poliestireno sensibilizadas con una fracción lipoprotéica purificada por cromatografía de afinidad con Acrylic-heparina a partir de liquido hidatídico fértil de bovino, ellos demostraron 88% de sensibilidad y 87% de especificidad (17).
Miranda et al. encontraron que de 40 sueros de pacientes con hidatidosis uno dio resultado negativo y de los 40 sueros de pacientes sin hidatidosis cuatro resultaron positivos obteniéndose una sensibilidad de 97,5% y una especificidad de 90% (10).
Si bien la sensibilidad hallada en el presente estudio esta muy cercana a lo encontrado por los autores mencionados, la especificidad es superior a ellos, creemos que esto fue posible ya que se logró la equivalencia del sistema látex-antígeno-anticuerpo obteniendo una reacción de aglutinación en treinta segundos.
En la repetibilidad y reproducibilidad hubo 100% de concordancia, evidencia que la prueba puede ser realizada sin mayores problemas; así mismo, hubiera sido posible evaluar la prueba de látex con un número mayor de sueros a fin de tener un resultado más representativo. No se llegó a evaluar el costo de la producción de un kit para diagnóstico de hidatidosis.
Se recomienda el uso de la prueba de aglutinación en látex como prueba tamiz para el diagnóstico de hidatidosis por ser simple, rápida y reproducible, a nivel de laboratorio o en campo para estudios epidemiológicos de zonas endémicas. Además, se recomienda que el Centro Nacional de Productos Biológicos realice la producción del mencionado reactivo en forma de kit y se ponga a disposición de hospitales y centros de salud del país.
AGRADECIMIENTOS
A la Sociedad Agrícola de Interés Social (SAIS) Túpac Amaru en Pachacayo, Junín, y a la Sociedad Anónima Comercial Industrial Peruana (SACIP) del Camal de Yerbateros en Lima, por las facilidades de obtención de vísceras de ovinos con quistes hidatídicos.
Fuente de financiamiento
Instituto Nacional de Salud.
Conflicto de interés
Los autores declaran no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Sapunar J. Hidatidosis. En: Atías A, editor. Parasitología Médica. 1ª ed. Santiago de Chile: Mediterráneo; 1999. p. 338-54.
2. Torgerson PR, Deplazes P. Echinococcosis: diagnosis and diagnostic interpretation in population studies. Trends Parasitol. 2009; 25(4): 164-70.
3. Garcia-Apaico V, Vargas-Cuba FH, Segovia G, Fernandez- Chillce I, Miranda E. Seroprevalencia de hidatidosis humana en población adulta de Sancos, Ayacucho 2005. Rev Perú Med Exp Salud Pública. 2009; 26(2) 193-97.
4. Sánchez M. Hidatidosis. En: Cordero M, Rojo F, Martínez A, Sánchez M, Hernández S, Navarrete I, et al. editores. Parasitología veterinaria. Madrid: McGraw-Hill Interamericana; 1999. p. 342-50.
5. Correa S, Pinto M, Culqui C, Huillca L, Salinas E. Hidatidosis hepática: revisión de casos intervenidos quirúrgicamente en el Hospital Militar Central Lima 1990 -1999. Rev Gastroenterol Peru. 2000; 20(3): 261-9.
6. Alva P, Cornejo W, Sevilla C, Huiza A. Encuesta serológica para hidatidosis humana por la prueba de doble difusión Arco 5 en la provincia de Chupaca, Junín, Perú. Rev Peru Med Exp Salud Publica. 2008; 25(1): 149-52.
7. Centro Panamericano de Zoonosis. Prueba de doble difusión arco 5 para el diagnostico de la Hidatidosis Humana. Nota Técnica No 22. Buenos Aires: Centro Panamericano de Zoonosis; 1979.
8. Benites M. Hidatidosis en el Hospital Arzobispo Loayza, técnicas quirúrgicas. [tesis de especialista en cirugía general]. Lima: Facultad de Medicina, Universidad Nacional Mayor de San Marcos; 1996.
9. Varela–Díaz V, Coltori E. Técnicas de diagnóstico de hidatidosis humana. Buenos Aires: Centro Panamericano de Zoonosis; 1974.
10. Miranda E, Sánchez E, Náquira C, Somocursio J, Ayala E, Miranda G. Evaluación de una prueba de aglutinación de látex para el diagnóstico serológico de la equinococosis quística. Rev Peru Med Exp Salud Publica. 2009; 26(2): 198-202.
11. Bangs Laboratories, INC. Inmunological applications. Tech Note # 301. Indianapolis: Bangs Laboratories Inc; 1999.
12. Devi Chandrakesan S, Parija SC. Latex agglutination test (LAT) for antigen detection in the cystic fluid for the diagnosis of cystic echinococcosis. Diagn Microbiol Infect Dis, 2003; 45(2): 123-6.
13. Bangs Laboratories. INC. Covalent Coupling. Tech Note # 205. Indianapolis: Bangs Laboratories Inc; 2002.
14. Bangs Laboratories .INC. Working with Microspheres. Tech Note # 201. Indianapolis: Bangs Laboratories Inc; 2002.
15. Sánchez E. Determinação de antígenos relevantes da forma larvar do Echinococcus granulosus: Padronização e aplicação do immunoblot no diagnostico da hidatidose humana. [Tesis de maestria]. Rio de Janeiro: Instituto Oswaldo Cruz-Fiocruz; 1995.
16. Szyfres B, Kagan, I. Prueba modificada de aglutinación de látex como procedimiento tamiz para hidatidosis. Bol Oficina Sanit Panam. 1963; 54(3): 208-12.
17. Barbieri M, Sterla S, Battistoni J, Nieto A. High performance latex reagent for hydatid serology using an Echinococcus granulosus Lipotroein antigen fraction purified from cyst fluid in one step. Int J Parasitol.1993; 23(5): 565-72.
Correspondencia: Flor Fuentes.
Dirección: Defensores del Morro 2268 Chorrillos, Lima, Perú.
Teléfono: (511) 617- 6200 anexo
Correo electrónico: ffuentes@ins.gob.pe
Recibido: 01-07-09
Aprobado: 16-12-09














