Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.26 n.4 Lima oct./dic. 2009
REVISIÓN
Breve reseña histórica de la enfermedad de chagas, a cien años de su descubrimiento y situación actual en el Perú
Short review of chagas disease history after a century of its descovery and the current situation in Peru
César Náquira1,a, Rufino Cabrera2,b
1 Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
2 Grupo Temático de Enfermedades Metaxénicas, Dirección General de Epidemiología, Ministerio de Salud. Lima, Perú.
a Médico Parasitólogo, Doctor en Medicina; b Biólogo Epidemiólogo.
RESUMEN
Se presenta un resumen sobre el descubrimiento de la enfermedad de Chagas y datos actuales de la situación epidemiológica y clínica de la enfermedad en el Perú. El hallazgo de Trypanosoma cruzi en la sangre de una niña en 1909, el aislamiento del agente etiológico en animales de experimentación y el hallazgo del parásito en el intestino de un triatomino, convierte a Carlos Chagas en el descubridor de la enfermedad, que hoy, con justicia, el mundo científico la reconoce como la enfermedad de Chagas. Ocho años después del descubrimiento de Carlos Chagas, Edmundo Escomel, médico arequipeño, reporta la presencia de Triatoma infestans en los valles del departamento de Arequipa y dos años después el primer caso de enfermedad de Chagas en un paciente de Madre de Dios. En el Perú se ha descrito 19 especies de triatominos y como el reservorio más importante el cobayo. Las áreas endémicas más importantes son el sur, norte, nororiente y existen algunos focos de transmisión activa en la cuenca amazónica. Tacna logró la certificación de la eliminación de la transmisión vectorial y se espera que otras áreas con T. infestans puedan lograrlo en el futuro.
Palabras clave: Enfermedad de Chagas, Epidemiología, Prevención de Enfermedades Transmisibles, Triatominos, Historia de la Medicina, Perú (fuente: DeCS BIREME).
ABSTRACT
This paper is a short review of the discovery of Chagas disease and the current information of the epidemiological and clinical aspects of the disease observed in Peru. With the discovery of Trypanosoma cruzi in the blood of a child in 1909, the isolation of the etiologic agent in experimental animals and the finding of similar parasites in the intestinal content of triatomines, Carlos Chagas determined the parasites life cycle and, clinical symptoms of this new entity designated as Chagas disease. Eight years after Dr Carlos Chagas discovery (1917), Dr. Edmundo Escomel born in Arequipa, reported the presence of Triatoma infestans in the valleys of Arequipa department and after two years the first human case of Chagas disease from Madre de Dios. In Peru, have been described 19 species of triatomines, and several studies show guinea pig cuy as the most important reservoir of the parasite. The endemic areas are present in the south, north and northeast, mainly the Amazonian area. Recently, Tacna has been declared free of vectorial transmission and we hope others parts of the country could receive similar certification.
Key words: Chagas disease, Epidemiology, Prevention of Communicable diseases, Triatomines, History of Medicine, Peru (source: MeSH NLM).
INTRODUCCIÓN
El conocimiento de la enfermedad de Chagas o trypanosomiosis americana se inicia con el descubrimiento del agente causal, el Trypanosoma cruzi, por el brillante médico brasileño Carlos Chagas en 1909 (1).
Carlos Chagas encontró el parásito en el vector, en el ser humano y, luego, describió las lesiones patológicas tanto en animales inoculados experimentalmente con T. cruzi, como en las autopsias de los casos humanos.
Estos hallazgos son contribuciones científicas pioneras sobre el conocimiento de la enfermedad de Chagas en el mundo, hecho que merece todos los reconocimientos tributados a su autor, el Dr. Carlos Chagas.
El 14 de abril de 2009 se cumplieron 100 años del descubrimiento de la enfermedad de Chagas, dado este acontecimiento, en el presente artículo presentamos un breve resumen de los hitos más importantes de este hallazgo y una revisión muy breve de la situación actual de esta enfermedad en el Perú.
EL DESCUBRIMIENTO DEL PARASITISMO
En 1908, cuando Carlos Chagas estaba a cargo de la campaña contra la malaria en el pueblo de Lassance, en el estado de Minas Gerais, Brasil (2), es informado que en las viviendas de los obreros que estaban construyendo el ferrocarril central de Brasil, había unos insectos hematófagos que se les conocía como barbeiros, tal vez, por que las picaduras que ocurrían en la noche eran más frecuentes en la cara (1). Fue así, que Carlos Chagas, examina microscópicamente el contenido intestinal de estos barbeiros y observa unos protozoos flagelados, similares en cuanto a su morfología y movimiento a los trypanosomas causantes de la enfermedad del sueño (1).
El 14 de abril de 1909, Carlos Chagas examina a una niña de 2 años, llamada Berenice, a quien detecta fiebre, hepato y esplenomegalia; por la sospecha de malaria, examina el frotis sanguíneo y encuentra un protozoo flagelado, similar al observado en los barbeiros. Es así que se da el primer caso humano descrito en el mundo. Asimismo, Chagas logró reproducir, por primera vez, la parasitemia en animales de experimentación, con la sangre de la niña infectada. Carlos Chagas denominó al parásito, Schizotrypanum cruzi, en honor a Oswaldo Cruz, médico brasileño, su mentor y guía de sus estudios (1).
DATOS BIOGRÁFICOS DEL DR. CARLOS CHAGAS
El Dr. Carlos Justiniano Riveiro das Chagas (Figura 1) nació el 9 de julio de 1878, en una pequeña ciudad llamada Oliveira en el estado de Minas Gerais, Brasil. A los siete años ingresó al Colegio Jesuita de Itú en el estado de São Paulo, y después, a la escuela São João del Rei (3).

Inicia sus estudios superiores en la Escuela de Ingeniería Minera de Ouro Preto, pero su tío médico, Carlos Riveiro de Castro, lo convence de abandonar la carrera de ingeniería e iniciar la de medicina, porque debía luchar contra muchas enfermedades endémicas que habían debilitado la mano de obra local, limitando el progreso económico, por ello, decide estudiar en la Escuela de Medicina de Río de Janeiro en 1897 (3,4).
Carlos Chagas fue un estudiante brillante, se graduó de médico en el año 1903 con una tesis sobre la hematología de la malaria, bajo la dirección del Dr. Oswaldo Cruz (4,5).
En 1903, Oswaldo Cruz fue nombrado Director de la Sanidad Pública brasileña y ofrece al joven Carlos la posibilidad de trabajar en su Instituto, pero Chagas, dado su carácter modesto, prefiere hacerlo en un pequeño hospital de Jurujuba y en su consultorio privado, para así conocer mejor los aspectos clínicos de las enfermedades tropicales(5). En el año 1905, luego de casarse y tener un hijo, acepta trabajar para la compañía Docas de Santos con el fin de realizar campañas profilácticas contra la malaria, debido a los estragos que venía ocasionando en los trabajadores del campo (5).
En el año 1906, Chagas regresó a Río de Janeiro y se une al Instituto Oswaldo Cruz, donde desarrolla sus actividades por el resto de su vida (5). En 1908, Oswaldo Cruz encomienda a Chagas la campaña contra la malaria en Lassance, en el estado de Minas Gerais, donde realiza el descubrimiento del T. cruzi, el vector y las características clínicas y epidemiológicas de la enfermedad que hoy lleva su nombre (1).
A raíz del descubrimiento, Chagas adquiere renombre dentro de la comunidad médica brasileña, debido a ello, el 26 de octubre de 1910, llega a ser miembro de la Academia Nacional de Medicina (4). En el año 1912, recibió el Premio Schaudinn, otorgado por el Instituto de Medicina Tropical de Hamburgo (Alemania), al mejor trabajo en parasitología y medicina tropical (2).
Después de la muerte de Oswaldo Cruz, ocurrido en febrero de 1917, Chagas es nombrado Director del Instituto, cargo que ocupa hasta su muerte en el año 1934 (2).
Fue nominado dos veces al Premio Nóbel de Medicina, la primera vez en el año 1913 y la segunda en 1921, pero nunca recibió el premio, las razones serían las influencias de los grupos opuestos que cuestionaban la existencia de la enfermedad de Chagas (2).
En 1920 fue el primer Director del Departamento de Salud Pública, realizó campañas contra la tuberculosis, sífilis y la lepra, en este último caso fue director del Centro Internacional de Leprología en Río de Janeiro, hasta su muerte (5).
Entre 1921 a 1934 transcurren los años más tranquilos y felices de su vida, colmado de honores y de amistad con grandes científicos del mundo, en 1921 es nombrado Caballero de la Orden de la Corona de Italia, en 1923 Caballero de la Legión de la Honra de Francia y Comendador de la Orden de la Corona de Bélgica, en 1926 Comendador de la Orden de Isabel La Católica, Madrid, entre otros títulos (6). Carlos Chagas murió a los 55 años el 9 de noviembre de 1934 en Río de Janeiro, como consecuencia de un infarto cardiaco (3).
LA ENFERMEDAD DE CHAGAS EN EL PERÚ
A propósito de la conmemoración del descubrimiento del T. cruzi, presentamos un recuento breve de los principales conocimientos sobre la enfermedad de Chagas en el Perú.
ANTIGÜEDAD EN EL CONOCIMIENTO DE LA ENFERMEDAD DE CHAGAS
En el Perú, en 1917, ocho años después del descubrimiento del T. cruzi en el Brasil, el Dr. Edmundo Escomel (7) (Figura 2) reporta, en los valles del departamento de Arequipa, la presencia de la chirimacha, insecto hematófago, de la subfamilia Triatominae, conocido como barbeiro en Brasil.

En 1919, Escomel observa al T. cruzi en el frotis sanguíneo de un paciente febril procedente de Tahuamanu del departamento de Madre de Dios, este es considerado como el primer caso diagnosticado en el país; el dibujo realizado de la observación microscópica forma parte de la publicación que luego hiciera Escomel (8); sin embargo, la infección parasitaria ha existido desde la época pre-colombina, hace aproximadamente 9000 a 4000 años, dato comprobado por el hallazgo de segmentos del ADN de T. cruzi en momias de la cultura Chinchorro (al norte de Chile y al sur del Perú) (9,10), también se ha demostrado el parásito en el tejido en una momia inca peruana (11).
La información que sigue es un resumen de los principales aspectos conocidos de la enfermedad de Chagas, en el Perú.
-
Los vectores y su distribución geográfica;
-
Los reservorios;
-
El parásito;
-
La infección humana;
-
Diagnóstico y tratamiento;
-
Las medidas de prevención y el control.
LOS VECTORES Y SU DISTRIBUCIÓN GEOGRÁFICA
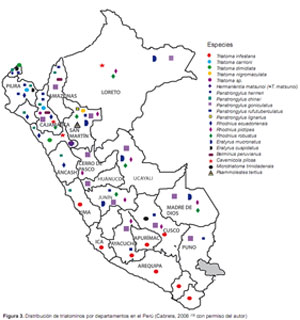
En el Perú, se ha descrito 19 especies válidas de reduvideos que se distribuyen en nueve géneros, de ellos, Triatoma, Panstrongylus y Rhodnius son los más importantes (12-14). Los investigadores que han contribuido al conocimiento de la fauna triatomínica en el Perú, son Herrer (15), Wygodzinsky (16), Lumbreras (17) Calderón (18), Guillén (19), Cuba (20), entre otros. La distribución de las especies por departamentos, compilada en base a los trabajos realizados por diferentes autores, se muestra en la Figura 3, la cual se va actualizando constantemente.
En nuestro país, los vectores intradomiciliarios más importantes son T. infestans en la región sudoccidental y P. herreri en las regiones norte y nororiental del país (Figura 4); sin embargo, cada vez, se viene demostrando que otras especies de hábitos silvestres como P. chinai y T. carrioni, tienen tendencia a domiciliarse.
Al estudiar la longitud de banda para el ITS-2 del ADN ribosomal de P. lignarius y de P. herreri, se encontró que la secuencia fue idéntica, debido a ello, los autores del estudio proponen dos subespecies, P. lignarius lignarius que se distribuye en la parte central este de la Amazonía y P. lignarius herreri que se distribuye en la parte este de los andes de Ecuador y Perú y en el curso del valle el Marañón (21). Por ello, Galvão et al., 2003 (22), consideraron que P. herreri es sinónimo de P. lignarius, desde entonces casi todas las publicaciones lo han considerado como la sub especie P. lignarius/herreri o como P. lignarius.
Se ha demostrado poblaciones domésticas y peridomésticas de R. ecuadoriensis infectados con T. rangeli en los departamentos de Tumbes, La Libertad, Cajamarca y Piura (20), mientras que en Tumbes, Piura, Lambayeque y La Libertad, se encontraron infectadas con T. cruzi (20,23). P. chinai también muestra una tendencia al comportamiento sinantrópico, con una tasa de infección natural por T. cruzi de alrededor de 7,02% en el norte y en la región nororiental del Perú (23).
También se ha demostrado la domiciliación de P. rufotuberculatus en el distrito de Ocobamba, provincia de La Convención, Cusco (24,25); sin embargo, se desconoce la magnitud de su infección natural en esa zona. Colonias domiciliadas de esta especie también se han encontrado en Tumbes y Piura (26).
Los casos de la enfermedad de Chagas procedentes de la cuenca amazónica en los últimos años parecen indicar la importancia del P. geniculatus (27,28), el cual tiene hábitos silvestres e ingresaría accidentalmente a la vivienda en busca de alimento con tendencia a domiciliarse (27,29). Esta especie se encuentra ampliamente distribuida en el Perú (12).
LOS RESERVORIOS
La enfermedad de Chagas es una infección parasitaria metaxénica, pues la transmisión vectorial aún es la más importante; pero cuando se observa la evolución histórica de la infección, hay consenso en considerarla como una zoonosis parasitaria ya que ha sido, antes de la presencia humana en la tierra, una infección mantenida entre los mamíferos silvestres y los vectores silvestres.
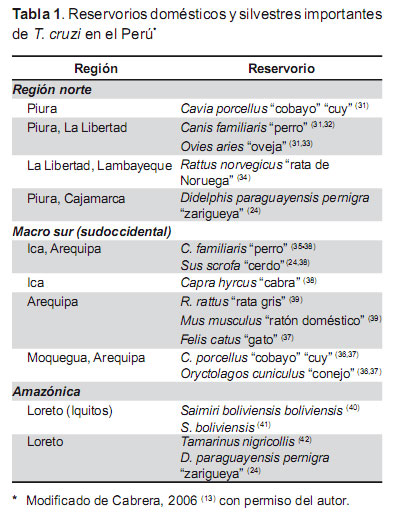
En nuestro país, entre los mamíferos que se han identificado como reservorios, el cobayo (Cavia spp.) es el más importante en la región sudoccidental (30), donde es criado en el interior del domicilio debido a que es una fuente importante de la alimentación de la población rural. Los reservorios identificados por regiones se muestran en la Tabla 1.
En las zonas endémicas el hombre puede ser un importante reservorio de la infección y con mayor importancia como fuente para la transmisión transfusional, por transplante de órganos y de la madre al hijo (congénita).
EL PARÁSITO
Después del aislamiento del T. cruzi por parte de Carlos Chagas en 1909 y su hallazgo en el Perú por Escomel (1919) (8), se ha podido establecer que los aislados de pacientes, de animales y vectores son poblaciones policlonales y que existe una importante variedad de cepas de T. cruzi. La caracterización se realiza en base a las propiedades biológicas como la virulencia, letalidad, parasitemia, histotropismo y datos bioquímicos como el perfil de isoenzimas o zimodemas o el perfil genómico o esquizodemas. Esta variedad de cepas podría explicar los patrones clínicos que se observan en diferentes partes de América Latina. En la actualidad el perfil genómico de las cepas encontradas y su clasificación, está en evolución, sin embargo, ya se van estableciendo pautas para dicha clasificación, habiéndose señalado perfiles más propios de cepas del parásito de circulación intradomiciliaria y de circulación extradomiciliaria.
En nuestro país las cepas TCI (T. cruzi cepa I) consideradas como de mayor transmisión intradomiciliaria se han señalado principalmente en el sur del país y TCIIa (T. cruzi cepa IIa) en la zona nororiental (Jenny Ancca, comunicación personal). En la región nororiental y norte se ha demostrado la circulación del clon TCII y TP de T. cruzi (43).
LA INFECCIÓN HUMANA
Uno de los casos más antiguos que conocemos de infección humana en nuestro país corresponde a la momia incaica examinada en Italia (11).
La infección humana reportada en nuestro país proviene de dos fuentes, una de ellas corresponde a la Dirección General de Epidemiología (DGE) del Ministerio de Salud, que registra los casos notificados al sistema de vigilancia y que son diagnosticados por los laboratorios regionales de referencia luego confirmados por el Instituto Nacional de Salud (INS); sin embargo, a pesar de ser una enfermedad de notificación obligatoria, existe un subregistro, especialmente de los casos agudos, porque son confundidos con malaria o pasan desapercibidos por no presentar signos o síntomas evidentes. La otra fuente son las encuestas epidemiológicas que nos permiten conocer la magnitud de la infección de la población, por la detección de anticuerpos anti-T. cruzi.
No hay ningún estudio con una muestra representativa en todo el país, por ello, no tenemos la situación de la magnitud actual para comprender la importancia del problema en nuestro medio. A pesar de ello, los estudios puntuales a nivel regional o local, nos indican que la infección humana estaría, preferencialmente, presente en la región sudoccidental (Arequipa, Moquegua e Ica), la región norte (Libertad, Lambayeque, Piura, Tumbes) y la región nororiental (Cajamarca, Amazonas, San Martín y Loreto).
En Arequipa se desarrolla un programa de control dirigido contra T. infestans, los datos recientes parecen indicar que las tasas conocidas de hasta 30% de seroprevalencia en escolares ha descendido hasta 4,7% (44), si se mantiene el programa, se espera que sean más bajas en un futuro cercano.
En la región norte hay escasa información sobre la magnitud de infección, sin embargo, algunos datos permiten inferir que es importante el problema, así, en Chirinos (Piura), en 304 muestras, la seroprevalencia fue de 11,5% (31). En la región nororiental, en encuestas realizadas en Cutervo (Cajamarca), en 14 localidades en 664 menores de 15 años, la seropevalencia para la enfermedad de Chagas fue de 4,8% (1,44 a 26,6%) y en Utcubamba (Amazonas) en 31 localidades, en 724 menores de 15 años, la seroprevalencia fue de 5,8% (0 a 23,5%) (45).
Se estima que en el Perú podrían existir entre 650 000 a 680 000 infectados por T. cruzi, con una población en riesgo entre 5 y 6,5 millones de habitantes (20). En la región norte del país, con una seroprevalencia estimada entre 1 y 2% habría 67 000 a 134 000 infectados, el 20% de la población vive en áreas de riesgo, aproximadamente 1,34 millones de habitantes (20).
En los últimos años (2006 -2009) en la Amazonía peruana, la red de laboratorios del Instituto Nacional de Salud y el sistema de vigilancia, han detectado siete casos agudos en áreas nuevas investigadas por el grupo de la DGE, INS y las direcciones regionales (27,46,47), en uno de ellos se logró incriminar al vector P. geniculatus, especie silvestre que ocasionalmente ingresa a la vivienda (27,29) y que el T. cruzi aislado pertenece al clon TCIIc (48).
Los países de América Latina acordaron realizar el tamizaje en los bancos de sangre para prevenir la transmisión transfusional, tomando en cuenta que la Organización Panamericana de la Salud (OPS) recomienda que para declarar a un donante serológicamente chagásico, debe realizarse dos pruebas con métodos diferentes, los sueros positivos son examinados a su vez por el INS. Ello se está llevando a cabo en nuestro país y las cifras nos indican que en todos los bancos de sangre hay donantes serológicamente positivos. En los hospitales de Lima, esta cifra estaría entre 0,04 a 2%. Se necesita establecer el seguimiento de estas personas para brindarles ayuda médica apropiada y terapéutica, según sea el caso.
La migración de millones de latinoamericanos a países desarrollados, en busca de un mejor futuro, ha originado la aparición de cientos de casos de enfermedad de Chagas autóctonos en estos países, donde no existe el vector, debido a la transfusión sanguínea y al transplante de órganos de los migrantes latinos. Así, se ha convertido en una enfermedad importante para los Estados Unidos, España y otros países considerados no endémicos (49).
Se reconocen las siguientes formas clínicas de la enfermedad de Chagas:
1. Aguda;
2. Subaguda o indeterminada;
3. Crónica; y
4. Congénita,
LA FORMA AGUDA
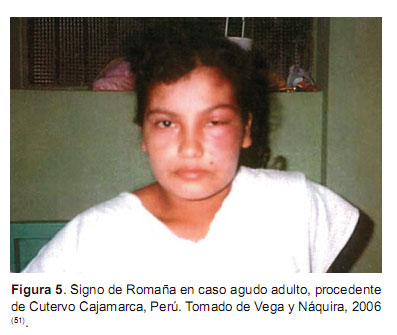
El 95% de los casos agudos son asintomáticos o no presentan ninguna signología. Generalmente afecta a los niños. Se caracteriza por el hallazgo de trypomastigotes sanguíneos del parásito en el examen directo, gota fresca o microconcentración. Se asocia con fiebre de duración variable, malestar, linfadenopatía, hepatoesplenomegalia, dolor muscular y articular, somnolencia, calambres, diarrea, edema, disturbios respiratorios, cianosis y coma (50). En el sitio de la inoculación puede presentarse una reacción inflamatoria (chagoma), si es en la cara, se presenta el signo de Romaña (edema bipalpebral unilateral, ganglio preauricular aumentado de volumen) (Figura 5). Se estima que este signo se presenta sólo en 20% de los infectados. En los casos de la Amazonía no es frecuente ver el signo de Romaña, pero es la fiebre el síntoma más frecuente (47).
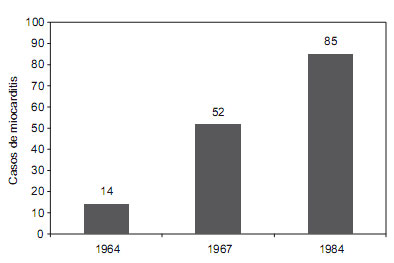
En esta forma clínica puede ocurrir invasión de tejidos profundos, prueba de ello son los reportes de casos de miocarditis aguda en el Hospital General de Arequipa (Figura 6).
Se ha demostrado (por biopsias de los músculos gemelos) la presencia de nidos de amastigotes en tejido muscular, explicable por el tropismo de T. cruzi por el músculo cardiaco y esquelético, abriendo una posibilidad para el diagnóstico histopatológico. Este hallazgo permitió conocer mejor la evolución de la enfermedad (52).
SUBAGUDA O INDETERMINADA
Esta forma clínica ocurre luego de la etapa aguda, es la más frecuente y se caracteriza por la ausencia o escasas manifestaciones clínicas, se confirma mediante pruebas serológicas. El nombre de indeterminada con que también se le designa, se debe a que no se puede señalar cual será la evolución de la infección, pues podría ser asintomática de por vida (portador) o en algún momento pueden aparecer manifestaciones de la forma crónica de la enfermedad.
La Organización Mundial de la Salud (OMS) considera que el criterio para declarar a una persona como infectada por T. cruzi es que tenga dos o más pruebas serológicas reactivas (53), además, se debe tener en cuenta para clasificarla como subaguda o indeterminada, la ausencia de síntomas. El tratamiento etiológico de los casos indeterminados puede ser opcional; sin embargo, deben ser vigilados por largos periodos (54).
En el Perú, algunas observaciones utilizando dos pruebas serológica indican, por ejemplo, en Lima entre 0,66% a 1,83% de seroprevalencia en bancos de sangre (55).
CRÓNICA
Las manifestaciones crónicas más frecuentes de la enfermedad de Chagas son las megaformaciones y las lesiones cardiacas. Las megaformaciones como el megaesófago y el megacolon descritas en nuestro país son similares a las descritas en otros países endémicos.
En la zona andina peruana, por encima de los 3500 m de altitud, se ha descrito el dolicomegacolon andino cuyas características clínicas y epidemiológicas (56), anatómicas e histológicas son diferentes del megacolon chagásico(57). En el megacolon andino la hipertrofia neuronal fue estadísticamente significativa sin denervación evidente, mientras que en el megacolon chagásico hubo hipertrofia neuronal, pero la denervación fue estadísticamente significativa (57).
Los compromisos cardiacos con trastornos de la conducción e insuficiencia cardiaca tienen mal pronóstico y generalmente de curso fatal (58,59).
CONGÉNITA
La transmisión congénita ocurre cuando el parásito logra atravesar la placenta de la madre seropositiva e infecta al hijo durante el embarazo o el parto. La tasa de transmisión varía entre los países, desde 1% en Brasil hasta 4 a 12% en Argentina, Bolivia, Chile y Paraguay (60). Estas variaciones se explican por diversos factores como las diferencias metodológicas en la detección de los casos congénitos o las características propias de los parásitos, diferencias en las respuestas inmunológicas de las personas infectadas, las condiciones genéticas o nutricionales de la madre, entre otros (60).
La seroprevalencia en 3000 puérperas de Arequipa fue de 0,73%, la evaluación se realizó mediante la detección de anticuerpos IgG anti-Trypanosoma cruzi por inmunofluorescencia indirecta (IFI) y ELISA. Las madres seropositivas y los hijos de las madres seropositivas fueron confirmados y titulados mediante ELISA IgG e IFI IgM, xenodiagnóstico y microconcentración. En cuatro de 20 puérperas seropositivas se aisló el parásito por xenodiagnóstico. Todos los recién nacidos de madres seropositivas fueron negativos a las pruebas parasitológicas, las madres y los recién nacidos no mostraron reactividad (61).
Estos resultados podrían indicar que la transmisión congénita en Arequipa, una de las zonas endémicas más conocidas del Perú, no parece ser similar a las zonas endémicas, por ejemplo, de Bolivia, donde es muy alta (62).
DIAGNÓSTICO Y TRATAMIENTO
Las pruebas diagnósticas de laboratorio para la enfermedad de Chagas son conocidas y su aplicabilidad depende de la forma clínica. Los métodos que se utilizan en el país, se encuentran muy bien descritos en el manual editado por el Instituto Nacional de Salud (51).
En la forma aguda se busca el parásito por métodos tan sencillos como el examen de la sangre fresca, frotis, gota gruesa, microconcentración y en laboratorios de mayor complejidad el xenodiagnóstico y el hemocultivo (51). En la forma crónica para la detección de anticuerpos IgG específicos contra T. cruzi se recomienda las pruebas serológicas. Los métodos que con frecuencia se usan son el ELISA y la IFI, el uso de ambas alcanzan una sensibilidad entre 95 a 98% (51). Para la investigación de la forma congénita se recomienda, entre las pruebas parasitológicas, la microcentración, concentración de Strout, xenodiagnóstico y el hemocultivo, y entre las pruebas serológicas, ELISA e IFI para la detección de IgG anti-T.cruzi; sin embargo, es necesario seguirlos hasta el año de vida, si el título de anticuerpos se eleva o se mantiene con respecto al nivel basal se confirma el caso (51). El PCR se recomienda para todas las formas, pero es más útil para los casos congénitos, la forma crónica y para el seguimiento de los casos (51).
La Dirección General de Salud de las Personas del Ministerio de Salud (MINSA), a través de las direcciones regionales de salud o su equivalente, proporciona en forma gratuita el tratamiento. La droga es administrada por los establecimientos de salud de acuerdo con el protocolo establecido por el MINSA (63). En los últimos años la Gerencia Regional de Salud de Arequipa viene administrando tratamiento a los adultos con infección crónica, sin embargo, aún no hay un estudio publicado en el país sobre esta experiencia.
La enfermedad de Chagas es considerada una enfermedad olvidada por la Organización Mundial de la Salud, pues no es una prioridad sanitaria para los países endémicos. Tampoco, existe interés en buscar nuevas drogas para el tratamiento, ya que el nifurtimox y el benznidazol, únicas drogas de efectividad conocida, siguen siendo las que se utilizan desde hace un cuarto de siglo. Las limitaciones para un uso más amplio son los efectos adversos, que requiere un tratamiento prolongado y la escasa disponibilidad debido a la limitada producción.
LAS MEDIDAS DE PREVENCIÓN Y EL CONTROL
Las formas de transmisión de la enfermedad de Chagas pueden agruparse en dos grupos: la vectorial y la no vectorial. Se ha demostrado que el control de la transmisión vectorial es posible sólo cuando el vector es intradomiciliario y se hace mediante el rociado con insecticidas de acción residual y la mejora de la construcción de las viviendas, ya que el ciclo del vector dura entre 6 a 12 meses. Pero si es silvestre o extradomiciliario, el control con insecticidas no tiene ningún efecto, en cambio, serán necesarias otras medidas preventivas para evitar la picadura del vector. En este escenario es clave la detección oportuna de los casos para un tratamiento adecuado.
La iniciativa de los países del Cono Sur ha demostrado que es posible interrumpir la transmisión vectorial, como lo ha certificado la Organización Panamericana de la Salud (OPS) en países como Chile, Uruguay y en zonas de Argentina y Brasil.
En el Perú, desde la década de 1970 se han realizado campañas masivas de desinsectación química contra T. infestans en Arequipa, Moquegua y Tacna (64), luego, en la década de 1990 se reiniciaron y se diseñaron los planes de prevención y control del actual programa de control, cuyos resultados en Arequipa, muestran drásticas caídas en los indicadores entomológicos después del rociado con piretroides; así como, disminución de la seroprevalencia en los escolares y reducción del número de casos agudos (Juan Cornejo, comunicación personal). En Moquegua también existen notables progresos en la reducción de los indicadores entomológicos y serológicos.
El año 2002, Tacna notificó los últimos casos de enfermedad de Chagas al sistema de vigilancia, un menor de 9 años y un adulto de 30 años. Se espera que aún se reporten casos en donantes de sangre o que exista transmisión congénita debido a la presencia de reservorios humanos infectados con anterioridad al inicio del programa de control. Los estudios serológicos en 2006 y 2009, en menores de 5 años, han mostrado ausencia de seropositivos y entre el 2008 y 2009 la ausencia del vector (Edgar Tejada, comunicación personal), lo cual ha servido para que la OPS, declare la certificación de la no transmisión vectorial, convirtiendo así a Tacna en el primer departamento del Perú que logra la interrupción de la transmisión vectorial.
También existe la posibilidad de lograr la interrupción de la transmisión vectorial en Ica, sin embargo, debe conocerse la magnitud de la infección en menores de edad y la magnitud de la infestación domiciliaria. En los departamentos de Ayacucho y Abancay, se debe explorar la dispersión actual del vector y las tasas de seroprevalencia.
La transmisión no vectorial como la transfusión sanguínea, el transplante de órganos y la forma de transmisión congénita, así como, el mecanismo recientemente señalado de la transmisión por vía oral (65-67), por jugos de frutas contaminadas con heces de Reduvideos infectados, representa un desafío que merece medidas apropiadas.
El Perú está llevando a cabo el tamizaje serológico acordado con los países del continente, permitiendo la detección de estos casos. Lo que debería añadirse es que los donantes seropositivos que son adultos de aparente buen estado de salud que pertenecerían a la forma indeterminada, pasen a ser parte de un protocolo de seguimiento que requiera una evaluación clínica y tratamiento etiológico, según el consenso de los expertos de diferentes países. La obligatoriedad del tamizaje transfusional contra T. cruzi se implantó en 1997 (68), desde entonces se realiza el tamizaje obligatorio en todo el país.
Aunque el tamizaje de las gestantes de áreas endémicas está propuesta como parte de la vigilancia de la enfermedad de Chagas (13), en la nueva norma de atención de la enfermedad de Chagas se debe incluir este aspecto además del análisis y seguimiento médico de los recién nacidos de estas madres hasta el año de vida.
El Estado y las universidades deben establecer las prioridades de investigación básica y operativa en zonas endémicas orientadas a conocer mejor la epidemiología y orientar las medidas de prevención y control, dado que la enfermedad de Chagas es un problema de salud pública importante, por los costos de su tratamiento, discapacidad, muerte y el impacto en miles de familias.
CONCLUSIONES
A cien años del descubrimiento de la enfermedad de Chagas, con justicia se reconoce las contribuciones científicas pioneras de Carlos Chagas, por el descubrimiento del agente, el vector y la enfermedad y por su preocupación por el control de los principales problemas de salud pública de su tiempo. En el Perú, el Dr. Edmundo Escomel es el pionero en las investigaciones sobre la enfermedad de Chagas al reportar la presencia de T. infestans en Arequipa y describir el primer caso humano para el país.
En el Perú existen 19 especies de vectores de la enfermedad de Chagas, con tendencia de algunas especies silvestres a domiciliarse; el reservorio más importante en el sur es el cobayo, en el norte roedores sinantrópicos y en la amazonia, mamíferos silvestres.
La seroprevalencia indica que la enfermedad de Chagas aún es importante en el sur del Perú, sin embargo, existen otras zonas de la región norte y nororiental con tasas de infección entre 5 y 11%. La seroprevalencia en los bancos de sangre en zonas no endémicas puede llegar hasta 2%, lo que revela la importancia del tamizaje transfusional.
El tratamiento de los casos es gratuito y las pruebas de diagnóstico de laboratorio están disponibles de acuerdo con el nivel de complejidad de los establecimientos de salud.
Tacna logró la interrupción de la transmisión vectorial de la enfermedad de Chagas y existe la posibilidad que otras áreas con T. infestans puedan certificar la interrupción de la transmisión vectorial.
Conflictos de interés
Los autores declaran no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Chagas, C. Nova trypanozomiaze humana. Estudos sobre a morfolojia e o cíclo evolutivo do Schizotripanum cruzi n. gen., n. sp., ajente etiolójico de nova entidade morbida do homem. Mem Inst Oswaldo Cruz. 1909; 1(2):159-218.
2. Lewinsohn R. Prophet in his own country. Carlos Chagas and Nobel Prize. Perspect Biol Med. 2003; 46(4): 532-49.
3. Chagas Filho C. Meu pai. Rio de Janiero: Casa de Oswaldo Cruz, Fiocruz; 1993.
4. Kropf SP, Sá MR. The discovery of Trypanosoma cruzi and Chagas disease (1908-1909): tropical medicine in Brazil. Hist Ciênc Saúde Manguinhos. 2009; 16(Supl 1): 13-34.
5. Lewinsohn R. Carlos Chagas and the discovery of Chagas disease (American trypanosomiasis). J Roy Soc Med. 1981; 74: 451-5.
6. Ibáñez-Herrera N. Antigüedad de la enfermedad de Chagas en Sud América. Rev Med Cir (Trujillo). 1966; 4: 15-34.
7. Escomel E. Insectos hemípteros heterópteros, hematófagos en nuestros valles del sur del Perú. Encierran formas protozoáricas herpetomónicas. ¿Existe entre nosotros la tripanosomiasis humana? Reforma Med. 1917; 38: 121-2.
8. Escomel E. La trypanosomiase humaine existe dans les forêts orientales du Pérou. Bull Soc Pathol Exotique. 1919; 12: 723-6.
9. Guhl F, Jaramillo C, Vallejo GA, Cárdenas-Arroyo FA, Aufderheide A. Chagas disease and human migration. Mem Inst Oswaldo Cruz. 2000; 95(4): 553-55.
10. Aufderheide AC, Salo W, Madden M, Streitz J, Buikstra J, Guhl F, et al. A 9,000-year record of Chagas disease. Proc Natl Acad Sci USA. 2004; 101(7): 2034-39.
11. Fornaciari G, Castagna M, Viacava P, Tognetti A, Bevilacqua G, Segura EL. Chagas disease in Peruvian Inca mummy. Lancet. 1992; 339(8785): 128-29.
12. Chávez J. Contribución al estudio de los triatominos del Perú: Distribución geográfica, nomenclatura y notas taxonómicas. An Fac Med (Lima). 2006; 67(1): 65-76.
13. Cabrera R. Enfermedad de Chagas o Trypanosomiasis Americana. En: Suárez OL, Beingolea ML, Nakamoto TI, Cabrera CR, compiladores. Protocolos de vigilancia epidemiológica. Parte I. 2da ed. Lima: Dirección General de Epidemiología, Ministerio de Salud; 2006. p. 89-114.
14. Cabrera R. Notas breves sobre Psammolestes tertius, Bergroth, 1911 (Reduviidae: Hemiptera): un triatomino silvestre. An Fac Med (Lima). 2006; 67(4): 345-6.
15. Herrer A. Reseña de la entomología médica en el Perú. I. Principales aspectos entomológicos en la bartonellosis, la trypanosomiasis y la leishmaniasis. Rev Peru Entomol. 1977; 20(1): 19-24.
16. Wygodzinsky P. Sobre Panstrongylus del Perú, con la descripción de una nueva especie (Triatomae, Reduviidae, Hemiptera). An Inst Med Reg. 1948; 2: 197-208.
17. Lumbreras H. El problema de la enfermedad de Chagas en los diferentes departamentos del Perú. Rev Viernes Med. 1972; 23(1): 43-77.
18. Calderón FG. Actualización de la distribución geográfica de los triatominos en el Perú (Hemiptera, Reduviidae). Lima: Ministerio de Salud, Dirección de Erradicación y Control de Enfermedades Transmisibles, Programa de Erradicación de la Malaria y Control de Chagas; 1977.
19. Guillén Z, Cáceres I, Elliot A, Ramírez J. Distribución geográfica de los triatominos en el oriente del Perú. Rev Peru Med Trop UNMSM. 1992; 6: 93-97.
20. Cuba CA, Abad-Franch F, Roldán RJ, Vargas VF, Pollack VL, Miles MA. The triatomines of northern Peru, with emphasis on the ecology and infection by trypanosomes of Rhodnius ecuadoriensis (Triatominae). Mem Inst Oswaldo Cruz. 2002; 97(2): 175-83.
21. Marcilla A, Bargues MD, Abad-Franch F, Panzera F, Carcavallo RU, Noireau F, et al. Nuclear rDNA ITS-2 sequences reveal polyphyly of Panstrongylus species (Hemiptera: Reduviidae:Triatominae), vectors of Trypanosoma cruzi. Infect Genet Evol. 2002; 1(3): 225-35.
22. Galvão C, Carcavallo R, Rocha DS, Jubert J. A checklist of the current valid species of the subfamily Triatominae Jeannel, 1919 (Hemiptera, Rediviidae) and their geographical distribution, with nomenclatural and taxonomic notes. Zootaxa. 2003; 202: 1-36.
23. Vargas F, Córdova-Paz Soldán O, Marín C, Rosales MJ, Sánchez-Gutiérrez R, Sánchez-Moreno M. Epidemiology of American trypanosomiasis in northern Peru. Ann Trop Med Parasitol. 2007; 101(7): 643-8.
24. Calderón G, Cuzquén L, Figueroa KE, Náquira F. Perú. In RU Carcavallo, JE Rabinovich, RJ Tonn (eds.), Factores Biológicos y Ecológicos en la Enfermedad de Chagas. Tomo II. Buenos Aires: Ministerio de Salud y Acción Social de Argentina, Centro Panamericano de Ecología Humana y Salud; 1985. p. 449-455.
25. Torres VD, Cabrera R. Distribution and evidences of domiciliation of Triatominae in the province of La Convencion, Cusco, Peru. Abstract International Symposium on the Centenary of Chagas Disease 1909-2009. Rio de Janeiro 8-10 july 2009.
26. Marín E, Santillán R, Cuba C, Jurberg J, Galvão C. Hallazgo de Panstrongylus rufotuberculatus (Champion, 1899) (Hemiptera, Reduviidae, Triatominae) en ambiente domiciliario en la Región Piura, Perú. Cad Saúde Pública. 2007; 23(9): 2235-38.
27. Vega S, Mendoza A, Cabrera R, Cáceres GA, Campos E, Ancca J, et al. Primer caso de enfermedad de Chagas aguda en la selva central del Perú: Investigación de colaterales, vectores y reservorios. Rev Peru Med Exp Salud Pública. 2006; 23(4): 288-92.
28. Solís H, Huamán A, Ávila G, Ferrer A, Sáez G, Diestro A, et al. Comunicación preliminar sobre la presencia de Trypanosoma cruzi en el distrito de Campoverde (Departamento de Ucayali, Perú) 2008. An Fac Med (Lima). 2009; 70(Supl.): s18.
29. Cáceres GA, Troyes L, Gonzáles-Pérez A, Llontop E, Bonilla C, Murias E, et al. Enfermedad de Chagas en la región nororiental del Perú. I. Triatominos (Hemiptera, Reduviidae) presentes en Cajamarca y Amazonas. Rev Peru Med Exp Salud Publica. 2002; 19(1): 17-23.
30. Herrer A. Trypanosomiasis americana en el Perú. III. Importancia del cobayo como reservorio de la enfermedad de Chagas en la región sudoccidental. Rev Peru Med Exp. 1955; 9(1-2): 45-55.
31. García ML, Lázaro ML, Chia PJ, Escalante AH. Frecuencia de pobladores y animales domésticos del Caserío de Chirinos (Piura) con anticuerpos a Trypanosoma cruzi entre abril a diciembre del 2000. Rev Peru Parasitol. 2003; 16: 35-40.
32. Jara C, Escalante H, Roldán J, Díaz E. Distribución y frecuencia de infección por Trypanosoma cruzi de triatominos y Ovies aries en el Valle de Chamán, La Libertad, Perú. Sciendo. 1999; 1: 21-37.
33. Jara CA, Escalante H, Roldán J, Díaz-Limay E, Gavidia C, Llerena C. Frecuencia de infección por Tripanosoma cruzi en pobladores y animales sinantrópicos del Valle Chamán, La Libertad-Perú. Sciendo. 1998; 2: 21-32.
34. Jara CA, Escalante H, Roldán J, Díaz E, Gavidia C, Llerena C. Aspectos epidemiológicos de la enfermedad de Chagas en el Valle de Zaña, Lambayeque – Perú. En: Libro de Resúmenes del IV Congreso Peruano de Parasitología. Lima: Sociedad Peruana de Parasitología; 2000. p.186.
35. Fernández RM, Quicaño AN. Reservorios domésticos de Trypanosoma cruzi en el Distrito de La Tinguiña - Ica. [Tesis para optar el título de Biólogo]. Ica: Facultad de Ciencias, Universidad Nacional San Luis Gonzaga de Ica; 1995.
36. Herrer A. Trypanosomiasis americana en el Perú. I. El insector vector y los animales que actúan de reservorio de la enfermedad de Chagas en la región sudoccidental. Rev Med Exp. 1955; 9(1-2): 23-37.
37. Córdova E, Montesinos J, Náquira F. Estudio epidemiológico sobre la enfermedad de Chagas en el Valle de Vítor (Distrito de Vítor, Dpto. de Arequipa). Arch Per Pat Clin. 1969; 23: 257-70.
38. Uyema TN, Montalván SE, Huapaya YJ. Seroprevalencia de los animales posibles reservorios de la enfermedad de Chagas en la provincia de Nazca, departamento de Ica- Perú. Rev Horizonte Med. 2006; 6(2): 80-3.
39. Ayaqui R, Córdova E. Infección natural de roedores sinantrópicos por Trypanosoma cruzi Chagas, 1909 en el valle del Río Vítor (Arequipa – Perú). Acta Méd Agustina. 1990; 1: 66-70.
40. Sullivan JJ, Steurer F, Benavides G, Tarleton RL, Eberhard ML, Landry S. Trypanosomes and microfilariae in feral owl and squirrel monkeys maintained in research colonies. Am J Trop Med Hyg. 1993; 49(2): 254-9.
41. Ayala MF. Finding of Trypanosoma cruzi Chagas 1909 in the monkey, Saimiri boliviensis, from Amazonia, Peru. Rev Bras Malariol Doencas Trop. 1961; 13: 99-105.
42. Dunn FL, Lambrecht FL, Du Plessis R. Trypanosomes of South american monkeys and marmosets. Am J Trop Med Hyg. 1963; 12: 524-34.
43. Vargas Vásquez FR. Epidemiología molecular de la Trypanosomiasis americana (Trypanosoma cruzi y Trypanosoma rangeli) en la región norte y nororiental del Perú. [Tesis Doctoral]. Granada: Facultad de Ciencias, Universidad de Granada; 2005.
44. Bowman NM, Kawai V, Levy MZ, Cornejo del Carpio JG, Cabrera L, Delgado F, et al. Chagas disease transmission in periurban communities of Arequipa, Peru. Clin Infect Dis 2008; 46: 1822-8.
45. Vega S, Náquira C, Cáceres A, Purisaca E, Gonzales L, Sánchez E, et al. Seroprevalencia de la tripanosomiosis americana en los departamentos de Amazonas, Cajamarca – Perú 2002. Parasitol Latinoam. 2005; 60(Supl 1): S157.
46. Asayag CR, Garay CR, Sanchez GM, Angeles CC, Baca CJ, Evans C, et al. Eight year old with fever, hepatomegaly, and positive thick smear. Am J Trop Med Hyg. 2008; 79(4): 473.
47. Cabrera R, Vega S, Valderrama Y, Cabanillas K, Fernández C, Rodríguez O, et al. Probable emergencia de la enfermedad de Chagas en la Amazonía peruana: reporte de 5 casos agudos en Datem del Marañón, Loreto (2006-2009). En: Abstract Book Colloquium Negleted Tropical Disease of Latin America, 12-14 nov 2009, Lima, Peru. p. 73.
48. Vega CS, Ancca JJ, Pinto CJ, Cáceres LA, Mendoza A, Cabrera R, Náquira VC. Caracterización del Trypanosoma cruzi en un foco de la enfermedad de Chagas en la selva central del Perú. Rev Peru Parasitol. 2008; 17: 17.
49. Schmunis G. Epidemiology of Chagas disease in non endemic countries: the role of international migration. Mem Inst Oswaldo Cruz. 2007; 102(Suppl.1): 75-86.
50. Teixeira ARL, Nitz N, Guimaro MC, Gomes C, Santos- Buch CA. Chagas disease. Postg Med J. 2006; 82: 788-98.
51. Vega S, Náquira C. Manual de procedimientos de laboratorio para el diagnóstico de la trypanosomiosis americana (enfermedad de Chagas). 2da ed. Serie de Normas Técnicas N.º 26. Lima: Ministerio de Salud, Instituto Nacional de Salud; 2006.
52. Fernán-Zegarra L. Miopatía chagásica esquelética. [Tesis Doctoral]. Lima: Facultad de Medicina Humana, Universidad Nacional Mayor de San Marcos; 1972.
53. World Health Organization. Control of Chagas disease. Second report of the WHO Expert Committee. Technical Report Series, N.º 905. Geneva: WHO; 2002.
54. Coura RJ, De Castro SL. A critical review on Chagas disease chemotherapy. Mem Inst Oswaldo Cruz. 2002; 97(1): 3-24.
55. Ortega HS, Mendoza VV, Concha LR. Infección por Trypanosoma cruzi en bancos de sangre de tres hospitales de la zona urbana de Lima, 1996. Rev Peru Parasitol. 2000; 13: 24-32.
56. Frisancho D, Frisancho O. Dólicomegacolon andino y megacolon chagásico: sus características y diferencias. Rev Gastroenterol Perú. 1985; 5: 81-87.
57. Laguna-Torres VA. Estudo comparativo clínico e anatomopatológico entre o megacolon andino e o megacólon chagásico. [Tesis doctoral]. Uberaba: Universidad Federal do Triangulo Mineiro; 2005.
58. Sanz G, Morales W, Boza A. Miocardiopatía chagásica. Bol Peru Parasit. 1980; 2: 76-86.
59. Campos BC, Carranza QF, Suárez OL, Salinas BP, Cabrera CR, Vega CH. Muerte súbita por cardiomiopatía chagásica en un área no endémica de Ica, Perú. Rev Peru Enf Infec Trop. 2001; 1(2): 92-95.
60. Carlier Y, Torrico F. Congenital infection with Trypanosoma cruzi: from mechanisms of transmission to strategies for diagnosis and control. Rev Soc Brasil Med Trop. 2003; 36(6): 767-71.
61. Mendoza Ticona CA, Córdova Benzaquen E, Ancca Juárez J, Saldaña Díaz J, Torres Choque A, Velásquez Talavera R, et al. Prevalencia de la enfermedad de Chagas en mujeres puérperas y transmisión congénita en un área endémica del Perú. Rev Panam Salud Publica. 2005; 17(3): 147-53.
62. Azogue E, La Fuente C, Darras C. Congenital Chagas disease in Bolivia: epidemiological aspects and pathological findings. Trans R Soc Trop Med Hyg. 1985; 79(2): 176-80.
63. Perú, Ministerio de Salud. Doctrina, normas y procedimientos para el control de la tripanosomiasis o enfermedad de Chagas en el Perú. Lima: Dirección General de salud de las Personas, Ministerio de Salud; 1998.
64. Flores González M. Control de los triatominos con hexaclorociclohexan en tres departamentos del sur del Perú. Bol Oficina Sanit Panam. 1978; 84(4): 324-31.
65. Nobrega AA, Garcia MH, Tatto E, Obara MT, Costa E, Sobel J, et al. Oral transmission of Chagas disease by consumption of açai palm fruit, Brazil. Emerg Infect Dis. 2009; 15(4): 653-55.
66. Dias JP, Bastos C, Araújo E, Mascarenhas AV, Martins Netto E, Grassi F, et al. Acute Chagas disease outbreak associated with oral transmission. Rev Soc Bras Med Trop. 2008; 41(3): 296-300.
67. Pereira KS, Schmidt FL, Guaraldo AM, Franco RM, Dias VL, Passos LA. Chagas´disease as a foodborne illness. J Food Prot. 2009; 72(2): 441-46.
68. Perú, Ministerio de Salud. Doctrina, normas y procedimientos del Programa Nacional de Hemoterapia y Bancos de Sangre. Lima: Dirección General de salud de las Personas, MINSA; 1998.
Correspondencia: Dr. César Náquira Velarde.
Dirección: Av. Faucett 571. A-303, San Miguel, Lima 32, Perú.
Correo electrónico: cnaquira2003@hotmail.com
Recibido: 07-11-09
Aprobado: 09-12-09