Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.26 n.4 Lima oct./dic. 2009
REVISIÓN
Ácido domoico e intoxicación amnésica por moluscos en salud pública
Domoic acid and amnesic shellfish poisoning In public health
Pedro P. Alvarez-Falconí1
1 Médico Farmacólogo, Doctor en Medicina, Bachiller en Derecho. Centro Nacional de Salud Pública, Instituto Nacional de Salud.
RESUMEN
El ácido domoico es una biotoxina marina que por primera vez produjo una intoxicación alimentaria en más de cien personas en 1987 en Canadá, con muerte en algunos de ellos después de la ingesta de mejillones contaminados. Dentro de las manifestaciones clínicas destacó la amnesia anterógrada, no vista con ninguna biotoxina ni fármaco conocido, pudiendo llegar a ser permanente, por lo cual el síndrome fue denominado intoxicación amnésica por moluscos. En el examen histopatológico del cerebro de los fallecidos, se encontró que el hipocampo fue una de las estructuras más afectadas, con necrosis celular en algunas áreas, lo que explicó el deterioro irreversible de la memoria. Se ha encontrado que muchas especies de mariscos, peces filtradores, krill y animales marinos, pueden contaminarse con dicha biotoxina que es producida por algunas algas microscópicas y que muchas veces son responsables de las denominadas mareas rojas. La biotoxina puede llegar al humano por la cadena alimenticia. En este artículo, se revisa los brotes tóxicos en mamíferos y aves marinas con posterior muerte debido al ácido domoico, el mecanismo en la producción de toxicidad, su agonismo en los receptores glutamatérgicos, la importancia en la salud pública, sus riesgos por evaluar en la salud humana, así como la difusión de la biotoxina por el mundo, incluyendo el Océano Pacífico y las posibles razones de tal difusión, así como su importancia ecológica y económica que ha obligado a la vigilancia mundial.
Palabras clave: Ácido domoico; Receptores de glutamato; Amnesia anterógrada; Intoxicación alimentaria; Moluscos (fuente: DeCS BIREME).
ABSTRACT
Domoic acid is a sea biotoxin that was first identified to produce food poisoning in more than a hundred people in Canada, in 1987, with some deaths reported, after intake of contaminated mussels. As part of the clinical presentation, anterograde amnesia is highlighted. As it had not been seen before with any know biotoxin or drug, and could be permanent, the syndrome was called amnesic poisoning due to shellfish. In the histopathological examination of the brain of the dead patients, the hippocampus was one of the most affected, showing cellular necrosis in some areas, which explains the irreversible deterioration of the memory. Many shellfish species, filtrating fish, krill and marine animals can get contaminated by the biotoxin , which is produced by microscopic algae, which are often responsible of the red tides. The biotoxin can reach the human being through the food chain. In this article, we revise the toxic outbreaks in mammals and marine birds, causing death due to domoic acid, the mechanism of toxicity production, its agonism in the glutamatergic receptors, its importance in public health, the risk they pose to human health and ought to be evaluated, and the diffusion of the biotoxin throughout the world, including the Pacific Ocean and the possible reasons of this diffusion, as well as its ecologic and economic importance, which has made it surveillance compulsory in all the world.
Key words: Domoic Acid; Glutamate Receptors; Amnesia; Anterograde; Food Poisoning; Mollusca (Source: Mesh Nlm).
INTOXICACIÓN EN HUMANOS POR PRODUCTOS MARINOS
En noviembre de 1987, fines del otoño del hemisferio norte, se presentó en la Isla Prince Edward, situada al este de Canadá y rodeada por el Océano Atlántico, una intoxicación alimentaria de características epidémicas, en comensales de mejillones azules (Mytilus edulis Linnaeus), cultivados y recolectados en la Bahía Cardigan de dicha Isla turística.
Más de 100 personas estuvieron intoxicadas, en 107 de ellos ocurrieron nauseas y vómitos (76%), dolores abdominales (50%), diarreas (42%), cefalea intensa (43%) y pérdida de memoria reciente (25%), menos frecuente fue la hemorragia digestiva, mientras que 12 de los 19 hospitalizados terminaron en cuidados intensivos (1) por presentar, además de una o más de las manifestaciones descritas, secreciones respiratorias profusas, inestabilidad de la presión sanguínea, convulsiones y coma en los casos más graves. El período de latencia, desde la ingesta de los mejillones contaminados hasta la aparición de la intoxicación, fue entre 15 m a 38 h, con un promedio de cinco horas, aunque en esta medida de la absorción debe considerarse otros factores que podrían haberla modificado, como el alimento que acompañaba al contaminado, la cantidad de éste último, la bebida, el estado previo del estómago y la presencia de algún posible factor de riesgo.
Los efectos en el sistema nervioso central (SNC) aparecieron desde las dos horas, y dentro de las 48 horas la cefalea era intensa, acompañada de uno o más síntomas, como confusión, desorientación, vértigo, inestabilidad de la marcha, pérdida de memoria, disturbios en la visión, convulsiones generalizadas, agitación, pérdida de contacto con el medio ambiente y mutismo que duraba varios días. Dentro de las 48 horas casi todos presentaron confusión y desorientación, la amnesia o pérdida de memoria (2) fue anterógrada, porque tenían dificultad o impedimento para recordar nuevas experiencias. La disfunción del sistema nervioso autónomo duró varios días e incluyó uno o más efectos como arritmias cardiacas, taquicardia, vasodilatación periférica, hipotensión, presión arterial inestable, secreciones bronquiales incrementadas, piloerección y castañeteo involuntario de los dientes. Las manifestaciones del sistema nervioso periférico incluyeron debilidad general por compromiso muscular estriado, hiperreflexia transitoria simétrica, fasciculación, signo de Babinski positivo, muecas, mioclonías y alteraciones en fijar la mirada.
La recuperación, cuando ocurrió, varió entre 24 h a doce semanas. A pesar de los cuidados, tres pacientes fallecieron dentro de los 24 días después de la intoxicación, dos de choque séptico. Un cuarto paciente falleció tres meses después del alta hospitalaria, por un ataque cardiaco.
Realizando un seguimiento de las manifestaciones neurológicas en doce pacientes, los más gravemente afectados (3), se encontró varios meses después, un déficit crónico agudo de la memoria anterógrada, en tanto que en once los estudios clínicos y electromiográficos confirmaron neuronopatía o axonopatía, motora o sensorimotora.
HALLAZGOS CLÍNICOS Y AUXILIARES EN INTOXICADOS
Un hombre saludable de 84 años (4), que presentó náuseas y vómitos una hora después de la ingesta de mejillones, al día siguiente estaba desorientado y con somnolencia, cayó en coma al tercer día.
Posteriormente presentó convulsiones que remitieron sólo con dosis altas de fenobarbital intravenoso mas no respondió a dosis adecuadas de fenitoína intravenosa. Después de tres semanas mejoró lentamente. Cuatro meses y medio después, fue dado de alta pero con un impedimento grave de memoria anterógrada. No tuvo convulsiones durante el siguiente año y el EEG fue normal ocho meses después. Las imágenes de la resonancia magnética demostraron marcada atrofia de ambos hipocampos. Alrededor de tres años después de la intoxicación, falleció por neumonía.
Un varón de 71 años (5), presentó náuseas después de la ingesta de mejillones, al día siguiente mostró somnolencia y debilidad generalizada. Sus manos perdieron fuerza, sintió fatiga y disminución en la concentración, además, incapacidad para recordar pues olvidaba lo que había hablabo. Cuatro meses después su memoria mejoró, la fuerza se normalizó, las extremidades inferiores estaban sin reflejos y con disminución del sentido de la vibración, el lenguaje se normalizó. La electromiografía mostró denervación crónica con neuropatía axonal sensimotora leve y difusa, compatible con lesiones de la neurona motora o daño axonal difuso.
Paciente de 69 años (5), presentó náuseas y vómitos intensos tres horas después de comer los mejillones, siendo hospitalizado al no tener respuesta verbal, sangrado gastrointestinal y choque debido a la hipovolemia. Estuvo en estado de coma, diez días después, aún sin respuesta verbal, deglutiendo y respirando bien, desarrolló paresia del lado derecho que se resolvió en 36 horas. Cuatro semanas después, las electromiografías mostraron neuropatía axonal sensomotora leve, que remitió cuatro meses después. En las doce semanas subsecuentes recobró la conciencia lentamente y llegó a estar alerta, su lenguaje se normalizó, pero notó un problema con su memoria reciente y su concentración, expresando incapacidad de retener información nueva.
BÚSQUEDA DEL AGENTE ETIOLÓGICO DEL BROTE EPIDÉMICO EN PRODUCTOS MARINOS
Todos los mejillones azules provenientes de la isla Prince Edward fueron inmediatamente retirados del mercado, no se presentaron nuevos casos, por lo que se le atribuyó el origen de la intoxicación. Los remanentes provenientes de los lotes consumidos, fueron investigados en forma de extractos inyectados a ratones (6), en busca de las respuestas típicas a cualquiera de las biotoxinas marinas conocidas entonces, sin hallar coincidencia con ninguna, mas bien existían otras respuestas, por lo que se asumió que se estaba frente a una biotoxina neurotóxica no conocida.
Los análisis químicos de los extractos del tejido de los mejillones permitieron aislar (7) y mostrar concentraciones altas de ácido domoico (AD). Este era conocido desde 1958 como un aminoácido excitatorio del SNC, pero no conocido como biotoxina en los mejillones ni mariscos, ni que afectara gravemente a los humanos hasta matarlos.
El AD contaminante en los mejillones no fue percibido por los consumidores, pues no altera las características del molusco como el color, olor, sabor, tamaño o forma, entonces fue imposible sentirlo antes o durante la degustación. El consumirlo cocido fue irrelevante porque el calor de la cocción no lo afecta.
BÚSQUEDA DE LA BIOTOXINA ÁCIDO DOMOICO EN EL FITOPLANCTON
En el contenido intestinal de los mejillones se encontró abundantes algas diatomeas Pseudo-nitzschia pungens (Grunow ex Cleve) o Pseudo-nitzschia pungens f. multiseries Hale, especie del fitoplancton marino.
En esas aguas del Océano Atlántico norte existen áreas malacológicas, donde se cosechó los mejillones. Un mes antes había ocurrido un florecimiento (proliferación de poblaciones densas de algas) de fitoplancton marino, de algas diatomeas, aislándose diversas especies, mayoritariamente de la Nitzschia pungens f. multiseries.
Se investigó el agua de mar de tales áreas con el fin de concentrar el fitoplancton, que luego se les inyectó a ratones, los que finalmente presentaron manifestaciones iguales que los de aquellos que se les inyectó el extracto de mejillones. Las algas diatomeas fueron aisladas, limpiadas, cultivadas, filtradas y sus contenidos celulares analizados, hallándose AD en los cultivos de N. pungens f. multiseries, con una correlación positiva entre el número de estas células y la concentración de AD en el fitoplancton (8).
Se encontró AD en todas las porciones digestivas de los mejillones, así como fragmentos de las frústulas de N. pungens. Por ser filtradores del fitoplancton marino, los mejillones habían acumulado el AD de las algas en sus vísceras, en particular en el hepatopáncreas (9), en cantidades que podían ser letales para los humanos u otros consumidores. Estudios adicionales confirmaron que el AD, había sido el responsable de estas primeras intoxicaciones en humanos en Canadá (10,11), y han confirmado el concepto de farmacología marina.
Las algas referidas son miles de especies microscópicas y son la base de la cadena alimenticia marina. El florecimiento de algas ocurre por los cambios de los factores ambientales, naturales o artificiales, como luz solar, estación anual, vientos, temperatura y nutrientes del medio, los que están incrementándose en todos los océanos debido a la eutrofización, así como el ingreso y adaptación de las algas a océanos donde no habitaban. El florecimiento de algas que poseen pigmentos, pueden ser mayoría en el plancton, confiriendo a las aguas un color rojo oscuro o marrón rojizo, por lo que es conocido como bloom o marea roja (red tides en países de habla inglesa, eau rouges en Francia, akashisho en Japón, aguaje en Perú, huirihue en Chile, etc.). Como el color de las aguas por algas tóxicas puede ser también verde o marrón claro, el término marea roja está siendo reemplazado por el de florecimiento de algas tóxicas (harmful algal blooms), en particular, cuando producen toxinas afectando la salud humana, marina, y la economía mundial. Las extracciones, el consumo y las exportaciones son suspendidas cuando aparecen biotoxinas, ocasionando pérdidas económicas inmensas a los productores y al país. De otro lado, puede haber florecimientos de algas no tóxicas que colorean el agua.
En ocasiones, aunque las aguas estén claras, las algas tóxicas pueden desarrollarse y estar diluidas en concentraciones bajas, no son visibles pero son dañinas porque sus biotoxinas pasan a otros organismos marinos que se alimentan de ellas, llegando finalmente a los humanos que los ingieren. Existe una vigilancia intensa del mar en todo el mundo, así como de los productos marinos de consumo humano, a fin de detectar biotoxinas marinas, exigencia de los países que exportan e importan productos marinos.
Los moluscos bivalvos se alimentan del plancton, constituido en especial por algas unicelulares, si ocurre florecimiento de algas tóxicas productoras de AD, las toman como alimento. El AD no daña a los bivalvos, pero se concentra en las vísceras y en otras partes de sus cuerpos. En sus aparatos digestivos se encuentran las algas tóxicas y el AD. Así, tales alimentos marinos pueden ser ingeridos por los comensales humanos del molusco, con o sin vísceras, semicrudos o cocidos, e intoxicarlos. Los predadores marinos de la cadena alimentaria, al ingerirlos también incorporan a sus organismos el AD y los puede afectar.
NECROSIS EN HIPOCAMPO HUMANO COMO EFECTO DE LA BIOTOXINA MARINA ÁCIDO DOMOICO
El examen histopatológico del cerebro de los fallecidos, encontró que la amígdala y el hipocampo fueron las áreas más afectadas, con necrosis neuronal, encontrando en el estudio microscópico pérdida neuronal prácticamente completa de los hipocampos (4), que explicaría las manifestaciones amnésicas anterógradas profundas, con preservación relativa de otras habilidades cognoscitivas, porque el hipocampo interviene en consolidar la memoria reciente. El deterioro de la memoria en algunos pacientes fue permanente. Experimentalmente en ratones, por efecto del AD, se encuentra también la incapacidad para formar memoria nueva (12).
Inicialmente, en algunos intoxicados, fue llamativa la pérdida de memoria reciente que permaneció como secuela permanente y síntoma principal, algunos pacientes fueron incapaces de reconocer a los miembros de su familia o realizar tareas simples; también fue secuela permanente la polineuropatía periférica. En la discusión de la denominación, por constituir la amnesia lo más relevante en este nuevo síndrome, se le denominó Amnesic Shellfish Poisoning (ASP intoxicación amnésica por moluscos), como una afección neurotóxica resultante del consumo accidental del AD de producción natural (13,14).
FACTORES DE RIESGO EN LA INTOXICACIÓN POR PRODUCTOS MARINOS CONTAMINADOS CON ÁCIDO DOMOICO
Un posible factor de riesgo podría ser la edad, porque los pacientes que murieron o los que sufrieron daño cerebral o neurológico relevante, tenían 68 o más años de edad, aunque es la edad de la mayoría de turistas. Los animales de laboratorio parecen más susceptibles al daño exitotóxico de la biotoxina según la mayor edad, por asumir una riqueza dendrítica donde se localizarían los receptores excitatorios (15). En tanto que in vitro en cortes de hipocampos de roedores, con el aumento de la edad (16) se ha observado un incremento de sensibilidad al AD.
Un posible factor de riesgo serían los mejillones, porque sus tejidos contienen cantidades importantes de ácido glutámico, habiéndose sugerido que ello incrementa la neurotoxicidad del AD por un sinergismo de potenciación (17), amparado en la observación que en cultivos neuronales los extractos de mejillones conteniendo AD fueron más neurotóxicos que el AD puro.
NUEVA INTOXICACIÓN POR LA BIOTOXINA MARINA ÁCIDO DOMOICO EN HUMANOS
En octubre y noviembre de 1991, un nuevo brote epidémico de intoxicación por AD ocurrió en USA, afectando a dos docenas de personas que consumieron almejas navaja (Siliqua patula) contaminadas (18), provenientes de las costas de Oregón y Washington. El AD estaba concentrado especialmente en los pies del molusco. Además, los cangrejos de Dungeness (Cancer magister) en esas zonas del Océano Pacífico, estaban también contaminados (19). Frente a ello, las autoridades de salud establecieron los límites tolerables para el consumo de tales especies, regulándose que no lleguen al mercado como alimento si las concentraciones de AD exceden de 30 mg/kg en el hepatopáncreas y vísceras del cangrejo Dungeness o de 20 mg/kg en la almeja (20). En general, los límites regulatorios señalan que 20 μg de ácido domoico/gramo del comestible es el límite, por encima de ello la cosecha de moluscos debe ser detenida hasta que los niveles disminuyan, lo que significa no extraer moluscos para consumo humano.
INTOXICACIONES Y CONTAMINACIONES POR LA BIOTOXINA MARINA ÁCIDO DOMOICO EN ANIMALES MARINOS
En septiembre de 1991, centenares de pelícanos pardos (Pelicanus occidentalis Ridgway) y cormoranes (Phalacrocorax penicillatus Brandt) fueron encontrados muertos en las playas de la Bahía Monterrey, Océano Pacífico, California, USA. La intoxicación de caracteres epidémicos, fue producida por el AD, esta vez por la pseudo-Nitzschia australis Frenguelli (= Nitzschia pseudoseriata Hasle), confirmando que otras especies del plancton podían producir la biotoxina (21). No se había reportado que el AD intoxicara a las aves marinas, lo que se demostró en los análisis del contenido intestinal en las necropsias de dichas aves y en las anchoas (Engraulis mordax Girard) contaminadas que habían ingerido, no hallándose la biotoxina en las aves marinas sanas. Así, se conoció que las anchoas podían actuar como vectores de la biotoxina.
En otro suceso diferente, en enero de 1996, en el Cabo de San Lucas, península de Baja California en el Océano Pacífico, México, ocurrió la muerte masiva de pelícanos pardos (P. occidentalis). En cinco días se contabilizó 150 aves muertas, por haberse alimentado con peces caballa (Scomber japonicus), contaminados con AD proveniente de las algas diatomeas Pseudonitzschia sp. (22). Miembros de las fuerzas gubernamentales mexicanas evitaron que especies marinas contaminadas llegaran a los mercados y fueran consumidas por los humanos. Este suceso confirmó que las floraciones de las algas tóxicas, se habían diseminado hacia nuevas áreas.
En 1998, en la costa del Estado de Washington, Océano Pacífico, floreció el alga tóxica Pseudo-nitzschia pseudodelicatissima (Hasle), productora de AD, acumulando las almejas navaja niveles nunca vistos de tal biotoxina marina en ese año, aunque con variaciones individuales (23), por lo cual las extracciones fueron suspendidas hasta 1999.
En un nuevo suceso, en mayo de 1998, cientos de leones marinos (Zalophus californianus Lesson) fueron afectados cuando se presentó un florecimiento de algas Pseudo-nitzschia australis (Frenguelli) productora de la neurotoxina AD, muchos de ellos convulsionaban en las playas de la costa central de California, Bahía Monterrey mientras tanto moría un estimado de cuatrocientos ejemplares (24). Se habían alimentado de anchoas o northern anchovy (Engraulis mordax Girard), que a su vez se habían alimentado del fitoplancton con algas tóxicas productoras de AD, que se hallaron en los intestinos, mientras que en los músculos se encontró la neurotoxina en niveles altos. De esta forma, tales peces actuaron como vectores intoxicando a los leones marinos (25) la biotoxina también se halló en las deposiciones. Se confirmó, por primera vez, la relación entre la muerte de leones marinos con el florecimiento de algas tóxicas.
En el episodio de 1998 fueron atendidos, por especialistas de la marina del país, 81 ejemplares de leones, de los cuales murieron 55, en otro episodio en la misma zona en el año 2000 (26), fueron afectados 184 leones marinos que presentaron la misma sintomatología, incluyendo ataxia, movimientos de cabeza, rascado y convulsiones, fallecieron 81, porcentaje menor que el primer episodio. El tratamiento de soporte consistió en diazepam, lorazepam y fenobarbital cuando fue necesario, además de fluidos. Desde 1992 se han presentado (27) episodios de esta naturaleza hasta el 2006, afectando especialmente a las hembras adultas, con preocupación por su impacto en la ecología. En el examen histopatológico de los animales fallecidos en los eventos de 1988 a 2000, se encontró atrofia bilateral en hipocampos, o necrosis neuronal isquémica de hipocampos en los casos agudos, afectando los sectores CA4, CA3 y CA1 (28).
En el año 2000, en la misma área y durante una floración de P. australis tóxica, se halló AD en el krill (Euphausia pacifica), que siendo miembro del zooplancton se alimenta de dicho fitoplancton, en cantidades superiores al límite permitido para el consumo humano, confirmándolo como un potencial vector de dicha biotoxina en esas condiciones (29). Los animales marinos que se alimentaran del krill con el alga tóxica en su intestino, incorporarían también la biotoxina. El estudio en las ballenas azules y jorobadas, que se habían alimentado con el krill contaminado, se orientó a las muestras fecales, en donde se halló AD. Se desconoce el efecto de la biotoxina en las ballenas, por ser de difícil seguimiento.
DIFUSIÓN DE LA BIOTOXINA MARINA ÁCIDO DOMOICO EN EUROPA Y OCEANÍA
En Europa, en el año 1994, por primera vez en ciertas áreas de las aguas marinas de España, se encontró que los mejillones cultivados estaban contaminados con AD. El origen de dicha biotoxina fue atribuido a la Pseudo-nitzschia australis encontrada en tales áreas. En el año 2000, ya era recurrente la contaminación de mejillones (M. edulis) en aguas de Portugal, a veces a niveles por encima de los límites aceptados (20ug AD/g) por las entidades reguladoras, contaminando además el contenido del aparato digestivo de las sardinas (Sardina pilchardus) (30) aunque sin acumularse en el tejido muscular. En estudios de seguimiento en Portugal, entre 1998 al 2000 se había hallado ocasionalmente el AD en concentraciones tóxicas en el common cockle (Cerastoderma edule) y carpet shell (Venerupis pullastra), el peppery furrow shell (Scrobicularia plana), almejas (Ruditapes decussata), ostras (Ostrea edulis Linnaeus) y almejas navaja (Ensis siliqua Linnaeus).
En 1999 y en el 2000, en aguas de Escocia, se hallaron contaminadas con AD dos especies de escalopas (Pecten maximus Linnaeus, Chlamys opercularis Linnaeus), por ello se cerró las pesquerías o empresas cultivadoras, siendo la P. australis el origen de dicha biotoxina.
En 1999, en aguas de Irlanda, la escalopa rey (P. maximus) fue detectada contaminada con AD (31) por encima de los límites regulatorios, por ello se prohibió la venta en las áreas de cultivo y la cosecha de tales moluscos, así se confirmó la presencia de P. australis (32) productora de la biotoxina en dichas aguas. Realmente se ha descrito alrededor de una decena de especies del género Pseudo-nitschia que producen AD, aunque no siempre lo hacen, requiriendo de condiciones al parecer relativas al medio, como nutrientes y a la especie, de tal forma que la sola presencia del género en cualquier mar no significa que sea productora de la biotoxina, lo cual tiene que demostrarse. Se ha encontrado el género Pseudo-nitzscha en diversos mares del mundo. En Portugal, en el 2002, se halló AD por encima de los niveles regulatorios, en muestras del cangrejo «nadador» (Polybius henslowii), especie abundante en Portugal, siendo considerado un potencial vector (33) del AD, de importancia en la cadena trófica más que en la comercial.
En Nueva Zelandia, en un florecimiento moderado de Pseudo-nitzschia australis (34) se encontró AD contaminando mejillones, acompañando como hallazgo inusual el ácido iso-domoico, considerado de escaso efecto neurotóxico, no se informó de intoxicación en humanos.
DIFUSIÓN DE LA BIOTOXINA MARINA ÁCIDO DOMOICO EN AMÉRICA DEL SUR
En Argentina, a mediados de octubre de 2000, se reportó la mortandad inusual de aves marinas en las costas de la Patagonia, se analizó el contenido de estómagos e intestinos de petreles, pingüinos de Magallanes y cormoranes, así mismo anchoas (anchovitas) de la región, y se encontró ácido domoico, en niveles bajos, en los mejillones, pero más altos de los límites seguros en las vísceras de las anchoas. Los estudios en las áreas marinas encontraron concentraciones de Pseudonitzschia australis, productoras de AD. Por primera vez se documentaba el AD presente como biotoxina marina en aguas del Atlántico en América del Sur.
En ninguna de las aves muertas se encontró AD, pero no se descartó totalmente que hubieran muerto por el tóxico al no conocerse la magnitud de la sensibilidad al AD en tales aves, que podría estar por debajo del límite de detección del método empleado. En Chile, fue detectado el AD, se confirmó así, la presencia de la biotoxina en el Océano Pacífico en América del Sur, describiéndose un posible potencial vector nuevo (35). Al ser conocida su presencia en el Pacífico norte, la difusión mundial del AD es muy amplia.
AISLAMIENTO INICIAL DE LA BIOTOXINA MARINA ÁCIDO DOMOICO
Esta biotoxina marina fue aislada inicialmente en 1958 del alga roja marina Chondria armata en Japón. En el dialecto japonés de la isla Tokunoshima, dicha alga es llamada domoi, por lo que a su contenido ácido se le denominó domoico. El alga es un producto tradicional, utilizado como antihelmíntico intestinal, pero nunca se ha descrito que produjera daño alguno, posiblemente por su escaso contenido. De otro lado, no es alimento de mejillones, bivalvos ni peces, sin afectar por ello la cadena alimenticia. Contiene además diversos isómeros que son los ácidos iso-domoicos, habiéndose identificado el A, B, C, D, E y F, que tienen menos potencia neurotóxica (36). Por otro lado, el ácido domoico también fue identificado en otras macroalgas, Chondria baileyana y Alsidium corallinum en 1975.
Después de la intoxicación humana en Canadá, se identificó al AD en diversas microalgas (37) del género Pseudo-nitzschia sp, en casi todos los mares del mundo, lo que ocasionó la vigilancia permanente en costas de frecuente aparición, incluyendo análisis alimentarios rutinarios para detectarla a tiempo y evitar intoxicaciones humanas que constituirían problemas en salud pública con efectos irreversibles, monitoreo por vía satélite, entre otras acciones que tienden a evitar enormes daños económicos en la industria pesquera. Ocasionalmente, se le ha identificado en algas de agua dulce en algunos humedales, inclusive pozas en el sudeste asiático en nuevas especies (38), se ha descartado su presencia en otros humedales como el de los Pantanos de Villa en la costa central de Perú (39).
ASPECTOS FISICOQUÍMICOS DE LA BIOTOXINA MARINA ÁCIDO DOMOICO Y POSIBLE CONSUMO CRÓNICO
El AD es un aminoácido, que por su estructura química es un ácido tricarboxílico, siendo análogo al ácido glutámico y al ácido kaínico. Es un polvo blanco, cristalino, incoloro, soluble en agua, aunque también se diluye en soluciones ácidas minerales e hidróxidas alcalinas.
El AD es estable por una año en solución acetonitrilo/ agua (1:9 v/v) a -12 ºC en la oscuridad. En el alimento contaminado, como sería un mejillón de referencia, es estable a 4 ºC por un año. Para detectar el AD en muestras de alimentos marinos, fitoplancton o agua, desde 1989 se emplea la cromatografía líquida (HPLC) y diversas variantes cada vez más exactas como la espectrometría de masa (LC-MS/MS).
Es estable a temperatura de hervido, cuando ello ocurre en un ejemplar marino contaminado con niveles por encima de los regulatorios o menores que ellos, la concentración de la biotoxina en los ejemplares se reduce aunque pasa al agua del hervido o caldo. Al parecer algunos ejemplares con trazas de la biotoxina son hervidos antes de ofrecerlos comercialmente, no se ha descrito, hasta ahora, efectos en la salud humana por el posible consumo a largo plazo de alimentos marinos contaminados con cantidades menores a los límites regulatorios de la biotoxina, aunque han aparecido expresiones de alerta porque no se conocerían los efectos finales en posibles consumidores crónicos. Sería dramático si se encontrara algún efecto en esas condiciones, considerando que se admiten bajas cantidades para el consumo humano y es desconocida la exposición repetitiva a bajas dosis discutiéndose si existe riesgo. En tanto, el AD en ratas preñadas cruza la placenta (40), y en ratonas preñadas se ha encontrado que pasa al feto produciendo daño funcional y estructural irreversible en el cerebro en desarrollo (41).
RECEPTORES DEL GLUTAMATO: BASE DEL MECANISMO DE ACCIÓN DE LA BIOTOXINA ÁCIDO DOMOICO
El glutamato, aminoácido dicarboxílico, es considerado el principal neurotransmisor excitatorio en el cerebro (42) y médula espinal de los mamíferos, por la extensión de áreas en que participa, como la formación reticular, tálamo, hipocampo y corteza cerebral, así como en la médula espinal, comandando casi un tercio de toda la actividad excitatoria sináptica, con receptores en muchas de las neuronas del SNC, permitiendo una transmisión sináptica inmediata e interviniendo en los mecanismos de memoria y en otras actividades neuronales.
El AD es un amino ácido neuroexcitatorio potente, hasta llegar a ser neurotóxico, por su mecanismo agonista de diversos receptores glutamato. Su mecanismo de acción implica la revisión sucinta en lo que corresponde, del mecanismo de acción del neurotransmisor glutamato (l-glutámico).
El neurotransmisor glutamato es sintetizado y depositado en el terminal presináptico de las neuronas y en la glia presináptica. Durante la neurotransmisión existe despolarización neuronal, lo cual ocasiona la liberación del neurotransmisor desde tales terminales, cae en el espacio sináptico y es transportado hasta alcanzar sus receptores en la neurona postsináptica.
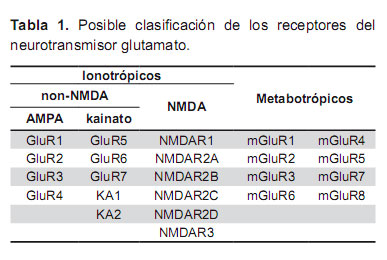
Los diversos y complejos receptores para el neurotransmisor glutamato, se han clasificado funcionalmente en dos grandes familias. La primera constituida por canales iónicos controlados por ligandos, en otros términos están formando o están asociados a los canales iónicos, por ello se les denomina receptores ionotrópicos que están formando o están asociados a los canales iónicos y han merecido constantes estudios experimentales y en cerebro humano (43), incluso en el hipocampo (44). La otra familia la constituye los receptores metabotrópicos que suelen estar ligados a las proteínas G de la membrana celular y han sido estudiados en cerebro humano por clonación (45,46) incluso en el hipocampo (47). Desde tiempo atrás se ha discutido sobre la participación de tales receptores en los mecanismos de exitoxicidad (48) en enfermedades neurodegenerativas (49). No se han concluido estudios para diversos aspectos de estos receptores glutamato, como sería la conformación del canal iónico.
Los receptores ionotrópicos se han subdividido en dos subfamilias, que han sido denominadas según sean estimulados o no por el agonista metil aspartato. Son los receptores NMDA (N-metil-D-aspartato) y los receptores non-NMDA (50).
A su vez, los receptores non-NMDA son de dos clases, denominados según lo active un agonista convencional, que obviamente no es el N-mertil-D-aspartato. Son los receptores AMPA (estimulados por el ácido alfa-amino- 3-hidroxi-5-metil-4-isoxazolpropiónico) y los receptores kainato (estimulados por el ácido kaínico) (Tabla 1).
MECANISMOS DE ACCIÓN DEL GLUTAMATO EN LA EXCITOTOXICIDAD DE LA BIOTOXINA ÁCIDO DOMOICO
El neurotransmisor l-glutamato neuronal es liberado por exocitosis en el espacio sináptico, desde su depósito en las vesículas sinápticas de las neuronas glutamatérgicas, para cumplir sus funciones excitatorias. Las vesículas, además, contienen sus transportadores (vesicular glutamate transporter: VGLUT) cuya función es intervenir en el depósito vesicular del neurotransmisor, su transporte y liberación. Comprende tres isoformas, de las cuales dos se encuentran especialmente en las neuronas glutamatérgicas del sistema nervioso central y periférico, que son la VGLUT1 y la VGLUT2 que se complementan (51), al VGLUT3 se le ha encontrado en tejidos diversos como los islotes de Langherans y estructuras vesiculares de otros neurotransmisores (52). Sólo en concentraciones altas, el glutamato puede causar la muerte neuronal, neurotoxicidad que se ha sugerido para la isquemia encefálica, hipoglicemia intensa y aun trauma. Si las concentraciones del l-glutamato en el espacio sináptico se elevaran más allá de lo normal y se acumulara, exhibiría capacidad neuroexcitatoria, pudiendo causar muerte neuronal y efectos neuroexcitotóxicos. Es fundamental su retiro o recaptación oportuna desde ese espacio, básicamente hacia los astrocitos mediante los transportadores de aminoácidos excitatorios (EAAT), de los que se conocen cinco. Con ellos, la concentración del glutamato se mantiene entre 1 a 3 μm en el espacio sináptico, pudiendo ser capaces de concentrar varios cientos de veces del l-glutamato a través de la membrana celular. Los transportadores están localizados especialmente en la glia o astrocitos perisinápticos, el EAAT1 es abundante en la glía y neuronas del cerebelo, el EAAT2 está casi exclusivamente en la glía cerebral, el EAAT3 está expresado en las neuronas de la corteza, hipocampo, caudado y putamen, el EAAT4 se encuentra en las células de Purkinje del cerebelo, el EAAT5 en la retina (53).
El AD es un agonista potente de los receptores glutamatérgicos, que se liga con alta afinidad, llegando a ser neuroexcitador, epileptogénico y neurotóxico. En cultivos in vitro de hipocampo y corteza, como en modelos experimentales, el AD produce el estímulo excesivo de los receptores glutamato, pudiendo llevar a la excitotoxicidad aguda. En la intoxicación con AD, el estímulo de los receptores ionotrópicos del glutamato, progresa en dos fases distintas y secuenciales.
La primera fase parece ser mediada por los receptores AMPA/kainato, que mediante un proceso complejo abren los canales que median el influjo del Na(+#43;) permitiendo su paso, seguido pasivamente por el Cl(-) y el agua, lo cual produce edema, tumefacción o turgencia neuronal aguda prolongada postsináptica (54) en el área afectada, incluyendo dendritas y perikarion. Ello se observa en especial en las regiones CA1 y CA3 del hipocampo dorsal, siendo muchas veces más potente en esta última región porque existiría una mayor densidad de receptores kainato a través de los cuales el AD ejercería parte de su efecto neurotóxico (55) , lo que demuestra además su potencia agonista de receptores kainato (56) . Pero también puede haber potencia agonista en los receptores AMPA/kainato de otras estructuras además del hipocampo, como se ha sugerido en el striatum de roedores (57), en la cuerda espinal embrionaria (58) y en la retina embrionaria (59).
La segunda fase subsecuente sería mediada por el estímulo de los receptores NMDA que estando excesivamente activados y relacionados con los canales de calcio, los abren y permiten incrementos bruscos y no regulados de calcio (2+) dentro de la neurona, lo que se ha demostrado en neuronas del hipocampo (60), produciendo su lisis (61). Se ha sugerido que en esta intoxicación por AD se progresa en ambas fases, participando ambas subfamilias de receptores (62). Adicionalmente, de algún modo el AD impediría que los astrocitos promuevan la captación del glutamato extracelular, incrementando sus niveles en el espacio sináptico, lo que contribuiría a su neurotoxicidad (63) y aparición de lesiones permanentes.
En este proceso podrían intervenir otros receptores ionotrópicos de glutamato no bien clasificados, que se han identificado en el estudio de múltiples genes de receptores en diversas neuronas, que también intervendrían en los mecanismos de acción del glutamato en los procesos normales y patológicos. Se ha demostrado así que el AD causa degeneración en regiones del hipocampo asociadas con formación de memoria, que en tales áreas tendría efecto neurotóxico permanente, en tanto que en las regiones del tronco cerebral, donde no se encuentran efectos neurodegenerativos, tendrían ahí solamente efectos neuroexcitatorios (64). La intervención de las tres familias de receptores, AMPA, kainato y NMDA en el mecanismo de neurotoxicidad del AD, se ha confirmado en preparaciones de neuronas neocorticales murinas (65), cuyo efecto neurotóxico sería dependiente de la concentración, confirmando la potencia agonista neurotóxica del AD cerca de veinte veces más que el kainato (66).
ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LA BIOTOXINA
En la administración parenteral en roedores, el AD se encuentra en la corriente sanguínea como una molécula hidrofílica, distribuyéndose a todos los tejidos, su biotransformación es escasa, se elimina por la orina mediante filtración glomerular (67). La nefrectomía produce elevación plasmática e incremento de su ingreso cerebral a través de la barrera hematoencefálica que siempre limita su pase (68) aunque no totalmente. Cuando es administrado oralmente en roedores, la absorción es lenta y se elimina también por las heces en un período de 36 horas (5). La toxicidad por vía oral suele alcanzarse con alrededor de diez veces la dosis tóxica por vía parenteral.
NEUROTOXICIDAD EXPERIMENTAL DE LA BIOTOXINA MARINA
La necrosis en el hipocampo por el AD ha sido ampliamente demostrada, en particular en las subregiones CA1/CA3, tanto en roedores en varias dosis (69), como en monos cynomolgus que presentaron extensas lesiones en áreas del hipocampo (70), aunque además en otras áreas límbicas (71) coincidentes con estructuras de alta densidad en receptores kainato. Además, en ratas neonatas la neurotoxicidad de la biotoxina se expresó por lesiones a nivel medular en las regiones ventral e intermedia (72).
En el estudio de los procesos de memoria y aprendizaje en roedores, como en la prueba de laberinto y el reaprendizaje, el AD en dosis simples mayores de 0,75 mg/kg como en dosis múltiples, demuestra que interfiere en tales procesos. El hipocampo, que está involucrado en el proceso de la memoria, es afectado en todos los casos por tal biotoxina, haciendo a los animales administrados incapaces de formar memoria que persista por 24 horas o utilizar las experiencias de los días anteriores.
DIAGNÓSTICO Y TRATAMIENTO EN LA INTOXICACIÓN POR LA BIOTOXINA MARINA ÁCIDO DOMOICO
El diagnóstico se basa en la historia de la ingestión de moluscos bivalvos, seguido por la sintomatología característica. Considerando la cadena alimenticia que puede contaminarse, podrían ser incluidos diversos alimentos marinos. La confirmación se realiza demostrando la presencia del AD por el análisis del alimento marino contaminado, mediante HPLC o LC/MS-MS.
El tratamiento de la intoxicación por AD es, a la fecha, sintomática y de soporte, no hay antídotos. En caso de producirse convulsiones podría emplearse difenilhidantoína, fenobarbital o diazepam, en tales condiciones no debería inducirse el vómito. Tal vez en períodos cortos, desde la ingesta, podría inducirse el vómito. El lavado gástrico con sonda requiere la administración previa de algún anticonvulsivante. Un adsorbente como carbón activado podría utilizarse en niños. Para los cuidados de posible colapso cardiovascular, hemorragia digestiva, depresión del SNS y aun convulsiones, corresponde el traslado a la Unidad de Cuidados Intensivos.
NIVELES EXPERIMENTALES DE ÁCIDO DOMOICO
La farmacología del AD ha sido estudiada en ratones (73), encontrando la DL50 en 3,9 mg/kg (3900 μg kg-1). Las descripciones señaladas en estudios en ratones, ofrecieron una serie de manifestaciones habitualmente conjuntas, de acuerdo con las dosis, incluyendo hipoactividad, sedación-akinesia, rigidez, conducta estereotipada (rascado), pérdida de control postural, tremor y convulsiones.
CONCLUSIONES
El avance de la difusión marina del AD en casi todos los mares del mundo, requiere la vigilancia constante de su aparición, como se está ejecutando actualmente, a fin de evitar los problemas de salud que podrían ser secuelas permanentes, como la amnesia anterógrada o incapacidad de retener en la memoria las actividades recientes de los afectados y manifestaciones neurológicas periféricas, con gastos relevantes en recursos de salud. Al ocasionar el AD un síndrome poco conocido, es conveniente su difusión porque a pesar de los cuidados, podría presentarse brotes tóxicos debido a la difusión de tal biotoxina marina. Al ser permitida la venta de especies marinas con niveles bajos de AD, pudiera ser pertinente la observación a largo plazo del consumo crónico de tales especies marinas, en países donde ello es admitido, así como su influencia en gestantes.
De otro lado, la importancia económica de las especies marinas, en particular para países exportadores de América del Sur, cuyos pedidos serían cancelados por temporadas, lo cual ocasionaría desempleo y merma en los ingresos, obliga a un control de calidad alimentario oportuno y eficiente, a fin de detectar a tiempo la posibilidad de aparición de biotoxinas marinas y así mantener el prestigio que obliga el control de calidad para las exportaciones. Finalmente, una adecuada política agraria y ambiental debe incluir la regulación del empleo de fertilizantes a fin de evitar las condiciones de eutrofización y florecimiento de microalgas productoras de biotoxinas, habiéndose descartado, por el momento, su aparición en aguas dulces pero que podría ocurrir sin los cuidados adecuados. La vigilancia actual es mundial, incluso por satélite, en búsqueda y detección de las mareas rojas y muerte de mamíferos y aves marinas, pero también a través del examen de las muestras de alimentos marinos que exportan los países costeros, dentro de ellos, Perú.
Conflicto de interés
El autor declara no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Perl TM, Bédard L, Kosatsky T, Hockin JC, Todd EC, Remis RS. An outbtreak of toxic encephalopaty caused by eating mussels contaminated with domoic acid. N Engl J Med. 1990; 322(25): 1775-80.
2. Zatorre RJ. Memory loss following domoic acid intoxication from ingestion of toxic mussels. Can Diss Wkly Rep. 1990; 16 (Suppl 1E): 101-3; discussion 103-4.
3. Teitelbaum JS, Zatorre RJ, Carpenter S, Gendron D, Evans AC, Gjedde A, et al. Neurologic sequelae of domoic acid intoxication due to the ingestion of contaminated mussels. N Engl J Med. 1990; 322(25): 1781-87.
4. Cendes F, Andermann F, Carpenter S, Zatorre RJ, Cashman N R. Temporal lobe epilepsy caused by domoic acid intoxication: evidence for glutamate receptor-mediated excitotoxicity in humans. Ann Neurol. 1995; 37(1): 123-26.
5. Nantel AJ. Domoic acid. Ontario: International Programme on Chemical Safety; 1996.
6. Iverson F, Truelove J, Nera E, Tryphonas L, Campbell J, Lok E. Domoic acid poisoning and mussel-associated intoxication: preliminary investigations into the response of mice and rats to toxic mussel extract. Food Chem Toxicol. 1989; 27(6): 377-84.
7. Lawrence JF, Charbonneau CF, Ménard C, Quilliam MA, Sim PG. Liquid chromatographic determination of domoic acid in shellfish products using the paralytic shellfish poison extraction procedure of the association of official analytical chemists. J Chromatogr. 1989; 462: 349-56.
8. Bates SS, Bird CJ, de Freitas ASW, Foxall R, Gilgan M, Hanic LA, et al. Pennate diatom Nitzschia pungens as the primary source of domoic acid, a toxin in shellfish from eastern Prince Edward Island, Canada. Can J Fish Aquat Sci. 1989; 46(7): 1203-15.
9. Grimmelt B, Nijjar MS, Brown J, Macnair N, Wagner S, Johnson GR, et al. Relationship between domoic acid levels in the blue mussel (Mytilus edulis) and toxicity in mice. Toxicon. 1990; 28(5): 501-8.
10. Wright JLC, Boyd RK, de Freitas ASW, Falk M, Foxall RA, Jamieson WD, et al. Identification of domoic acid, a neuroexcitatory amino acid, in toxic mussels from eastern Prince Edward Island. Can J Chem. 1989; 67(3): 481-90.
11. Nijjar MS, Grimmelt B, Brown J. Purification of domoic acid from toxic blue mussels (Mytilus edulis) and phytoplankton. J Chromatogr 1991; 568(2): 393-406.
12. Clayton EC, Peng Y-G, Means LW, Ramsdell JS. Working memory deficits induced by single but not repeated exposures to domoic acid. Toxicon. 1999; 37(7): 1025-39.
13. Perl TM, Teitelbaum J, Hockin J, Todd EC. Domoic acid toxicity. Panel discussion: definition of the syndrome. Can Dis Wkly Rep 1990; 16 (Suppl 1E): 41-5.
14. Perl TM, Bédard L, Kosatsky T, Hockin JC, Todd EC, McNutt LA, et al. Amnesic shellfish poisoning : a new clinical syndrome due to domoic acid. Can Dis Wkly Rep. 1990; 16 (Suppl 1E): 7-8.
15. Auer RN. Excitotoxic mechanisms, and age-related susceptibility to brain damage in ischemia, hypoglycemia and toxic mussel poisoning. Neurotoxicology. 1991; 12(3): 541-46.
16. Kerr DS, Razak A, Crawford N. Age-related changes in tolerance to the marine algal excitoxin domoic acid. Neuropharmacology. 2002; 43(3): 357-66.
17. Novelli A, Kispert J, Fernandez-Sanchez MT, Torreblanca A, Zitko V. Domoic acid-containing toxic mussels produce neurotoxicity in neuronal cultures through a synergism between excitatory amino acids. Brain Res 1992; 577(1): 41-8.
18. Kizer KW. Domoic acid poisoning. West J Med. 1994; 161(1): 59-60.
19. Wekell JC, Gauglitz EJ, Barnett HJ, Hatfield CL, Simons D, Ayres D. Occurrence of domoic acid in Washington state razor clams (Siliqua patula) during 1991-1993. Nat Toxins. 1994; 2(4): 197-205.
20. Mariën K. Establishing tolerable dungeness crab (Cancer magister) and razor clam (Siliqua patula) domoic acid contaminant levels. Environ Health Perspect. 1996; 104(11): 1230-36.
21. Fritz L, Quilliam MA, Wright JLC, Beale AM, Work TM. An outbreak of domoic acid poisoning attributed to the pennate diatom Pseudonitzschia australis. J Phycol. 1992; 28(4): 439-42.
22. Sierra Beltran A, Palafox-Uribe M, Grajales-Montiel J, Cruz-Villacorta A, Ochoa JL. Sea bird mortality at Cabo San Lucas, Mexico: Evidence that toxic diatom blooms are spreading. Toxicon. 1997; 35(3): 447-53.
23. Wekell JC, Trainer VL, Ayres D, Doug S. A study of spatial variability of domoic acid in razor clams: recommendations for resource management on the Washington coast. Harmful Algae. 2002; 1(1): 35-43.
24. Scholin CA, Gulland F, Doucette GJ, Benson S, Busman M, Chavez FP, et al. Mortality of sea lions along the central california coast linked to a toxic diatom bloom. Nature. 2000; 403(6765): 80-4.
25. Lefebvre KA, Powell CL, Busman M, Doucette GJ, Moeller PD, Silver JB, et al. Detection of domoic acid in northern anchovies and Californian sea lions associated with an unusual mortality event. Nat Toxins. 1999; 7(3): 85- 92.
26. Gulland FM, Haulena M, Fauquier D, Langlois G, Lander ME, Zabka T, et al. Domoic acid toxicity in Californian sea lions (Zalophus californianus): clinical signs, treatment and survival. Vet Rec. 2002; 150(15): 475-80.
27. Bejarano AC, Gulland FM, Goldstein T, St Leger J, Hunter M, Schwacke LH, et al. Demographics and spatiotemporal signature of the biotoxin domoic acid in California sea lion (Zalophus californianus) stranding records. Mar Mammal Sci. 2008; 24(4): 899-912.
28. Silvagni PA , Lowenstine LJ, Spraker T, Lipscomb TP, Gulland FMD. Pathology of domoic acid toxicity in California Sea lions (Zalophus californianus). Vet Pathol. 2005; 42(2): 184-91.
29. Bargu S, Powell CL, Coale SL, Busman M, Doucette GJ, Silver MW. Krill: a potential vector for domoic acid in marine food webs. Mar Ecol Prog Ser. 2002; 237: 209-16.
30. Vale P, Sampayo MA. Domoic acid in Portuguese shellfish and fish. Toxicon. 2001; 39(6): 893-904.
31. Furey A, Lehane M, Gillman M, Fernandez-Puente P, James KJ. Determination of domoic acid in shellfish by liquid chromatography with electrospray ionization and multiple tandem mass spectrometry. J Chromatogr A. 2001; 938(1-2): 167-74.
32. Cusack CK, Bates SS, Quilliam MA, Patching JW, Raine R. Confirmation of domoic acid production by Pseudonitzschia australis (Bacillariophyceae) isolated from irish waters. J Phycol 2002; 38(6): 1106-12.
33. Costa PP, Rodrigues SM, Botelho MJ, Sampayo MA. A potential vector of domoic acid: the swimming crab Polybius henslowii Leach (Decapoda-brachyura). Toxicon. 2003; 42(2): 135-41.
34. Holland PT, Selwood AI, Mountfort DO, Wilkins AL, McNabb P, Rhodes LL, et al. Isodomoic acid C, an unusual amnesic shellfish poisoning toxin from Pseudo-nitzschia australis. Chem Res Toxicol. 2005; 18(5): 814-6.
35. López-Rivera A, Pinto M, Insinilla A, Suárez Isla B, Uribe E, Alvarez G, et al. The occurrence of domoic acid linked to a toxic diatom bloom in a new potential vector: the tunicate Pyura chilensis (piure). Toxicon. 2009; 54(6): 754-62.
36. Hampson DR, Huang X, Wells JW, Walter JA, Wright JLC. Interaction of domoic acid and several derivatives with kainic acid and AMPA binding sites in rat brain. Eur J Pharmacol. 1992; 218(1): 1-8.
37. Pan Y, Parsons ML, Busman M, Moeller PDR, Dortch Q, Powell CL, et al. J. Pseudo-nitzschia sp. cf. pseudodelicatissima -a confirmed producer of domoic acid from the northern Gulf of Mexico. Mar Ecol Prog Ser 2001; 220(1): 83-92.
38. Thuoc C, Minh Huyen N T, Chu Hoy N, et al. Domoic acid production in Nitzschia sp. (bacillariophyceae) isolated from a shrimp-culture in Do Son, Vietnam. J Phycol. 2000;36(6): 1057-60.
39. Alvarez-Falconí PP, Santiago CA. Ausencia de biotoxina ácido domoico en los Pantanos de Villa Chorrillos, Perú. Ecol Apl. 2006; 5(1-2): 167-70.
40. Maucher JM, Ramsdell JS. Maternal-fetal transfer of domoic acid in rats at two gestational time points. Environ Health Perspect. 2007; 115(12): 1743-46.
41. Tanemura K; Igarashi K; Matsugami TR ; Aisaki K; Kitajima S; Kanno J. Intrauterine environment-genome interaction and childrens development (2): Brain structure impairment and behavioral disturbance induced in male mice offspring by a single intraperitoneal administration of domoic acid (DA) to their dams. J Toxicol Sci. 2009;34 (Suppl 2): SP279-86.
42. Henneberry RC. Cloning of the genes for excitatory amino acid receptors. Bioessays. 1992; 14(7): 465-71.
43. Collins C, Duff C, Duncan AM, Planells-Cases R, Sun W, Norremolle A, et al. Mapping of the human NMDA receptor subunit (NMDAR1) and the proposed NMDA receptor glutamate-binding subunit (NMDARA1) to chromosomes 9q34.3 and chromosome 8, respectively. Genomics. 1993; 17(1): 237-39.
44. Foldes RL, Rampersad V, Kamboj RK. Cloning and sequence analysis of cDNAs encoding human hippocampus N-methyl-D-aspartate receptor subunits: evidence for alternative RNA splicing. Gene. 1993; 131(2): 293-98.
45. Emile L, Mercken L, Apiou F, Pradier L, Bock MD, Menager J, et al. Molecular cloning, functional expression, pharmacological characterization and chromosomal localization of the human metabotropic glutamate receptor type 3. Neuropharmacology. 1996; 35(5): 523-30.
46. Makoff A, Pilling C, Harrington K, Emson P. Human metabotropic glutamate receptor type 7: molecular cloning and mRNA distribution in the CNS. Mol Brain Res. 1996; 40(1): 165-70.
47. Rampersad V, Elliott CE, Nutt SL , Foldes RL , Kamboj RK. Human glutamate receptor hGluR3 flip and flop isoforms: cloning and sequencing of the cDNAs and primary structure of the proteins. Biochim Biophys Acta. 1994; 1219(2): 563-66.
48. Beal MF. Role of excitotoxicity in human neurological disease. Curr Opin Neurobiol. 1992; 2(5): 657-62.
49. Doble A. Excitatory amino acid receptors and neurodegeneration. Therapie. 1995; 50(4): 319-37.
50. Bochet P, Rossier J. Molecular biology of excitatory amino acid receptors: subtypes and subunits. EXS. 1993; 63: 224-33.
51. Bai L, Xu H, Collins JF, Ghishan FK. Molecular and functional analysis of a novel neuronal vesicular glutamate transporter. J Biol Chem 2001; 276(39): 36764-9.
52. Moriyama Y, Omote H. Vesicular glutamate transporter acts as a metabolic regulator. Biol Pharm Bull. 2008; 31(10): 1844-46.
53. Arriza JL, Eliasof S, Kavanaugh MP, Amara SG. Excitatory amino acid transporter 5, a retinal glutamate transporter coupled to a chloride conductance. Proc Natl Acad Sci USA. 1997; 94(8): 4155-60.
54. Polischuk TM, Andrew RD. Real-time imaging of intrinsic optical signals during early excitotoxicity evoked by domoic acid in the rat hippocampal slice. Can J Physiol Pharmacol. 1996; 74(6): 712-22.
55. Debonnel G, Beauchesne L, de Montigny C. Domoic acid, the alleged mussel toxin, might produce its neurotoxic effect through kainate receptor activation: an electrophysiological study in the dorsal hippocampus. Can J Physiol Pharmacol. 1989; 67(1): 29-33.
56. Debonnel G, Weiss M, de Montigny C. Reduced neuroexcitatory effect of domoic acid following mossy fiber denervation of the rat dorsal hippocampus: further evidence that toxicity of domoic acid involves kainate receptor activation. Can J Physiol Pharmacol. 1989; 67(8): 904-8.
57. Quintela BA, Durán R, Alfonso M. Mediation of ionotropic glutamate receptors in domoic acid-induced striatal dopamine release in rats. Eur J Pharmacol. 2000; 401(2): 173-77.
58. Stewart GR, Olney JW, Pathikonda M, Snider WD. Excitotoxicity in the embryonic chick spinal cord. Ann Neurol. 1991; 30(6): 758-66.
59. Stewart GR, Zorumski CF, Price MT, Olney JW. Domoic acid: a dementia-inducing excitotoxic food poison with kainic acid receptor specificity. Exp Neurol. 1990; 110(1): 127-38.
60. Xi D, Ramsdell JS. Glutamate receptors and calcium entry mechanisms for domoic acid in hippocampal neurons. Neuroreport. 1996; 7(6): 1115-20.
61. Berman FW, LePage KT, Murray TF. Domoic acid neurotoxicity in cultured cerebellar granule neurons is controlled preferentially by the NMDA receptor Ca(2+) influx pathway. Brain Res. 2002; 924(1): 20-29.
62. Berman FW, Murray TF. Domoic acid neurotoxicity in cultured cerebellar granule neurons is mediated predominantly by NMDA receptors that are activated as a consequence of excitatory amino acid release. J Neurochem. 1997; 69(2): 693-703.
63. Ross IA, Johnson W, Sapienza PP, Kim CS. Effects of the seafood toxin domoic acid on glutamate uptake by rat astrocytes. Food Chem Toxicol. 2000; 38(11): 1005-11.
64. Peng YG, Taklor TB, Finch RE, Switzer RC, Ramsdell JS. Neuroexcitatory and neurotoxic actions of the amnesic shellfish poison, domoic acid. Neuroreport. 1994; 5(8): 981-85.
65. Jensen JB, Schousboe A, Pickering DS. Role of desensitizacion and subunit expression for kainate receptor-mediated neurotoxicity in murine neocortical cultures. J Neurosci Res. 1999; 55(2): 208-17.
66. Larm JA, Beart PM, Cheung NS. Neurotoxin domoic acid produces cytotoxicity via kainate- and AMPA- sensitive receptors in cultured cortical neurones. Neurochem Int. 1997; 31(5): 677-82.
67. Suzuki CA, Hierlihy SL. Renal clearance of domoic acid in the rat. Food Chem Toxicol. 1993; 31(10): 701-6.
68. Preston E, Hynie I. Transfer constants for blood-brain barrier permeation of the neuroexcitatory shellfish toxin, domoic acid. Can J Neurol Sci. 1991; 18(1): 39-44.
69. Sobotka TJ, Brown R, Quander DY, Jackson R, Smith M, Long SA, et al. Domoic acid: neurobehavioral and neurohistological effects of low-dose exposure in adult rats. Neurotoxicol Teratol. 1996; 18(6): 659-70.
70. Hall S, Paule MG, Rountree RL, et al. Domoic acid-treated cynomolgus monkeys (M. fascicularis): effects of dose on hippocampal neuronal and terminal degeneration. Brain Res. 1993; 627(2): 307-13.
71. Schmued LC, Scallet AC, Slikker W. Domoic acidinduced neuronal degeneration in the primate forebrain revealed by degeneration specific histochemistry. Brain Res. 1995; 695(1): 64-70.
72. Wang GJ, Schmued LC, Andrews AM, Scallet AC, Slikker W, Binienda Z. Systemic administration of domoic acid-induced spinal cord lesions in neonatal rats. J Spinal Cord Med. 2000; 23(1): 31-39.
73. Tasker RA, Connel BJ, Strain SM. Pharmacology of systemically administered domoic acid in mice. Can J Physiol Pharmacol. 1991; 69(3): 378-82.
Correspondencia: Dr. Pedro P. Alvarez-Falconí
Dirección: Cápac Yupanqui 1440, Lima11
Teléfono: (511) 435-4465
Correo electrónico: catecol@hotmail.com
Recibido: 17-11-09
Aprobado: 09-12-09














