Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.27 n.1 Lima mar. 2010
ORIGINAL BREVE
Estandarización del método de centrifugación en placa para el aislamiento del virus dengue
Rapid centrifugation assay standarization for dengue virus isolation
Miryam Palomino1,a, Victoria Gutierrez2,a, Ramses Salas3,a
1 Escuela de Biología, Facultad de Ciencias Naturales y Matemáticas, Universidad Nacional Federico Villarreal. Lima, Perú.
2 Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
3 Laboratorio de Biotecnología, Facultad de Ciencias Naturales y Matemáticas, Universidad Nacional Federico Villarreal. Lima, Perú.
a Biólogo.
RESUMEN
Se estandarizó el método de centrifugación en placa, para el aislamiento del virus dengue a partir de muestras de suero humano. Se utilizó la línea celular C6/36-HT determinándose los valores óptimos de velocidad de centrifugación, volumen de inóculo, dilución de suero y tiempo de incubación. Posteriormente, 22 muestras de suero con aislamiento viral positivo y cepas referenciales de los cuatro serotipos del virus dengue, fueron procesadas simultáneamente por el método de centrifugación en placa y el método convencional de cultivo en tubo, los aislamientos fueron tipificados mediante inmunofluorescencia indirecta empleando anticuerpos monoclonales. Se optimizó el método de centrifugación en placa inoculando 200 μL de dilución de suero 1/20, centrifugación a 1600 rpm/30 min, presentando sensibilidad de 95,5% a cinco días postinoculación. Se concluye que el método de centrifugación en placa mejora el porcentaje de aislamiento, con significativa reducción en tiempo de aislamiento del virus dengue.
Palabras clave: Dengue; Virus del Dengue; Pruebas inmunológicas; Aislamiento viral; Centrifugación en placa.
ABSTRACT
The plate centrifugation assay was standardized for dengue virus isolation from serum samples. C6/36-HT cells were used determining the optimal values for centrifugation spin speed, inoculum, sera dilution, and incubation time. Then, 22 positive serum samples with viral isolation and viral strains of the four reference dengue virus serotypes were tested simultaneously by the standardized plate centrifugation method and the conventional tube culture. The isolations were typified by indirect immunofluorescent test using monoclonal antibodies. The plate centrifugation method was optimized to 200 μL of inoculum, dilution of sera 1/20, centrifugation speed at 1600 rpm/30 min, and sensitivity of 95,5% after 5 days post-inoculation. We concluded that the plate centrifugation method increased dengue virus isolation, with a significant reduction of the time of isolation for dengue virus.
Key words: Dengue; Inmunologic Test; Viral isolation; Plate centrifugation.
INTRODUCCIÓN
El dengue es considerado una enfermedad emergente y reemergente en el mundo, se estima cada año 50 a 100 millones de casos de fiebre dengue (FD) y miles de casos de fiebre hemorrágica por dengue (FHD) a nivel mundial, porque representa un importante problema de salud pública en los trópicos y subtrópicos. La enfermedad es causada por alguno de los cuatro serotipos (DENV-1, 2, 3 y 4) del virus dengue, transmitido por su principal vector el mosquito Aedes aegypti (1). El año 2000, el Perú informó el mayor número de casos de infección por virus dengue, con 23 329 casos de FD y los primeros 250 casos de FHD con tres defunciones, con lo cual se comprobó la circulación de los serotipos: DENV-1, DENV-2 (variedad asiática, responsable de la FHD), DENV-3 y DENV-4 (2). En la ciudad de Lima se identificó la presencia de Aedes aegypti desde el año 2000 (3) y en abril de 2005 se informó los primeros casos autóctonos de dengue en el distrito de Comas, con circulación del serotipo DENV-3 (4).
En este contexto, por ser un problema de salud pública en nuestro país, el diagnóstico de la enfermedad del dengue debe incluir métodos de alta sensibilidad y especificidad como parte del sistema de vigilancia clínica. En el diagnóstico laboratorial del virus dengue, la sensibilidad está determinada por el método empleado para el aislamiento del virus, mientras la especificidad está determinada por anticuerpos monoclonales que identifican a cada serotipo del virus (5).
El aislamiento viral es considerado como la prueba de oro, utilizada en la confirmación de infección por virus, siendo el cultivo en células de artrópodos el sistema de elección en el laboratorio.
El cultivo en tubo, considerado un método estacionario, se basa en la aparición del efecto citopático (ECP), la desventaja de este método es el tiempo que requiere el proceso para obtener resultados (7 a 15 días) por la necesidad de requerir de uno o dos pasajes para lograr el aislamiento viral, y lectura diaria para observar algún efecto citopático (5).
La técnica shell vial, basada en la centrifugación que permite acelerar la adhesión del virus a los receptores celulares, fue descrita por primera vez por Gleaves et al. para el aislamiento de citomegalovirus en viales de 12 mm de diámetro (6), posteriormente, fue adaptada en placas de 24 pozos, siendo estas utilizadas exitosamente en ensayos de aislamiento viral por ser de fácil manipulación y costo-efectividad, al procesar gran número de muestras (7). Este tipo de aislamiento por centrifugación en placa ha mejorado en gran medida el aislamientos viral en cultivos celulares, al haber disminuido notablemente el tiempo requerido para el diagnóstico en laboratorio, y por su alta sensibilidad en el aislamiento de virus respiratorios (8), enterovirus y adenovirus (9), virus herpes simplex (10), citomegalovirus (6) y dengue (11), volviéndose una de las técnicas usada con más frecuencia en los laboratorios de virología. Rodríguez et al., demostraron la utilidad de la técnica de centrifugación en placa para el aislamiento de virus DENV-2 al obtener aislamientos en menor tiempo, sugiriendo la extensión del método para el aislamiento de otros serotipos (12).
Este estudio tiene como objetivo estandarizar el método de centrifugación en placa para el aislamiento del virus dengue a partir de muestras de suero, determinando los valores óptimos para mayor sensibilidad del método. La especificidad está determinada por el uso de anticuerpos monoclonales específicos para cada serotipo de virus dengue realizada por la prueba inmunofluorescencia indirecta (IFI).
EL ESTUDIO
Estudio observacional, descriptivo, de corte transversal, realizado en el Laboratorio de Referencia Nacional de Arbovirus del Instituto Nacional de Salud (INS), Lima- Perú.
La estandarización del método de centrifugación en placa determinó los parámetros para un óptimo aislamiento, siendo estos: velocidad de centrifugación, tiempo de centrifugación, dilución del suero, volumen de inóculo, incubación postinoculación, aspiración del inóculo y tiempo de incubación postinoculación. Posteriormente, se procedió a comparar el método estandarizado de centrifugación en placa, con el método de rutina de cultivo en tubo con cepas de los cuatro serotipos dengue y muestras de suero con aislamiento positivo.
El estudio de centrifugación a 1000 g a 33 ºC/hora informado para el aislamiento de DENV-2 (12), realizó los procesos de adhesión y penetración viral en sólo un paso, considerando que la adhesión del virus dengue a los receptores de la superficie celular es un proceso independiente de la temperatura y puede realizarse entre los 4 a 37 °C, mientras la penetración del virión es más afectiva a 33°C por fusión de membranas en las células C6/36 (13). Ante la ausencia de centrifuga temperada, las muestras fueron centrifugadas por 30 min a temperatura ambiente e incubadas a 33 ºC por 30 min adicionales. La elección del tiempo de centrifugación se basa en el informe que dice: 30 min de centrifugación es tan efectivo como 45 ó 60 min (14). Luego de la incubación, cuando probablemente aconteció el ingreso del virus, se procedió a aspirar la dilución de suero para disminuir la toxicidad producida en las células durante los siguientes días postinoculación.
Para la estandarización del método se utilizó muestras de suero humano en fase aguda (de 0 hasta 5 días de inicio de síntomas) con diagnóstico de caso probable de dengue, enviadas para el aislamiento viral al Laboratorio de Arbovirus del INS en el año 2005. Los sueros, inicialmente procesados por el método de rutina de cultivo en tubo, fueron conservados en congelación a -40 °C y las muestras recientemente obtenidas se conservaron en cadena de frio de 4 a 8 °C hasta su procesamiento. Se seleccionó muestras con volumen mayor a 1 mL, para mantener el stock de la seroteca del laboratorio, y procesadas en cadena de frio de 4-8 ºC realizando las diluciones en medio de mantenimiento. Se excluyó de la población de estudio, aquellos sueros que presentaron contaminación por hongos o bacterias.
También se utilizó cepas referenciales de los cuatro serotipos: DENV-1 (Hawai), DENV-2 (Nueva Guinea), DENV-3 (H87), y DENV-4 (H421), que fueron mantenidos por pases sucesivos en células C6/36-HT.
Cultivo. Se utilizó la línea celular C6/36-HT (High temperature), originada del mosquito Aedes albopictus, las células y cepas referenciales fueron donadas por el Instituto de Medicina Tropical Pedro Kouri, Cuba. Las células C6/36 fueron sembradas en placas de poliestireno de 24 pozos a concentración de 2x105 células/mL/pozo, e incubadas a 33 °C hasta la formación de monocapa confluente (36 a 48 horas), para el crecimiento de las células se usó el medio mínimo esencial con sales de Earles (E-MEM) suplementado con aminoácidos, antibiótico-antimicótico y 10% de suero bovino fetal (SBF), posterior a la formación de la monocapa, se eliminó el medio de crecimiento (MC) y se usó el medio de mantenimiento (MM) conteniendo 2% SBF.
Evaluación de la velocidad de centrifugación. Las placas de cultivo con los 24 pozos en monocapa celular, fueron inoculadas con 200 μL de MM considerada como muestra control y centrifugadas a velocidades de 1600, 1800, 2000 y 2200 rpm por 30 min a temperatura ambiente con promedio en 22,5 °C (cuatro placas por cada velocidad). Posteriormente, utilizando un microscopio de luz invertido se procedió a contar el número de pozos que presentaban monocapa de células intacta después de la centrifugación, calculándose la media para cada velocidad evaluada.
Evaluación del volumen de inóculo. Se seleccionó ocho muestras de suero con resultado de aislamiento positivo DENV-3, que fueron diluidas 1/5, 1/10, 1/20 y 1/30, e inoculadas en volúmenes de 100 y 200 μL, los pozos controles fueron inoculados con 200 μL de MM. Las muestras fueron centrifugadas a 1600 rpm/30 min e incubadas a 33ºC/30 min, seguidamente se aspiró el inóculo y adicionó 1 mL de MM. Las placas fueron incubadas a 33 ºC, observándose diariamente la viabilidad de las células, finalmente la detección del antígeno se realizó por IFI comparándose los dos volúmenes de inóculo.
Evaluación de la toxicidad del suero sobre la monocapa celular. Se seleccionó 216 muestras de suero con resultado negativo de aislamiento viral, las cuales fueron distribuidas en tres grupos: 1/10, 1/20 y 1/30, se preparó las placas por triplicado para ser centrifugadas a las velocidades de 1600, 1700 y 1800 rpm. Se procedió como en el paso anterior con la diferencia que se incubó por cinco días, luego se observó al microscopio y se registró las características de las células en cada pozo (monocapa o agrupada, desprendimiento y toxicidad), durante los siguientes cinco días postinoculación, y se obtuvo la media final de las tres diluciones por cada velocidad de centrifugación.
Comparación de los métodos de aislamiento viral. Se evaluó 22 muestras de suero con resultado confirmado de serotipo DENV-3, y cepas referenciales de los cuatro serotipos del virus dengue. Los métodos fueron realizados simultáneamente y el antígeno en los cultivos celulares fue identificado por la prueba de IFI al presentar células sospechosas, ECP o completar el tiempo de incubación.
Método de centrifugación en placa. Las muestras fueron diluidas 1/10, 1/20 y 1/30 en MM e inoculadas a volumen de 200μL sobre células en monocapa, las cepas también fueron inoculadas realizándose cinco repeticiones por cada serotipo y muestra. Las placas fueron centrifugadas a 1600 rpm/30 min e incubadas a 33 °C/30 min, seguidamente, se aspiró el inóculo, se agregó 1 mL de medio de MM, e incubaron a 33 °C durante cinco días. Las muestras de suero y las cepas fueron cosechadas cada día postinoculación, para ser identificadas por IFI.
Método convencional de cultivo en tubo. Se siguió el método descrito en el manual de procedimientos de arbovirus (15). Brevemente, las células C6/36-HT fueron sembradas en tubos 16x125 mm, formada la monocapa celular se eliminó el MC y se inoculó 200 μL de suero a dilución 1/30 y cepas de los cuatro serotipos del dengue, los tubos fueron incubados para adsorción viral a 33 °C por una hora, se agregó 1 mL de MM, y continuaron a 33 °C durante dos semanas.
Análisis estadístico. Se calculó la media de pozos con monocapa/placa proporcionando el valor representativo para cada velocidad y dilución. Se utilizó el análisis de varianza (ANOVA) de una sola vía para determinar si existían diferencias entre las medias de las velocidades y diluciones, posteriormente, se aplicó la prueba de comparación múltiple de Tukey a fin de evaluar los pares con diferencias significativas. Los cálculos de las pruebas estadísticas se realizaron usando el programa SPSS versión 14.0, se consideró un p<0,05 como significativo.
HALLAZGOS
Después de centrifugar las placas cuyos pozos fueron inoculados con medio de mantenimiento (muestra control), se obtuvo la media de pozos/placa que presentaban monocapa de células intactas, siendo los valores de 24 pozos a 1600 rpm (100%), 18 pozos a 1800 rpm (75%), 12 pozos a 2000 rpm (50%) y ningún pozo con monocapa a 2200 rpm (0%).
En la comparación de volumen de inóculo de 100 y 200 μL, sólo una muestra presentó células viables al tercer día postinoculación, comenzando a presentar toxicidad a diluciones 1/5 y 1/10, por lo que fueron cosechadas. La inmunofluorescencia mostró que la infección en las células está en relación directa con el volumen y dilución de inóculo, siendo el volumen de 200 μL el que presenta mayor cantidad de células fluorescentes en todas las diluciones (Figura 1). Además, los pozos controles adyacentes a los pozos positivos, no presentaron alteración celular o presencia de antígeno al ser evaluados por IFI, por lo que se estableció 200 μL como volumen óptimo. Las otras muestras evaluadas lisaron las células o desprendieron la monocapa celular en la dilución 1/5, formaron agrupaciones o desprendieron las células a dilución 1/10, sin permitir la adherencia de las células a las láminas de inmunofluorescencia.
La centrifugación de las células con las diluciones de suero disminuyó el número de pozos con células en monocapa/placa en comparación a la centrifugación con medio de mantenimiento de células a la misma velocidad. El incremento tanto de la velocidad de centrifugación como la concentración de las muestras tiene el mismo efecto, pues disminuye la media del número de pozos con células en monocapa por placa (Tabla 1). También se observó a diluciones 1/10, algunos pozos con todas las células desprendidas después de la centrifugación, que durante los días de incubación comenzaban a morir en suspensión, este efecto fue más frecuente a mayor velocidad de centrifugación.
El análisis de varianza y la comparación múltiple de Tukey de la media final de pozos en monocapa indica que las velocidades de 1700 y 1800 rpm son estadísticamente iguales y difieren con 1600 rpm, asimismo los pares de las diluciones 1/10-1/20 y 1/20- 1/30 son estadísticamente iguales, presentando diferencias las diluciones 1/10 y 1/30.
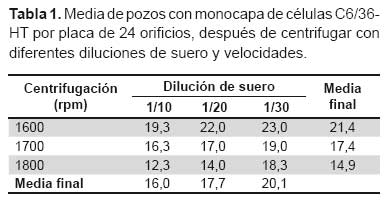
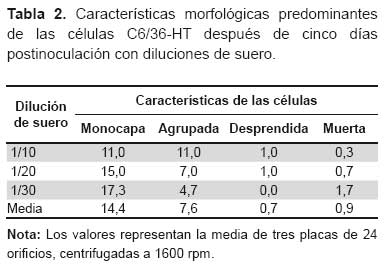
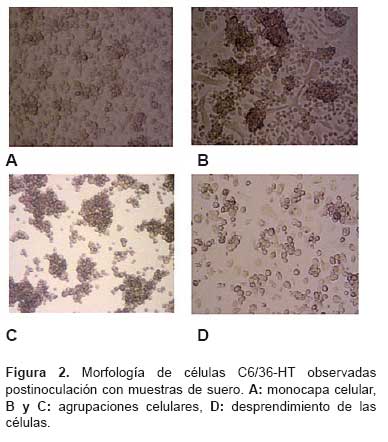
Durante el transcurso de la incubación, las células de las tres diluciones mostraron modificaciones en su morfología, cuya característica predominante varía desde monocapa celular o agrupaciones celulares si el suero fue tóxico, y durante los primeros días pueden desarrollar o acentuarse las agrupaciones celulares, desprendimiento celular e incluso muerte de las células (Figura 2). Al quinto día de incubación se observó que muestras más diluidas presentaban mayor número de pozos en monocapa y, en consecuencia, menos pozos que desarrollaron agrupaciones celulares, constituyendo estas dos morfologías casi el 90% de pozos por placa en todas las diluciones. La comparación de las medias mostró que no existe diferencia estadística significativa entre las diluciones 1/20 y 1/30 para el número de pozos con células en monocapa y agrupadas. También se observó desprendimiento y muerte celular a diluciones 1/10, 1/20 y 1/30 las cuales no fueron significativas. El grado de estas modificaciones en las células está relacionado con la concentración de las muestras, así como a la toxicidad propia de algunas muestras (Tabla 2).
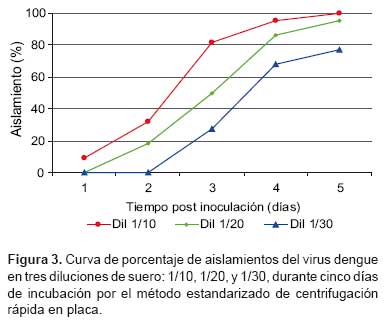
El porcentaje de aislamiento de virus según lectura de inmunofluorescencia durante los días de incubación por el método de centrifugación rápida en placa fueron para la concentración 1/30: 0%, 0%, 27,3%, 68,2% y 77,3%; la concentración 1/20: 0%, 18,2%, 50,0%, 86,4% y 95,5%, y la concentración 1/10: 9,1%, 31,8%, 81,8%, 95,5%, y 100%; para los días 1, 2, 3, 4 y 5 de incubación en los tres casos. Estos datos se reflejan en la Figura 3 en la que sobresale la dilución 1/10 que logra aislar el 100% de muestras al quinto día de postinoculación
La evaluación de las mismas muestras por el método de cultivo en tubo aisló virus en 12 de 22 muestras (54,5%), después de 12 días promedio de incubación, incluyendo un pasajes por muestra, la identificación fue por anticuerpos monoclonales (Tabla 6).
Se observó, al tercer día de incubación, aparición de efecto citopático (ECP) característico del virus dengue, en una muestra de suero a dilución 1/20 y centrifugación a 1600 rpm/30 min, sin embargo la misma muestra a diluciones de 1/10 y 1/30 presentó sólo agrupaciones celulares sin ECP, confirmándose el serotipo por la prueba de inmunofluorescencia indirecta.
La evaluación del aislamiento de cepas referenciales del virus dengue por el método estandarizado de centrifugación en placa, identificó por inmunofluorescencia indirecta los serotipos DENV-1, DENV-2, DENV-3 y DENV-4 después de 24 horas postinoculación. Las células con las cepas inoculadas, fueron especificas para cada anticuerpo monoclonal, no presentando contaminación cruzada entre pozos contiguos de cepas diferentes. Por el método de cultivo en tubo, las cepas referenciales DENV-2 y DENV-4 fueron identificadas después de 48 horas postinoculación, la cepa DENV-1 y DENV-3 después de cuatro y seis días postinoculación respectivamente.
DISCUSIÓN
El diagnóstico rápido de la infección por virus dengue, es importante en el sistema de vigilancia clínica, dependiendo de la sensibilidad del método empleado para el aislamiento del virus. Por estos motivos nos propusimos estandarizar el método de shell vial o centrifugación rápida, reconocido por su sensibilidad y disminución en el tiempo de aislamiento.
Considerando el número de muestras a ser procesadas para el aislamiento del virus dengue, se evaluó la velocidad máxima de centrifugación que es capaz de tolerar la línea celular C6/36-HT conservando la monocapa celular en los 24 pozos de la placa de cultura y, así posteriormente, cada pozo representará una muestra inoculada. Se adicionó un medio de mantenimiento de células a los pozos de la placa, registrándose alteraciones celulares producidas sólo por la velocidad de centrifugación.
Nuestro resultado de velocidad óptima de centrifugación a 1600 rpm (647g) difiere de lo informado en el aislamiento de virus DENV-2 en la misma línea celular C6/36-HT (1000g [2214 rpm]) (12), y se aproxima a la velocidad de centrifugación de 700g informada en el aislamiento de citomegalovirus (6), virus respiratorios (8), adenovirus y enterovirus (9) en otras líneas celulares. Otros autores refieren centrifugación a 3000-3500g en el aislamiento de virus herpes simplex, citomegalovirus, y Chlamydia trachomatis produciendo resultados iguales o mejores que centrifugación a baja velocidad, lo cual permite reducir el tiempo de centrifugación (16). El desprendimiento de las células en monocapa es producido por la fuerza de la velocidad de centrifugación a velocidades mayores (1800, 2000, 2200 rpm), en un ensayo aparte, la centrifugación de las placas por un minuto en aquellas velocidades, presenta la misma cantidad y distribución de pozos desprendidos en la placa, estableciendo el rango de centrifugación entre 1600 (100% pozos) a 1800 rpm (75% pozos).
Informes de aislamiento viral describen diferentes volúmenes de inóculo, siendo 100 μL para citomegalovirus (6) y dengue (11,12), 200 μL para virus respiratorios (8) y 400 μL para enterovirus y adenovirus (9). En el presente estudio y después de los resultados negativos de contaminación contigua entre los pozos de la placa, se consideró usar 200 μL como volumen de inóculo al observar las diferencias por inmunofluorescencia (Figura 2).
La interacción dilución de suero - velocidad de centrifugación favorece simultáneamente el desprendimiento de las células, por lo que se realizó la evaluación de los efectos, contando el número de pozos en monocapa celular después de la centrifugación a diferentes velocidades, y observando las células durante los días siguientes. Si se considera que la interacción virus-receptor es el primer paso para iniciar la infección, y que la infección primaria involucra la dosis inicial de virus, se determinó la estandarización del método de centrifugación en placa a 1600 rpm por presentar la media con el mayor número de pozos en monocapa/ placa, con mayor probabilidad de aislamiento viral a dilución de suero 1/20 lo que permite mantener un buen estado de las células durante los días de incubación, favoreciendo la replicación viral.
Se usó un gran número de muestras para obtener la mayor representatividad de los efectos de las diluciones de suero en la línea celular, sin realizar la inmunofluorescencia. Posteriormente, con la técnica estandarizada se evaluó nuevamente las diluciones de suero con muestras positivas, y se realizó la IFI para observar el tiempo de detección del antígeno y las diluciones de suero.
La dilución 1/10 que presenta el 100% de aislamientos al quinto día de incubación, tiene la desventaja que presenta mayor número de pozos con células desprendidas, las cuales deben ser nuevamente inoculadas en una concentración menor (1/20), lo que ocasiona gastos de tiempo y material. Además, la mayoría de los pozos con diluciones de 1/10 comienzan a desprenderse de la monocapa celular cerca del tercer día postinoculación (sensibilidad 81,1%), dificultando su adherencia a las láminas de inmunofluorescencia.
Se intenta padronizar un tiempo de cosecha para el mayor número de muestras inoculadas por placa, siendo 1/20 la mayor dilución que permite el mayor número de muestras con células viables para ser observadas por IFI, si se presentaran muestras con lectura sospechosa se realiza un pasaje de 200 μL de la suspensión siguiendo los mismos procedimientos.
En estas muestras positivas, también se observó la formación de sincitios en dos muestras a dilución 1/20, lo cual fue confirmado por inmunofluorescencia; los sincitios son fusiones celulares y probablemente se realice en células que no sufrieron daño en la superficie celular, ya que la misma muestra a dilución 1/10 no presentó sincitios siendo identificado el virus por IFI. Algunas muestras muy tóxicas, por ejemplo las hemolisadas, alteran la confluencia celular a dilución 1/20 e incluso a 1/30, por lo que deben ser procesadas más diluidas y después de uno o dos días postinoculación debe hacerse un pasaje de 200 μL a otra placa, repitiendo los procesos descritos.
El método convencional de cultivo en tubo mostró un aislamiento de 54,5% a 12 días postinoculación, con dos pasajes en el mismo sistema. La disminución de la sensibilidad en el aislamiento por el mismo método, puede deberse a la disminución de la carga viral en la muestra, que al ser inoculado a mayor concentración en las placas, permite aislar más virus. El cultivo en tubo es inoculado con muestras diluidas (1/30) que de forma pasiva permite que los virus presentes en la muestra se unan a las células, sin permitir inóculos más concentrados, por mantenerse el inóculo del suero incubando con las células hasta el final, generando toxicidad.
Las muestras de suero evaluadas por ambos métodos fueron del serotipo DENV-3 la de mayor número de aislamientos en el Instituto Nacional de Salud en el año 2005.
El método evaluado por Rodríguez et al. (12) para el aislamiento del virus dengue, utiliza 100 μL de inóculo a concentración 1/30, el método estandarizado en el presente trabajo emplea 200 μL de inóculo a concentración 1/20, estas diferencias deben haber influido en los respectivos valores de sensibilidad de 73,3 % (n=30) y 95,5% (n=22) respectivamente. Estudios comparativos entre los dos métodos de aislamiento, informan mayor sensibilidad del método empleando centrifugación (6-8), otros informan la misma sensibilidad en los aislamientos por el método empleando centrifugación y cultivo en tubo, pero todos coinciden en la disminución en el tiempo de aislamiento viral mediante la centrifugación.
En conclusión, el método de centrifugación en placa estandarizado mejora el porcentaje de aislamientos y reduce el tiempo de aislamiento a cinco días postinoculación, además, las placas de 24 pozos usadas en pruebas de centrifugación, obteniéndose un método rápido, de fácil manipulación que podría ser costo-efectivo para evaluar un gran número de muestras. Es necesario validar este procedimiento de aislamiento viral para ser aplicados en el aislamiento de otros flavivirus utilizando los anticuerpos monoclonales necesarios, ya que la proteína E que pertenece a la envoltura viral tiene un 40% de homología con diferentes miembros de la familia.
Fuente de Financiamiento
Instituto Nacional de Salud, Lima, Perú.
Conflictos de Interés
Los autores declaran no tener conflictos de interés en la publicación de este artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. Guzmán M, Kourí G. Dengue: an update. Lancet Infect Dis. 2002; 2(1): 33-42. [ Links ]
2. Mostorino R, Rosas A, Gutierrez, V, Anaya E, Cobos M, García M. Manifestaciones clínicas y distribución geográfica de los serotipos de dengue en el Perú – Año 2001. Rev Peru Med Exp Salud Publica. 2002; 19(4): 171-80. [ Links ]
3. Andrade C, Caceres A, Vaquerizo A, Ibañez-Bernal S, Sulca L. Reappearance of Aedes aegypti (Diptera: Culicidae) in Lima, Perú. Mem Inst Oswaldo Cruz. 2001; 96(5): 657-8. [ Links ]
4. Mamani E, García M, Gutiérrez V, Cabezas C, Harris E. Tipificación molecular del virus dengue 3 durante el brote epidémico de dengue clásico en Lima, Perú 2005. Rev Peru Med Exp Salud Publica. 2005; 22(3): 161-64. [ Links ]
5. Kao C, King C, Chao D, Wu H, Chang G. Laboratory diagnosis of dengue virus infection: current and future perspectives in clinical diagnosis and public health. J Microbiol Inmunol Infect. 2005; 38(1): 5-16. [ Links ]
6. Gleaves C, Smith T, Shuster E, Pearson G. Comparison of standard tube and shell vial cell culture techniques for the detection of cytomegalovirus in clinical specimens. J Clin Microbiol. 1985; 21(2): 217-21. [ Links ]
7. Mills R, Cain K, Woods G. Detection of Influenza virus by centrifugal inoculation of MDCK cells and staining with monoclonal antibodies. J Clin Microbiol. 1989; 27(11): 2505-8. [ Links ]
8. Navarro-Marí J, Sanbonmatsu-Gámez S, Pérez-Ruiz M, De La Rosa-Fraile M. Rapid detection of respiratory viruses by shell vial assay using simultaneous culture of Hep-2, LLC-MK2 and MDCK cells in a single vial. J Clin Microbiol. 1999; 37(7): 2346-47. [ Links ]
9. Van Doornum G, De Jong J. Rapid shell vial culture technique for detection of enteroviruses and adenoviruses in fecal specimens: comparison with conventional virus isolation method. J Clin Microbiol. 1998; 36(10): 2865-68. [ Links ]
10. Athmanathan S, Bandlapally S, Rao G. Comparison of the sensitivity of a 24 h-shell vial assay, and conventional tube culture, in the isolation of herpes simplex virus - 1 from corneal scrapings. BMC Clin Pathol. 2002; 2(1): e1. [ Links ]
11. Gutierrez V, Palomino M, Olivares M, Noroña G. Aislamiento rápido del virus dengue 3 por el método de Shell vial en el brote de dengue en Lima. Rev Peru Med Exp Salud Publica. 2005; 22(3): 233-35. [ Links ]
12. Rodriguez Roche R, Alvarez M, Guzmán M, Morier L, Kourí G. Comparison of rapid centrifugation assay with conventional tissue culture method for isolation of dengue 2 virus in C6/36-HT cells. J Clin Microbiol. 2000; 38(9): 3508-10. [ Links ]
13. Hase T, Summers P, Eckels K. Flavivirus entry into cultured mosquito cells and human peripheral blood monocytes. Arch Virol. 1989; 104: 129. [ Links ]
14. Espy M, Smith T, Harmon M, Kendal A. Rapid detection of influenza virus by shell vial assay with monoclonal antibodies. J Clin Microbiol. 1986; 24(4): 677-9. [ Links ]
15. Instituto Nacional de Salud. Manual de procedimientos para el diagnóstico de arbovirus. Lima: INS; 1996. Serie de Normas Técnicas N° 16. [ Links ]
16. Engler H, Selepack S. Effect of centrifuging Shell Vials at 3,500xg on detection of viruses in clinical specimens. J Clin Microbiol. 1994; 32(6): 1580-82. [ Links ]
Recibido: 24-06-09
Aprobado: 02-03-10
Correspondencia: Myriam Palomino Rodriguez
Teléfono: (511) 5833638
Correo electrónico: miryampalomino@hotmail.com















