Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.27 no.3 Lima July/set. 2010
ARTICULO ORIGINAL
Peste neumónica primaria con transmisión intrahospitalaria en La Libertad, Perú 2010
Primary pneumonic plague with nosocomial transmission in La Libertad, Peru 2010
Luis F. Donaires1,a, Manuel Céspedes1,b,c, Pedro Valencia1,a,c, Juan Carlos Salas2,d, María E. Luna2,e, Alex Castañeda3,a, Víctor Peralta4,f, César Cabezas1,a, Paul E. Pachas1,e
1 Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
2 Hospital Regional Docente de Trujillo, Gobierno Regional de La Libertad. Trujillo, Perú.
3 Hospital Víctor Lazarte Echegaray, EsSalud. Trujillo, Perú.
4 Dirección Regional de Salud La Libertad, Gobierno Regional de La Libertad. Trujillo, Perú.
a Médico Infectólogo; b Biólogo; c Magíster en Salud Pública; d Médico internista; e Médico Epidemiólogo; f Médico pediatra.
RESUMEN
La peste neumónica es una forma clínica de peste, de baja frecuencia y alta letalidad, transmitida por la inhalación directa de Yersinia pestis proveniente de un animal o de persona a persona. Objetivo. Describir las características clínicas y epidemiológicas de los casos de un brote de peste neumónica primaria humana en el norte de Perú. Materiales y métodos. Se revisaron las historias clínicas de los casos confirmados de peste neumónica primaria presentados en un brote ocurrido en la región de La Libertad, en el mes de julio de 2010, asimismo, se efectuó la búsqueda e investigación de contactos. Resultados. Se identificó el caso índice y tres casos adicionales, de estos últimos, dos fueron infecciones intrahospitalarias relacionadas con el caso índice. La presentación clínica inicial se caracterizó por fiebre de inicio súbito, escalofríos, mialgias y dolor torácico y evolución en menos de 24 horas a hipotensión arterial y cianosis. El inicio del tratamiento específico varió de 2 a 12 días, observándose que los casos con inicio precoz de tratamiento tuvieron un mejor resultado clínico. La letalidad fue de 50% (2/4). Conclusión. Se evidenció la transmisión intrahospitalaria de peste neumónica en el Perú con manifestaciones graves y alta letalidad.
Palabras clave: Peste neumónica; Yersinia pestis; Infección intrahospitalaria; Transmisión de enfermedad infecciosa; paciente a profesional; Brotes; Perú (fuente: DeCS BIREME).
ABSTRACT
Pneumonic plague is one of the clinical forms of plague, of low frequency and high mortality, transmitted by direct inhalation of Yersinia pestis coming from an animal or from person to person. Objective. To describe the clinical and epidemiological characteristics of the cases of primary pneumonic plague in an outbreak in the north of Peru. Materials and methods. The clinical records of the confirmed cases of primary pneumonic plague presenting in an outbreak occurring in La Libertad, in July 2010, were reviewed, also the search and contact investigation was performed. Results. The index case was identified, as well as three additional cases, out of these, two were nosocomial infections related to the index case. The initial clinical presentation was characterized by sudden onset of fever, chills, myalgia and chest pain, which in less than 24 hours evolved to hypotension and cyanosis. The initiation of specific treatment varied from 2 to 12 days, and cases with prompt initiation of treatment had a better clinical outcome. The lethality was 50% (2/4). Conclusion. Nosocomial transmission of pneumonic plague in Peru is evidenced, with severe clinical manifestations and high lethality.
Key words: Pneumonic plague; Yersinia pestis; Cross infection; Infectious disease transmission, patient-to-professional; Diseases outbreaks; Peru (source: MeSH NLM).
INTRODUCCIÓN
La peste es una zoonosis que tiene como reservorio a roedores silvestres o urbanos. Es transmitida por la picadura de pulgas que adquieren la bacteria al alimentarse con sangre de roedores infectados con Yersinia pestis (1-3). En los humanos y roedores, así como en otros mamíferos susceptibles, es una infección accidental, que se adquiere generalmente mediante la picadura de estos insectos infectados y, ocasionalmente, por contacto directo con animales infectados, mordedura o arañazo de estos, o por inhalación aérea de partículas contagiosas (4).
Existen focos dispersos de peste en grandes áreas de Asia, África y América (3). La peste ingresó al Perú por los puertos de Callao y Pisco en el año 1903, luego se expandió por toda la costa (5,6). En el caso del norte de Perú, específicamente en la región La Libertad, ingresó por el puerto de Pacasmayo (7) y se estableció en las regiones Piura, Lambayeque, Cajamarca y La Libertad (1), en esas áreas se han presentado brotes de peste bubónica (6).
En cuanto a la evolución de esta enfermedad, entre el 5 y 15% de pacientes con peste bubónica y septicémica desarrollan secundariamente compromiso pulmonar –peste neumónica secundaria–, donde predomina la neumonía fulminante (8). La peste neumónica primaria es adquirida por la inhalación de gotas infectivas de personas o animales y rara vez por exposición accidental con aerosoles. Estudios en primates sugieren que la dosis infectiva para peste neumónica primaria varía entre 100 a 20 000 bacilos (8); sin embargo, se ha reportado que la inhalación o inyección intradérmica de solo diez bacilos puede ocasionar infección humana (9). Otros modelos animales indican la importancia del tamaño de la partícula en las manifestaciones clínicas (10), la distancia entre las personas para el contagio (menos de dos metros de distancia de un paciente tosedor) (11,12) y la presencia de factores de virulencia de la bacteria como el activador de plasminógeno (Pla) (13).
La peste neumónica primaria tiene un periodo de latencia individual de 4,3 ± 1,8 días, y un periodo de infección de 2,5 ± 1,2 días (2), con lo que el periodo de incubación suele ser muy corto, de pocas horas a tres días, aunque se ha reportado que en humanos puede ser hasta de 21 días (14). Se caracteriza clínicamente por dos estadios clínicos, el primero marcado principalmente por escalofríos, fiebre alta, malestar general, cefalea intensa, náuseas, vómitos, mareos probablemente de origen central (14,15) (presumiblemente secundario a toxinas bacterianas), disminución del apetito y sed aumentada, con la tos usualmente ausente. La duración de este estadio es variable, pero generalmente es de 24 horas. El inicio del segundo estadio está definido por la presencia de tos seca al inicio, luego expectoración escasa que se incrementa rápidamente hasta la aparición de hemoptisis, la fiebre llega a ser continúa (frecuentemente alrededor 39,4 °C), desarrollo de disnea, cianosis (característico de este estadio) y la muerte, que ocurre con frecuencia debido a falla cardiaca. Las complicaciones pulmonares pueden incluir áreas localizadas de necrosis y cavitación, efusión pleural y síndrome de dificultad respiratoria del adulto (16-19). Es posible encontrar diarrea, agitación, postración y coma (20); esta forma de peste tiene una alta tasa de letalidad (14,21), es por eso que el tratamiento debe ser instaurado de inmediato (3). El diagnóstico diferencial debe incluir a infecciones graves por leptospiras, hantavirus, rickettsias, fiebre Q, neumonías adquiridas en la comunidad e infecciones virales respiratorias como la influenza A(H1N1).
Luego de 12 años de silencio epidemiológico en La Libertad, en septiembre de 2009 se notificó dieciséis casos de peste bubónica en el distrito de Casa Grande, provincia de Ascope y, en abril de 2010, cinco casos de peste bubónica y un caso de peste septicémica en el distrito de Chicama en la misma provincia. Una intervención conjunta del Instituto Nacional de Salud (INS) y la Gerencia Regional de Salud La Libertad logró aislar Y. pestis en muestras colectadas de roedores, pulgas, canes y gatos de la provincia de Ascope, La Libertad entre los meses de mayo a julio de 2010.
Nuestro estudio tiene como objetivo describir las características clínicas y epidemiológicas de los casos de peste neumónica primaria presentados durante el brote en la región La Libertad en julio de 2010.
MATERIALES Y MÉTODOS
ÁREA DE ESTUDIO
La región La Libertad está ubicada en la zona noroccidental de Perú. Tiene una superficie de 25 569, 67 km2, y una población estimada para el año 2010 de 1 746 913 habitantes (22) (Figura 1). Cuenta con tres hospitales de nivel de complejidad III-1, entre los que se encuentran el Hospital Regional Docente de Trujillo con 248 camas (23).
SISTEMATIZACIÓN DE LA INFORMACIÓN
Se revisó las historias clínicas de todos los casos confirmados de peste neumónica ocurridos en el mencionado brote. Se registró las características demográficas, tipo y características de la exposición, ruta de contacto, presentación clínica inicial, evolución, tratamiento recibido y complicaciones. Asimismo, se realizó entrevistas en profundidad al equipo de médicos tratantes, amigos y familiares de los casos. Para el caso índice, se realizó la búsqueda de epizootias en el área domiciliaria y peridomiciliaria, a los encontrados se les realizó cultivo de tejidos para Y. pestis.
DEFINICIONES
Consideramos los criterios de la OMS para la clasificación de los casos (24).
Caso sospechoso. (a) Persona con presentación clínica compatible y con (b) antecedentes epidemiológicos como exposición a animales o humanos infectados, evidencia de picadura de pulgas, residencia o viaje a focos endémicos conocidos en los 10 días previos.
Caso probable. (a) Caso sospechoso con (b) al menos una de las siguientes pruebas positivas: evidencia microscópica de cocobacilos bipolares (tinción Wayson o Giemsa), serología única anti-F1 sin evidencia previa de infección o vacunación, detección de antígeno F1 mediante inmunofluorescencia, detección de PCR de Y. pestis.
Caso confirmado. (a) Caso sospechoso con (b) aislamiento identificado como Y. pestis (morfología de la colonia y dos de las cuatro siguientes pruebas positivas: fagólisis de cultivos a 20-25 °C y 37 °C, perfil bioquímico de Y. pestis, detección de antígeno F1 o PCR; o (c) un aumento significativo (> 4 veces) del título de anticuerpos frente al antígeno F1 en muestras de suero pareadas; o (d) en áreas endémicas cuando ninguna prueba confirmatoria puede ser realizada, una prueba rápida positiva usando una prueba inmunocromatográfica para detección de antígeno F1.
Contacto. Todas las personas que estuvieron a menos de dos metros de distancia de un paciente con peste neumónica desde que inició sus síntomas hasta las 48 horas luego de haber iniciado el tratamiento específico (20).
PRUEBAS DIAGNÓSTICAS
Las pruebas de laboratorio se realizaron en el Centro Nacional de Salud Pública del Instituto Nacional de Salud (INS) en Lima, Perú, y fueron las siguientes:
1) Aislamiento de Y. pestis por cultivo e identificación por caracterización bioquímica, PCR y fagólisis (25).
2) Detección de ADN de Y. pestis por reacción en cadena de la polimerasa (26,27).
3) Detección de anticuerpos anti- Y. pestis mediante las técnicas de hemoaglutinación/inhibición, ELISA IgG y ELISA IgM (25).
4) Detección de la fracción F1 de Y. pestis por la prueba de inmunocromatografía (28).
ASPECTOS ÉTICOS
La investigación fue realizada en el contexto de un brote de peste, por lo que el protocolo no fue enviado a un Comité de Ética en Investigación para su aprobación según las normas internacionales (29).
RESULTADOS
DESCRIPCIÓN GENERAL
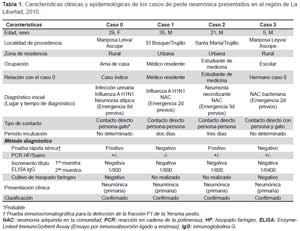
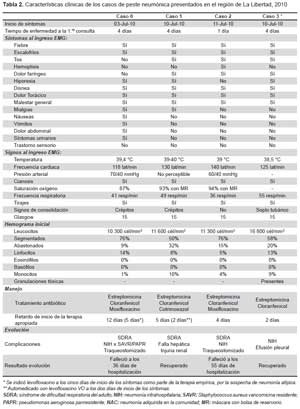
Se registró 55 contactos del caso 0 o índice (12 en la vivienda y 43 en el hospital). Se encontró tres casos secundarios confirmados de peste neumónica. Las características epidemiológicas, clínicas y de laboratorio de estos casos se resumen en las Tablas 1 y 2. La transmisión hacia los otros casos ocurrió tanto en la vivienda del caso 0 (para el caso 3), como en el hospital de atención del caso 0 (para los casos 1 y 2). Tres de los cuatro casos fueron del sexo masculino. La mediana de la edad fue de 22,5 años (rango 5-35). Asimismo, no existió evidencia de bubón en ninguno de los casos (Tabla 2).
De los dos casos considerados como infecciones intrahospitalarias, ninguno de ellos utilizó equipo de protección personal a pesar de tener contacto directo con el paciente; ambos procedían de la ciudad de Trujillo (donde no se ha demostrado casos de peste en humanos ni en animales) y negaron viajes a zonas rurales. El periodo de incubación se pudo determinar para estos dos casos y fue de 2 a 3 días.
Los síntomas iniciales fueron fiebre de inicio súbito, escalofríos, mialgias y dolor torácico; en menos de 24 horas presentaron hipotensión y cianosis. La mediana de leucocitos fue 12 500 cél/mm3 (Rango: 10 300-16 800 cél/ mm3) y de las formas inmaduras 19% (Rango: 9-32%). Todos los cultivos de hisopado faríngeo fueron negativos. El PCR en hisopado faríngeo fue positivo para Y. pestis en los cuatro casos. En los cuatro casos hubo incremento de los títulos de anticuerpos en muestras pareadas. La prueba inmunocromatográfica para la fracción F1 de Y. pestis fue positiva en muestras séricas del caso 0 y caso 2 (Tabla 1).
A todos se les administró tratamiento con estreptomicina y cloranfenicol, en dos casos se incluyó además, moxifloxacina y en uno cotrimoxazol. Las complicaciones que presentaron fueron choque séptico en tres de los pacientes, síndrome de dificultad respiratoria del adulto en tres de los casos, asimismo, tres sufrieron una infección intrahospitalaria por otros gérmenes, dos tuvieron neumotórax secundario, la hemoptisis se presentó solamente en un caso; falla hepática y efusión pleural en uno de ellos. El inicio del tratamiento específico varió de 2 a 12 días. La letalidad fue de 50%.
DESCRIPCIÓN DETALLADA DE LOS CASOS
Caso 0 (Caso índice).
Mujer de 29 años de edad, procedente de la localidad de Mariposa Leiva, distrito de Chocope, provincia de Ascope, La Libertad, que acudió con cuatro días de fiebre, escalofríos, mialgias, malestar general y cefalea. El día de admisión se agregó disuria, poliaquiuria, disnea, dolor abdominal y torácico retroesternal izquierdo de moderada intensidad. Adicionalmente a la información contenida en las tablas, otros exámenes de laboratorio realizados al ingreso fueron creatinina 1,2 mg/dL, amilasa 31 U/L, pH: 7,397, PCO2: 24,8 mmHg, PO2: 52,7 mmHg, HCO3 -: 15,4 mmol/L, Na+: 134,4 mmol/L, K+: 2,95 mmol/L, lactato: 1,7 mmol/L, urea: 59,9 mg/dL, Ca++: 0,92 mmol/L, en la coloración Zielh Neelsen de esputo no se observó BAAR.
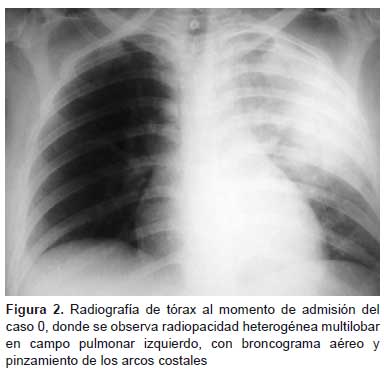
La radiografía de tórax, tomada al ingresar, mostraba una radiopacidad heterogénea multilobar izquierda con broncograma aéreo (Figura 2). El diagnóstico inicial fue insuficiencia respiratoria aguda grave por probable influenza A H1N1 y se inició tratamiento con oseltamivir. A las 12 horas de ingreso, debido al deterioro de la paciente, se solicitó soporte ventilatorio en la Unidad de Cuidados Intensivos (UCI), además, de vasopresores y antibióticos de amplio espectro por siete días (incluyendo levofloxacino).
A los seis días de hospitalización el resultado de influenza A H1N1 fue negativo. Se sospechó de peste neumónica debido a que un estudio previo realizado por el Instituto Nacional de Salud, había reportado aislamien- to de Y. pestis en roedores en los distritos de Chocope, Ascope, Casa Grande, Chicama y Razuri; además, se había reportado casos confirmados de peste bubónica en el distrito de Chicama, a 20 km de la localidad de la residencia del caso 0. Dos días después de tomar las muestras respectivas, la prueba inmunocromatográfica para la fracción F1 de Y. pestis en hisopado faríngeo y hemaglutinación pasiva en suero fue positiva para peste y se evidenció seroconversión del ELISA IgG (Tabla 1). Retrospectivamente, el hisopado nasofaríngeo inicial colectado en la admisión fue positiva a Y. pestis por PCR.
La prueba de ELISA IgM para Hantavirus, Oropuche y encefalitis equina venezolana fue negativa. Se inició tratamiento con estreptomicina IM, cloranfenicol y moxifloxacino EV por diez días. A los 13 días de hospitalización cursó con neumotórax secundario y neumonía intrahospitalaria. En un aspirado bronquial obtenido por fibrobroncoscopía se aisló Staphylococcus aureus vancomicina-resistente y Pseudomonas aeruginosa carbapenem-resistente, se inició tratamiento con linezolid y meropenem a dosis plenas. Murió a los 36 días de hospitalización en la UCI.
Al realizar la visita domiciliaria, los familiares y los vecinos no refirieron epizootias. Sin embargo, se encontró un gato pequeño muerto de aproximadamente tres meses de edad a 40 metros del domicilio del caso y otro gato pequeño de aproximadamente dos meses de edad aparentemente sano, pero con ganglios cervicales hipertróficos que fue capturado y sacrificado. El cultivo y PCR de tejidos de este gato fue negativo a Y. pestis.
Caso 1.
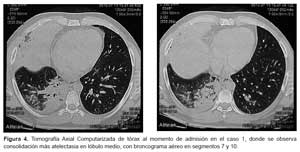
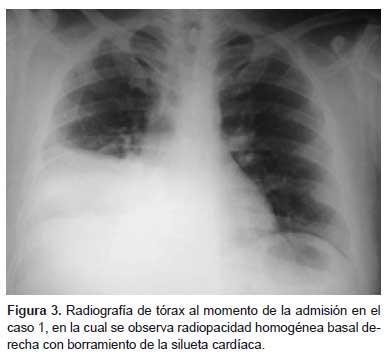
Médico residente de 35 años de edad, procedente de Trujillo, dos días previos al inicio de síntomas evaluó al caso 0 sin equipo de protección personal. Tuvo contacto directo con el caso índice en dos oportunidades (30 minutos y 15 minutos), en un ambiente de emergencia destinado a aislamiento respiratorio de aproximadamente 20 m2 de superficie, con pobre ventilación, con un ventilador doméstico permanentemente encendido. Luego de dos días presentó fiebre (40 °C), tos, dolor de garganta, congestión conjuntival y congestión faríngea; se automedicó con oseltamivir y levofloxacino sin presentar mejoría. Al cuarto día del inicio de enfermedad se agregó taquipnea, astenia, mialgias, malestar general, dolor torácico moderado. Al momento de la admisión presentó hipotensión (PA imperceptible) e hipoxia (SatO2: 93%) (Tabla 2), por lo que fue referido a la UCI del hospital de EsSalud Víctor Lazarte Echegaray de Trujillo para soporte avanzado. En las pruebas de laboratorio se encontró leucocitosis con desviación izquierda (Tabla 2), creatinina 2,2 mg/dL, pH: 7,438, PCO2: 20,8 mmHg, PO2: 66,4 mmHg, HCO3 -: 14,2 mmol/L, Na+: 142 mmol/L, K+: 3,33 mmol/L, lactato: 4,4 mmol/L, urea: 64,7 mg/dL, Ca++: 0,81 mmol/L, en la coloración Zielh Neelsen de esputo no se observó BAAR. Los hallazgos radiográficos se muestran en la Figura 3, asimismo, se presenta imágenes tomográficas en este caso (Figura 4).
El diagnóstico inicial fue de choque séptico secundario a neumonía lobar con disfunción renal. Se inició tratamiento con oseltamivir y antibióticos de amplio espectro. A los seis días de iniciado los síntomas la prueba de hemaglutinación pasiva en suero fue positiva para peste y se evidenció seroconversión del ELISA IgG (Tabla 1). La prueba rápida para la detección inmunocromatográfica de la fracción F1 de Y. pestis en suero fue no reactiva, el PCR de suero e hisopado faríngeo fueron negativos a Y. pestis. La prueba de ELISA IgM fue negativa a Hantavirus, Oropuche y encefalitis equina venezolana; el PCR en tiempo real para influenza A H1N1 negativo, IFI y cultivo viral fue negativo para virus respiratorios, y la serología negativa a Legionella, Mycoplasma y Chlamydia. Se inició tratamiento con estreptomicina IM, cloranfenicol EV y cotrimoxazol por SNG por diez días. Cursó con síndrome de dificultad respiratoria del adulto, falla hepática que evolucionó favorablemente. Fue dado de alta a los 21 días de hospitalización.
Caso 2.
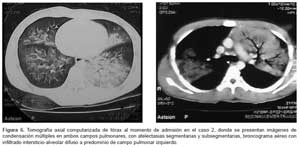
Estudiante de medicina de 21 años de edad, sexo masculino, procedente de Trujillo, que evaluó al caso 0 sin uso del equipo de protección personal. Las características del contacto con el caso índice no están bien determinadas; sin embargo, se presume que son similares a las del Caso 1. Inició la enfermedad al tercer día del contacto, y a las 24 horas fue admitido en la unidad de emergencia. Los síntomas iniciales fueron malestar general, cefalea moderada, fiebre (39,7 °C), escalofríos, tos seca. A las tres horas de la admisión se agregó dolor faríngeo, tos con expectoración, dificultad respiratoria. Dos horas después presentó hemoptisis moderada (aproximadamente 300 mL), mayor disnea, hipotensión (60/40 mmHg) e hipoxia (SatO2: 94%). En las pruebas de laboratorio presentó leucocitosis con desviación izquierda (tabla 2), creatinina 1,3 mg/dL, Na+ 145,7, K+ 3,68, Ca++ 0,75, en la coloración Zielh Neelsen de esputo no se observó BAAR, la prueba de ELISA para VIH fue no reactivo, procalcitonina sérica 24,6 ng/mL. La radiografía de tórax mostró radiopacidades heterogéneas multilobares en ambos campos pulmonares con broncograma aéreo (Figura 5 y 6).
El diagnóstico inicial fue insuficiencia respiratoria aguda grave por neumonía necrotizante; se inició tratamiento con oseltamivir y antibioticoterapia de amplio espectro. A las 12 horas de ingreso presentó mayor deterioro general y fue transferido a la UCI. A los tres días de hospitalización se sospechó de peste neumónica y se inició tratamiento específico con estreptomicina IM, cloranfenicol y moxifloxacino EV por diez días. La prueba inmunocromatográfica para detección de la fracción F1 de Y. pestis en suero, PCR en hisopado faríngeo y hemaglutinación pasiva en suero fueron positivos para peste humana, además, se evidenció seroconversión de ELISA IgG (Tabla 1). Los resultados de PCR para influenza A H1N1 e IFI para virus respiratorios fueron negativos. La prueba de ELISA IgM para Hantavirus, Oropuche y encefalitis equina venezolana fue negativa. El HBsAg fue no reactivo. El PCR para Mycobacterium tuberculosis en aspirado bronquial obtenido por fibrobroncoscopía fue positivo. A los 12 días de hospitalización la procalcitonina se normalizó (0,9 ng/mL). Evolucionó con neumotórax secundario y síndrome de dificultad respiratoria del adulto y fístula pleuroparenquimal. Se le realizó una traqueostomía para continuar con soporte ventilatorio; sin embargo, falleció a los 55 días de hospitalización en la UCI.
Caso 3.
Niño de cinco años de edad, hermano del caso 0, ambos compartían el mismo dormitorio. Inició los síntomas cuatro días antes del ingreso hospitalario con fiebre (39 °C), escalofríos, tos, dolor faríngeo, malestar general; el diagnóstico inicial fue infección respiratoria aguda, por lo que indicaron tratamiento sintomático sin presentar mejoría. La fiebre persistía y se agregó tos persistente, respiración rápida, dolor torácico moderado, soplo tubárico en hemitórax derecho y cianosis. Fue hospitalizado en un Hospital Nivel II para manejo y soporte oxigenatorio. Las pruebas de laboratorio indicaron leucocitosis con desviación izquierda (Tabla 2), VSG: 50 mm/h, PCR: 3,2 U/L. La radiografía de tórax mostró una radiopacidad homogénea basal derecha con pérdida de la delimitación de la silueta cardíaca (Figura 7). A los cinco días de enfermedad, se inició tratamiento con estreptomicina IM, cloranfenicol EV y ceftriaxona EV, por ser contacto del caso 0.
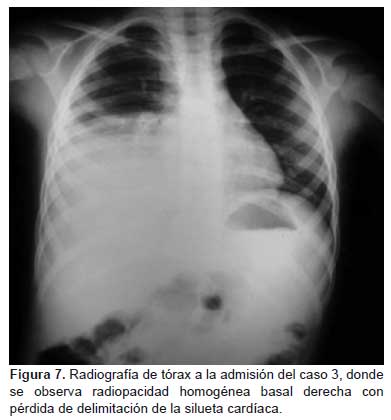
La prueba inmunocromatográfica de la fracción F1 de Y. pestis en suero y la hemaglutinación pasiva para peste humana fueron negativas; sin embargo, los controles luego de tres semanas resultaron positivos para anticuerpos contra Y. pestis, asimismo, se evidenció seroconversión del ELISA IgG (Tabla 1). El PCR en hisopado faríngeo fue positivo a Y. pestis. Los resultados de PCR en tiempo real para influenza A H1N1 e IFI para virus respiratorios fueron negativos. Al 10.º día de iniciado los síntomas, fue trasferido a un hospital de mayor complejidad por persistir febril y con efusión pleural, y se añadió vancomicina al tratamiento. Presentó mejoría clínica y radiológica, evolucionó sin complicaciones. Fue dado de alta al 21.er día de hospitalización.
DISCUSIÓN
Describimos cuatro casos de peste neumónica primaria confirmadas por presentación clínica compatible en áreas con circulación de Y. pestis demostrada y seroconversión de títulos de anticuerpos anti Y. pestis en muestras pareadas mediante técnica de ELISA IgG con títulos ≥1/800 en la segunda muestra. La prueba inmunocromatográfica de la fracción F1 de Y. pestis ha demostrado ser muy sensible (100%) y especifica (100%) en estudios previos (28); sin embargo, en nuestra serie sólo dos casos (50%) fueron positivos; los otros dos casos con pruebas negativas habían recibido terapia antibiótica previa.
Se ha reportado que el PCR tiene baja sensibilidad (<50%) y alta especificidad (100%) (27), en esta serie de casos todos tuvieron PCR reactivo a Y. pestis en hisopado faríngeo. La rapidez de los resultados del PCR nos permitió adoptar medidas oportunas que limitaron la expansión del brote. No aislamos ninguna cepa de Y. pestis probablemente por colectar muestras inadecuadas para realizar los cultivos y por que ya estaban recibiendo tratamiento con antibióticos. Solo cultivamos dos hisopados faríngeos que fueron negativos. Las muestras adecuadas para el diagnóstico de peste incluyen sangre y otros fluidos o tejidos potencialmente infecciosos (esputo, pulmón, hígado, bazo, médula ósea).
Las muestras para cultivo y serología siempre deben obtenerse para confirmar el caso; un diagnóstico rápido puede realizarse con anticuerpos específicos para detectar la fracción F1 de la Y. pestis (prueba inmunocromatográfica). El diagnostico serológico requiere muestras pareadas ya que títulos detectables se desarrollan después de días de la aparición de los primeros síntomas, como se evidencia en la presente publicación. El aislamiento de Y. pestis por cultivo requiere un tiempo ≥ 2 días y es mayor si la muestra se inocula en animales de laboratorio.
La asociación de la peste neumónica humana con la exposición a gatos infectados, en el caso índice no fue demostrada. La trasmisión intrahospitalaria se relacionó con el contacto directo persona a persona (< 2m) y sin usar equipo de protección personal. Las secreciones respiratorias del caso índice durante la fase infecciosa (una vez iniciada la tos), en un ambiente cerrado, poco ventilado e inclusive con uso de ventiladores domésticos, favoreció la transmisión por aerosoles.
Similares hallazgos de ambientes que facilitan la transmisión por aerosoles, fueron reportados en los brotes de peste neumónica ocurridos en Manchuria (1910-11 y 1920-21) (11), Madagascar (1997) (11) y la India (2002) (14). Los casos de peste neumónica que describimos presentaron compromiso sistémico y respiratorio, y necesitaron terapia de soporte avanzado en unidades de cuidados críticos que no cuentan con salas de aislamiento respiratorio, lo cual pone en riesgo al personal de salud.
La presentación clínica inicial de los casos de peste neumónica primaria se caracterizó por la presencia de escalofríos, mialgias, cefalea, vértigo, hiporexia, sed aumentada y ausencia de tos, en concordancia con lo descrito para el primer estadio clínico. La aparición de tos, expectoración, dificultad respiratoria, dolor torácico y abdominal, postración, hipotensión, disminución de la saturación, cianosis y hemoptisis se evidenciaron luego de las 24 horas de iniciada la enfermedad, correspondiendo al segundo estadio clínico; hallazgos similares fueron descritos en el brote de peste neumónica en Manchuria (1910-11) (11), en los casos de peste neumónica asociado a gatos en los EE.UU en el 2000 (4) y en el brote ocurrido al norte de la India en el 2002 (14). En nuestra serie, todos los casos presentaron dolor abdominal indiferenciado de moderada intensidad y después dolor torácico, aunque sólo se presentó hemoptisis en uno de ellos.
La disfunción multiorgánica se manifestó dentro de las 12 horas de la admisión al hospital. Ningún caso presentó bubón, concordantemente con la serie de casos de peste neumónica primaria de la India en el 2002 (14), a diferencia de los brotes en Manchuria y Madagascar, que fueron precedidos por casos con peste bubónica y posteriormente, peste neumónica secundaria. Proponemos los hallazgos del segundo estadio clínico como signos de gravedad, que permitan tomar medidas terapéuticas oportunas, sin la necesidad de tener confirmación por laboratorio en zonas endémicas de peste, ya que el retraso en el inicio del tratamiento incrementa la letalidad.
Las imágenes radiográficas evidenciaron infiltrados pulmonares alveolares de distribución segmentar y lobar en todos los casos, correlacionándose el infiltrado pulmonar multilobar y bilateral con la evolución tórpida de dos de los casos.
La evolución de los sucesos descritos, en la que una mujer con dificultad respiratoria aguda grave, que llega a un servicio de emergencia y termina en una unidad de cuidados intensivos, es el inicio de una serie de eventos que termina con la muerte de la paciente, de un estudiante de medicina y la presencia de otros dos casos graves. Dentro del contexto de una pandemia de influenza, el diagnóstico clínico inicial de infección por el virus de influenza pandémico es correcto desde el punto de vista clínico y epidemiológico, por lo que todos los casos inicialmente fueron tratados como neumonías adquiridas en la comunidad e influenza pandémica A H1N1, que posteriormente fueron descartados, como ocurrió con el brote de peste neumónica de Oakland (1919) (30). Nuestro sistema de salud demoró en hacer la correlación con el contexto epidemiológico de la región, donde ya había información de la circulación de la Y. pestis en roedores, gatos, canes y sus pulgas (31) y el antecedente de un brote de peste bubónica y un gato con diagnóstico de peste neumónica, con alto riesgo de la ocurrencia de casos de peste neumónica primaria en humanos. Los servicios de salud no se encontraban preparados para enfrentar esta situación, no tenían experiencia en el diagnóstico y tratamiento de casos de peste neumónica. La sospecha de peste neumónica, fue realizada mediante una acción colaborativa y multiinstitucional de la GERESA y un equipo de investigación del Instituto Nacional de Salud.
La droga de elección de la peste neumónica es la estreptomicina; sin embargo, hay estudios que evidencian la efectividad de la gentamicina y tetraciclinas (32). El cloranfenicol también es considerado efectivo, y por sus propiedades de penetración a tejidos es el antibiótico de elección en casos de meningitis (33), pleuritis, endoftalmitis y miocarditis (4). Algunos estudios que usaron ciprofloxacino, gatifloxacino y moxifloxacino han mostrado un incremento en la sobrevida de ratones con peste neumónica que fueron infectados experimentalmente (34-37), sin embargo, no se han realizado ensayos clínicos en humanos. Las guías de manejo de OMS y BICHAT sugieren monoterapia con estreptomicina o gentamicina, basados en experiencias de manejo de peste bubónica, septicémica y neumónica (38). La utilización de terapia combinada en nuestros casos, incluyendo fluoroquinolonas, no evidenció mejor evolución clínica en comparación al uso de terapia combinada de cloranfenicol y esptreptomicina. Sin embargo, al parecer, el inicio precoz de tratamiento si tuvo un efecto sobre la sobrevida (dos días para los pacientes que sobrevivieron versus cuatro y 12 días para los que fallecieron).
Todos los casos fueron tratados en unidades críticas y el soporte invasivo requerido facilitó las infecciones nosocomiales sobreagregadas por gérmenes multiresistentes, incrementando la morbilidad, hallazgos no reportados previamente en la literatura, por lo que no deben escatimarse en revisar y reforzar las medidas de control de infecciones en estas unidades.
En conclusión, la peste neumónica, considerada como la forma más grave de peste, es un diagnóstico que se debe tener en cuenta en áreas endémicas de peste. Las manifestaciones son rápidamente progresivas y letales, y el tratamiento antibiótico especifico debe ser iniciado lo más precoz posible. Asimismo, es una causa potencial de brotes intrahospitalarios en personal de salud que no cumple los criterios universales de control de infecciones y bioseguridad.
A inicios del siglo XXI y con la tecnología desarrollada para obtener confirmaciones diagnósticos tempranos, aún observamos formas graves de peste como es la forma neumónica, que a pesar de contar con antibióticos de amplio espectro no logramos disminuir la gravedad de la enfermedad, quedando muchas interrogantes por responder sobre la evolución tórpida y el manejo adecuado de las complicaciones producidas.
AGRADECIMIENTOS
A Víctor Alberto Laguna-Torres, por la revisión crítica del texto y comentarios técnicos del presente artículo. A Melvin Castro Prieto por su apoyo con la lectura de las imágenes radiográficas. A Pedro Díaz Camacho, Presidente del Comité de Prevención y Control de Peste en La Libertad, por el apoyo logístico brindado. A los médicos tratantes de la Unidad de Cuidados Intensivos del Hospital Regional Docente de Trujillo: Rómulo Contreras, María Hinojosa, Félix Evangelista y Percy Abanto, así como a los médicos tratantes de la Unidad de Cuidados Intensivos del Hospital de EsSalud Víctor Lazarte Echegaray: Jorge García, Iliana Paredes, Roxana Honorio, Germán Gastelo, Abel Arroyo, Ronald Rodríguez y William Hilares por su arduo sacrificio en la evaluación y manejo de los pacientes descritos en el presente artículo.
Fuente de Financiamiento
Instituto Nacional de Salud. Lima, Perú.
Conflictos de Interés
Los autores declaran no tener conflictos de interés en la publicación de este artículo
REFERENCIAS BIBLIOGRÁFICAS
1. Laguna-Torres A., Gómez Benavides J. La peste en el Perú. Rev Peru Med Trop. 2004;9(1):89-98. [ Links ]
2. Raymond G, Steve L. Epidemiologic determinants for modeling pneumonic plague outbreaks. Eme Infec Dis. 2004;10(4):608-14. [ Links ]
3. Dennis DT, Mead PS. Plague. In: Guerrant RL, Walker DH, Weller PF. Tropical infectious diseases: principles, pathogens and practice. 2nd ed. Philadelphia: Elsevier Health Sciences; 2005. p. 471. [ Links ]
4. Gage KL, Dennis DT, Orloski KA, Ettestad P, Brown TL, Reynolds PJ, et al. Cases of cat-associated human plague in the Western US, 1977-1998. Clin Infect Dis 2000;30(6):893-900. [ Links ]
5. Cueto M. La ciudad y las ratas: La peste bubónica en Lima y en la costa peruana, 1903-1930. En: Cueto M. El regreso de las epidemias, salud y sociedad en el Perú del siglo XX. Lima: Instituto de Estudios Peruanos; 1997. [ Links ]
6. Dávalos VA, Torres MA, Mauricio CO, Laguna- Torres VA, Chinarro MP. Outbreak of bubonic plague in Jacocha Huancabamba, Perú. Rev Soc Bras Med Trop. 2001;34(1):87-90. [ Links ]
7. Grupo Renovación. Programa para el control de la peste en la región La Libertad 1996-97. Trujillo: Grupo renovación; 1996. [ Links ]
8. McGovern TW, Friedlander AM. Plague. In: Sidell FR, Takafuji ET, Franz DR (eds). Medical aspects of chemical and biological warfare. Washington, DC: Office of the surgeon general; 1997. p. 479-502. [ Links ]
9. Franz DR, Jahrling PB, Friedlander AM, McClain DJ, Hoover DL, Bryne WR, et al. Clinical recognition and management of patients exposed to biological warfare agents. JAMA. 1997;278(5):399-411. [ Links ]
10. Babin SM. Using syndromic surveillance systems to detect pneumonic plague. Epidemiol Infect. 2010;138(1):1-8. [ Links ]
11. Dennis DT, Gage KL, Gratz N, Poland JD, Tikhomirov E. Plague manual: epidemiology, distribution, surveillance and control. Geneva: World Health Organization; 1999. [ Links ]
12. Kool JL. Risk of person-to-person transmission of pneumonic plague. Healthcare epidemiology. Clin Infect Dis. 2005;40(8):1166-72. [ Links ]
13. Hampton T. Plague pneumonic. JAMA. 2007;297(9): 941. [ Links ]
14. Kortepeter M, Christopher G, Cieslak T, Darling R, Pavlin J, Rowe J, et al. Medical management of biological casualties handbook. 3rd ed. Fort Detrick, MD: US Army Medical Research Institute of Infectious Diseases; 1998. [ Links ]
15. Gupta ML, Sharma A. Pneumonic plague, Northern India, 2002. Emerg Infect Dis. 2007;13(4):664-66. [ Links ]
16. Wu LT. Pathology of pneumonic plague. A treatise on pneumonic plague. Geneva: League of Nations Health Organization; 1926. p. 196-236. [ Links ]
17. Strong RP. Report of the International Plague Conference, Mukden, April 1911. Manila: Manila Bureau of Printing; 1912. [ Links ]
18. Also from DJ, Mettler FA, Mann JM. Radiographic manifestations of plaque in New Mexico, 1975-1980. A review of 42 proved cases. Radiology. 1981;139(3):561-5. [ Links ]
19. Florman AL, Spencer RR, Sheward S. Multiple lung cavities in a 12-year-old girl with bubonic plague, sepsis, and secondary pneumonia. Am J Med. 1986;80(6):1191-93. [ Links ]
20. Prentice MB, Rahalison L. Plague. Lancet. 2007;369(9568):1196-207. [ Links ]
21. Centers for Disease Control and Prevention. Pneumonic plague -- Arizona, 1992. MMWR. 1992;41(40):737-39. [ Links ]
22. Instituto Nacional de Estadística e Informática. Perú: Población proyectada por departamento, 2009 y 2010. Lima: INEI; 2009. [ Links ]
23. Hospital Regional Docente de Trujillo. Análisis situacional de salud 2008. Trujillo: Ministerio de Salud del Perú; 2008. [ Links ]
24. World Health Organization; Organisation Mondiale De La Santé. Relevé épidémiologique hebdomadaire. Weekly epidemiological record 2006;81(28):273-284. [ Links ]
25. Chu MC. Laboratory manual of plague diagnostic test. Atlanta: Centers for Disease Control and Prevention; 2000. [ Links ]
26. Campbell J, Lowe J, Walz S, Ezzell J. Rapid and specific identification of Yersinia pestis by using a nested polymerase chain reaction procedure. J Clin Microbiol. 1993;31(3):758- 59. [ Links ]
27. Rahalison L., Vololonirina E., Ratsitorahina M., Chanteau S. Diagnosis of bubonic plague by PCR in Madagascar under field conditions. J Clinl Microbiol. 2000;38(1):260-3. [ Links ]
28. Chanteau S, Rahalison L, Ralafiarisoa L, Foulon J, Ratsitorahina M, Ratsifasoamanana L, et al. Development and testing of a rapid diagnostic test for bubonic and pneumonic plague. Lancet. 2003;361(9353):211-16. [ Links ]
29. Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS); Organización Mundial de la Salud (OMS). Pautas éticas internacionales para la investigación biomédica en seres humanos. Ginebra: CIOMS-OMS; 2002. [ Links ]
30. Instituto Nacional de Salud. Prevención y control de brote de peste en el departamento de La Libertad, mayo-julio 2010. Lima: INS; 2010. [ Links ]
31. Kellogg WH. An epidemic of pneumonic plague. Am J Public Health. 1920;10(7):599-605. [ Links ]
32. Mwengee W, Butler T, Mgema SI, Mhina G, Almasi Y, Bradley C, et al. Treatment of plague with gentamicin or doxycycline in a randomized clinical trial in Tanzania. Clin Infect Dis. 2006;42(5):614-21. [ Links ]
33. Mensa J, Gatell J, Azanza J, Domínguez-Gil A, García J, Jiménez de Anta D, et al. Guía terapéutica antimicrobiana 2008. 18ª ed. Barcelona: Elsevier Masson; 2008. [ Links ]
34. Anisimov A, Amoako K. Treatment of plague: promising alternatives to antibiotics. J Med Microbiol. 2006;55(Pt 11):1461-75. [ Links ]
35. Russell P, Eley S, Green M, Stagg A, Taylor R, Nelson M, et al. Efficacy of docycycline and ciprofloxacin against experimental Yersinia pestis infection. J Antimicrob Chemother. 1998;41(2):301-5. [ Links ]
36. Byrne W, Welkos S, Pitt M, Davis K, Brueckner R, Ezzell J, et al. Antibiotic treatment of experimental pneumonic plague in mice. Antimicrob Agents Chemother. 1998;42(3):675-81. [ Links ]
37. Steward J, Lever M, Russell P, Beedhama R, Stagg A, Taylor R, et al. Efficacy of the latest fluoroquinolones against experimental Yersinia pestis. Int J Antimicrob Agents. 2004;24(6):609-12. [ Links ]
38. Instituto Nacional de Salud. Recomendaciones en el tratamiento de peste neumónica. Lima: INS; 2010. Nota técnica N.° 04. [ Links ]
Correspondencia: Dr. Paul E. Pachas
Dirección: Cápac Yupanqui 1400, Lima11, Perú.
Teléfono: (511) 617-6200 anexo 2143
Correo electrónico: ppachas@ins.gob.pe
Recibido: 20-08-10 Aprobado: 15-09-10