Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.27 n.4 Lima oct./dic. 2010
ARTÍCULO ORIGINAL
Efecto vasodilatador mediado por óxido nítrico del extracto hidroalcohólico de Zea mays L. (maíz morado) en anillos aórticos de rata
Vasodilator effect mediated by nitric oxide of the Zea mays L (andean purple corn) hydroalcoholic extract in aortic rings of rat
Oscar Moreno-Loaiza1,2,a, Azael Paz-Aliaga1,3,b
1 Facultad de Medicina, Universidad Nacional San Agustín, Arequipa, Perú.
2 Sociedad Científica de Estudiantes de Medicina Agustinos, Arequipa, Perú.
3 Centro de Investigación y Desarrollo Científico, Universidad Nacional San Agustín, Arequipa, Perú.
a Estudiante de medicina; b Biólogo, PhD en Fisiología y Biofísica.
RESUMEN
Objetivo. Evaluar la respuesta vasodilatadora e inhibidora de la vasoconstricción del extracto hidroalcohólico de Zea mays L. (maíz morado) y determinar si esta respuesta es mediada por óxido nítrico (NO). Materiales y métodos. Se obtuvo un extracto de las corontas de maíz morado maceradas durante ocho días en etanol al 70%, y posterior concentración del producto. Se trabajó con anillos aórticos de rata en cámara de órganos aislados, bañada con solución Krebs-Hensleit (K-H) y se registró la actividad vasomotora con un transductor de tensión isométrica. Se produjo una contracción basal con KCl 120 mM sobre la cual determinó el efecto vasodilatador de tres dosis del extracto: 0,1; 0,5 y 1,0 mg/mL. Se utilizó L-NG-Nitroarginina metil ester (L-NAME) para comprobar que la vasodilatación depende de la óxido nítrico sinteasa (NOs). Luego se comparó la inhibición de la contracción vascular tras la incubación durante 30 minutos, con extracto de maíz morado y captopril 10-5 M. Resultados. Se observó una reducción de la contracción máxima (100%) a 85,25 ± 2,60%, 77,76 ± 3,23% y 73,3 ± 4,87%, para las dosis de 0,1; 0,5 y 1,0 mg/mL, respectivamente. La vasodilatación fue inhibida por la incubación previa con L-NAME. El extracto de maíz morado no inhibió la contracción vascular, a diferencia del captopril (reducción a 75,27 ± 8,61%). Conclusión. El extracto hidroalcohólico de Zea mays L produce vasodilatación dependiente de la síntesis de NO.
Palabras clave: Plantas medicinales; Agentes antihipertensivos; Óxido nítrico; In vitro (fuente: DeCS BIREME).
ABSTRACT
Objective: To evaluate the vasodilator response of the hydroalcoholic extract of Zea mays L. (Andean purple corn) and to determine if this response is mediated by nitric oxide (NO). Material and methods: We obtained an extract by maceration for eight days of Andean purple corn cobs in 70% ethanol and subsequent concentration of the product. Thoracic aortic rings were evaluated in an isolated organ chamber, bathed with Krebs-Hensleit solution (KH), and vasomotor activity was recorded with an isometric tension transducer. Basal contraction was produced with 120 mM KCl and then, we proceeded to determinate the vasodilator effect of 3 doses of the extract: 0.1, 0.5, and 1.0 mg/mL. We used L-NG-Nitroarginin methyl ester (L-NAME) to verify that the vasodilation depends on nitric oxide sinteasa (NOs). Then we compared the inhibition of vascular contraction after incubation for 30 minutes, with purple corn extract and captopril 10-5 M. Results: We observed a reduction in maximum contraction (100%) to 85.25 ± 2.60%, 77.76 ± 3.23%, and 73.3 ± 4.87% for doses of 0.1, 0.5 and 1,0 mg/mL respectively. The vasodilation was inhibited by prior incubation with L-NAME. Andean purple corn extract did not inhibit vascular contraction as captopril did (reduction to 75.27 ± 8.61%). Conclusion. The hydroalcoholic extract of Zea mays L produces NO dependent vasodilation.
Key words: Medicinal plants; Antihypertensive agents; Nitric oxide; In vitro (source: MeSH NLM).
INTRODUCCIÓN
La hipertensión arterial es uno de los trastornos de mayor impacto en salud pública, con una prevalencia en el Perú de aproximadamente 23,7% en la población adulta (1). El control de sus factores de riesgo, así como el uso adecuado de fármacos, mejora, sin duda, el curso de la enfermedad. No obstante, y pese a los avances logrados, se busca nuevas opciones farmacológicas y fitoterapéuticas que permitan reducir aun más estas complicaciones.
El tono vascular, factor determinante de la presión arterial, depende directamente de la función del órgano endotelial (2-4) y de su producción de óxido nítrico (NO) (5). La disfunción endotelial es un estado patológico asociado con hipercolesterolemia, diabetes, hipertensión y estrés oxidativo (6-10). En ella, observamos una pérdida de la vasodilatación dependiente del endotelio por la disminución de la actividad del NO en la pared vascular, ya sea por una menor producción, una producción aberrante o una mayor degradación (10,11). Es por ello que la prevención de la enfermedad cardiovascular va dirigida fundamentalmente a prevenir la disfunción endotelial y los factores asociados con esta.
En el Perú, el maíz morado (Zea mays L) es utilizado con frecuencia en la preparación de bebidas y postres como la chicha morada, o la mazamorra morada, y se constituye en uno de los componentes principales de la dieta peruana.
En los últimos años se han descrito muchas propiedades benéficas del Zea mays L, entre las que se encuentra su capacidad antihipertensiva, hipolipemiante, hipoglicemiante y antioxidante (12-19). Todas estas propiedades se atribuyen a su alto contenido de antocianinas, en especial cianidina 3 glicósido, la antocianina que el Zea mays L. tiene en mayor cantidad y que le otorga su color característico (20,21).
Arroyo et al. demostraron la reducción de la presión arterial al administrar un extracto hidroalcohólico de Zea mays L. a ratas hipertensas (19); no obstante, el mecanismo de acción por el cual observaron dicho efecto, aún no ha sido explicado. Se han realizado múltiples trabajos para evaluar la actividad sobre los vasos sanguíneos, de vegetales con alto contenido de antocianinas (22-24); sin embargo, no se han realizado estudios similares con el Zea mays L. Por ello, el objetivo del trabajo es evaluar si el efecto hipotensor del Zea mays L. es mediado por la inhibición de la vasoconstricción o por un mecanismo vasodilatador y, a la vez, determinar si dicha vasodilatación es mediada por la producción de NO endotelial.
MATERIALES Y MÉTODOS
PREPARACIÓN DEL EXTRACTO HIDROALCOHÓLICO
Se usó corontas de maíz morado (Zea mays L) provenientes de un cultivo orgánico. El registro taxonómico fue realizado por la facultad de biología de la Universidad Nacional San Agustín (Registro taxonómico 2010-28). Para la preparación del extracto se empleó un método similar al descrito por Arroyo et al. (19). Se procedió a separar los granos de la coronta de Zea mays L y luego se dejó secar las corontas a temperatura ambiente (18-22 ºC). Una vez secas, las corontas se pulverizaron en un molino de granos. Luego se agregó etanol al 70% en una proporción 10 g de pulverizado/200 mL de alcohol y se dejó macerar durante ocho días. La solución restante fue filtrada y se dejó evaporando en baño maría a 40 ºC. El producto obtenido se guardó en ambiente seco a temperatura ambiente y protegido de la luz.
OBTENCIÓN DE LOS ANILLOS AÓRTICOS
Se usó anillos aórticos procedentes de ratas macho de la especie Rattus norvegicus, variedad albina swiss, de tres a cuatro meses de edad, con pesos que oscilaron entre 230 y 300 g, criadas en el bioterio del Centro de Investigación y Desarrollo Científico de la Facultad de Medicina de la Universidad Nacional San Agustín (Arequipa, Perú), en camas de viruta, con agua y alimento ad libitum, y ciclo de luz/oscuridad de doce horas. Para su alimentación se usó alimento de mantenimiento (Tomasino ®). Se sacrificó diez ratas mediante contusión cervical e inmediatamente se procedió a extraer la aorta torácica, la cual fue cuidadosamente disecada en una placa Petri con solución Krebs-Henseleit (K-H), compuesta por (mM): NaCl 115; KCl 4,6; KH2PO4 1,2; SO4Mg 1,2; CaCl2 2,5; NaHCO3 25; glucosa 11. Luego se seccionó las aortas en anillos circulares de 5 mm de longitud, obteniéndose cinco anillos por cada rata. Cada anillo fue utilizado para experimentos diferentes. Por cada animal, tres anillos fueron utilizados para las pruebas de motilidad a diferentes dosis y dos anillos para la comparación con captopril.
DETERMINACIÓN DE LA VASOMOTILIDAD
Se utilizó el método descrito por Furchgott et al. (2-4). Los anillos aórticos se insertaron en dos postes dentro de una cámara para órganos aislados. Uno de los postes era móvil y estaba conectado a un transductor de tensión isométrica (Grass FT-10) y a un polígrafo (Grass AM-5), el cual registró sobre papel milimetrado la actividad de los anillos aórticos. Se llenó el pozo de la cámara con solución K-H mantenida a 37 ºC, y con burbujeo constante de una mezcla carbógena de 95% de O2 y 5% de CO2. Finalmente, se aplicó una tensión equivalente a 2g. Este valor fue obtenido en los experimentos piloto previos al estudio; debido a que fue la tensión en la cual logramos el máximo valor de vasoconstricción estable con KCl 120 mM.
Luego de un periodo de 60 min de estabilización de la preparación, durante el cual se cambió cada 10 min la solución K-H, los anillos fueron contraídos agregándose al baño una solución despolarizante de KCl 120 mM.
aplicó el extracto hidroalcohólico de Zea mayz L en tres diferentes dosis: 0,1; 0,5 y 1,0 mg/mL, se registró su actividad vasomotora durante 10 min. Se realizó diez pruebas con cada dosis. Se calculó el porcentaje de vasodilatación considerando la máxima contracción sostenida de cada caso como el 100%.
A otro grupo de anillos se los incubó previamente durante 20 min con el inhibidor de la óxido nítrico sintetasa (NOs), L-NG-Nitroarginina metil ester (L-NAME) 100 μM, luego se produjo vasoconstricción con KCl 120 mM y se agregó el extracto hidroalcohólico de Zea mayz L a dosis de 1,0 mg/mL.
INHIBICIÓN DE LA VASOCONSTRICCIÓN
Luego de determinar la máxima contracción sostenida con KCl 120 mM de veinte anillos aórticos, se incubó diez anillos en captopril 10-5 M y otros diez en el extracto hidroalcohólico de Zea mays L. 1,0 mg/mL, durante 30 min. Luego de ello, se realizó el lavado de la cámara con solución K-H por tres veces. A continuación se procedió a realizar nuevamente la vasoconstricción con KCl 120 mM y se comparó, en cada caso, las contracciones previas y posteriores a la incubación.
ANÁLISIS ESTADÍSTICO
La base de datos y los gráficos fueron construidos con el programa Microsoft Office Excel 2007 y el análisis de datos se realizó con el paquete estadístico SPSS v.15. Una vez determinada la normalidad de los datos (prueba de Kolmogorov-Smirnov) se procedió a utilizar las pruebas t de Student para una muestra, para grupos independientes, ANOVA y Tukey como prueba posthoc. Se consideró como significativos los valores de p<0,05. Los resultados se expresan como media ± error estándar.
RESULTADOS
En la Figura 1 se observa la vasodilatación en relación con las dosis utilizadas del extracto hidroalcohólico de Zea mays L. La administración de las dosis de 0,1; 0,5 y 1,0 mg/mL produjo una reducción de la contracción máxima (100%) a un promedio de 85,25 ± 2,60%, 77,76 ± 3,23% y, 73,3 ± 4,87% respectivamente. Dichos valores son diferentes de la máxima contracción sostenida o 100% (t de Student para una muestra, p<0,05), por lo tanto, son considerados como vasodilatación. Además, existió diferencia significativa entre la vasodilatación producida a 0,1 mg/mL con respecto a 1,0 mg/mL, mas no con 0,5 mg/mL (ANOVA y prueba de Tukey, p<0,05).
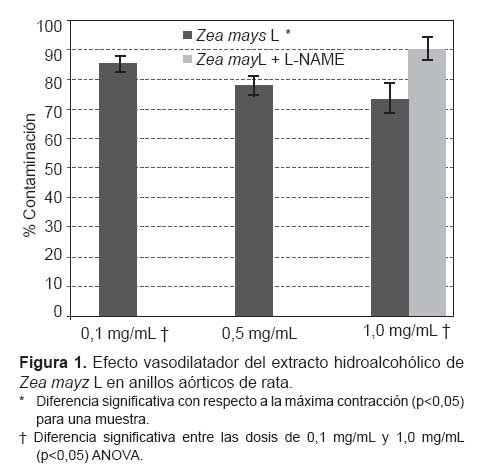
En el caso de los anillos preincubados con L-NAME no se evidenció diferencia significativa con respecto a la máxima contracción estable (t de Student para una muestra, p>0,05).
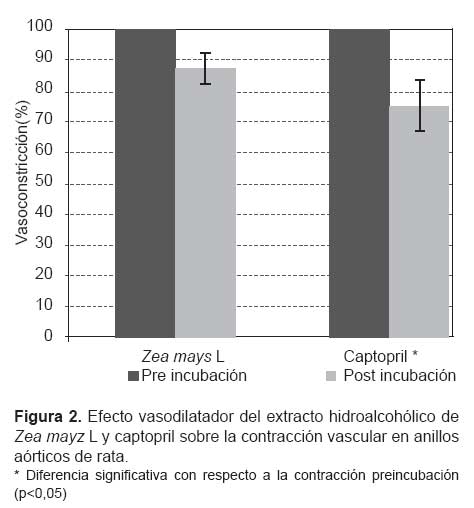
La Figura 2 muestra que tras la incubación con captopril la contracción producida fue un 75,27±8,61% de la contracción preincubación (p<0,05), y de un 87,17±7,64%, tras la incubación con el extracto hidroalcohólico de Zea mays L. Dicha reducción de la vasoconstricción no fue significativa (p>0,05).
DISCUSIÓN
La Figura 1 muestra la acción vasodilatadora del extracto hidroalcohólico de Zea mays L. Esta respuesta sigue un patrón dependiente de la dosis, simulando una curva dosis-efecto clásica, la cual sugiere que este extracto podría actuar activando alguna vía enzimática, ya que sigue una curva cinética similar a la de estas.
Arroyo J. et al. (19) hallaron que el extracto hidroalcohólico de Zea mays L producía disminución de la presión arterial en ratas con hipertensión inducida por L-NAME. La Figura 1 muestra que el Zea mays L no produjo vasodilatación luego de incubar los anillos con L-NAME. Esto indica que el efecto observado es diferente al descrito por Arroyo et al., lo cual podría deberse a la participación de vías fisiológicas a largo plazo, que nuestro experimento no permitió analizar, pero que son dependientes del NO. Una de ellas sería la mayor síntesis de NOs que supliría la actividad de las enzimas que fueron bloqueadas por L-NAME, tal como lo describieron Xu et al. en cultivos de células endoteliales (24).
Tal como muestra la Figura 2, el extracto hidroalcohólico de Zea mays L no provocó inhibición de la vasoconstricción, como sí lo hiciera el captopril. Esto demuestra que los componentes de este extracto no tendrían participación en el proceso de contracción de la célula muscular lisa y que no deprimirían la respuesta vascular frente al estímulo contráctil provocado en este caso por despolarización (KCl); no obstante, aún queda por evaluar la existencia de tal efecto ante otros estímulos contráctiles, como los de sustancias adrenérgicas o el calcio.
Estos hallazgos se complementan bien con la buena tasa de absorción y biodisponibilidad tanto en ratas como en humanos, que tienen las antocianinas presentes en el Zea mays L (25-27); en especial la cianidina 3 glicósido, la cual, tras ser administrada por vía oral, es incorporada a la circulación manteniendo su estructura química intacta (27). A pesar de ello, es necesario recalcar que los resultados obtenidos no pueden extrapolarse en su totalidad al ser humano o reemplazar la terapia medicamentosa actual de la hipertensión. Aún falta determinar la farmacocinética de estos compuestos, su toxicidad, relevancia clínica y limitaciones; así como determinar si el consumo tradicional de la chicha morada en nuestro medio, llega a ser un factor de protección de la salud cardiovascular.
Queda por estudiar la variación del efecto vasodilatador encontrado en vasos sanguíneos con disfunción endotelial producida por hipercolesterolemia, diabetes, hipertensión arterial y la aplicación farmacológica que tendría el Zea mays L frente a dichas entidades. En conclusión, los resultados obtenidos en este trabajo demuestran que el Zea mays L produce vasodilatación dependiente de la síntesis de NO.
Financiamiento
Estudio autofinanciado.
Conflictos de Interés
Los autores declaran no tener conflictos de interés al ejecutar o publicar este artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. Agusti RC. Epidemiología de la hipertensión arterial en el Perú. Acta Med Peru. 2006;23(2):69-75. [ Links ]
2. Furchgott RF, Zawadzki JV. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature. 1980;288(5789):373-76. [ Links ]
3. Furchgott RF. Role of endothelium in responses of vascular smooth muscle. Circ Res. 1983;53(5):557-73. [ Links ]
4. Furchgott RF, Vanhoutte PM. Endothelium-derived relaxing and contracting factors. FASEB J. 1989;3(9):2007-18. [ Links ]
5. Rees DD, Palmer RM, Moncada S. Role of endothelium-derived nitric oxide in the regulation of blood pressure. Proc Natl Acad Sci USA. 1989;86(9):3375-78. [ Links ]
6. Heitzer T, Schlinzig T, Krohn K, Meinertz T, Münzel T. Endothelial dysfunction, oxidative stress, and risk of cardiovascular events in patients with coronary artery disease. Circulation. 2001;104:2673-78 [ Links ]
7. O'Donnell VB, Chumley PH, Hogg N, Bloodsworth A, Darley-Usmar VM, Freeman BA. Nitric oxide inhibition of lipid peroxidation: kinetics of reaction with lipid peroxyl radicals and comparison with alpha-tocopherol. Biochemistry. 1997; 36(49):15216-23. [ Links ]
8. Gimbrone MA Jr. Vascular endothelium: an integrator of pathophysiologic stimuli in atherosclerosis. Am J Cardiol. 1995;75(6):67B-70B. [ Links ]
9. Suzuki YJ, Ford GD. Inhibition of Ca(2+)-ATPase of vascular smooth muscle sarcoplasmic reticulum by reactive oxygen intermediates. Am J Physiol. 1991;261(2):H568-74. [ Links ]
10. Cai H, Harrison DG. Endothelial dysfunction in cardiovascular diseases: the role of oxidant stress. Circulation Res. 2000;87(10):840-44. [ Links ]
11. Wilcox JN, Subramanian RR, Sundell CL, Tracey WR, Pollock JS, Harrison DG, et al. Expression of multiple isoforms of nitric oxide synthase in normal and atherosclerotic vessels. Arterioscler Thromb Vasc Biol. 1997;17(11):2479-88. [ Links ]
12. Shindo M, Kasai T, Abe A, Kondo Y. Effects of dietary administration of plant-derived anthocyanin-rich colors to spontaneously hypertensive rats. J Nutr Sci Vitaminol. 2007;53(1):90-93. [ Links ]
13. Tenorio López FA, Del Valle Mondragón L, Pastelín Hernández G. Los flavonoides y el sistema cardiovascular: ¿Pueden ser una alternativa terapéutica? Arch Cardiol Mex. 2006;76(4):33-45. [ Links ]
14. Nijveldt RJ, van Nood E, van Hoorn DEC, Boelens PG, van Norren K, van Leeuwen PA. Flavonoids: a review of probable mechanisms of action and potential applications. Am J Clin Nutr. 2001;74(4):418-25. [ Links ]
15. Tsuda T, Horio F, Uchida K, Aoki H, Osawa T. Dietary cyanidin 3-O-β-D-glucoside-rich purple corn color prevents obesity and ameliorates hyperglycemia in mice. J Nutr. 2003;133(7):2125-30. [ Links ]
16. Arroyo J, Raez E, Rodríguez M, Chumpitaz V, Burga J, De la Cruz W, et al. Reducción del colesterol y aumento de la capacidad antioxidante por el consumo crónico de maíz morado (Zea mays L) en ratas hipercolesterolémicas. Rev Peru Med Exp Salud Publica. 2007;24(2):157-62. [ Links ]
17. Kuskoski EM, Asuero AG, García-Parilla MC, Troncoso AM, Fett R. Atividade antioxidante de pigmentos antociânicos. Ciênc Tecnol Aliment. 2004;24(4):691-93. [ Links ]
18. Ramirez-Tortosa C, Andersen ØM, Gardner PT, Morrice PC, Wood SG, Duthie SJ, et al. Anthocyanin-rich extract decreases indices of lipid peroxidation and DNA damage in vitamin E-depleted rats. Free Radic Biol Med. 2001;131(9):1033-37. [ Links ]
19. Arroyo J, Raez E, Rodríguez M, Chumpitaz V, Burga J, De la Cruz W, et al. Actividad antihipertensiva y antioxidante del extracto hidroalcohólico atomizado de maíz morado (Zea mays L.) en ratas. Rev Peru Med Exp Salud Publica. 2008;25(2):195-99. [ Links ]
20. Aoki H, Kuze N, Kato Y, Gen S-E. Anthocyanins isolated from purple corn (Zea mays L.). Foods Food Ingred Jap. 2002;199(2):41-45. [ Links ]
21. Pedreschi R, Cisneros-Zevallos L. Phenolic profiles of Andean purple corn (Zea mays L.). Food Chem. 2007;100(3):956-63. [ Links ]
22. Bell DR, Gochenaur K. Direct vasoactive and vasoprotective properties of anthocyanin-rich extracts. J Appl Physiol. 2006;100(4):1164-70. [ Links ]
23. Kim SH, Kang KW, Kim KW, Kim ND. Procyanidins in crataegus extract evoke endothelium-dependent vasorelaxation in rat aorta. Life Sci. 2000;67(2):121-31. [ Links ]
24. Xu JW, Ikeda K, Yamori Y. Upregulation of endothelial nitric oxide synthase by cyanidin-3-glucoside, a typical anthocyanin pigment. Hypertension. 2004;44(2):217-22. [ Links ]
25. Miyazawa T, Nakagawa K, Kudo M, Muraishi K, Someya K. Direct intestinal absorption of red fruit anthocyanins, cyanidin-3-glucoside and cyanidin-3,5-diglucoside, into rats and humans. J Agric Food Chem. 1999;47(3): 1083-91. [ Links ]
26. Andlauer W, Stumpf C, Frank K, Fürst P. Absorption and metabolism of anthocyanin cyanidin-3-glucoside in the isolated rat small intestine is not influenced by ethanol. Eur J Nutr. 2003;42(4):217-33. [ Links ]
27. Talavéra S, Felgines C, Texier O, Besson C, Lamaison JL, Rémésy C. Anthocyanins are efficiently absorbed from the stomach in anesthetized rats. J Nutr. 2003;133(12):4178-82. [ Links ]
Correspondencia: Oscar Moreno-Loaiza
Dirección: Coop. Gloria IV f-7 Arequipa, Perú.
Teléfono: (51-054) 222-686
Correo electrónico: oscarml5@hotmail.com
Recibido: 04-04-10
Aprobado: 27-10-10














